60Coγ射线复合硫酸二乙酯诱变选育高产新型细菌素Plantaricin 163-1菌株的研究
2015-08-02党丽娟高钰淇别小妹吕凤霞赵海珍陆兆新
党丽娟,高钰淇,别小妹,吕凤霞,赵海珍,陆兆新
(南京农业大学食品科学技术学院,江苏南京 210095)
60Coγ射线复合硫酸二乙酯诱变选育高产新型细菌素Plantaricin 163-1菌株的研究
党丽娟,高钰淇,别小妹,吕凤霞,赵海珍,陆兆新*
(南京农业大学食品科学技术学院,江苏南京 210095)
为提高Lactobacillusplantarum163产的新型细菌素Plantaricin 163-1的抑菌相对效价,以Lb. plantarum 163为出发菌株,通过60Coγ射线复合硫酸二乙酯(DES)诱变,以期得到具有稳定遗传性且细菌素高产的菌株。 结果表明:60Coγ射线诱变的最佳辐照剂量为0.6 kGy,获得了抑菌活性提高23.68%的突变株。然后,在35 ℃下用0.7%硫酸二乙酯复合处理突变菌体25 min,最终得到一株高产突变菌株L150,其相对抑菌效价是原始菌株2.11倍。通过5代传代培养,遗传稳定性良好。
植物乳杆菌,细菌素,诱变,硫酸二乙酯
目前,食品工业中大多在使用化学防腐剂,但随着人们生活水平的提高,消费者对食用化学防腐剂在一定程度上怀疑其安全性和潜在的副作用,而且越来越多的细菌表现出对化学防腐剂的耐受性[1],因此开发出广谱、高效、稳定和安全的天然食品防腐剂是食品工业发展的必然趋势[2]。乳酸菌(Lactobacillussp.)是一类可发酵糖并产生大量乳酸的细菌统称。自古以来,乳酸菌广泛应用于乳制品、蔬菜及肉制品的发酵和防腐中[3]。细菌素是乳酸菌在代谢过程中合成并分泌到环境中的一类具有抑菌活性的多肽或蛋白类物质,一般只对亲缘关系较近的细菌有抑制作用,产生菌对其产生的细菌素具自身免疫性[4]。少部分细菌素具广谱抑菌活性,在人体内可被降解,具有安全、易降解、对酸和高温稳定等特点,因此,近年来成为天然防腐剂研究与开发的热点。乳酸菌细菌素以乳酸链球菌素(Nisin)为代表,已被食品添加剂联合专家委员会确认可作为食品防腐剂[5]。
植物乳杆菌163(Lb. plantarum163)为本实验室分离纯化鉴定的一株优良的乳酸菌菌株,能产生两种新型的细菌素Plantaricin 163及Plantaricin 163-1,其中Plantaricin 163为32个氨基酸残基的多肽(分子量3553 u)[6],Plantaricin 163-1为7个氨基酸残基的多肽(分子量825 u)[7]。本实验室前期研究发现,Lb. plantarum163产生的2种细菌素,Plantaricin 163-1的抑菌效果更好。故本实验以Plantaricin 163-1相对效价为指标,采用物理复合化学诱变的方法来提高Plantaricin 163-1的相对效价,以期获得具有工业应用价值的高产菌株。
1 材料与方法
1.1 材料与试剂
Lb. plantarum163(Lactobacillusplantarum163),来源于实验室分离菌株[7],现由中国微生物保藏中心保藏(No.8224)。
指示菌菌株及来源:短小芽孢杆菌(CMCC 63202)。
MRS液体培养基(g/L):蛋白胨10、牛肉膏10、酵母粉5、葡萄糖20、无水乙酸钠5、吐温-80 1、柠檬酸二胺 2、磷酸氢二钾 2、硫酸镁 0.58、硫酸锰 0.25、蒸馏水 1 L,pH6.2~6.4。115 ℃,30 min,灭菌备用。
指示菌培养基为营养琼脂培养基(g/L):牛肉膏 3,蛋白胨 10,氯化钠 5,蒸馏水1 L,pH7.2~7.4,121 ℃,20 min,灭菌备用。
主要试剂:
pH6.0磷酸缓冲液(1 L):K2HPO42 g,KH2PO48 g,121 ℃,20 min,灭菌备用;pH7.0磷酸缓冲液(1 L):K2HPO49.39 g,KH2PO43.5 g,蒸馏水1 L,121 ℃,20 min,灭菌备用。
0.85%生理盐水(1 L):NaCl 8.5 g,121 ℃,20 min,灭菌备用。
10%(v/v)硫酸二乙酯(DES):2 mL硫酸二乙酯(Sigma公司)加入9.8 mL无水乙醇Nisin标准品(Sigma公司):抑菌效价(1000000 U/g)。
1.2 仪器与设备
SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;隔水式电热恒温培养箱 上海跃进医疗器械厂;EUTECH pH510酸度计 EUTECH 优特;冷冻离心机 Centrifuge 5840R,Eppendorf公司;DK-8D型电热恒温水槽 上海森信实验仪器有限公司;数显游标卡尺 杭州工量具制造有限公司。
1.3 实验方法
1.3.1 原始菌株生长曲线的测定 从-70 ℃保藏的甘油管中取出保藏菌种,将菌种活化12 h后,按1%的接种量,接种于 MRS液体培养基中混合均匀,37 ℃静置连续培养46 h,每隔2 h取样,并做三个平行实验。用分光光度计测定不同时间段发酵液的 OD600值,发酵液的pH,未接种的 MRS 液体培养基作为空白对照。以培养时间为横坐标,OD600值为纵坐标,绘制生长曲线[8-9]。
1.3.260Coγ射线诱变 取对数生长期菌液5 mL,5000 r/min离心15 min,用无菌的生理盐水振荡混匀(不加玻璃珠)洗涤菌体,再次离心,重复两次后,去除上清液,再用生理盐水重悬,使菌体浓度为107cfu/mL。根据剂量要求置盛有菌体悬液的玻璃管于一定剂量的辐照台面上,照射剂量分别为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 kGy,剂量率为9 Gy/min。处理相应时间后取出马上进行10倍梯度稀释,稀释至10-4,涂布于MRS固体培养基上。实验于江苏省农科院原子能研究所进行。
1.3.3 硫酸二乙酯(DES)诱变 取γ射线诱变所得的高产菌株作为出发菌株,进行硫酸二乙酯诱变。取对数生长期菌液5 mL,5000 r/min离心15 min,再以pH为7.0的磷酸缓冲液洗涤2次,用磷酸缓冲液稀释到107cfu/mL,转入10 mL离心管中。配制DES母液浓度为10%,加入不同体积的DES母液和菌悬液,使终浓度为0.3%~0.8%的DES反应体系,处理10~30 min,处理温度为30~50 ℃。按照2.5倍 DES溶液体积加入质量分数为25%硫代硫酸钠溶液终止反应。取0.1 mL的诱变后菌悬液涂布于MRS固体培养基中。将培养好的平板取出进行菌落计数,根据平板上菌落计数结果,以未经DES处理的菌液涂平板作为对照,计算致死率。
致死率(%)=(未处理平板菌落数-处理平板菌落数)/未处理平板菌落数×100
分别进行不同的单因素实验:分别取DES浓度、处理时间、诱变温度3个因素。选取单因素实验中最优的实验结果。
1.3.4 筛选方法
1.3.4.1 初筛 诱变涂板后培养36 h,待菌落长出。用灭过菌的牙签挑取菌落,挑入液体MRS培养基中,置于37 ℃恒温培养箱培养36 h。8000 r/min离心2 min,得到的上清液采用琼脂扩散法[10-11]做抑菌实验。以出发菌株为对照,用数显游标卡尺量取抑菌圈直径,每次测量重复三次。选择抑菌圈直径比出发菌株大的菌株保藏。
1.3.4.2 抑菌相对效价的定义 采用牛津杯双层琼脂平板法测定发酵上清液的抑菌活性[12],采用Nisin标准曲线法测定细菌素的相对抑菌效价[13-14]。具体为:以短小芽孢杆菌为指示菌,以乳酸链球菌素Nisin为对照。首先将Nisin配制成16000 U/mL的母液,再用0.02 mol/L的稀盐酸分别稀释至8000、4000、2000、1000、500 U/mL,采用牛津杯法做抑菌实验,绘制Nisin效价的对数值和抑菌圈直径之间关系的标准曲线,得到Nisin的标准曲线,然后将待测发酵上清液稀释到标准曲线范围内,将抑菌圈直径代入效价回归方程,计算发酵液中细菌素的相对抑菌效价。
1.3.5 遗传稳定性测试[15]选取复筛所得到抑菌效价较高的突变株进行连续传代,每次传代后发酵培养,测定相对效价的变化。
2 结果与分析
2.1 菌株Lactobacillusplantarum163生长曲线的测定
面向5G通信的高速PAM4信号时钟与数据恢复技术…………………廖启文,Patrick Yin CHIANG,祁楠 24-4-21
在Lactobacillusplantarum163发酵过程中,会产生乳酸,除了OD600值可以反映菌体的生长情况外,pH的变化也会反映出菌体的生长情况。接种后,0~4 h内处于延滞期,生长较缓慢,OD值变化较小,发酵液pH变化比较平缓;4 h后,OD值迅速升高,发酵液的pH同时迅速下降,菌体生长进入对数期;当培养14 h后,菌体生长速度减慢,OD值变化趋于平缓,pH变化也较小,菌体进入对数末期。根据不同时期菌体生长情况,培养12 h菌体进入生长的对数中后期。此时,OD值为2.0左右,pH控制在4.1左右。诱变处理的菌株一般要求处于对数生长期,此时菌体生长状态比较同步,对于诱变剂较敏感,容易变异,且重复性较好。同时,为了保证处理时具有一定的细胞浓度,增加可能变异的细胞总数,常选用对数生长中后期的细胞供处理[16]。所以实验选取培养12 h的菌体进行诱变处理。Lactobacillusplantarum163生长曲线的测定,不仅可以为该菌株进行各种诱变处理提供合适的菌体状态,还可以为进一步原生质体制备、融合作为实验参考。

图1 Lactobacillus plantarum 163生长曲线的测定Fig.1 Growth curve of Lactobacillus plantarum 163
2.260Coγ射线诱变对致死率的影响
2.2.160Coγ射线诱变剂量的选择 从图中可以看出,出发菌株Lactobacillusplantarum163在剂量率为9 Gy/min条件下,不同注入剂量对存活率的影响见图2。研究表明,致死率在80%~90%时正向突变的概率较高[17]。所以,选取致死率在80%~90%的诱变剂量和诱变时间长出的菌落作为筛选的对象。以致死率为参考标准[18],致死率越高,菌株突变的概率越大,但是,在高剂量高强度的致死率下,往往负突变占较大比例。而致死率较低时,菌落数量庞大,不利于筛选工作。从致死曲线可以推断,γ射线诱变菌株,是一个能量沉积的过程,随着能量的增大,致死率升高。而对于诱变菌株的筛选,初筛的菌株数量越多,优良菌株被遗漏的概率越小,扩大筛选量,是育种成功与否的一个关键因素[19]。γ射线诱变的剂量为0.6 kGy时,即致死率为84.36%,在最易产生突变的致死率范围。因此,在0.6 kGy剂量作用后,随机大量挑选菌株,利用琼脂扩散法进行初筛。
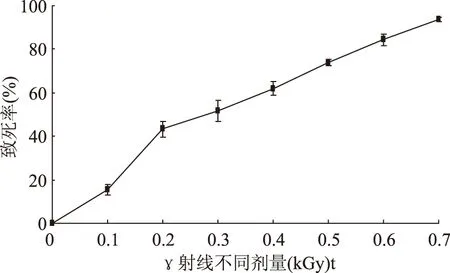
图2 60Coγ射线致死率曲线Fig.2 Lethality curve of Lactobacillus plantarum 163by irradiating 60Coγ
2.2.260Coγ射线诱变后菌株的筛选 将原出发菌株经过多次γ射线诱变后,在0.6 kGy条件下,筛选出18株突变菌株,其所产细菌素的相对效价比原始菌株所产的有小幅度提高。经过初筛、复筛,挑选出菌株γ120,所产细菌素的相对抑菌效价较其他菌株提高的最多,约提高了23.68%。接种到斜面试管保藏,以备下一步进行化学诱变,以达到提高突变菌株生产Plantaricin163-1相对效价的目的。
2.3 硫酸二乙酯诱变
2.3.1 硫酸二乙酯诱变剂量的确定 致死率与DES作用的浓度有密切关系。因此选定作用时间30 min,分别选取体积分数为0.3%~0.8%的DES反应,做单因素实验。当体积分数为0.7%,作用30 min时,致死率达到了94%。结果见图3。
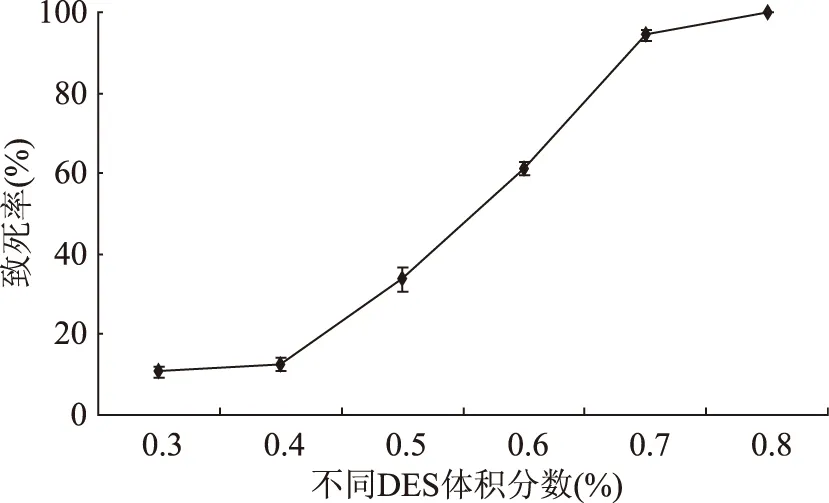
图3 DES浓度对Lactobacillus plantarum 163致死率的影响Fig.3 Effect of DES concentration on lethal rateof Lactobacillus plantarum 163
从图3可以看出,DES浓度在低于0.7%时,致死率迅速增长,但达到0.7%以后,致死率增加缓慢。DES体积分数较低时,相同时间内不能够作用于所有的菌株,因此,致死率随着体积分数的增加而迅速增加。当诱变剂量为0.6%时,致死率为61%,达不到诱变作用的致死率;当增加到0.8%时,致死率达到100%,绝大多数菌株都不耐受诱变剂的作用。综合考虑,选用DES的体积分数为0.7%,致死率在理想的范围内。
2.3.2 硫酸二乙酯诱变时间对致死率的影响 确定了0.7% DES为作用的体积分数,分别选取10、15、20、25、30 min进行单因素实验,实验结果如图4。
从图4可知,随着作用时间的延长,致死率的提高速度较快,会提高DNA突变的概率。DES处理10 min,菌体的致死率为34.24%,随着诱变时间的增加,菌体致死率显著提高。诱变时间为25 min时,致死率达到89.67%,在目标致死范围之内。而诱变时间为30 min时,菌体致死率为98%。因此在DES诱变中处理时间选择25 min。
2.3.3 硫酸二乙酯诱变温度对致死率的影响 当DES浓度为0.7%,处理时间为25 min时,诱变温度对Lactobacillusplantarum163致死率的影响见图5。当温度是30 ℃时,致死率分别为74.45%;当温度是35 ℃时,致死率分别为85.23%。当温度为40 ℃时,致死率为91.78%。40 ℃以上绝大部分菌体死亡。对综合考虑突变率与致死率,选择35 ℃为诱变温度。

表1 诱变后菌株对指示菌的抑菌圈直径比较
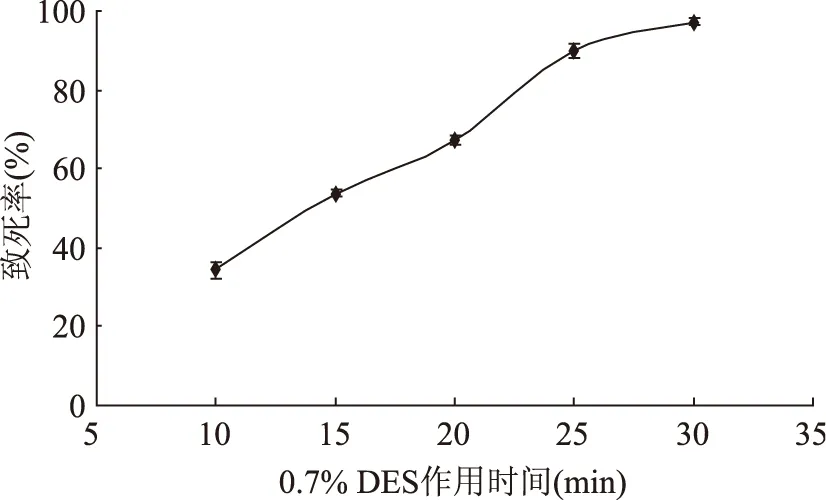
图4 DES诱变时间对Lactobacillus plantarum 163致死率的影响Fig.4 Effect of treated time by DES on lethal rateof Lactobacillus plantarum 163
注:
注:同行比较不同字母表示在0.05水平差异显著,下同。

图5 DES诱变温度对Lactobacillus plantarum 163致死率的影响Fig.5 Effect of treated temperature by DESon lethal rate of Lactobacillus plantarum 163
根据以上实验结果可以得出最佳DES诱变条件:DES浓度为0.7%、处理时间25 min、诱变温度35 ℃为最佳条件。
2.4 DES诱变结果
先将原始菌株进行60Coγ射线诱变,得到的抑菌圈较大的菌株进行DES诱变,从初筛中挑取活性较高的菌进行复筛,然后将复筛得到活性较高的菌株中大约6株进行多次复筛,通过抑菌圈直径比较,发现编号L150菌株发酵上清液的抑菌效果较好。
2.5 抑菌相对效价的定义
通过不同浓度的Nisin的抑菌圈的测定,本实验测得回归方程为:Y=0.2549x+0.03,R2=0.9954。式中:Y表示效价的对数值;x表示抑菌圈直径,mm。利用Nisin标准曲线法来测定各突变菌株所产Plantaricin 163-1的相对效价的变化。以Nisin效价作为参照指标,Nisin效价的对数作为纵坐标,抑菌圈直径为横坐标,做抑菌效价的曲线。由图6可见,标准效价的对数与抑菌圈直径之间呈线性关系,相关系数为0.99,符合进一步实验的要求。

图6 Nisin 标准效价曲线Fig.6 The standard titer curve of Nisin
2.6 复合诱变后各菌株的相对效价
将抑菌圈直径代入回归方程,得到图6中突变菌株细菌素的相对效价值。其中,相对效价最高的是L150,为1591.02 U/mL,次之为L113,为1553.45 U/mL。原始菌株的所产细菌素的相对效价为753.87 U/mL。L150产Plantaricin 163-1的相对效价是原始菌株的2.11倍。
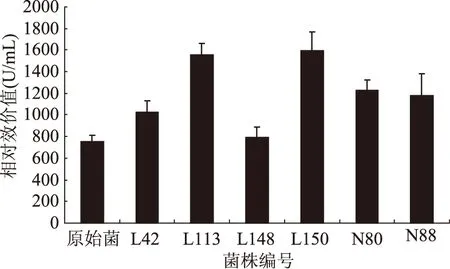
图7 复合诱变各菌株的相对效价Fig.7 Relative potency of different strainsafter compound mutation
2.7 遗传稳定性实验
为观察筛选得到的较高正突变菌株L150的遗传稳定性,进行遗传稳定性实验,传5代培养,抑菌实验短小芽孢杆菌为指示菌,结果如表2所示。
诱变后的菌株做完抑菌实验后,其传代过程中波动很小,处于稳定状态。利用Nisin标准曲线法,所计算出的相对效价也相对稳定,由此可以得出所筛得的菌株具有较好的遗传稳定性。因此,挑选L150诱变菌株作为今后进一步研究的实验菌株。如图8所示。

表2 诱变菌株L150遗传稳定性
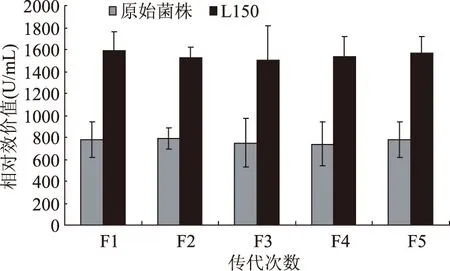
图8 L150的遗传稳定性Fig.8 Genetic stability of L150 after five generation
3 讨论
Lb. Plantarum163是一种能产生新型细菌素Plantaricin 163-1的Lb. plantarum,该菌株所产的细菌素具有广谱抑菌、安全可食用等诸多优点,因而在食品工业上有良好的应用前景。由实验的结果可以看出,利用γ射线复合DES诱变对Lb. plantarum 163进行诱变是一种可行有效的手段。
野生型乳酸菌经长期自然选择,能够适应周围环境与其他物种的竞争。但是,却不能按照人们的需要生产所需的物质。通过诱变和筛选的随机选择,可以提高现有发酵物质的相对效价。随着人们对基因工程越来越多的应用,诸多利用基因组改组技术成功的例子,该方法可以将不同方法获得的优良突变菌株进行基因重组。因此,下一步的实验工作可以考虑基因组改组,利用原生质体融合等手段进一步提高菌株产细菌素的相对效价。另外,可以将基因组改组技术与代谢工程相结合[20],分析其表型的改善与代谢途径的分子机制。通过比较蛋白质组学分析其出发菌株与突变菌株,探究高产的机理性问题。
4 结论
本实验采用60Coγ诱变结合DES诱变手段,通过合理的致死率得到最佳诱变条件,即诱变剂的浓度、诱变时间和作用温度。60Coγ射线的辐照剂量为0.6 kGy处理后,再结合硫酸二乙酯诱变。DES诱变剂的体积分数为0.7%、作用时间为25 min、反应温度为35 ℃。在此条件下获得突变菌株。从大量诱变菌株中筛选抑菌圈较大的6株进行复筛,最后由琼脂扩散法和Nisin标准曲线法测定相对效价,确定突变菌株L150为实验所获得的Plantaricin 163-1相对效价提高的菌株。在相同培养条件下,突变株L150产生Plantaricin 163-1的相对效价是原始菌株的相对效价的2.11倍。经过5次连续传代,该菌株产生的细菌素抑菌圈直径和相对效价较稳定,证明其具有良好的遗传稳定性。
[1]Dalié D K D,Deschamps A M,Richard-Forget F. Lactic acid bacteria-Potential for control of mould growth and mycotoxins:A review[J]. Food control,2010,21(4):370-380.
[2]Schnurer J,Magnusson J. Antifungal lactic acid bacteria as biopreservatives[J]. Trends in Food Science & Technology,2005,16(1-3):70-78.
[3]Perlak F J,Dwaton R W,Armstrong T A.Insect resistant cotton plants[J]. Biotechnol,1990,8(10):939-943.
[4]Perdigon G,Fuller R,Raya R. Lactic Acid Bacteria and Their Effect on the Immune System[J]. Curr Issues Intest Microbio1,2001,2(1):27-42.
[5]潘天太,还连栋,何松.一种天然的食品防腐剂-Nisin[J].肉类工业,1992(3):20.
[6]Hu M,Zhao H,Zhang C,et al.Purification and characterization of plantaricin 163,a novel bacteriocin produced byLactobacillusPlantaricin163 isolated from traditional Chinese fermented vegetable[J]. Journal of agricultural and food chemistry,2013,61(47):11676-11682.
[7]胡美忠.Lactobacillusplantarum163分离鉴定及其细菌素研究[D].南京:南京农业大学,2014.
[8]徐晶雪,邹积宏,袁杰利. 降胆固醇乳酸菌的筛选及应用的研究进展[J]. 中国微生态学杂志,2009,21(6):570-571.
[9]张红丹,杜茜,张正坤,等.放线菌769抑菌谱及液体培养生长曲线的测定[J]. 中国植保导刊,2010,3(7):5-9.
[10]Gong H S,Meng X,Wang H. Plantaricin MG active against Gram-negative bacteria produced byLactobacillusplantarumKLDS1.0391 isolated from “Jiaoke”,a traditional fermented creamfrom China[J].Food control,2010,21(1):89-96.
[11]Jagadeeswari S,Vidya P D J,Mukesh Kumar D J,et al.Isolation and characterization of bacteriocin producingLactobacillussp. from traditional fermented food[J]. Electronic journal of environment,agricultural&food chemistry,2010,9(3):575-581.
[12]吕燕妮.戊糖乳杆菌31-1菌株产细菌素研究[D].北京:中国农业大学,2004.
[13]Delgado A,Brito D,Fevereiro P,et al. Bioactivity quantification of crude bacteriocin solutions[J]. Microbiological Methods,2005,(2):121-124.
[14]刘国荣,周康,李平兰,等.传统干酪中一株产Ⅱa类细菌素乳酸菌的分离与鉴定[J].食品科学,2007,28(5):185-190.
[15]陈洪卫,陈林海,张国只. 低能氮离子注入诱变选育乳链菌肽产生菌的研究[J].食品科学,2009,30(7):177-180.
[16]陈志刚,巴吐尔,罗红霞.硫酸二乙酯诱变保加利亚乳杆菌最佳条件的研究[J].农产品加工(上),2008,12:65-67.
[17]诸葛建. 工业微生物实验技术手册[M].北京:中国轻工出版,1994:145-147.
[18]施巧琴,吴松刚.工业微生物育种学[M].第三版.北京:科学出版社,2009:121-122.
[19]张玉梅,李军,国石磊,等.复合诱变选育酸性蛋白酶缺陷菌株[J].食品科技,2014,39(5):15-19.
[20]Santos C N,Stephanopoulos G. Combinatorial engineering of microbes for optimizing cellular phenotype[J]. Curr Opin Chem Biol,2008,12(2):168-176.
Screening of High-yeilding Plantaricin 163-1 Strains induced by60Coγ-ray and Diethyl sulfate
DANG Li-juan,GAO Yu-qi,BIE Xiao-mei,LV Feng-xia,ZHAO Hai-zhen,LU Zhao-xin*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
To obtain high yield and stable strain for the production of plantaricin 163-1,60Coγ-ray and Diethyl sulfate were employed to induceLactobacillusplantarum163 to enhance the production of a novel bacteriocin Plantaricin 163-1.Through the method60Coγ-ray and diethyl sulfate(DES)mutagenesis,the optimum parameters of60Coγ-ray and diethyl sulfate was determined by observing the lethal rate of each methods,which irradiation dose of60Coγ-ray was 0.6 kGy and DES treatment was 0.7%,treated for 25 min,at 35 ℃. At last,the high-yielding mutant strain L150 was obtained and had stable inheritance. The antibacterial activity of the mutant L150 was 2.11 times comparison with original strain.
Lactobacillusplantarum;bacteriocin;mutant;diethyl sulfate
2014-11-24
党丽娟(1989-),女,在读硕士研究生,研究方向:食品科学,E-mail:2011108026@njau.edu.cn。
*通讯作者:陆兆新 (1957-),男,博士,研究方向:酶工程、食品微生物、农产品加工,E-mail:fmb@njau.edu.cn。
国家科技部支撑计划(2011BAD23B05)。
TS201.3
A
1002-0306(2015)15-0174-06
10.13386/j.issn1002-0306.2015.15.029
