水热法合成纳米LiFePO4材料
2015-08-01查红英邓伯华
汪 勇, 陈 恳, 查红英, 邓伯华
(武汉理工大学理学院应用化学系,湖北武汉430070)
水热法合成纳米LiFePO4材料
汪 勇, 陈 恳, 查红英*, 邓伯华
(武汉理工大学理学院应用化学系,湖北武汉430070)
采用水热法合成纳米LiFePO4材料并研究了反应溶液pH值和温度对LiFePO4材料颗粒形貌、微观结构和电化学性能的影响。控制Li∶Fe∶P摩尔比为3∶1∶1,按照先混合LiOH与H3PO4溶液后加入FeSO4溶液的投料顺序,在溶液pH值为6.0以上可以得到结晶度好且比容量较高的纳米级LiFePO4材料。pH为6.0和180℃条件下得到的是LiFePO4纳米薄片,调整反应溶液pH值为中性和弱碱性,或控制反应温度在140℃以下或者200℃以上,LiFePO4材料可能是方形或者形貌不规则的纳米颗粒。电化学测试结果表明,颗粒形貌方形或者不规则的LiFePO4材料大电流放电性能优于薄片状纳米材料。
锂离子电池;LiFePO4;纳米材料;水热法
自1997年Goodenough等报道橄榄石型磷酸铁锂材料作为锂离子电池正极材料以来,LiFePO4的合成和电化学研究等引起了广泛的关注[1-2]。磷酸铁锂材料不仅具有较高的质量比容量和优异的循环稳定性,而且还有安全性高、环境友好和原材料来源丰富等优点。其主要缺点是大电流放电性能较差,这是由于磷酸铁锂材料较差的电子导电能力和较低的锂离子扩散速率。通过表面包碳处理能够改善磷酸铁锂的表面电子导电性能,从而很大程度提高大电流放电性能,但是包碳会导致体积比容量下降[2-3]。目前表面包碳磷酸铁锂材料已经应用在锂离子电池实际生产中,如矿灯、储能和动力用锂离子电池等的正极材料。此外,通过减小磷酸铁锂材料内部锂离子扩散路径,如制备纳米级LiFePO4材料,可以一定程度改善大电流放电性能[4]。目前应用广泛的磷酸铁锂制备方法中有固相高温烧结和碳热还原法,由于高温处理时候需要惰性气体保护,使得磷酸铁锂材料成本较高。此外,由于固相反应的均匀性等问题,实际生产中可能出现材料性能批次稳定性问题。近年来,水热法合成磷酸铁锂材料引起较大关注[5-7]。水热合成法具有方法简便,不需要高温烧结和惰性气体保护,合成颗粒大小可控等优点。
2001年Whittingham研究组首次报道了水热合成磷酸铁锂方法,由于合成条件没有优化,他们合成的材料可逆放电比容量较低,约100 mAh/g[5]。2006年Whittingham等人改进了实验方法,合成了可逆比容量达140 mAh/g的磷酸铁锂材料[6]。与此同时,Dokko等人也采用水热法成功合成出比容量较高的LiFePO4材料,并且优化条件下合成的材料比容量可达160 mAh/g[7]。但是,采用水热法合成比容量较高的LiFePO4材料需要原料中的Li∶Fe∶P的摩尔比为3∶1∶1,这样锂原料有较大的浪费,会增加水热法合成材料的成本。为了减少锂盐的用量,已有研究者对传统水热法进行改进,如采用水和有机溶剂混合或者纯有机溶剂的溶剂热法合成LiFePO4[8-9]。此外,Dokko等研究发现Li∶Fe∶P的摩尔比、溶液pH等因素不仅对水热法合成LiFePO4材料的电化学性能主要是容量有较大影响,而且对材料颗粒大小和形貌有明显的影响[7]。本文将进一步研究不同水热反应条件对LiFePO4材料形貌和电化学性能的影响,并在此基础上控制合成纳米级LiFePO4材料。
1 实验
以分析纯原料分别配置LiOH溶液,H3PO4溶液,FeSO4和抗坏血酸的混合溶液(摩尔比1∶0.05)。首先取一定量的LiOH溶液,慢慢加入适量的H3PO4溶液,得到白色沉淀。搅拌一段时间后,再向白色沉淀中慢慢加入适量的FeSO4和抗坏血酸混合溶液。上述实验过程中严格控制Li∶Fe∶P的投料摩尔比为3∶1∶1。之后,继续加入适量的LiOH或H3PO4溶液调节溶液pH值,通氩气30 min后将反应混合物迅速转入水热反应釜。控制一定的水热反应温度并保温一段时间。反应后反应釜自然冷却至室温,过滤得到固体样品,用去离子水和无水乙醇分别洗涤3次,然后在80℃条件下真空干燥5 h,将干燥样品称重。
将新制水热合成样品进行XRD、SEM和电化学性能测试表征。粉末X射线衍射测试采用德国Bruke公司的D8Aavance型X射线衍射仪,测试条件为:Cu靶Kα射线,40 kV管压,电流为40 mA,扫描步长为0.02°,扫描范围5°~75°。SEM表征仪器是采用JSM-5610LV型扫描电子显微镜 (SEM)或者S4800型场发射扫描电子显微镜(FESEM)。电化学性能测试采用自制的CR-2032模拟扣式电池在LandCT2001A测试系统上进行。模拟扣式电池制作步骤如下[10]:准确称量约20 mg正极材料,与约14 mg粘结剂TAB(聚四氟乙烯化乙炔黑)混合碾磨成片状(面积约1 cm2),然后将其压在不锈钢网上作为正极。将正极,隔膜,电池壳在真空干燥箱中150℃干燥5 h后放入充满氩气的手套箱。采用金属锂片为负极,电解液是1 mol/L LiPF6/(EC+DMC)(质量比为1∶1)。将正极、负极、隔膜和电解液在惰性气氛手套箱中组装CR-2032型扣式电池。对电池进行恒流充放电测试,电压测试范围为2.5~4.2 V。
2 结果与讨论
2.1 水热反应溶液pH值影响
图1是不同pH条件下(180℃保温20 h)得到的LiFePO4样品电化学充放电曲线,充放电速率为10 mA/g(约0.05)。从图1可见,在pH=5.0时得到的材料可逆放电比容量较低,约15 mAh/g,说明样品中大部分物质可能是没有电化学活性的杂质。当pH升高到5.5时,样品比容量可达100 mAh/g,这说明样品中可能还存在部分杂质。当pH=6.0时,比容量可达150 mAh/g,说明合成了纯度很高的LiFePO4材料。继续提高pH值,比容量开始下降,可能是存在少量杂质,尽管在图2的XRD结果中没有看到杂质峰。图2是不同pH值条件下得到样品材料的XRD图,对比文献资料可知,pH在5.0~8.0条件下能够得到橄榄石结构的LiFePO4材料。同时,在pH为5.0和 5.5条件下的样品XRD图都有明显的杂质峰出现,而且杂质峰越高对应的材料电化学比容量越低。在pH为6.0、7.0和8.0条件下得到的材料没有看到杂质峰,样品比容量也较高。
表格1中总结了XRD数据的分析和计算结果。从表1可见,pH=5.0条件下LiFePO4材料的晶胞参数值较大,较高pH条件下得到的材料晶胞参数基本相同。此外值得注意的是,随着pH值升高101峰尖锐程度的变化,XRD衍射峰尖锐程度由该衍射峰的半峰宽除以峰高度判断。由表2结果可知,随着pH值的提高101峰尖锐程度上升,pH=6.0时101峰尖锐程度最高,继续提高pH值后101峰尖锐程度下降,说明pH=6.0条件下合成的材料结晶度最高。图3比较了不同pH值对LiFePO4颗粒形貌的影响。在酸性较强的条件下如pH=5.5时,得到的材料颗粒较大(2~5µm),颗粒形貌呈不规则块状堆积。在pH=6.0时,颗粒平均粒径约200 nm且分布较均匀,大部分颗粒是棱角分明的薄片,厚度约80 nm。进一步提高反应溶液pH至7.0和8.0后,样品颗粒大小与pH=6.0基本相同,但是颗粒形貌不规则,且表面光滑看不到棱角。

图1 不同pH下LiFePO4材料的首次循环充放电曲线

表1 不同反应条件下LiFePO4材料的XRD数据分析
由上述结果可知,反应溶液pH值对LiFePO4的形貌,微观结构组成和电化学性能有较大影响。在弱酸性条件下如pH=6.0有利于形成结晶度较高的LiFePO4材料,但是pH太低反而不利于生成LiFePO4,样品中存在较多杂质。这可能是由于弱酸性条件有利于反应前驱体(固体沉淀颗粒)的溶解,从而再转化生成LiFePO4。如果溶液酸性较强,LiFePO4相对容易分解,LiFePO4再沉淀结晶颗粒较大,易夹杂其它杂质;如果溶液碱性太强不利于前驱体溶解并转化为LiFePO4而残存少量杂质。从颗粒大小变化分析,控制溶液pH在6.0以上可得到纳米级LiFePO4材料,在pH6.0条件下可以得到纳米级薄片。

图3 不同pH下LiFePO4材料的SEM图
2.2 水热反应温度的影响
图4是控制反应溶液pH值为6.0在不同温度下得到的LiFePO4样品的电化学充放电性能曲线。从中可见100℃材料在3.4 V放电平台没有容量,说明样品中没有生成LiFePO4。该材料在3.0 V下的放电比容量可能与样品中存在少量Li3Fe2(PO4)3或其它三价铁氧化物有关[5]。110℃样品可逆放电比容量达到100 mAh/g,升温至120℃比容量反而下降至65 mAh/g左右。提高反应温度到140℃或者160℃,可逆放电比容量在135 mAh/g左右,说明在140~160℃能够得到纯度较高的LiFePO4样品。控制反应温度在180~220℃之间,LiFePO4样品比容量能够达到150 mAh/g以上。

图4 不同温度下LiFePO4材料的首次循环充放电曲线
图5是不同温度下得到的LiFePO4样品XRD图。从图5可见,除了100℃外,110℃及更高温度下得到的样品都可以看到典型的LiFePO4特征衍射峰,这说明能够生成LiFePO4的最低温度是110℃,其它文献也证实生成LiFePO4的最低温度是105℃左右。这些结果都说明水热法能够生成LiFePO4的最低温度在100~110℃之间。此外,在110和120℃下得到的样品XRD图可见明显的杂质峰,而140℃以上则杂质峰不太明显或者没有。这说明140℃以上合成的LiFePO4纯度较高,这与图4的电化学充放电结果一致。从表1中的分析数据可见,110和120℃得到的材料101衍射峰尖锐程度较140℃以上样品低,同时140℃以上样品101衍射峰尖锐程度基本相同。XRD结果和电化学充放电结果都说明,在140℃以上能够合成电化学比容量较高的LiFePO4样品,也就是说大部分前驱体材料能够转化为LiFePO4。
图6是不同温度下合成的LiFePO4样品的SEM图。从图6可见,110℃样品是方形LiFePO4颗粒(200 nm左右)。随着温度升高,方形颗粒的棱角更加清晰,说明材料颗粒结晶度提高。到140℃以上,LiFePO4晶体生长出现片状化趋势,180℃左右大部分颗粒是纳米薄片(见图3)。但是在更高温度下如200℃,样品表面的棱角反而消失,样品颗粒表面光滑且形状不规则。这可能是高温下时水蒸气压力较高,LiFePO4晶体生长倾向于各向均匀生长,不再是二维片状生长。
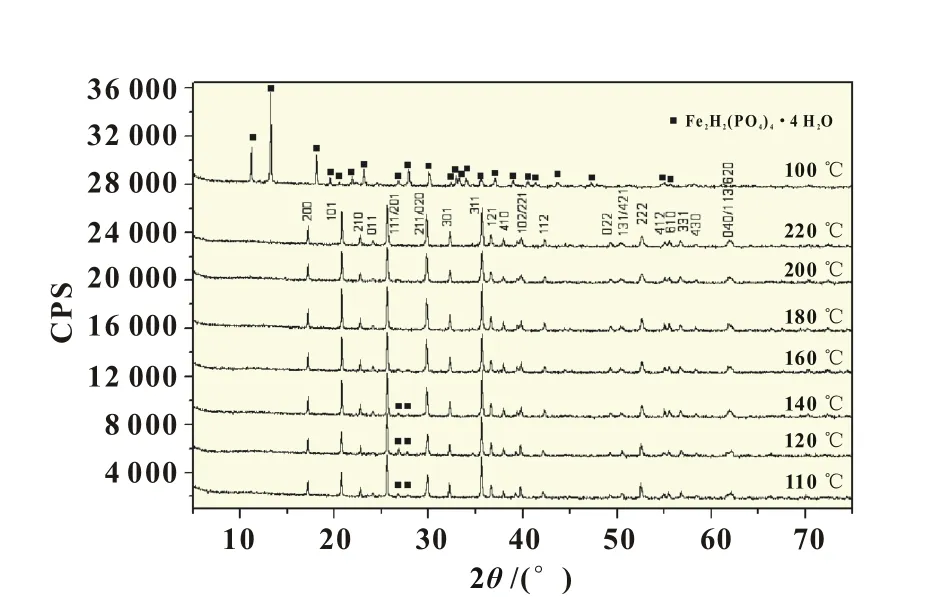
图5 不同温度下LiFePO4材料的XRD图

图6 不同温度下LiFePO4材料的SEM图

图7 200℃下LiFePO4材料在不同放电速率下的放电曲线
图7是200℃(pH=6.0)样品在不同放电速率下的放电曲线比较,图7和表2中的放电比容量数据是以0.05充电至4.2 V后以不同倍率放电至2.5 V测得。从图7可见,随着放电倍率的提高,放电曲线的平台电压降低,比容量减少。当放电倍率为2.5时(约400 mA/g),可逆放电比容量约85 mAh/g,相当于0.05时可逆容量的56%左右。表2比较了容量较高样品的大电流放电性能。从表2可见,200℃样品大电流放电性能最好,180℃样品大电流放电性能最差。结合前面关于不同温度对样品微观结构组成和表面形貌的影响,初步判断二维生长的片状材料不利于大电流放电性能的提高,而倾向于各向均匀生长的形貌不规则的样品(更接近球形)或者方块形材料的大电流性能较好。由于不同温度下得到的材料颗粒大小比较接近,平均粒径约200 nm左右,也就是说锂离子扩散距离相当。所以,影响上述不同材料大电流放电性能的主要因素可能是表面电子导电性能的不同,且各向均匀生长的材料电子导电性能较好。有关晶体生长取向对电子导电性能的影响还有待后续研究进行分析。
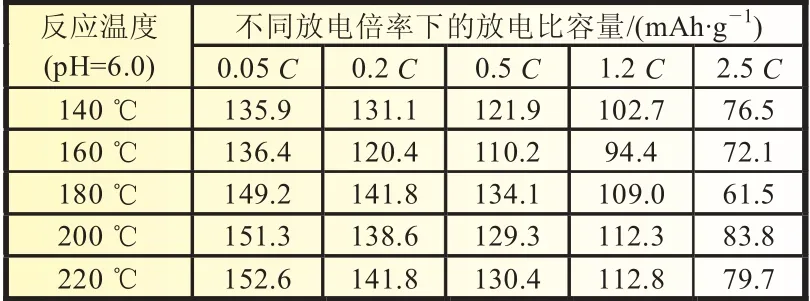
表2 不同温度下LiFePO4材料大电流放电性能比较
3 结论
本文实验结果和相关表征分析表明,按照先混合LiOH与H3PO4溶液后加入FeSO4溶液的顺序(Li∶Fe∶P摩尔比为3∶1∶1),控制水热反应溶液pH值和温度能够合成不同形貌的LiFePO4纳米材料。在pH=6.0和180℃时可以得到棱角清晰的纳米LiFePO4薄片,提高pH值后颗粒形貌不规则且表面光滑。控制反应温度在140℃以下,LiFePO4材料的形貌为方块形,200℃以上形貌不规则。大电流放电结果表明,形貌不规则(更接近球形)或者方块形的LiFePO4纳米材料大电流性能比薄片状材料好,这可能与各向均匀生长的材料(类球形或者方块形)其电子导电性能较好有关。
[1]PADHU A K,NANJUNDASWAMY K S,GOODENOUGH J B. Phospho-o-livines as positive-electrode materials for rechargeable lithium bat-teries[J].Journal of the Electrochemical Society,1997, 144(4):1188-1194.
[2]ZHANG W J.Structure and performance of LiFePO4cathode materials:a review[J].J Power Source,2011,196:2962-2970.
[3]DOHERTY C M,CARUSO R A,SMARSKY B M,et al.Hierarchically porous monolithic LiFePO4/Carbon composite electrode materials for high power lithium ion batteries[J].Chem Mater,2009, 21:5300-5306.
[4]SUN C W,RAJASEKHARA S,GOODENOUGH J B,et al.Monodisperse porous LiFePO4microspheres for a high power Li-ion battery cathode[J].J Am Chem Soc,2011,133:2132-2135.
[5]YANG S F,ZAVALIJ P Y,WHITTINGHAM M S.Hydrothermal synthesis of lithium iron phosphate cathodes[J].Electrochemistry Communications,2001,3(9):505-508.
[6]CHEN J J,WHITTINGHAM M S.Hydrothermal synthesis of lithium iron phosphate[J].Electrochemistry Communications,2006,8 (5):855-858.
[7]KAORU D,SHOHEI KHIROYUKI N,et al.Particle morphology, crystal orientation,and electrochemical reactivity of LiFePO4synthesized by the hydrothermal method at 443 K[J].J Mater Chem,2007,17:4803-4810.
[8]宋杨,赵浩川,郭孝东,等.改良水热法合成磷酸铁锂的研究[J].电源技术,2011,35(7):806-808.
[9]LIM J,GIM J,KANG S W,et al.Synthesis of LiFePO4nanoparticles and crystal formation mechanism during solvothermal reaction[J].J Electrochem Soc,2012,159(4):A479-A484.
[10]DENG B,NAKAMURA H,YOSHIO M.Capacity fading with oxygen loss for manganese spinels upon cycling at elevated temperatures[J].J Power Sources,2008,180:864-868.
Hydrothermal synthesis of LiFePO4nano-materials
WANG Yong,CHEN Ken,ZHA Hong-ying*,DENG Bo-hua
LiFePO4nano-materials for Li-ion battery were prepared by hydrothermal method,and the effects of pH value and reaction temperature on the particle morphology,structural composition and electrochemical properties of the LiFePO4material were investigated.With the final molar ratio of 3∶1∶1 for Li∶Fe∶P by adding FeSO4solution into the mixture of LiOH and H3PO4solutions,nanoparticles of LiFePO4with well crystallinity and high special capacity were obtained by regulating pH values to above 6.0.The flake-like LiFePO4nano-materials were prepared at pH 6.0 and 180℃. The particle morphology was rectangular-like or irregular if regulating pH values to above 7.0 or controlling hydrothermal reaction temperatures to higher than 200℃or below 140℃.The electrochemical results show that the high rate capability of LiFePO4nano-materials with rectangular-like or irregular shape is better than that of flake-like nano-materials.
Li-ion battery;LiFePO4;nano-materials;hydrothermal synthesis
TM 912.9
A
1002-087 X(2015)04-0688-03

2014-09-04
汪勇(1986—),男,湖北省人,硕士生,主要研究方向为电池材料。
查红英,E-mail:dengbh@qq.com
