乳腺癌改良根治术后胸壁新发良性肿物的超声特征
2015-07-31朱庆莉姜玉新李建初王红燕游珊珊
杨 倩,朱庆莉,姜玉新,李建初,张 璟,王红燕,游珊珊
(中国医学科学院 北京协和医学院 北京协和医院 超声诊断科, 北京 100730)
乳腺癌改良根治术后胸壁新发良性肿物的超声特征
杨 倩,朱庆莉,姜玉新*,李建初,张 璟,王红燕,游珊珊
(中国医学科学院 北京协和医学院 北京协和医院 超声诊断科, 北京 100730)
目的探讨乳腺癌改良根治术后胸壁新发良性肿物的超声表现特点。方法回顾性分析19例乳腺癌改良根治术后胸壁新发肿物并被病理证实为良性患者的超声表现及临床病理特征。结果19例患者乳腺癌改良根治术后3个月~10年胸壁新发良性肿物,其中73.7%(14/19)集中于术后2年内,24个病灶大小4.0~45.0 mm,术后病理诊断证实: 45.8%(11/24)为脂肪坏死,33.3%(8/24)为炎性反应伴异物巨细胞反应,其他20.9%(5/24)。24个胸壁病灶术前超声正确提示11个(11/24,45.8%)为良性病变可能,其中脂肪坏死4个,超声表现:2个低或无回声,形态规则,边界清,未见血流;2个低回声,形态不规则,边界不清,内可见中高回声或钙化,未见血流。炎性反应伴异物巨细胞反应5个均为多发病灶,超声表现:3个伴显著后方回声衰减,2个呈中高回声,少或未见血流。1个脂肪瘤及1个纤维脂肪组织急性及慢性炎性反应均表现为中高回声。结论乳腺癌改良根治术后患者胸壁新发良性肿物的时间多在手术后2年内,病理类型复杂,多见脂肪坏死或炎性反应伴异物巨细胞反应,超声表现多样,需依靠病理明确诊断。
超声;乳腺癌;胸壁良性肿物
乳腺癌是女性最常见的恶性肿瘤之一,目前国内多采用根治术及改良根治术作为临床首选治疗方法并辅以放、化疗。术后患者胸壁新发肿物仍较常见,部分肿物为乳腺癌局部复发[1- 2],部分为良性肿物,其鉴别诊断直接影响患者的临床诊治,有重要的临床价值。超声是乳腺癌改良根治术后患者胸壁检查的重要影像学检查方法。然而,目前针对乳腺癌改良根治术后胸壁新发良性肿物超声表现的相关报道较少,本研究对因乳腺癌改良根治术后胸壁新发肿物就诊北京协和医院、术后病理证实为良性的19例患者的临床、病理特征及超声声像图表现进行总结分析,报告如下。
1 材料与方法
1.1 研究对象
2000年1月至2014年11月因乳腺癌改良根治术后胸壁新发肿物就诊北京协和医院术后、病理证实为良性的患者19例,均为女性,年龄31~74岁,平均(54.4±11.5)岁。就诊时距离原发癌手术时间间隔3个月~10年,中位时间11个月。其中术后第1年内10例(10/19,52.6%),1~2年间4例(4/19,21.1 %),2年以上5例(5/19,26.3%)。本研究获得北京协和医院伦理委员会批准。
1.2 仪器与方法
用GE Logiq 700、GE logiq 9、Philips iU22、Siemens 2000型彩色多普勒超声诊断仪,实时高频线阵探头,频率10~18 MHz。发现胸壁病灶,观察病灶大小、部位、组织层次、回声、形态、边界、内部回声、后方回声、有无钙化、彩色多普勒血流成像状况等。按Adler半定量法[3]对病灶内血流信号的丰富程度进行分级:0级:病灶内未见血流信号;I级:病灶内见少量血流信号,为1~2处点状血流信号,管径﹤1.0 mm;Ⅱ级:病灶内见中量血流信号,为1条主要血管,其长度超过病灶的半径,或为1~2条小血管;Ⅲ级:病灶内见丰富血流信号,为4条以上血管或血管相连通交织成网状。
1.3 病理检查
胸壁病灶手术切除病变组织均行病理检查。
2 结果
2.1 一般情况
19例患者共计24个病灶,其中15例为单发病灶,4例为多发病灶。临床表现主要为乳腺肿物,其中临床可触及者15例(18个病灶),临床不可触及者4例(6个病灶)。24个病灶大小4.0~45.0 mm,中位大小10.0 mm。所有患者均行胸壁病灶切除术后病理诊断为良性病变,其中脂肪坏死11例(11个病灶),炎性反应伴异物巨细胞反应4例(8个病灶),其他4例(5个病灶)。
2.2 胸壁新发良性肿物超声声像图表现
2.2.1 脂肪坏死11个病灶表现:以不均质低回声为主,少见混合回声及无回声,结节后方回声增强(1个)或衰减(2个),3个内部见条状钙化(图1),内部未见血流或边缘少许血流(表1)。
2.2.2 炎性反应伴异物巨细胞反应8个病灶表现:多呈不均质低回声,部分可见中高回声,形态不规则,边界不清, 3个后方回声衰减(图2);内部未见血流或边缘少许血流(表1)。
2.2.3 纤维化2个病灶均表现为均质低回声,形状不规则,边界不清,1个未见血流,1个仅见边缘血流;1个脂肪瘤病灶表现为均质中高回声,形态规则,边界清晰,内见少许血流;1个淋巴结反应性增生病灶表现为均质低回声,形态规则,边界清晰,内见较丰富血流;1个纤维脂肪组织急性及慢性炎性反应病灶表现为不均质中高回声,形态不规则,边界不清,内未见血流(表1)。
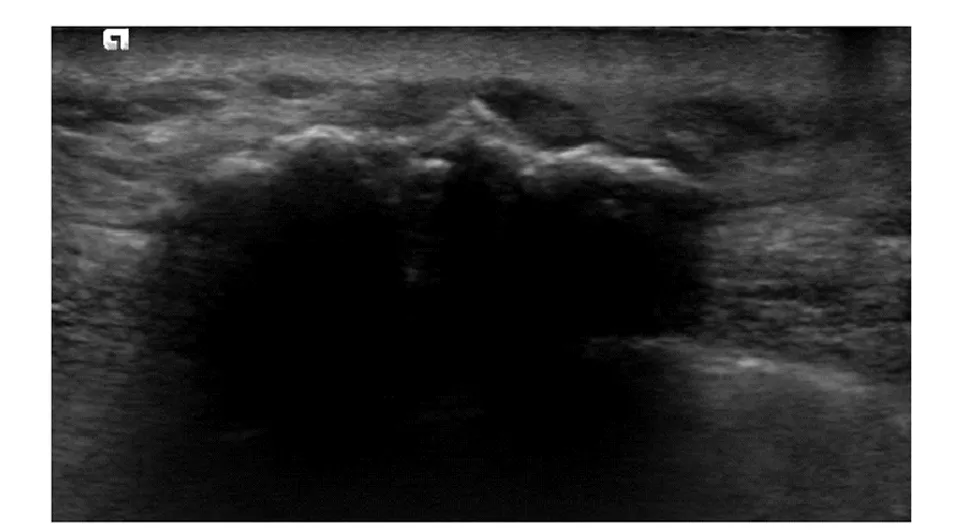
A 57-year-old female who underwent right mastectomy 120 months previously; US showed a hypoechoic lesion in the subcutaneous soft tissue on the right chest wall, size of 45.0 mm×19.0 mm, irregular in shape, indistinct margin, multiple calcifications at the front edge of the lesion with posterior acoustic shadowing and no blood flow signal; final pathologic examination revealed fat necrosis with formation of granulation tissue and a large number of calcifications图1 脂肪坏死声像图Fig 1 Ultrasonographic features of fat necrosis
2.3 病理检查与超声特征关系
24个胸壁病灶术前超声正确提示11个(11/24,45.8%)为良性病变可能(表2);提示为结节良恶性待定6个(6/24,25.0%);误诊为乳腺癌术后胸壁复发7个(7/24,29.2%)。
3 讨论
乳腺癌术后超声检查是发现复发病灶的最主要影像学方法。在乳腺癌术后复查的检查方法中,超声对较早发现胸壁病灶比临床触诊、乳腺钼靶摄影及乳腺核磁更具优势[4],本研究中6个病灶临床触诊不清,仅超声检查发现病灶大小5.0~20.0 mm,但超声检查易存在一些假阳性结果。本研究在对24个胸壁新发病灶术前超声与术后病理诊断结果对照分析中发现,术前超声正确提示良性病变仅11个,占45.8%,性质待定或误诊为复发病灶的13个,占54.2%,这13个病灶的病理结果分别为脂肪坏死7个,炎性反应伴异物巨细胞反应3个,纤维化2个,淋巴结反应性增生1个。本研究通过对乳腺癌根治术后胸壁良性肿物的超声表现及病理特征总结分析,意在为超声工作者对胸壁新发良性肿物的诊断上提供经验,提高诊断准确率,为良性肿物临床随诊观察及恶性复发患者进一步检查提供判断依据。
本研究中患者就诊距离原发癌手术时间间隔多在术后2年内14例,占73.7%,其中术后第一年呈高峰期,达10例,占52.6 %。新发病灶主要病理类型为脂肪坏死11个,炎性反应伴异物巨细胞反应8个,与文献报道相符[5- 6]。
脂肪坏死常发生于物理性损伤(如外伤、手术、细针穿刺和放疗)等,但约50%病例没有明确的损伤史,临床易误诊为乳腺癌[7]。本研究中患者均有乳腺癌改良根治术史,部分有术后放疗史,此为脂肪坏死高发的诱因。脂肪坏死病理表现以脂肪细胞坏死液化、慢性肉芽肿性炎性反应、囊肿形成及纤维化为主要特征。在本研究中,11个脂肪坏死的的病灶1个呈囊实性,表现为无回声壁上可见少许低回声;1个呈无回声,伴后方回声增强;9个低回声病灶中,3个病灶体积较大,大小2.4~4.5 cm,表现为形状不规则,边界不清,内部回声不均可见多个强回声,并其中2个伴有后方回声明显衰减,这3个病灶术前超声误诊为乳腺癌复发,术后病理显示为脂肪坏死伴肉芽组织形成,可见大量泡沫细胞、纤维化及钙化。综上可见,超声图像多种多样,差异较大,主要由于脂肪坏死的影像表现与病理基础密切相关。随着病情的发展程度不同,病理改变不一,而声像表现主要取决于脂肪坏死的纤维化、脂肪液化及钙化的程度。当病灶呈现很少或不存在纤维化反应时声像图多为典型的良性表现,边界清晰,形态规则,回声均匀;当病灶呈现较强烈纤维化反应,但未完全取代透声好的坏死的脂肪细胞时,会表现为周边有较厚的不规则,边界不清,似有毛刺的厚壁中等回声晕;当纤维化程度完全取代脂肪坏死则表现为不规则,似有毛刺的肿物伴较多的钙化,有些时候纤维化和钙化是晚期仅有的表现[8- 9]。
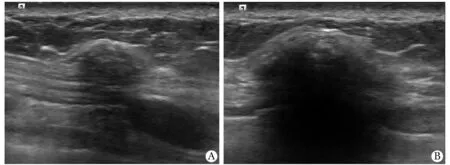
A 57-year-old female who underwent right mastectomy 24 months previously; US showed 2 hypoechoic lesions in the subcutaneous soft tissue on the right chest wall, size of 20.0 mm×7.0 mm(A) and 12.0 mm×6.0 mm(B), both irregular in shape, indistinct margin and no blood flow signal; final pathologic examination both revealed inflammation and foreign body giant cell reaction
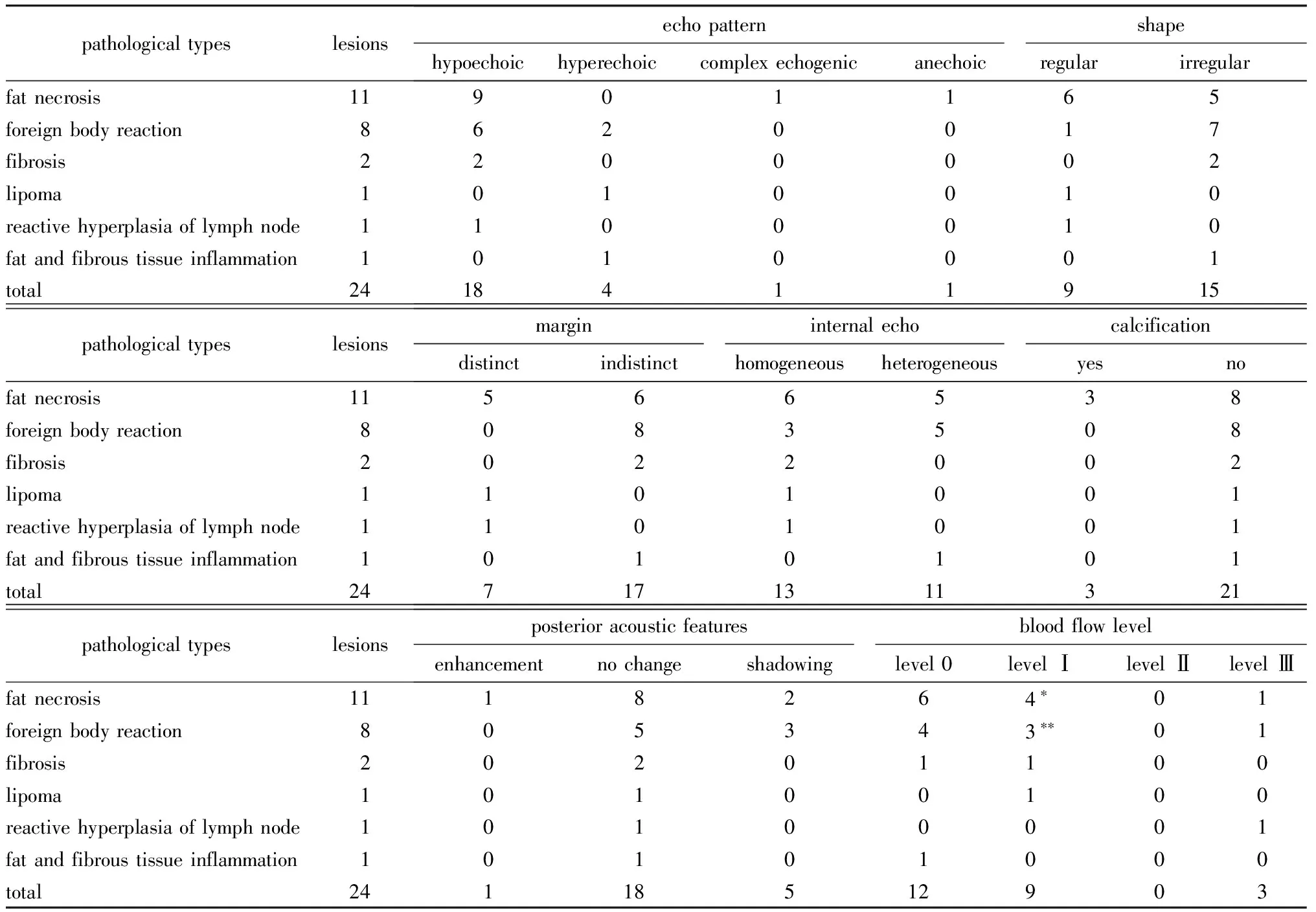
表1 24个胸壁新发良性病灶术前超声检查结果Table 1 Preoperative ultrasonography results of the 24 chest wall newly developed benign lesions (n)
*blood flow signal were all on the periphery of the lesions;**two had blood flow signal on the periphery of the lesions.
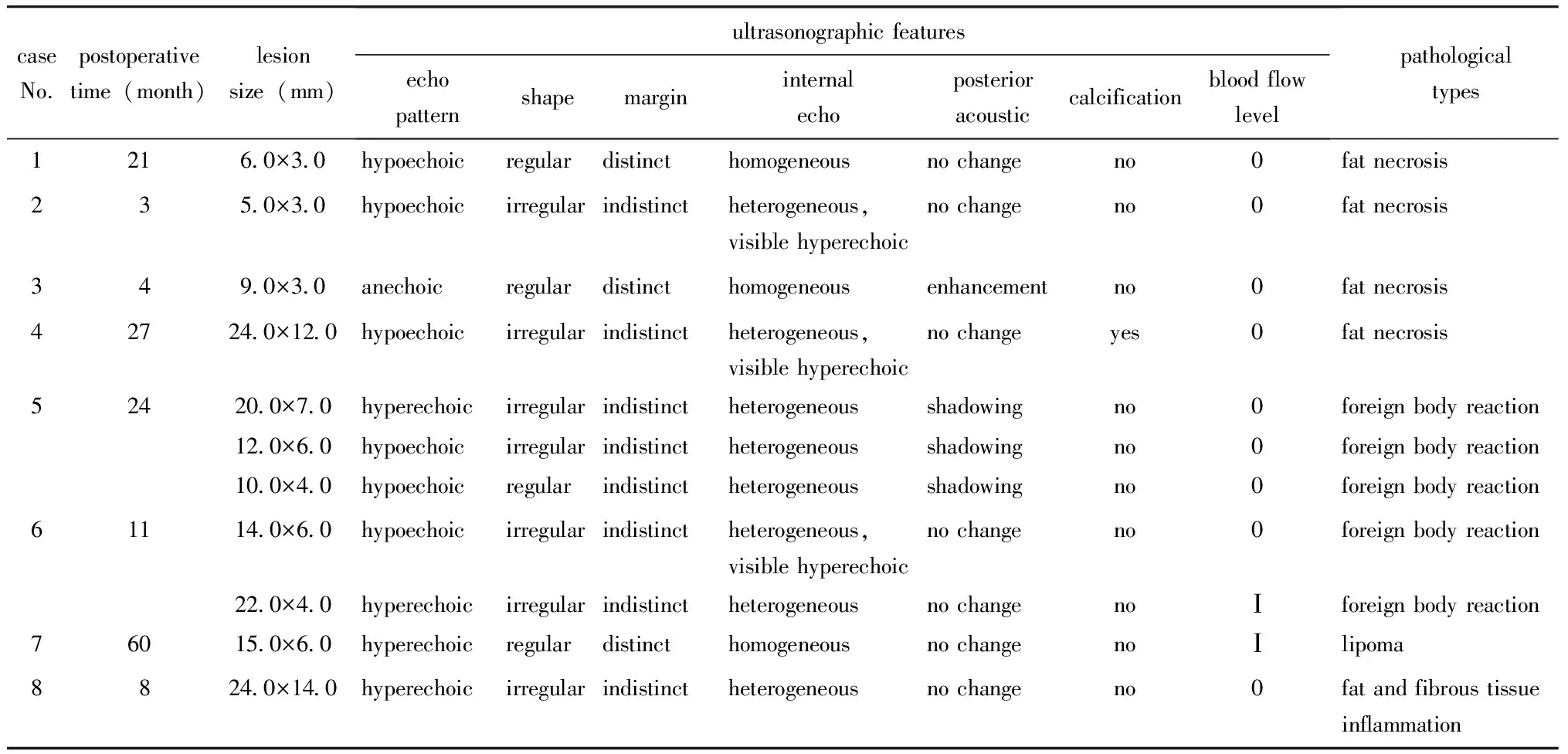
表2 术前超声正确诊断11个胸壁新发良性病灶临床、病理情况及超声表现
本研究中另一类较常见的病理类型为组织炎性反应伴异物巨细胞反应,多由手术缝线或手术中使用的龙胆紫残留机体引起组织炎性反应及异物巨细胞反应,有些进而形成异物性肉芽肿病变。本研究中此病理类型4例患者以多发常见,提示术后短时间胸壁多发低回声结节,长期随诊无明显变化,可能对诊断胸壁异物反应良性病变有帮助。除了上述两种主要的病理类型外,本研究中1个淋巴结反应性增生的病灶超声表现有丰富血流信号,术前超声受血流信号丰富的干扰考虑为乳腺癌复发,忽略了对正常淋巴结结构的观察,影响正常诊断。本研究中超声正确诊断了1个脂肪瘤的病灶,该病例距手术时间间隔60个月,结节临床触诊活动性好,且随访无明显增大;另1个纤维脂肪组织急性及慢性炎性反应的病灶,该病例距手术时间间隔8个月,结节临床触诊活动性差,有轻微触痛,上述结节超声表现均呈中高回声,后者无明显占位效应,与文献报道典型良性征象相符[10]。
综上所述,乳腺癌改良根治术后患者胸壁新发良性肿物的时间多在手术后2年内,病理多为脂肪坏死或炎性反应伴异物巨细胞反应,影像表现与病理基础密切相关,随病情进展程度不同,超声表现多样,诊断时应当密切结合临床特征,最终诊断需病理检查。
[1] Yilmaz MH, Esen G, Ayarcan Y,etal. The role of US and MR imaging in detecting local chest wall tumor recurrence after mastectomy[J]. Diagn Interv Radiol, 2007, 13:13- 18.
[2] 杨倩,朱庆莉,姜玉新,等. 乳腺癌改良根治术后局部胸壁复发的临床特征与超声表现[J/CD]. 中华医学超声杂志,2013, 10: 656- 661.
[3] Adler DD, Carson PL, Rubin JM,etal. Doppler ultrasound color flow imaging in the study of breast cancer: preliminary findings[J]. Ultrasound Med Biol,1990,16:553- 559.
[4] Günther-Tritsch K, Bojahr B, Ohlinger R,etal. Diagnostic value of palpation and ultrasonography for diagnosing breast cancer recurrence after mastectomy—a comparison[J]. Ultraschall Med, 2009, 30: 577-584.
[5] Kim SJ, Moon WK, Cho N,etal. The detection of recurrent breast cancer in patients with a history of breast cancer surgery: comparison of clinical breast examination, mammography and ultrasonography[J]. Acta Radiol, 2011, 52:15- 20.
[6] Rissanen TJ, Mäkäräinen HP, Mattila SI,etal. Breast cancer recurrence after mastectomy: diagnosis with mammography and US[J]. Radiology, 1993, 188:463- 467.
[7] Pullyblank AM, Davies JD, Basten J,etal. Fat necrosis of the female breast—hadfield re-visited[J]. Breast, 2001, 10: 388- 391.
[8] Taboada JL, Stephens TW, Krishnamurthy S,etal. The many faces of fat necrosis in the breast[J]. Am J Roentgenol, 2009,192:815- 825.
[9] Chala LF, de Barros N, de Camargo Moraes P,etal. Fat necrosis of the breast: mammographic, sonographic, computed tomography, and magnetic resonance imaging findings[J]. Curr Probl Diagn Radiol, 2004, 33:106- 126.
[10] Bilgen IG, Ustun EE, Memis A. Fat necrosis of the breast: clinical, mammographic, and sonographic features[J]. Eur J Radiol, 2001, 39:92- 99.
Ultrasonographic features of chest wall newly developed benign mass after mastectomy for breast cancer
YANG Qian,ZHU Qing-li, JIANG Yu-xin*, LI Jian-chu, ZHANG Jing, WANG Hong-yan, YOU Shan-shan
(Dept. of Diagnostic Ultrasound, PUMC Hospital, CAMS & PUMC, Beijing 100730, China)
ObjectiveTo observe the ultrasonographic features of chest wall newly developed benign mass after mastectomy for breast cancer.MethodsThe ultrasonographic features, clinical and histopathological characteristics of 19 patients with chest wall newly developed benign mass after mastectomy confirmed histopathologically were retrospectively reviewed.ResultsThe postoperative time of 19 patients with chest wall newly developed benign nodule after mastectomy ranged from 3 months to 10 years and 73.7%(14/19) occured within 2 years after mastectomy. The size of the 24 lesions ranged from 4.0 mm to 45.0 mm. Confirmed by postoperative pathologic diagnosis: 45.8%(11/24) for fat necrosis, 33.3%(8/24) for inflammation and foreign body giant cell reaction, the other 20.9%(5/24). Preoperative ultrasonography correctly suggested that 11(11/24, 45.8%) chestwall lesions would be benign lesions, including 4 fat necrosis, 5 inflammation and foreign body giant cell reaction, 1 lipoma and 1 fibrous and fat tissue of inflammation. On ultrasonography, 2 lesions of fat necrosis showed hypoechoic or anechoic, regular shape, clear boundary and no blood flow signal, 2 lesions of fat necrosis showed hypoechoic, irregular shape, indistinct margin, visible in hyperechoic or calcification, no blood flow signal. Five lesions for Inflammation and foreign body giant cell reaction showed that 3 lesions had significant posterior echo attenuation, 2 lesions were hyperechoic, 5 lesions had little or no blood flow signal. One lesion for lipoma and 1 lesion for fibrous and fat tissue of inflammation showed hyperechoic.ConclusionsThe chest wall newly developed benign masses often occur within 2 years after mastectomy. The pathological type is complex, but the common types are fat necrosis, inflammation and foreign body giant cell reaction. The sonographic features are varied and the diagnosis still depends on histopathology.
ultrasonography; breast neoplasms; chest wall benign mass
2015- 01- 23
:2015- 03- 13
国家自然科学基金(81371557)
*通信作者(correspondingauthor):jiangyuxinxh@163.com
1001-6325(2015)05-0621-05
研究论文
R445.1
:A
