分光光度法测定脂肪酶活性的优化研究
2015-07-27李志红买旭林义马煤业集团煤生化高科技工程有限公司河南三门峡472300
李志红,买旭林(义马煤业集团煤生化高科技工程有限公司,河南 三门峡 472300)
分光光度法测定脂肪酶活性的优化研究
李志红,买旭林(义马煤业集团煤生化高科技工程有限公司,河南 三门峡 472300)
针对该分光光度法,在研究过程中任何一个因素的改变都会对测定结果造成偏差,为此对各个因素进行了优化:体积比为0.25的橄榄油微乳液4ml、酶液1ml、体系温度35℃、体系pH7.0、反应时间20min。在该组合条件下所测酶活数值为最大。
脂肪酶;活力测定;分光光度;条件优化
1 概述
该方法在对不同来源的脂肪酶活力测定较为常见,但由于没有统一的国家或地方性的标准,该研究对各个条件进行了优化,在该体系条件下所测酶活力达到最大,说明此时为最适条件。从而建立一套准确性高、重现性好的脂肪酶活的测定方法[1]。
2 试剂和溶液
脂肪酶(食品级,深圳绿微康生物工程有限公司);脂肪酸(分析纯,天津市恒津化学制剂制造有限公司);橄榄油(分析纯,国药集团化学试剂有限公司);吐温-80(分析纯,上海苏懿化学试剂有限公司);醋酸铜(分析纯,天津市恒津化学试剂制造有限公司);正己烷(分析纯,天津市大茂化学试剂厂)其他均为国产分析纯;0.05mol/L磷酸盐缓冲液(pH =7.5)。
3 仪器和设备
磁力搅拌器、高速离心机、振荡器、超声仪、分光光度计等。
4 试验
4.1 显色剂用量对吸光度的影响
本方法所用显色剂使用5%的醋酸铜溶液,加入吡啶并将pH调至6.1,在波长为710nm时,铜皂在此溶液的吸光度最大,所以此法配制的显色剂较为理想。但显色剂的添加量又对最终吸光度的影响较大,添加过少或过多都不能真实反映脂肪酸的生成量。需要试验以确定显色剂的添加量[2]。
根据本试验要求,取脂肪酸的苯溶液4ml于100ml锥形瓶中,依次添加0.4、0.6、0.8、1.0、1.2、1.4ml不同量的显色剂,磁力搅拌2min,静止片刻,取上层有机相在710nm波长处测定吸光度,同时以4ml苯作为空白样。根据显色剂用量的曲线图确定最佳用量。
4.2 反应时间对测定结果的影响
酶分子和底物的反应,在初期速度呈线性,即为酶反应的初速度,此阶段的时间和产物生成量呈正比,时间的计算才有意义。时间过长,产物产量趋于平缓,再计算平均速度已无实际意义。
为考察时间对酶反应的影响,设计试验方案,其他条件如3,反应时间分别为10、15、20、25、30min,反应结束后根据吸光度计算不同组脂肪酸的产生量。
4.3 反应体系的pH值对测定结果的影响
其它条件如3,调节缓冲液的pH值分别为3、4、5、6、7、8、9。考察反应体系pH对酶活力测定的影响。
4.4 反应体系温度对测定结果的影响
其它条件如3,调节水浴温度分别为25、30、35、40、45、50℃,考察反应体系温度对酶活力测定的影响。
4.5 底物浓度对测定结果的影响
其它条件如3,考察底物浓度(橄榄油)分别为0.1、0.15、0.2、0.25、0.3、0.35(V/V)时对酶活测定的影响。底物浓度和酶液浓度的最佳值都是相对而言的,由于酶促催化反应存在酶饱和现象,当橄榄油浓度低时,脂肪酶没有完全被橄榄油饱和,因而酶活力随着底物浓度的增大而增加。当底物浓度达到一定值后,脂肪酶被完全饱和,随着底物浓度增大而酶促反应速率开始放缓,此时可测得最大酶活。
5 结果与讨论
5.1 显色剂用量对吸光度的影响
分别测得显色剂在不同添加量0.4、0.6、0.8、1.0、1.2、1.4 ml时的吸光度分别为0.801、0.843、0.877、0.881、0.889、0.902 L/(g.cm)。以吸光度为纵轴、显色剂用为横轴作图,得到图1所示显色剂用量-吸光度曲线图,从曲线中看出当用量达到1.0ml时吸光度增大不明显,因此选取1.0ml较为合适[3]。

5.2 反应时间对测定结果的影响
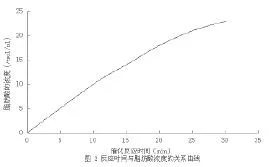
反应分别进行10、15、20、25、30 min后测得脂肪酸的浓度为10、14、18、21、23 µmol/L。以脂肪酸浓度对反应时间作图,即得到图2所示曲线,由图可看出,反应前25min曲线呈线性,该段时间内酶促反应处于初速度阶段,而为了检验步骤的简便,同时在保证结果准确的情况下,选取20min为宜。
5.3 反应体系的pH值对测定结果的影响
该组试验分别在pH为3、4、5、6、7、8、9条件下进行,通过对缓冲溶液调节酸碱度实现,经过反应后得到的结果以百分比的形式表示,以测得酶活的最大值为100%,结果分别为21%、44%、79%、88%、97%、86%、15%。用百分比对pH作图,得到如图3所示曲线,由图可看出反应最适pH为7,较低或较高的酸碱度都对结果影响较大。
5.4 反应体系温度对测定结果的影响
该组试验分别设置不同的温度进行反应,分别为25℃、30℃、35℃、40℃、45℃、50℃,经过反应后得到的结果以百分比的形式表示,以测得酶活的最大值为100%,结果分别为51%、93%、98%、89%、58%、5%,用百分比对温度作图,得到如图4所示曲线,由图可看出反应的最适温度为35%左右,30%以下、45%以上酶的活力急剧下降降幅在50%左右,这是由于高温下酶分子的空间结构遭到破坏,酶失去活性,不再具有降低反应活化能的功能,而温度过低自然会降低酶反应的速率[4]。
5.5 底物浓度对酶活测定的影响
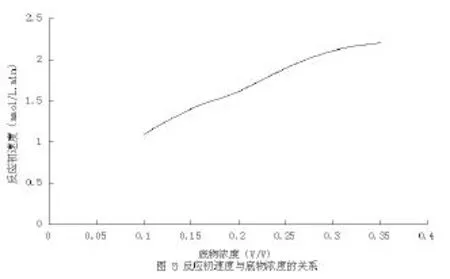
该组反应分别添加不同量的橄榄油,分别为0.1、0.15、0.2、0.25、0.3、0.35(v/v),反应产生的脂肪酸浓度分别为1.10、1.40、1.62、1.90、2.11、2.20 µmol/L.min。以脂肪酸浓度对底物浓度作图,得到如图5所示曲线,由图可看当底物浓度超过0.3时反应速度增加缓慢,不呈线性关系,为了保证结果的准确性,选取0.25为添加浓度[5]。

5.6 注意事项
(1)固体酶粉的处理应确保酶分子充分浸提,稀释定容过程中应防止交叉污染,否则对结果的影响较大。酶液配制完成后应在12h内使用。
(2)试验过程中发现,形成微乳液的水来自酶液,而水含量对酶活又有较大影响,因此酶液的体积应准确控制。同时,试验中为降低反应体系中水的生成量,可采用在低压环境下进行。
6 结论
该方法采用分光光度法,与滴定法相比较而言有较高的灵敏度和可重复性,失误率也较低,可作为脂肪酶活性测定的一个可靠方法。不足之处是该方法的反应条件有待更加严谨的确定,可以采用正交分析法或响应面分析法,设计出多因素、多水平、数据更加精确的数据,综合分析出最优的组合,从而使结果更加接近真实值。该方法的研究也在一定程度上对酶促反应的基本理论的完善奠定了基础,为行业进一步提高脂肪酶检测的效率和准确率做出了贡献。
[1]郑毅,叶海梅.脂肪酶活力测定研究进展.工业微生物,2005,35(04):36.
[2]张海燕,丁玉.脂肪酶活力测定的最新研究.生物学通报,2007,42(03):16.
[3]廖朝晖.在有机介质中固定化脂肪酶反应特性及其动力学研究.南昌大学学报(理科版),2000,24(04):326-331.
[4]五校合编.有机化学[M].高等教育出版社,1986.
李志红(1981-),本科,助理工程师,研究方向:生物科学。
