磁珠联合MALDI-TOF-MS筛选尿液中早期肾透明细胞癌多肽标志物
2015-07-26付德来李和程刘洪涛王子明
付德来,种 铁,李和程,张 鹏,刘洪涛,王子明
(西安交通大学医学院第二附属医院:1.泌尿外科,2.麻醉科,陕西西安 710004)
肾癌是泌尿系统常见恶性肿瘤,其发病率逐年上升。早期肾癌缺乏特异性表现,多由健康查体偶然发现,约1/3的肾癌患者首次就诊时已处于晚期。目前晚期肾癌缺乏有效的治疗手段,预后较差。寻找肾癌标志物对于提高肾癌的早期诊断水平、研究肾癌发病机制、改善肾癌预后具有重要意义。本课题以肾癌患者尿液作为研究对象,采用磁珠联合 MALDI-TOFMS技术,探索尿液中可能存在的肾癌多肽标志物。
1 材料与方法
1.1 研究对象实验方案经西安交通大学医学院第二附属医院伦理委员会讨论通过,按照知情同意的原则筛选2009年3~12月期间西安交通大学医学院第二附属医院泌尿外科住院的患者,包括肾患者、非肾癌肾脏病变患者(肾积水、肾错构瘤、肾盂癌、肾囊肿、肾结核、肾结石),以及另外3名健康志愿者。入组肾癌患者均为行根治性手术治疗的早期肾癌(AJCC肾癌TNM分期T1~2N0M0期)患者,且病理类型为肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)。
1.2 主要仪器及试剂MALDI-TOF-MS质谱分析仪购自德国Bruker公司,铜螯合纳米磁珠试剂盒购自北京国家生物医学分析中心。
1.3 方法
1.3.1 尿液的收集与处理 收集患者及志愿者晨起空腹第二次排尿中段尿液标本约10mL,分为术前组(肾癌患者入院第7天尿液)、术后组(肾癌患者术后第7天尿液)和对照组(非肾癌肾脏病变患者入院第2天和同期健康志愿者尿液)。尿液标本经低温离心机4 000r/min离心10min,获得的上清液2mL/管分装,-80℃保存。尿液标本从收集到离心完毕分装冻存需在1h内完成。
1.3.2 MALDI-TOF-MS分析尿液多肽组 参考铜螯合纳米磁珠试剂盒使用说明书及吴杰等[1]的报道提取尿液中多肽。获得的多肽提取液1μL和等体积饱和α-羟基肉桂酸(CCA)基质溶液混匀,点在 MALDI不锈钢靶面上,室温下自然干燥,放入UltraflexⅢ MALDI-TOF-MS质谱仪进行检测。检测条件设置如下:N2激光源,波长337nm,正离子线性模式,扫描相对分子质量范围800~10 000Du,激光能量36%,每个样叠加2 000张谱图。
1.3.3 质谱数据的处理与分析 参考钟立业等[2]的报道,质谱采集获得的原始数据应用 MALDI-TOF-MS专门的分析软件ClinProTools2.2进行分析。首先调入各组样品的数据,对采集图像进行归一化处理,经过基线的平滑、去背景、标峰后,产生一张所有样品的平均谱图,筛选此谱图上信噪比≥7的谱峰作为高可信谱峰。调入各个样品数据,查高可信谱峰在各组不同样品内表达情况,采用SPSS 17.0统计软件分析各高可信谱峰在各组表达情况,组间差异P<0.05认为有统计学意义。
1.3.4 差异多肽的数据库搜索初步鉴定 有意义多肽采用Tagldent检索程序搜索 UniProtKB/Swiss-Prot数据库进行鉴定。在Tagldent检索页面(http://us.expasy.org/tools/tagldent.html),在“Mw”一栏输入目的多肽的分子质量,在“Organism name”一栏输入筛选条件“homo sapiens”,点击“Start Tagldent”进行搜索。
2 结 果
2.1 基本信息共收集得到167份尿液标本,经筛选获得符合入组条件的肾癌患者术前组、术后组尿液标本各32份,对照组尿液标本34份,入组患者基本信息无明显差异(表1)。

表1 研究对象基本资料
2.2 各组尿多肽表达谱术前组、术后组、对照组分别共检测到115、105、128个多肽信号峰,分析发现84.48%的信号峰集中分布于 [1 000~6 000Du]之间,仅有13.51%的信号峰分布于 [6 001~10 000Du]之间(图1)。ClinProTools 2.2对所有样品谱图归一化处理后获得平均谱图,在相对分子质量800~10 000Du范围内,共鉴定出信噪比≥7的高可信多肽峰12个,其m/z分别为854、1 025、1 116、1 315、2 790、3 176、3 297、4 750、5 557、8 817、9 730、9 923。各组之间信号峰集合分布既相互独立又有交集(图2)。
2.3 差异多肽峰筛选以峰面积代表多肽的表达量,比较信噪比≥7的高可信多肽在各组表达情况。结果发现m/z=1 025、1 116的多肽在术前组高表达,同时在术后组、对照组低表达。m/z=9 730的多肽在术后组、对照组高表达,在术前组低表达。m/z=2 790、4 750的多肽在三组表达无差异(表2、图3)。其余7个高可信多肽峰表达不稳定,仅出现于个别样品中。
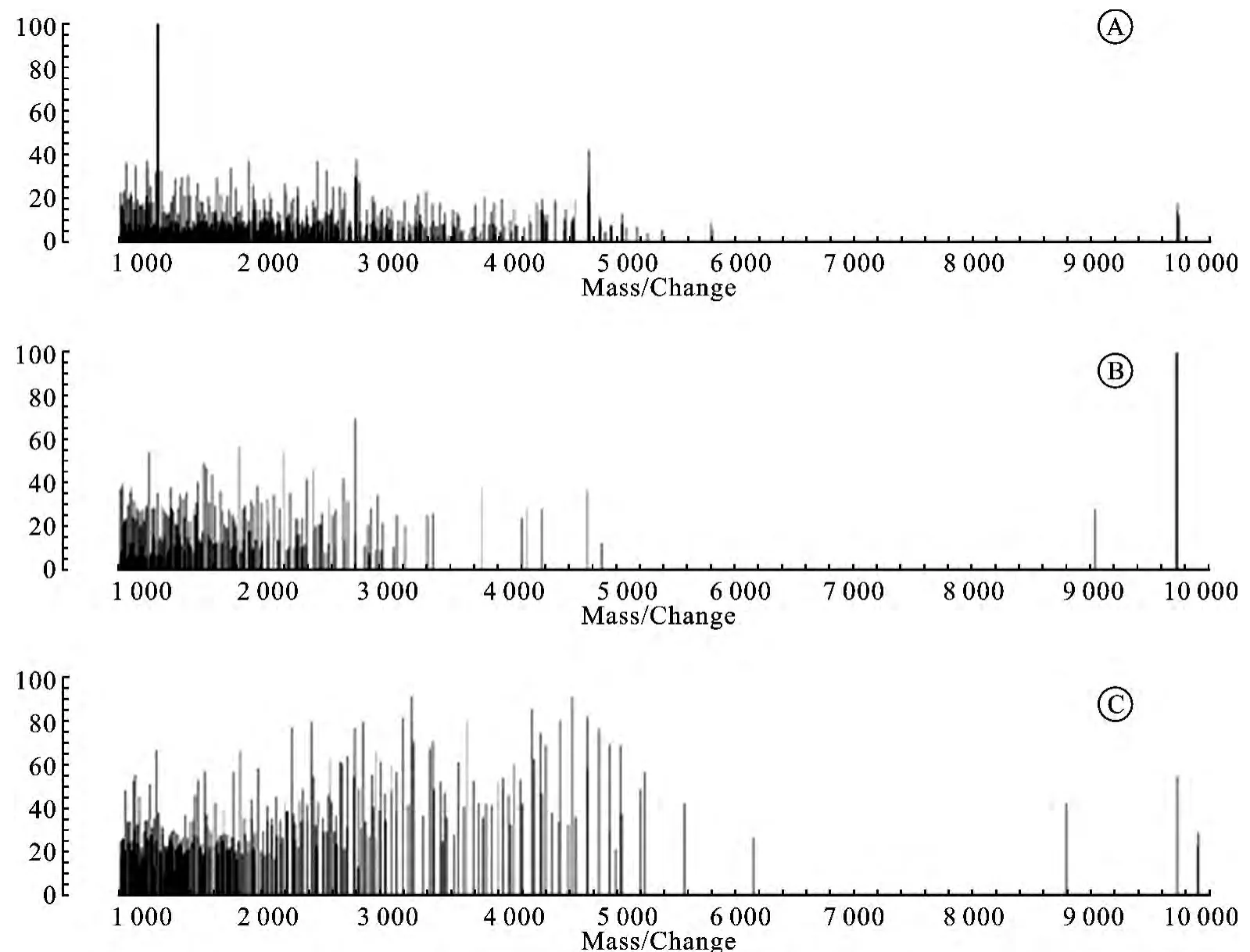
图1 各组尿液多肽表达谱
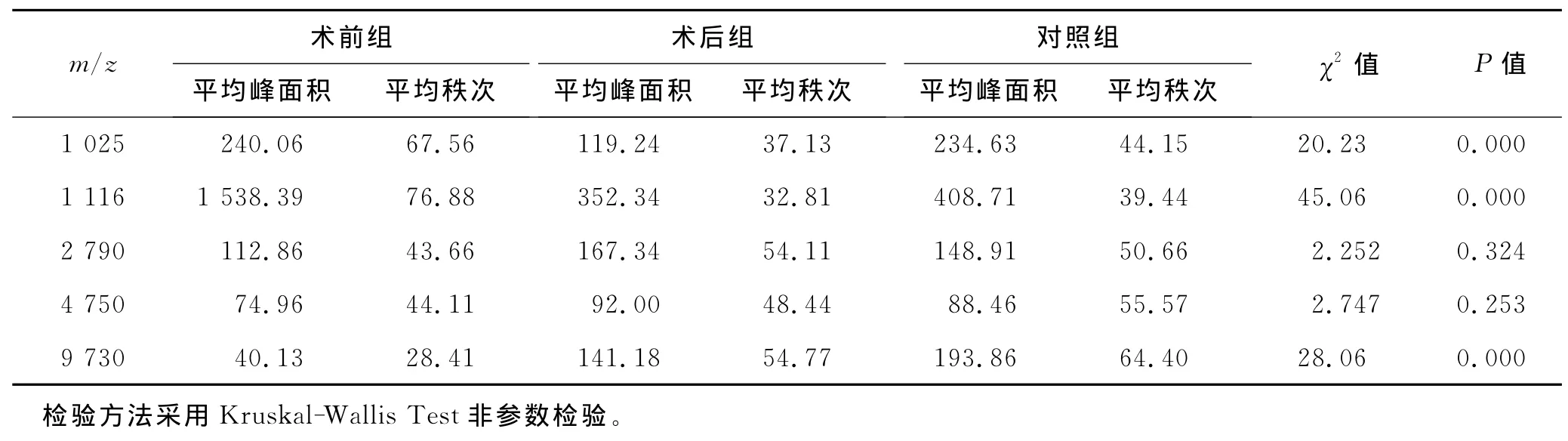
表2 不同质荷比多肽在各组中相对表达量
2.4 差异多肽峰的检索鉴定采用Tagldent检索程序检索UniProtKB/Swiss-Prot数据库对相关多肽进行初步鉴定,结果发现m/z=1 025、1 116、9 730的信号峰与多个多肽或蛋白相匹配(表3)。
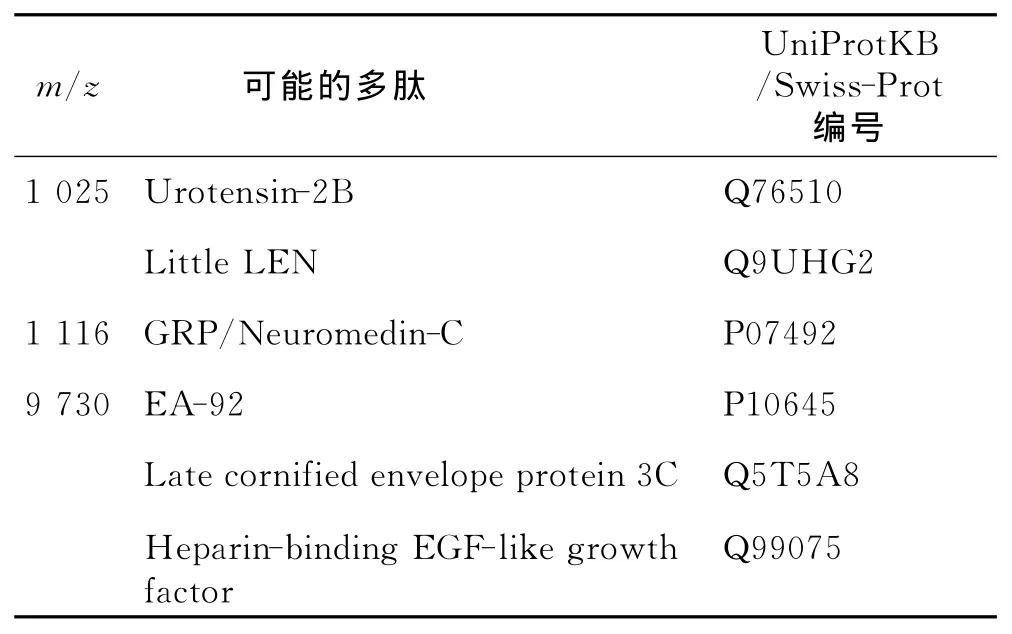
表3 差异多肽的初步鉴定

图2 各组多肽信号峰集合分布
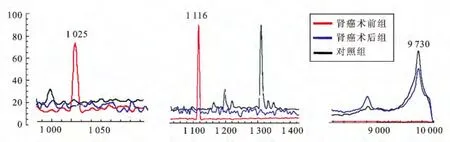
图3 术前组高表达(m/z=1 025、1 116)、低表达(m/z=9 730)的多肽
3 讨 论
肿瘤标志物(tumor marker)是反映肿瘤存在的化学类物质。肾癌标志物一方面可以经血液循环、由肾小球过滤进入尿液,另一方面可经肾小管分泌直接进入尿液[3]。尿液采集方便,其蛋白质组的组成较血浆简单,是筛选肾癌标志物的理想标本。磁珠联合MALDI-TOF-MS技术检测尿液多肽组具有简便快速、标本用量少的优点[1],已用于肾小球疾病尿液多肽组研究[4]。
尿液多肽组表达谱受到尿液留存时间、饮食、药物、疾病、遗传背景等各种因素的影响。本课题通过选用合理的尿液标本和设计双重对照筛选尿液中肾癌特异性多肽标志物。首先,为减少尿液留存时间、饮食、药物对尿液多肽表达谱多肽表达谱的影响,本课题采用晨起空腹第二次排尿中段尿液标本。同时,本课题对照组包含了健康志愿者和非肾癌肾脏病变(肾积水、肾囊肿、肾血管平滑肌脂肪瘤、肾盂癌、肾结核、肾结石),这样不仅将肾癌患者和健康人尿液多肽谱区别开来,同时还将肾癌患者和各种非肾癌肾脏病变者尿液多肽谱区别。另外,本课题还采用肾癌患者术前术后自身对照,这样就减少了基因组差异对尿多肽组的影响。我们期望根治性肾切除术后尿液中肾癌标志分子会减少或消失,所以在患者选择上仅采用了行根治性肾切除术的早期肾癌(Ⅰ、Ⅱ期)患者。至于术后标本收集时间点的选择,目前有限的文献并没有明确答案,原则上术后时间越长尿液中肾癌特异性标志物代谢完全的几率越大。考虑到实验的易实施性,我们收集了患者术后第7天的尿液标本。
3.1 尿液中肾癌多肽标志物目前已有多篇文献通过组学技术寻找尿液中肾癌特异性多肽(表4)。分析既往数据不难发现,各研究中筛选出的肾癌相关分子缺乏一致性,这可能与尿液多肽组表达谱受众多因素影响有关。结合既往研究进一步分析本实验结果我们惊喜发现,本研究中m/z为1 116的多肽在肾癌组及对照组中的表达规律与CHINELLO等[5]的研究一致,这充分说明尿液中m/z为1 116的多肽与肾癌关系密切,可能是尿液中潜在的肾癌特异性标志分子。
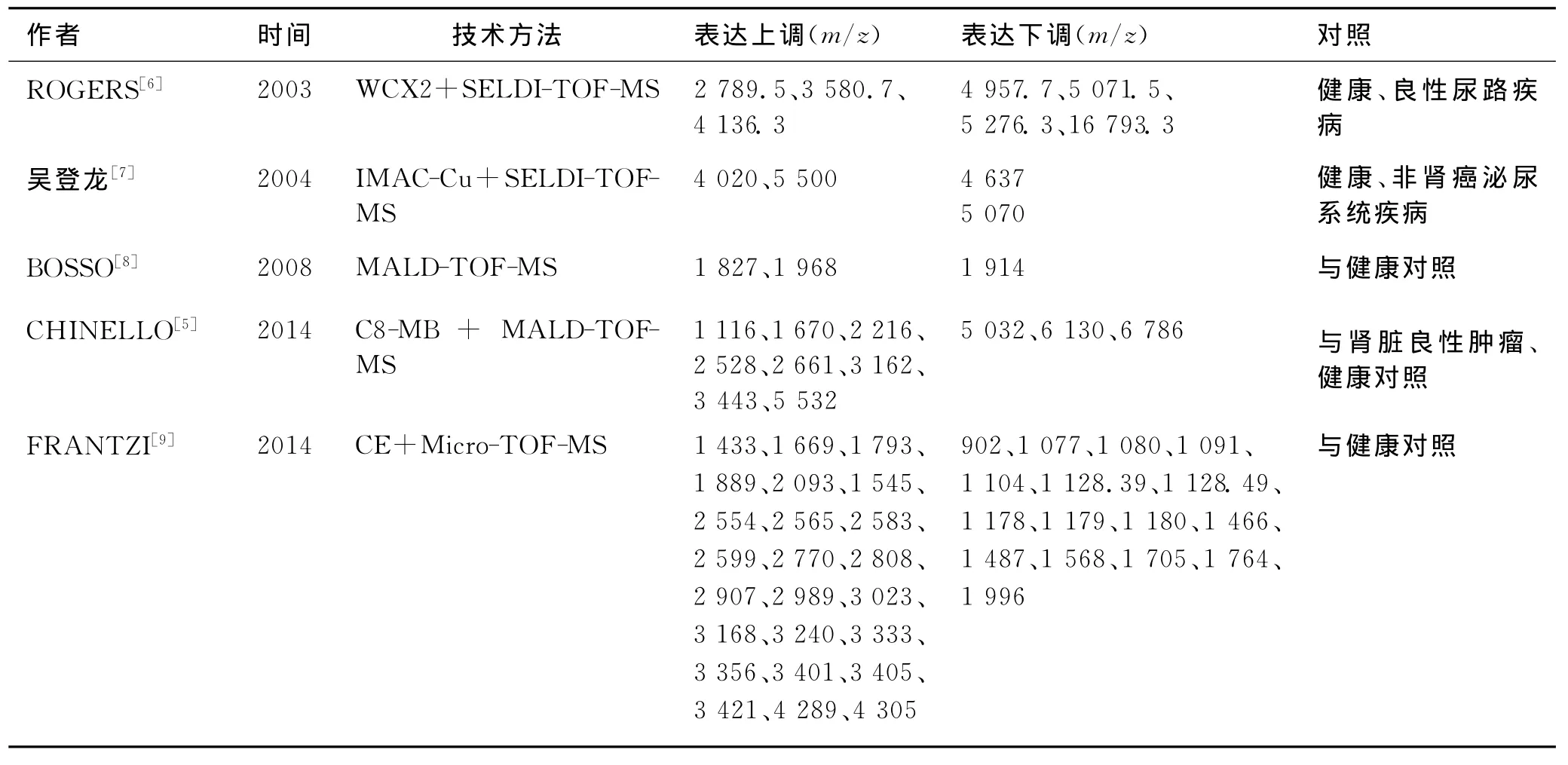
表4 肾癌尿液多肽标志物研究一览表
3.2 m/z=1025多肽初步鉴定分析通过Tagldent检索程序在UniProtKB/Swiss-Prot数据库中进行初步鉴定,发现m/z=1025的多肽与urotensin-ⅡB、little LEN相吻合。Urotensin-ⅡB属于urotensinⅡ家族,是一个含有8个氨基酸的分泌多肽。UrotensinⅡ最初从虾虎鱼(Goby fish)尾部下垂体中获得,具有强烈的丝裂原作用。YOSHIMOTO等[10]发现肾癌VMRC-RCW细胞系培养液中可检测到urotensinⅡ表达,提示肾癌细胞可分泌urotensinⅡ。外源性给予urotensinⅡ24h后,肾癌VMRC-RCW细胞密度明显增加。王文营等[11]通过免疫组化和RTPCR技术研究发现,urotensinⅡ在肾透明细胞癌和正常肾组织中均有表达,肾透明细胞癌中urotensinⅡ及其受体mRNA的表达明显高于正常肾组织。
Little LEN是Pro-SAAS(proprotein convertase 1inhibitor)剪切产生的7个片段之一,由10个氨基酸组成。Pro-SAAS参与神经内分泌通路,可能是内源性、特异性PCSK1抑制剂。Little LEN的详细功能尚不得而知。
3.3 m/z=1 116多肽初步鉴定分析Tagldent程序在UniProtKB/Swiss-Prot数据库中检索发现m/z=1 116的多肽与胃泌素释放肽(gastine-releasing peptide,GRP)吻合。GRP是胃泌素释放肽前体(proGRP1-125)羧基端的10个肽。HEUSER 等[12]研究发现GRP受体(GRPR)在RCC细胞及肿瘤血管高表达。PANSKY等[13]研究发现GRPR在肾癌组织中表达,在正常肾组织中不表达。最近ISCHIA等[14]通过ELISA、放免法定量检测肾癌细胞系GRP表达及功能,结果发现肾癌细胞系ACHN、Caki-1、Caki-2均高表达GRP,外源性GRP可促进体外培养的人肾癌ACHN、Caki-2细胞增殖,可增强ACHN细胞的迁移能力。GPR可诱导ACHN、Caki-2细胞分裂关键酶ERK1/2快速磷酸化,可上调ACHN肾癌细胞 HIF1-α、VEGF的表达。
本研究及CHINELLOC等[5]的研究均提示m/z为1 116的多肽在肾患者尿液中高表达,Tagldent程序提示此多肽极有可能为GRP。结合上述研究,我们有理由相信GRP与肾癌关系密切,GRP在肾癌发生、发展中的作用值得深入研究,GRP及其代谢产物在肾癌患者尿液中的检测价值亦值得进一步探讨。
3.4 m/z=9 730多肽初步鉴定分析Tagldent程序检索发现m/z=9 730的多肽与EA-92、Late cornified envelope protein 3C(LCE3C)、Heparin-binding EGF-like growth factor(HB-EGF)相吻合。
EA-92是chromogranin-A剪切产生的13个片段之一。chromogranin-A最早在肾上腺髓质嗜铬颗粒中被发现,具有稳定嗜铬颗粒的作用,chromogranin-A与儿茶酚胺一起分泌。chromogranin-A在大约90%的肠源性神经内分泌癌表达上调,并且与肿瘤负荷及复发相关,有效治疗后chromogranin-A水平往往下降[15]。chromogranin-A在肾癌中的表达与肠源性神经内分泌肿瘤存在差异。RASMUSON等[16]早在1999年就对比分析了200例肾癌患者和15例肾囊肿患者chromogranin-A水平,结果发现28例(14%)肾癌患者血清chromogranin-A水平升高,但与对照组比较缺乏显著性差异。多因素分析发现chromogranin-A不是肾癌预后影响因子。2010年RONKAINEN等[17]通过免疫组化分析chromogranin-A在152例原发性肾癌中表达情况,结果发现chromogranin-A免疫组化染色全为阴性。
LCE3C又称富含脯氨酸的表皮分化小复合蛋白3A(Small proline-rich-like epidermal differentiation complex protein 3A),主要见于某些皮肤疾病[18-19],其在肿瘤发生发展中的意义尚不明确。
HB-EGF是EGF家族成员之一,可参与胚囊着床、骨骼肌发育、心肌分化、肾小管形成、伤口修复和肿瘤发生。TAKEMURA 等[20]发现膜结合 HBEGF可保护体外培养的肾小管上皮细胞耐受H2O2及足叶乙甙(etoposide)的杀伤,膜结合 HB-EGF可增加肾小管上皮细胞细胞存活率,降低细胞凋亡。在无血清培养下,膜结合HB-EGF可促进肾小管上皮细胞粘附并形成上皮细胞克隆。无血清培养3d后膜结合HB-EGF组细胞存活率84%,对照组存活率0%。大鼠正常肾小管细胞转染HB-EGF后可诱导细胞恶性转化[21]。SCHAFER 等[22]研究发现 HBEGF可特异性地诱导肾癌Caki2、ACHN、A498细胞系EGFR的过度转录激活。
本研究中m/z=9 730的多肽在肾癌术前组低表达,在肾癌术后组、对照组高表达,结合目前EA-92、LCE3C、HB-EGF有关研究结果,本研究中 m/z=9 730的多肽与EA-92有关研究相吻合。EA-92及其前体chromogranin-A在肾癌中低表达,EA-92及chromogranin-A与肾癌发生、发展的关系值得进一步研究。
本研究通过磁珠联合 MALDI-TOF-MS技术分析肾癌术前组、肾癌术后组及对照组尿液中多肽标志物,结果发现三个多肽差异表达(m/z=1 025、1 116的多肽在肾癌术前组高表达,m/z=9 730的多肽在肾癌术前组低表达)。通过Tagldent检索程序在UniProtKB/Swiss-Prot数据库中对这些多肽进行初步鉴定发现了多个匹配分子。这些多肽或其对应的蛋白在肾癌和/或肾癌患者尿液中的表达需进一步明确,其作为尿液中肾癌标志分子的意义值得深入研究。
[1]吴杰,王杰,李燕,等.铜螯合纳米磁珠结合 MALDI-TOF/TOF MS分析人尿液中多肽组的方法初探[J].军事医学科学院院刊,2009,33(2):137-140,196.
[2]钟立业,刘天浩,耿素霞,等.利用 MALDI-TOF-MS分析RAEB型骨髓增生异常综合症患者血清蛋白质组学特征[J].中华肿瘤防治杂志,2009,16(21):1625-1627.
[3]GONZáLEZ-BUITRAGO JM,FERREIRA L,LORENZOI.U-rinary proteomics[J].Clin Chem Acta,2007,375:49-56.
[4]吴杰,李燕,谢院生,等.磁珠分离结合生物质谱分析肾小球疾病患者尿液多肽谱[J].中华肾脏病杂志,2009,25(8):596-600.
[5]CHINELLO C,CAZZANIGA M,SIO GD,et al.Urinary signatures of renal cell carcinoma investigated by peptidomic approaches[J].PloS One,2014,9(9):e106684.
[6]ROGERS MA,CLARKE P,NOBLEJ,et al.Proteomic profiling of urinary proteins in renal cancer by surface enhanced laser desorption ionization and neural-network analysis:identification of key issues affecting potential clinical utility[J].Cancer Res,2003,63(20):6971-6983.
[7]吴登龙,王文静,关明,等.表面增强激光解吸/离子化质谱蛋白质芯片技术在筛选肾癌患者尿液标记物中的应用[J].中华医学杂志,2004,84(13):1092-1095.
[8]BOSSO N,CHINELLO C,PICOZZI SCM,et al.Human urine biomarkers of renal cell carcinoma evaluated by ClinProt[J].Prot Clin Appli,2008,2(7-8):1036-1046.
[9]FRANTZIA M,METZGERA J,BANKSC RE,et al.Discovery and validation of urinary biomarkers for detection of renal cell carcinoma[J].J Prot,2014,98:44-58.
[10]YOSHIMOTO T,MIKA MATSUSHITA,HIRATA Y.Role of urotensin II in peripheral tissue as an autocrine/paracrine growth factor[J].Peptides,2004,25(10):1775-1781.
[11]王文营,王红霞,张立克,等.尾加压素Ⅱ及其受体在人肾透明细胞癌组织中的表达及意义[J].临床泌尿外科杂志,2010,25(7):510-513.
[12]HEUSER M,SCHLOTT T,SCHALLY A,et al.Expression of gastrin releasing peptide receptor in renal cell carcinomas:a potential function for the regulation of neoangiogenesis and microvascular perfusion[J].J Urol,2005,173(6):2154-2159.
[13]PANSKY A,WEERTH AD,FASLER-KAN E,et al.Gastrin releasing peptide-preferring bombesin receptors mediate growth of human renal cell carcinoma[J].J Amer Soci Nephrol,2000,11(8):1409-1418.
[14]ISCHIA J,PATEL O,SETHI K,et al.Identification of binding sites for C-terminal pro-gastrin-releasing peptide(GRP)-derived peptides in renal cell carcinoma:apotential target for future therapy[J].Bri J Urol Int,2015,115(5):829-838.
[15]MODLIN M,GUSTAFSSON B,MOSSS,et al.Chromogranin a-biological function and clinical utility in neuro endocrine tumor disease[J].Ann Surg Oncol,2010,17(9):2427-2443.
[16]RASMUSON T,GRANKVIST K,ROOS G,et al.Neuroendocrine differentiation in renal cell carcinoma[J].Acta Oncol,1999,38(5):623-628.
[17]RONKAINEN H,SOINI Y,VAARALA MH,et al.Evaluation of neuroendocrine markers in renal cell carcinoma[J].Diagn Pathol,2010,5:28.
[18]CID RD,RIVEIRA-MUNOZ E,ZEEUWENPLJM,et al.Deletion of the late cornified envelope LCE3Band LCE3Cgenes as a susceptibility factor for psoriasis[J].Nat Gene,2009,41(2):211-215.
[19]COTO E,SANTOS-JUANES J,COTO-SEGURA P,et al.Mutation analysis of the LCE3B/LCE3Cgenes in Psoriasis[J].BMC Med Gen,2010,11:45-51.
[20]TAKEMURA T,KONDO S,HOMMA T,et al.The membrane-bound form of heparin-binding epidermal growth factorlike growth factor promotes survival of cultured renal epithelial cells[J].J Bio Chem,1997,272(49):31036-31042.
[21]FU SL,BOTTOLI I,GOLLER M,et al.Heparin-binding epidermal growth factor-like growth factor,a v-Jun target gene,induces oncogenic transformation[J].Proceed Nati Aca Sci USA,1999,11(96):5716-5721.
[22]SCHAFER B,GSCHWIND A,ULLRICH A.Multiple G-protein-coupled receptor signals converge on the epidermal growth factor receptor to promote emigration and invasion[J].Oncogene,2004,23(4):991-999.
