氢能载体十氢萘制氢表观动力学
2015-07-25寇小文顾雄毅李平
寇小文,顾雄毅,李平
(华东理工大学化学工程联合国家重点实验室,上海 200237)
氢气是一种极好的能量载体,但其储运问题限制了其应用[1]。液体有机氢化物因其储氢密度大,可逆性高,无含碳副产物产生,常温常压为液相方便储运等优点[2-4],近些年来被研究者所重视;它通过环烷烃的催化脱氢及对应不饱和芳烃的催化加氢实现放氢、储氢循环[5-7]。十氢萘是一种储氢密度很高的氢能载体,其储放氢循环见图1。

图1 十氢萘储放氢循环
Hodoshima、Kariya 和Biniwale 报道了Pt、Pt-Ni等催化剂用于环烷烃的脱氢反应[8-10],作者课题组李平等[11-13]进行了大量Pt/CNF、Pt/CNT 催化十氢萘脱氢的研究,Pt 具有很好的氢溢流及氢结合性 能[9],这些含Pt 贵金属催化剂都表现出较好催化效果;本研究使用自制的Pt/AC 进行脱氢反应。按反应物相态十氢萘产氢可分为气相、湿干多相态和液相三类[9,14]。气相反应温度较高,转化率较高,但高温使催化剂易结焦失活[15];湿干多相态是指催化剂表面周期性的经历反应物润湿、干燥的过程,反应温度介于沸点及热源温度间,能突破沸点温度的限制,接触效率及产氢速率高,但需特种反应器,技术不够成熟[16]。液相脱氢所产氢气与反应液直接分离,氢气纯化容易;但液相温度最高只能达液相沸点,十氢萘常压沸点较低,沸点温度下反应速率和平衡转化率过低。加压可提高沸点,从而提高液相反应温度;本工作在加压条件下进行十氢萘液相脱氢动力学实验,建立起适宜于工业应用的表观动力学方程。已有十氢萘气相[17]和湿干多相态[9,18]脱氢动力学的研究,但未见十氢萘液相脱氢动力学的报道,本研究对十氢萘液相制氢反应器设计及工业放大有一定指导意义。
1 实验部分
1.1 实验原料及催化剂
十氢萘,分析纯,国药试剂有限公司;氮气,纯度99.999%,上海沃格气体设备有限公司。色谱, PerkinElmer Clarus580;反应釜,GS-0.5 型上出料式磁力搅拌高压釜,威海化工机械有限公司。Pt/AC 催化剂:自制;活性炭颗粒为载体,Pt 负载量(质量分数)2%,采用等体积浸渍法制备。
1.2 实验方法
图2 为实验装置示意图。十氢萘脱氢反应在磁力搅拌高压釜中进行,反应釜公称容积为0.5L,釜温通过热电偶来测定,反应过程釜内温度保持恒定(温度波动±0.1℃)。N2为反应体系的载气,通过质量流量计控制其流量,反应器上端冷凝器使物料蒸气冷却液化回流。实验进行时首先将催化剂与十氢萘加入反应釜内(十氢萘加入量250mL,催化剂加入量10g),通入N2加压吹扫4 次,除去釜内空气,随后将反应釜调至反应温度,维持载气N2流量50mL/min,打开搅拌装置在特定温度和压力下进行反应。定时对釜内液相产物取样分析(每次取样1.5mL),液相产物采用带有氢焰离子化检测器(FID)的气相色谱进行分析,尾气采用带有热导池检测器(TCD)的气相色谱在线分析,尾气每次进样前用皂膜流量计测定其流量。
2 结果与讨论
2.1 热力学分析
十氢萘脱氢反应在热力学上是强吸热、分子数增大的可逆反应,脱氢反应如式(1)所示。图3为不同压力及温度下式(1)所示反应的十氢萘平衡转化率理论热力学计算值,计算采用Aspen Plus v7.0 软件,计算过程涉及吉布斯自由能最小化及气液相平衡计算。可以看到,相同压力下十氢萘平衡转化率随着反应温度的增加而增大,这与吸热反应的热力学特征相符;相同温度下,随着系统压力的增大,十氢萘脱氢平衡转化率减小,这也与脱氢反应分子数增大的化学计量特征相符。常压下十氢萘沸点约为192℃,此温度下十氢萘脱氢平衡转化率理论计算值约为9%,如图3 所示,平衡转化率过小;热力学限制导致常压下十氢萘液相产氢难以 实现。

图2 实验装置简图
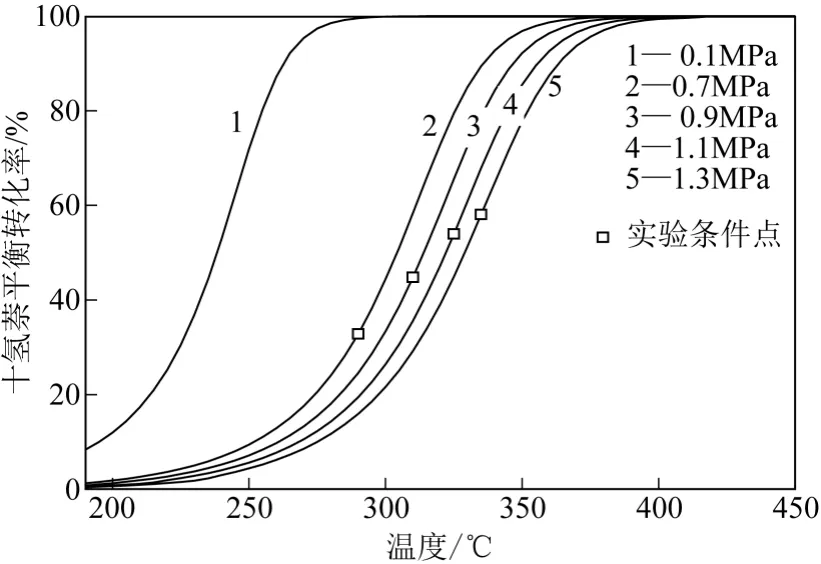
图3 不同压力及温度下十氢萘脱氢平衡转化率
增加反应体系压力,十氢萘的沸点温度增加,压力增加会使平衡向逆反应方向移动,但热力学计算显示十氢萘饱和液体的平衡转化率随总压的增加而增大,温度对平衡的正向作用补偿了压力的逆向作用。加压后饱和液体的平衡转化率相对大气压下有着显著提高。本实验选取4 个压力点,分别将反应器压力增至0.7MPa、0.9MPa、1.1MPa、1.3MPa,实验采用略低于沸点的温度,与压力对应的温度分别为290℃、310℃、325℃、335℃,实验条件点如图3 中的小方格所示,可见随着压力和温度的升高,对应的十氢萘平衡转化率明显增大。对反应平衡性质的分析有助于对反应的理解,有助于判断反应过程的控制因素是热力学的还是动力学的,在此前提下得以进行动力学研究。
2.2 内外传递因素的影响
通过改变转速与催化剂粒径来考察内外传递的影响。表1 反映了催化剂粒径及转速与十氢萘转化率的关系,可以看到,随着搅拌转速的增加,十氢萘转化率增幅起初较大,随后趋于平缓,转速由800 r/min 增至1000r/min 时转化率增幅非常小,考虑到可能的实验误差,可认为1000r/min 时外部传递的影响已经排除;在进行动力学实验时采用1000 r/min 的搅拌速率以消除外部传递的影响。对于固体催化剂,内部传递阻力与催化剂粒径有关,粒径越小,阻力越小;如表1 所示,随着粒径的减小,转化率明显提高,实验条件下颗粒内部传递影响较严重,欲排除内部传递的影响,需要更细颗粒的催化剂,但十氢萘脱氢催化剂粒径不能过小,后续液相脱氢流程设计需将催化剂与反应液分离,过小的粒径会增加分离难度,所以动力学实验采用粒径为0.25~0.84mm 的催化剂。
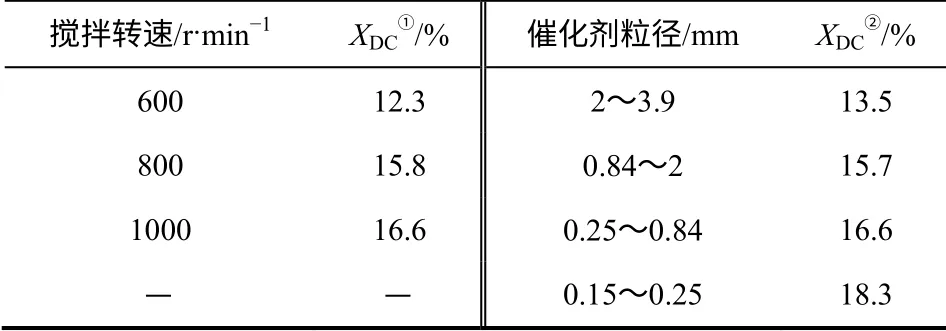
表1 催化剂粒径及转速对十氢萘转化率的影响
2.3 脱氢实验结果
十氢萘脱氢是在0.7~1.3MPa,290~335℃,搅拌速率1000r/min,10g 2% Pt/AC 催化剂(0.25~0.84mm),250mL 十氢萘条件下进行的。Wang 等[17]对Pt-Sn/AC 催化十氢萘气相脱氢进行了研究,认为十氢萘脱氢是先脱去三分子氢生成四氢萘(C10H12),最后完全脱氢生成萘的串联反应,如式(2)所示。然而,根据本实验的脱氢液相产物浓度分布,如图4 所示,随着反应物十氢萘的消耗,四氢萘和萘的浓度都逐渐增大,脱氢反应表现出平行反应的性质,十氢萘分别脱氢生成萘及四氢萘的平行反应路径与实验浓度分布性质更相符,如式(3)所示。
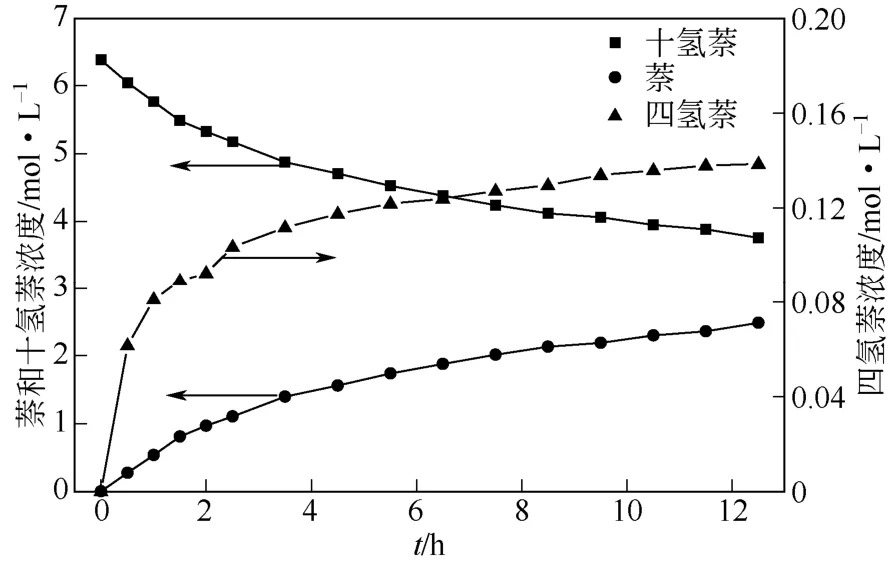
图4 325℃,1.1MPa 下脱氢产物各组分浓度曲线

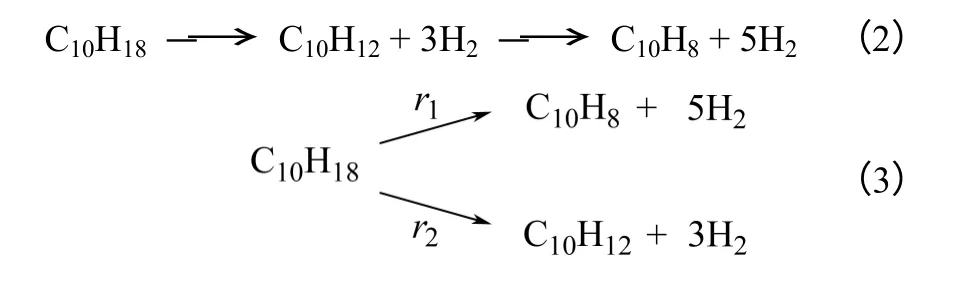
表2 为不同反应条件下Pt/AC 催化十氢萘脱氢的实验数据,各转化率均为考虑取样损失换算后得到的。表中给出了十氢萘生成萘的转化率及十氢萘生成四氢萘的转化率,转化率的定义如式(4)、式(5)所示。十氢萘转化率(XDC= XNP+ XTT)最高可达47.35%,产氢量(由氢气产率~时间曲线积分得到)最高达3.72mol。
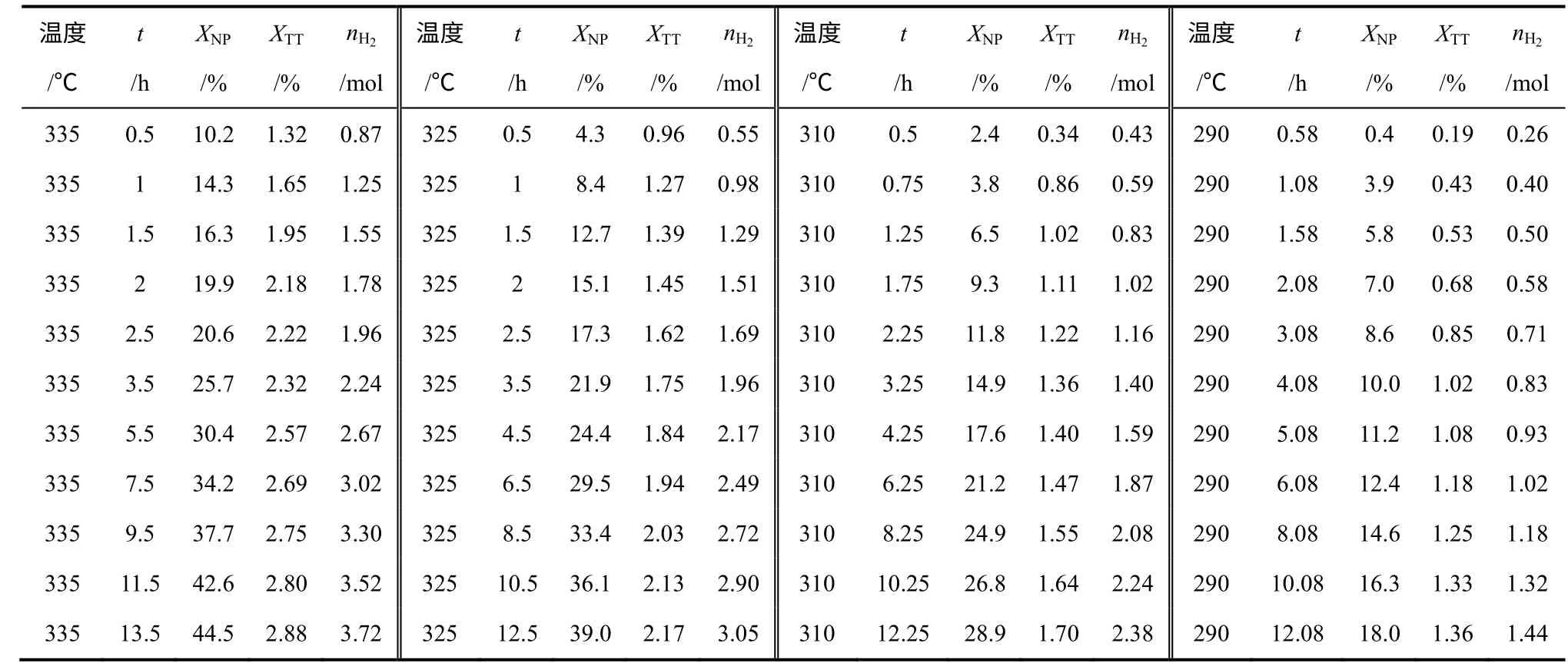
表2 十氢萘脱氢实验数据
2.4 动力学模型及参数估算
十氢萘脱氢为液固相催化反应过程,分析表明颗粒内部传递因素影响难以排除,而反应实际进行区域的温度和浓度难以测定,本征动力学不仅难以得到,而且往往得到的本征动力学方程对工业优化或反应器放大意义不大,更关注的是在一定传递因素影响下的表观动力学。因此采用液相主体温度、浓度来表示脱氢反应速率。密函数型动力学模型因其形式简单,参数数目少,通常也足够精确地拟合实验数据的优点,在非均相反应过程开发和工业反应器设计中得到了广泛应用,如式(6)所示,当产物有阻滞作用时(Kariya 等[9]对十氢萘脱氢进行了报道,认为脱氢产物萘及四氢萘对脱氢反应具有阻滞作用),CTT和CNP的指数为负值,反应开始时产物浓度为零,速率趋于无穷大,显然不合理;将式(6)改写为式(7)、式(8)能避免上述困难[19]。采用式(7)、式(8)所示的考虑产物阻滞作用的动力学模型,以萘和四氢萘的生成速率来表示各反应速率。

r1和r2皆为XTT和XNP的函数,反应系统物料衡算式(9)、(10)构成以XTT和XNP为因变量、反应时间t 为自变量的的常微分方程组。对于应给定的动力学参数初值,对物料衡算式组成的微分方程组求解得到对应于实验点t 处的萘和四氢萘转化率计算值,利用Matlab 计算软件的lsqnonlin 非线性最小二乘函数,以转化率测量值与计算值的残差平方和为优化目标函数进行迭代计算,如式(11)所示。计算得到模型中各参数值如表3 所示。
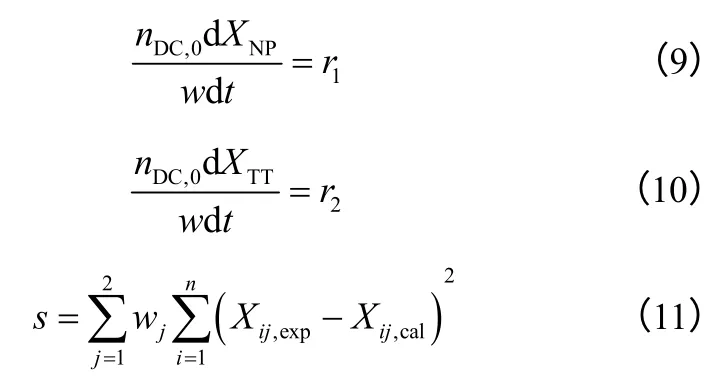

表3 动力学参数计算结果
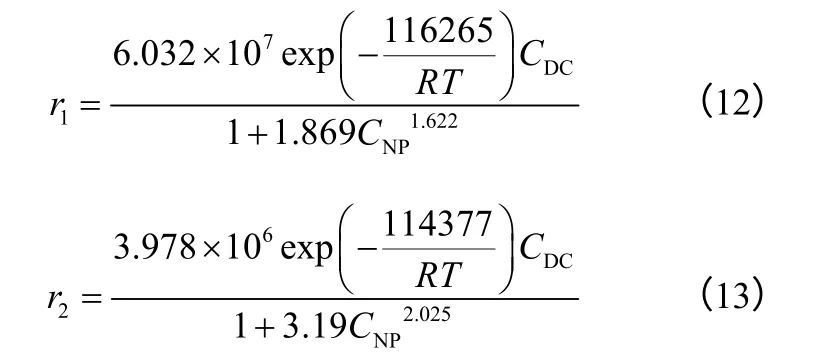
最终得到的生成萘及四氢萘的表观动力学方程如式(12)、式(13)所示。
2.5 拟合效果及参数检验
为考察所得动力学方程对实验数据的拟合效果,将各反应条件下脱氢反应的萘及四氢萘转化率的模型计算值与实验值进行了比较,如图5 所示,实验数据与模型计算值较吻合,拟合效果较好,萘与四氢萘的计算值与实验值的平均相对偏差分别为11.2%、9.6%。氢气产量是十氢萘产氢反应的一个重要指标,将动力学方程计算的产氢量与实测产氢量进行了比较,如图6 所示,产氢量计算值与实测值较匹配,产氢量的匹配进一步验证了基于液相浓度的动力学的可靠性;产氢量计算值与实验值平均相对偏差为8.0%,偏差可能是由于反应器内氮气及氢气混合不均造成的氢气含量测量误差所致,不过这一偏差已满足工业设计的需求。
要判断建立的动力学模型是否适定,还需计算决定性系数ρ2、F 统计值(回归均方和与模型计算误差均方和之比)并进行残差分布检验,见式(14)、式(15)。对于非线性回归,通常认为ρ2>0.9, F>10Fα(Np,Ne-Np),说明得到的模型在α 水平上是显著可信的,其中Ne为实验点数,Np为待估参数数目。
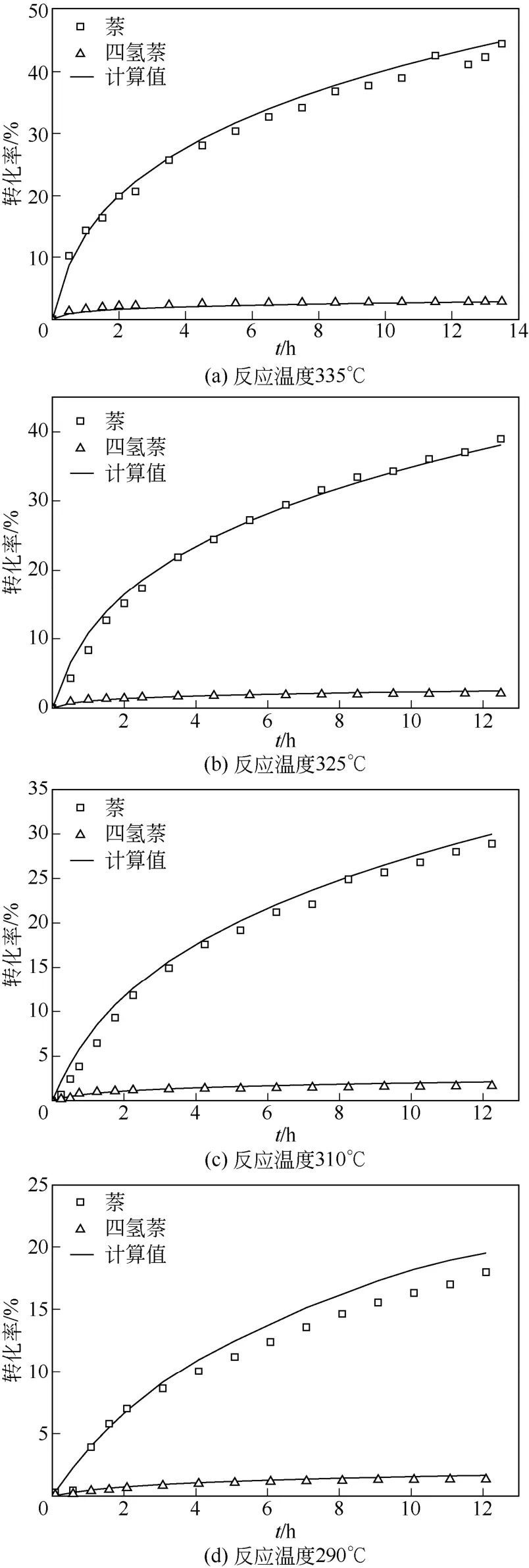
图5 萘及四氢萘转化率实验值与计算值的比较
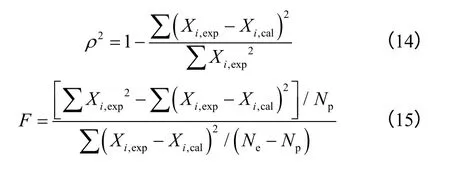
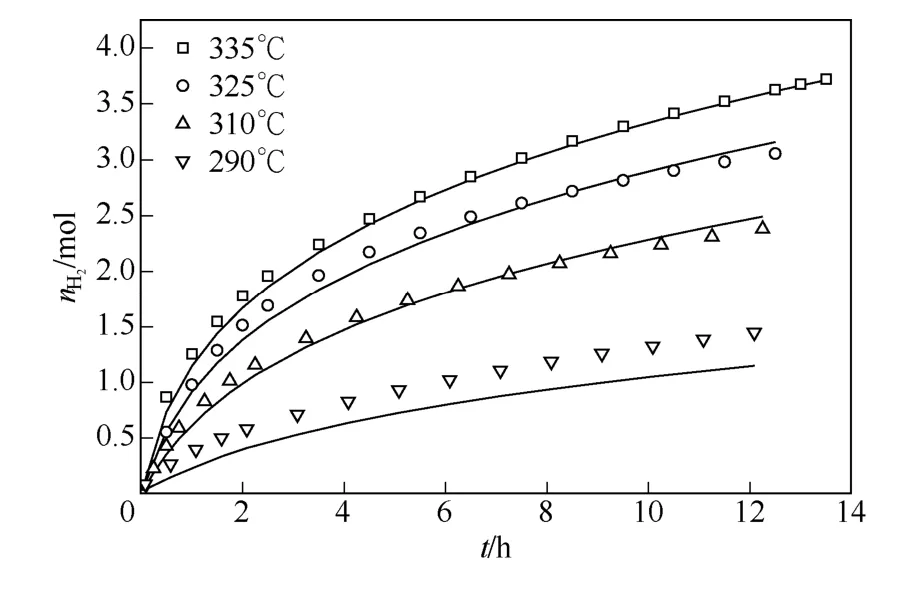
图6 产氢量实验值与计算值的比较
α一般取0.05、0.01,对应于95%、99%的置信度,本实验条件下,查F 分布表得F0.05=1.83, F0.01=2.34,计算得模型决定性系数ρ2=0.987,满足ρ2>0.9 的要求。F 统计值F=5377,显然F>10F0.05、F>10F0.01,且由图7 残差分析图看出,各数据点都随机分布在对角线附近,残差性态很好,因此该模型是适宜的。
LIU Yulin, LIU Changmiao, LIU Hongzhao, et al. Utilization technology of mine tailings in China and exploitation suggestions[J]. Conservation and utilization of mineral resources, 2018(6):140-144,150.

图7 转化率实验值及其对应模型计算值的比较
为验证动力学方程在实验范围内的适用性,进行了一组330℃条件下的脱氢实验,由表4 所示,此条件下萘与四氢萘转化率实验值与计算值的相对偏差均在12%以内,实验数据与模型计算值的匹配度较好,因此模型是可靠的,动力学方程可在实验范围内内插使用。
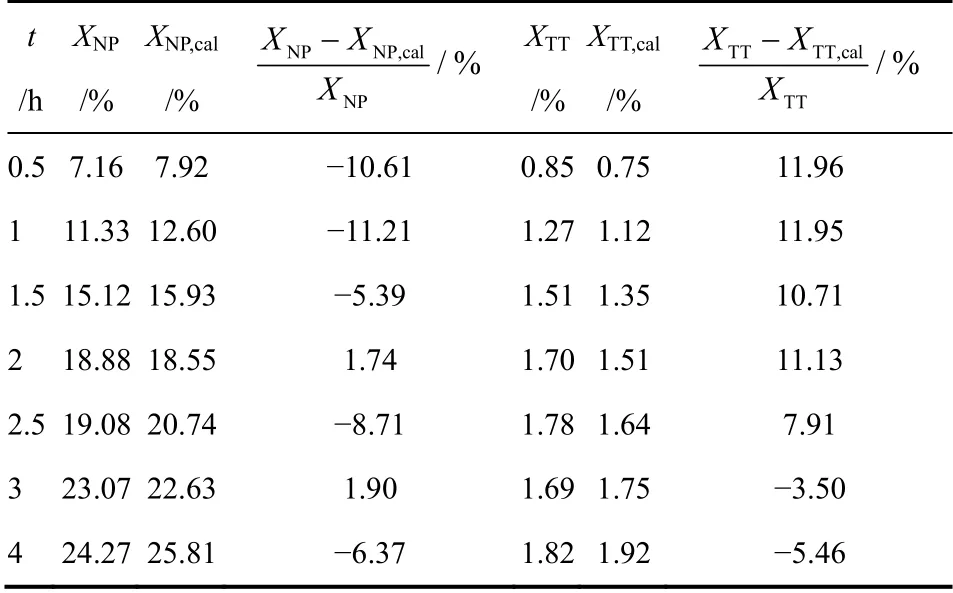
表4 330℃时脱氢转化率实验值与计算值比较
3 结 论
热力学理论计算表明,加压能显著提高十氢萘液相脱氢可达到的平衡转化率,1.3MPa、335℃时平衡转化率达58.06%;此条件下采用Pt/AC 催化剂进行了十氢萘液相脱氢实验,可获得约47%的十氢萘脱氢转化率。液相产物浓度分析表明,脱氢反应路径为十氢萘脱氢分别生成萘及四氢萘的平行反应。在消除外部传递因素的影响下,采用考虑产物阻滞作用的表观动力学模型,对十氢萘脱氢实验数据进行拟合,分别得到萘及四氢萘生成的表观动力学方程,生成萘及四氢萘的表观活化能分别为116.27kJ/mol、114.38kJ/mol,所得动力学方程有较好的实验数据拟合效果,且经参数检验及其他温度条件下的实验验证,动力学模型也有较好的可靠性。
符 号 说 明
CDC,CNP,CTT——分别为十氢萘、萘及四氢萘的浓度,mol/L
CDC,0,CNP,0,CTT,0——分别为十氢萘、萘及四氢萘的初始浓度,mol/L
DC,NP,TT——分别为十氢萘、萘及四氢萘
E1,E2——分别为生成萘及四氢萘的表观活化能,J/mol
K1——生成萘的反应速率阻滞常数,L1.57/mol1.57
K2——生成四氢萘的反应速率阻滞常数,L1.61/mol1.61
k1,k2——分别为生成萘及四氢萘的反应速率指前因子,L/(gcat·h)
nH2——氢气产量,mol
nDC,0——十氢萘初始摩尔量,mol
r1,r2——分别为萘、四氢萘的生成速率,mol/(gcat·h)
s——最优化计算目标函数
T——反应温度,K
t——反应时间,h
w——催化剂质量,g
wj——生成萘及四氢萘的反应的计算权重值
Xi,cal,Xi,exp—— 分别为转化率计算值及实验值
XDC,XNP,XTT—— 分别为十氢萘、萘及四氢萘的转化率
α1,β1,γ1—— 分别为萘生成反应的十氢萘、萘及四氢萘的浓度指数项
α2,β2,γ2—— 分别为四氢萘生成反应的十氢萘、萘及四氢萘的浓度指数项
ρ2—— 决定性参数
[1] Dunn S. Hydrogen futures:Toward a sustainable energy system[J]. International Journal of Hydrogen Energy,2002,27(3):235-264.
[2] Teichmann D,Arlt W,Wasserscheid P. Liquid organic hydrogen carriers as an efficient vector for the transport and storage of renewable energy[J]. International Journal of Hydrogen Energy,2012,37(23):18118-18132.
[3] 周鹏,刘启斌,隋军,等. 化学储氢研究进展[J]. 化工进展,2014,33(8):2004-2011.
[4] Shukla A,Karmakar S,Biniwale R B. Hydrogen delivery through liquid organic hydrides:Considerations for a potential technology[J]. International Journal of Hydrogen Energy,2012,37(4):3719-3726.
[5] 姜召,徐杰,方涛. 新型有机液体储氢技术现状与展望[J]. 化工进展,2012,31(s1):315-322.
[6] Teichmann D,Arlt W,Wasserscheid P,et al. A future energy supply based on liquid organic hydrogen carriers (LOHC)[J]. Energy and Environmental Science,2011,4(8):2767-2773.
[7] 王锋,杨运泉,王威燕,等. 芳烃储氢技术研究进展[J]. 化工进展,2010,29(10):1877-1884.
[8] Saito Y,Aramaki K,Hodoshima S,et al. Efficient hydrogen generation from organic chemical hydrides by using catalytic reactor on the basis of superheated liquid-film concept[J]. Chemical Engineering Science,2008,63(20):4935-4941.
[9] Kariya N,Fukuoka A,Ichikawa M. Efficient evolution of hydrogen from liquid cycloalkanes over Pt-containing catalysts supported on active carbons under “wet-dry multiphase conditions”[J]. Applied Catalysis A:General,2002,233:91-102.
[10] Biniwale R B,Kariya N,Ichikawa M. Dehydrogenation of cyclohexane over Ni based catalysts supported on activated carbon using spray-pulsed reactor and enhancement in activity by addition of a small amount of Pt[J]. Catalysis Letters,2005,105(1-2):83-87.
[11] Li P,Huang Y L,Chen D,et al. CNFs-supported Pt catalyst for hydrogen evolution from decalin[J]. Catalysis Communications,2009,10(6):815-818.
[12] Zhou Q,Li P,Wang X,et al. Preparation of CNF-supported Pt catalysts for hydrogen evolution from decalin[J]. Materials Chemistry and Physics,2011,126(1):41-45.
[13] Li X,Tuo Y X,Li P,et al. Effects of carbon support on microwave-assisted catalytic dehydrogenation of decalin[J]. Carbon,2014,67:775-783.
[14] 陈卓,杨运泉,包建国,等. 氢能载体甲基环己烷在Ni/γ-Al2O3上的脱氢反应[J]. 化工进展,2010,29(3):484-489.
[15] 朱刚利,杨伯伦. 液体有机氢化物储氢研究进展[J]. 化学进展,2009,21(12):2760-2770.
[16] Kariya N,Fukuoka A,Utagawa T,et al. Efficient hydrogen production using cyclohexane and decalin by pulse-spray mode reactor with Pt catalysts[J]. Applied Catalysis A:General,2003,247(2):247-259.
[17] Wang B,Goodman D W,Froment G F. Kinetic modeling of pure hydrogen production from decalin[J]. Journal of Catalysis,2008,253(2):229-238.
[18] 钟立龙. 多相态反应条件下十氢萘催化脱氢反应过程的研究[D]. 杭州:浙江大学,2007.
[19] 程振民,朱开宏,袁渭康. 高等反应工程教程[M]. 上海:华东理工大学出版社,2010:18-19.
