自养、异养和混合营养污泥沉降性能差异原因探讨
2015-07-25陈瑶徐愿坚陈玉成徐贵华
陈瑶,徐愿坚,陈玉成,徐贵华,3
(1 西南大学资源环境学院,重庆 400716;2 中国科学院重庆绿色智能技术研究院,重庆 400714;3 中国科学院水库水环境重点实验室,重庆 400714)
活性污泥法因其运行方式灵活、工作效率高、运行费用低等优点成为目前应用最广泛的生物处理工艺。通过重力作用进行固液分离是活性污泥工艺中的重要处理单元[1],其中活性污泥沉降性能的好坏直接影响到固液分离的效果。传统的活性污泥沉淀工艺大多通过调节沉淀池构造和沉淀操作等外部宏观条件来控制固液分离效果,而这些外部条件都是通过影响活性污泥表面理化性质(粒径、Zeta 电位、亲疏水性等)来间接影响污泥沉降性能[2-5]。因此,研究污泥表面理化性质这一直接影响因素显得尤为迫切和重要。然而,污泥表面理化性质众多且相互影响,很难直接从中找出最重要的理化性质。Randall[6]研究发现脱氮和脱氮除磷工艺的污泥沉降和脱水性能优于传统的异养污泥,而Hartley[7]和Tsai 等[8]的研究表明污泥沉降性能是由脱氮过程决定的,除磷过程基本没有影响。这些研究结果表明自养污泥的沉降性能优于异养污泥。自养污泥特别是硝化污泥和传统的异养污泥工艺操作条件一致,只是由于底物不同造成微生物菌群有所差异。此外,有研究显示菌落组成对污泥沉降性能影响不大[9],因此必然存在一种或几种微生物组成之外的污泥表面理化性质对其沉降性能差异起到关键作用,这些表面特性很有可能是影响污泥沉降性能的最重要因素。因此,通过研究造成自养污泥和异养污泥沉降性能差异的表面理化性质,有可能找出影响污泥沉降性能的最重要的微观因素,为更好地控制污泥沉淀过程提供理论支持。
本研究拟通过分析自养、异养和混合营养3 种不同基质类型的活性污泥沉降性能差异的原因,找出造成沉降差异的微观原因,为改善污泥的沉降性能提供新的途径和理论依据。首先保持操作条件一致启动培养3 种不同营养类型污泥,观测3 种污泥沉降性能差异,通过分析3 种污泥的粒径、Zeta 电位、接触角等参数找出影响污泥沉降性能的重要表面理化性质,进而研究污泥的表面物质微观成分如胞外聚合物(extracellular polymeric substances,EPS)含量及组分,找出造成污泥沉降差异的微观原因,从而为改善污泥的沉降性能提供依据。
1 试验材料与方法
1.1 实验装置
采用3 个完全相同的SBR 反应器培养好氧活性污泥,分别为自养反应器(R1)、异养反应器(R2)和混合营养反应器(R3)。反应器采用有机玻璃加工而成,由内外两个圆筒组成,内筒为活性污泥培养区,外筒为保温区(图1),冬天时利用加热棒控制反应器温度维持在28℃±0.5℃。内筒直径14cm,高39.5cm,有效容积为4.2L。3 个反应器每天运行3 个周期,每个周期8h,利用可编程四路时间继电器控制进水、曝气、沉降和出水4 个阶段,其中进水20min、曝气380min、沉降60min、出水20min。利用转子流量计控制每个反应器进气量为0.8L/min,保证3 个反应器中溶解氧(DO)浓度基本一致。另外,为保证反应器内污泥充分悬浮无积泥死角,需要较大的进气量,而较大的进气量远远超过自养反应器所需,很容易造成自养反应器污泥流失,造成污泥培养失败。因此本研究将充气和搅拌分开,采用转速200r/min 的电动搅拌器搅拌使污泥混合,尽量保证反应器内水力条件一致。同时,通过控制取样量和排泥量,将3 个反应器污泥龄控制在30 天左右。

图1 实验装置图
1.2 接种污泥
3 个反应器接种污泥保持一致,均取自重庆市北碚区污水处理厂曝气池,该污泥容积指数(SVI)为90.05mg/L。接种量为1.5L,接种后3 个反应器内污泥浓度完全一致,悬浮固体浓度(MLSS)约为4000mg/L,挥发性悬浮固体浓度(MLVSS)约为2300mg/L。
1.3 试验污水
3 个反应器进水采用人工模拟废水,自养反应器R1 以氯化铵作为底物进行硝化自养反应;异养反应器R2 以乙酸钠和葡萄糖作为底物,以硝酸钾作为氮源进行去除COD 的异养过程;混合营养反应器R3 以氯化铵作为氮源,以乙酸钠和葡萄糖作为有机碳源,进行硝化和去除COD 的异养反应。3个反应器利用磷酸氢二钾和磷酸二氢钾作为缓冲控制反应器内pH 值在7~8,模拟配水配方具体成分见表1。此外为了满足微生物对钙镁离子和微量营养元素的需求,配水中分别加入2mL 浓度为0.04g/L的CaCl2和0.08g/L 的MgSO4溶液以及2mL 微量元素,其具体成分见参考文献[10]。
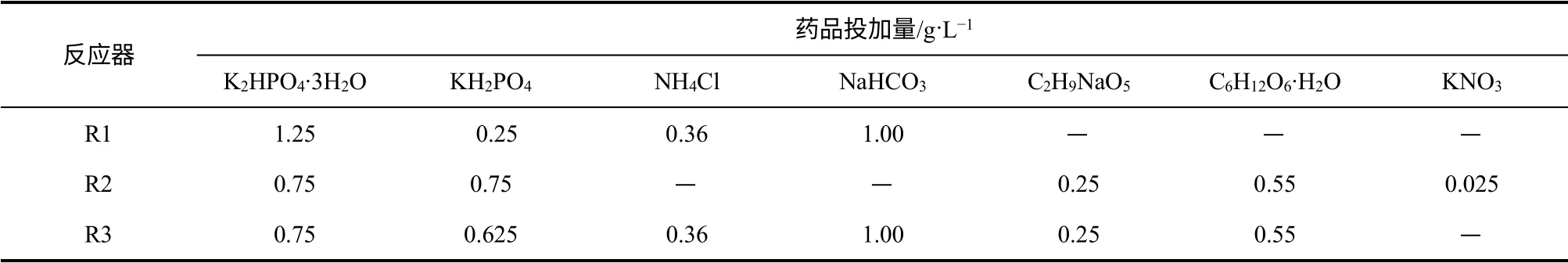
表1 3 种反应器进水基质
1.4 分析方法
MLSS、MLVSS、SVI 和pH 值测定采用国标方法测定,具体方法参考《水质和废水监测分析方法》(第四版)。粒径采用激光颗粒粒度分析仪(Mastersizer 3000,英国Malvern 公司)测量。污泥Zeta 电位使用纳米粒径和Zeta 电位分析仪测定(ZS90,英国Malvern 公司),污泥样品稀释后的浓度大约为干重的0.002%~0.005%,每个样品分别测量8 次,结果取平均值。使用接触角测量仪(DSA-100,德国Kruss 公司)测定污泥的静态水接触角。具体操作参照刘晓猛[11]的方法:将一定量的污泥抽滤至0.45μm 乙酸纤维素膜上,用蒸馏水洗涤两次后放在1%琼脂板上以保持其水分;测定时,从膜上剪一小条置于载玻片上,干燥10min;然后采用静滴法,将5μL 水滴到膜片上,使用CCD拍摄液滴形状,最后由软件分析计算污泥的接触角;每个样品测定10~15 次取平均值。EPS 提取采用Li 等[12]的两段式热提法提取,其中多糖浓度采用蒽酮法测定[13],以葡萄糖为标准物质;蛋白质采用改进的Lowry 法来测定[14],以卵清蛋白为标准物;腐殖酸采用改进的Lowry 法来测定[14],以腐殖酸为标准物;用多糖蛋白腐殖酸总和表示EPS 总量。
2 结果分析
2.1 3 种营养类型污泥SVI 变化
图2 为培养43 天后3 种营养类型污泥30min内污泥沉降比(SV30)的变化,其中量筒内3 种营养类型污泥浓度相同(4125mg/L±328mg/L)。由图2 可以看出,3 种营养类型污泥的沉降性能存在明显差异,自养污泥R1 在15min 后基本沉降完毕,异养污泥R2 和混合营养污泥R3 在30min 之后才达到最低点,但R3 污泥的SV30更低,说明R1 污泥沉降速度最快,R2 污泥最慢。图3 为培养43 天后3种营养类型污泥的100 倍光学显微镜图,可以看出经过驯化培养后3 种污泥形貌较接种污泥均有明显变化。R1 污泥形成更为密实的絮体结构,R3 污泥絮体小且较密实,R2 污泥絮体较大但结构疏松。这一结果与图2 所示污泥沉降快慢结果完全相符。此外,启动培养过程中3 种污泥SVI 的结果同样表明了这一差异,如图4 所示,3 种污泥的沉降性能在培养初期都有不同程度的恶化,这可能是由于微生物对环境的不适应造成的,但随着培养时间的增加,3 种污泥的SVI 趋于稳定。R1、R2 和R3 分别在经过22 天、25 天和22 天的培养后SVI 达到稳定,并出现明显差异。其中,自养污泥R1 具有最优的沉降性能,其SVI 值为20.46mL/g±5.52mL/g;异养污泥 R2 沉 降 性 能 最 差, 其 SVI 值 为88.52mL/g±5.01mL/g;混合营养污泥R3 沉降性能介于R1 和R2 之间,SVI 值为57.91mL/g±7.16mL/g。而污泥的絮凝和沉降过程直接由微生物絮体表面理化性质决定[1],因此必然是由一种或几种污泥絮体的表面理化性质造成了3 种污泥沉降性能的差异。接下来分析了本研究中3 种不同营养类型污泥的表面理化性质,以期找出造成其沉降性能差异的原因。
2.2 3 种营养类型污泥絮体表面理化性质的差异
3 个反应器培养稳定后,在43 天取样分析3 种营养类型污泥的表面理化性质(平均粒径、Zeta 电位、接触角),结果如表2 所示。从表2 中可以看出,R2 污泥的平均粒径最大,R3 污泥最小。根据斯托沉降公式,如果密度一样的颗粒,尺寸较大的颗粒沉降速度更快。而本研究中颗粒大的沉降反而较差,这可能由于活性污泥结构复杂,是一个由各类微生物聚集在一起的多孔絮体复杂结构[15],而所测量的粒径只能反映污泥絮体的表观尺寸,无法真实反映其絮体内部结构。如图3 所示,虽然R2 反应器污泥絮体粒径较大,但结构较为松散,密度不高,而R1 和R3 与此相反,颗粒较小但结构较为致密。因此污泥沉降性能的好坏与污泥絮体的粒径没有直接关联。

图2 不同营养类型污泥SV30 对比图
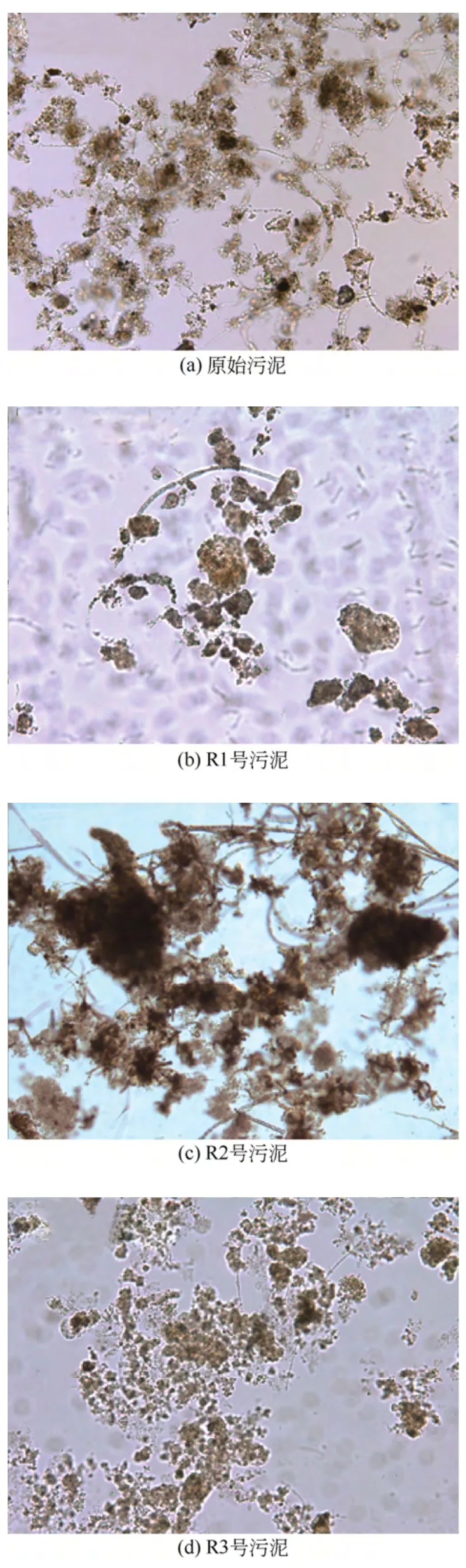
图3 不同营养类型污泥100 倍光学显微镜图
从表2 中还可以得知,3 种污泥的Zeta 电位存在明显差别。R2 污泥的Zeta 电位最低;R1 污泥的Zeta 电位最高;R3 位于R1 和R2 之间。对比Zeta电位和SVI 值可以发现,Zeta 电位越高,即污泥絮体表面负电荷越少,污泥沉降性能越好。根据DLVO(derjarguin landau verwey overbeek)理论[16-17],污泥絮体表面负电荷越多,表明有更多的自由电荷,这会造成絮体间的静电斥力增大,使得絮体难于进一步接触凝聚,导致污泥沉降性能恶化。同时,静电斥力增大还会使污泥絮体处于一个“伸展状态”,形成毯状结构,此时污泥具有更高的比表面积,污泥沉降所受阻力增大,从而恶化絮体沉降效果[18]。另外,Zeta 电位绝对值越高,分散在液体中的颗粒的稳定性越好[19],活性污泥絮体不易聚集,污泥沉降能力也会变差。

表2 不同营养类型污泥平均粒径、Zeta 电位和接触角
表2 中接触角和SVI 的结果显示,3 种污泥接触角有明显差别,R1 污泥的最高;R2 污泥最低;R3 位于R1 和R2 之间,表明R1 污泥相对疏水性最好,R2 污泥最差。对比接触角值和SVI 值可以发现,接触角值越大,即污泥相对疏水性越好,污泥沉降性能越好。这与龙向宇等[4]的研究结果相同。
综上所述,污泥沉降性能与污泥表面性质如下:粒径无明显关联,而Zeta 电位、相对疏水性与污泥沉降性能密切相关,电位值越接近于0,污泥相对疏水性越好,污泥沉降性能越好,表明Zeta 电位、相对疏水性是决定污泥沉降性能的最重要表面理化性质。然而Zeta 电位和相对疏水性只是污泥表面物质的一个理化指标,因此为找出造成3 种不同营养类型污泥沉降差异的微观原因,需要进一步研究污泥表面物质的组成,即包裹在微生物细胞和污泥絮体表面的胞外分泌物(EPS),找出造成沉降差异的最终原因。
2.3 3 种营养类型污泥EPS 变化
3 种不同营养类型污泥的EPS 总量在前10 天内波动较大,从100mg/L 减少到40mg/L,这可能是由于污泥还没有培养稳定(图5)。在此之后污泥经培养驯化适应了新的环境条件,出现较为明显的差异:R3 反应器EPS 总量最高,为91.57mg/gMLVSS±8.11mg/gMLVSS ; R1 稍 低 于 R3 , 为83.93mg/gMLVSS±11.55mg/gMLVSS;R2 最低,为54.45mg/gMLVSS±8.88mg/gMLVSS。而在3 个反应器稳定后(43 天)的Zeta 电位为R1>R3>R2,相对疏水性为R1>R3>R2,SVI 为R1<R3<R2,这一结果与EPS 总量没有相关性,表明EPS 总量对污泥表面Zeta 电位、相对疏水性和污泥沉淀效果好坏没有明显影响。这与Chao 等[20]和王红武等[5]的研究结果一致。以上结果表明,EPS 中的某种或几种组分决定了污泥表面Zeta 电位和相对疏水性的高低,进而影响了污泥的沉降性能,因此下一步需要对污泥EPS 的组成进行详细分析,找出造成污泥表面Zeta电位和相对疏水性差异的重要组分。
EPS 主要由多糖、蛋白质和腐殖酸组成,因此本研究就这3 种组成进行了研究。图6(a)表明,R1 和R2 污泥EPS 中腐殖酸的含量差别在整个培养过程中相差不大,但Zeta 电位、相对疏水性和SVI(表2 和图4)都表明R1 和R2 之间差异最大,说明污泥EPS 中腐殖酸含量对污泥表面Zeta 电位、相对疏水性和污泥沉降性能基本无影响。多糖在3 种不同营养类型污泥中从启动培养到稳定后含量较低而且波动甚微[图6(b)],在培养20 天之后出现较小差异,R2、R3 相差不大,R1 稍低。而3 种污泥表面的Zeta 电位、相对疏水性和污泥沉降性能差异较大(表2 和图4),说明污泥EPS 中多糖组分对污泥表面Zeta 电位和污泥沉降性能基本无影响。R1、R2 和R3 反应器分别在培养22 天、25 天和22 天后,随着污泥初步培养驯化完成,其蛋白质组分含量也趋于稳定[图6(c)],分别为4 8.0 5 m g/g M LV S S±5.8 5 m g/g M LV S S、1 4.0 8 m g/g M LV S S±3.3 6 m g/g M LV S S 和28.55mg/gMLVSS±3.51mg/gMLVSS。同时R1、R2和R3 污泥表面Zeta 电位值为R1>R3>R2,相对疏水性为R1>R3>R2。这一结果证明污泥EPS 中蛋白含量与污泥表面Zeta 电位密切相关,且这与3 种污泥的沉降性能结果一致。通过相关性分析(图7)也可以发现:在SVI 稳定后蛋白含量和SVI 呈负相关,且相关性较高,达R2=0.8792(P<0.05)。这表明蛋白含量是造成3 种营养类型污泥表面Zeta 电位和相对疏水性差异的最重要原因。这主要是由于下面两个因素造成的。首先蛋白质上含有阳离子结合位点和聚合物交互点,而蛋白与多价阳离子的结合是影响污泥沉降性能的重要因素[21]。蛋白含量越多,能与越多的阳离子结合,形成更为紧密的污泥絮体结构,促进污泥沉降[22]。其次,蛋白与阳离子的结合又能减少污泥表面负电荷,从而降低污泥之间的静电斥力而促进絮体聚集。最后,蛋白中的带有疏水作用的氨基酸对污泥絮体的疏水性贡献很大。综上所述,蛋白含量是造成本研究中污泥沉降差异的微观原因,蛋白质含量越高,会导致表面负电荷减少,相对疏水性升高,有利于污泥絮凝和沉降。

图4 不同营养类型污泥SVI 变化曲线
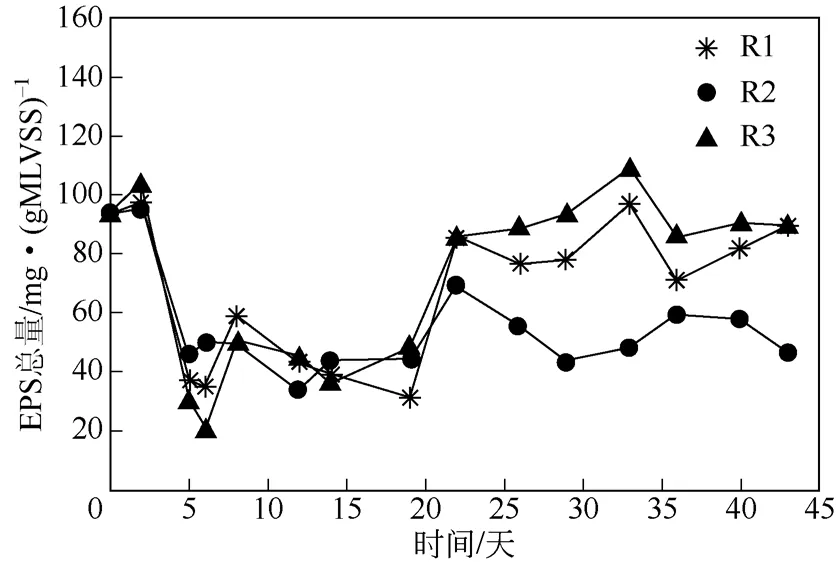
图5 不同营养类型污泥EPS 总量

图6 EPS 中腐殖酸、多糖、蛋白质含量

图7 蛋白质含量对SVI 的影响
3 结 论
通过实验室内培养自养、异养和混合营养3 种活性污泥,分析造成3 种污泥沉降性能差异的微观原因,其结果表明:3 种不同营养类型污泥沉降性能存在明显差异,即自养污泥>混合营养污泥>异养污泥。污泥表面Zeta 电位和相对疏水性是造成本研究中3 种污泥沉降性能差异的最重要表面理化性质,污泥中EPS 蛋白质组分含量的差异是造成3 种污泥表面Zeta 电位和相对疏水性差异的微观原因,蛋白质与阳离子的结合减少污泥表面负电荷,从而降低污泥之间的静电斥力而促进絮体聚集,进而影响污泥沉降性能。
[1] Jin B,Wilén B M,Lant P. A comprehensive insight into floc characteristics and their impact on compressibility and settleability of activated sludge[J]. Chemical Engineering Journal,2003,95:221-234.
[2] 杨雄,彭永臻,郭建华,等. 氮/磷缺乏对污泥沉降性能及丝状菌生长的影响[J]. 化工学报,2014,65(3):1040-1047.
[3] 朱哲,李涛,王东升,等. pH 对活性污泥表面特性和形态结构的影响[J]. 环境工程学报,2008,2(12):1599-1640.
[4] 龙向宇,龙腾锐,唐然. 胞外聚合物及其表面性质对活性污泥沉降性的影响[J]. 城市环境与城市生态,2008,21(3):15-20.
[5] 王红武,李晓岩,赵庆祥. 活性污泥的表面特性与其沉降脱水性能的关系[J]. 清华大学学报:自然科学版,2004,44(6):766-769.
[6] Randall C W. Activated sludge:Latest developments and a look into the future (abridged)[J]. Water and Environmental Journal,1998,12:375-383.
[7] Hartley K J. Controlling sludge settleability in the oxidation ditch process[J]. Water Research,2008,42:1459-1466.
[8] Tsai M W,Wentzel M C,Ekama G. A. The effect of residual ammonia concentration under aerobic conditions on the growth of Microthrix parvicella in biological nutrient removal plants[J]. Water Research,2003,37:3009-3015.
[9] Wilén B M,Jin B,Lant P. Impacts of structural characteristics on activated sludge floc stability[J]. Water Research,2003,37:3632-3645.
[10] Tsuneda S,Ohno T,Soejima K. Simultaneous nitrogen and phosphorus removal using denitrifying phosphate-accumulating organisms in a sequencing batch reactor[J]. Biochemical Engineering Journal,2006,27:191-196.
[11] 刘晓猛. 微生物聚集体的相互作用及形成机制[D]. 合肥:中国科学技术大学,2008.
[12] Li X Y,Yang S F. Influence of loosely bound extracellular polymeric substances (EPS) on the flocculation , sedimentation and dewaterability of activated sludge[J]. Water Research,2007,41:1022-1030.
[13] Dubois M,Uilles K A,Hamilton J K,et al. Colorimetric method for determination of sugars and related substance[J]. Analytical Chemistry,1956,28(3):350-356.
[14] Lowry O H,Farr A L,Randall R J. Protein measurement with the folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265-275.
[15] Wu R,Lee D,Waite T,et al. Multilevel structure of sludge flocs[J]. Colloid Interface Science,2002,252:383–392.
[16] Grasso D,Subramaniam K,Butkus M. A review of non-DLVO interactions in environmetal colloidal systems[J]. Environmental Science & Bio/Technology,2002,1(1):17-38.
[17] Feldner J,Bredt W,Kahane I. Influence of cell shape and surface charge on attachment of mycoplasma pneumonia to glass surfaces[J]. Journal of Bacteriology,1983,153(1):1-5.
[18] Mikkelsen L H,Keiding K. Physico-chemical characteristics of full scale sewage sludges with implications to dewatering[J]. Water Research,2002,36(10):2451-2462.
[19] 万里平,孟英. 油田作业废水絮凝过程中Zeta 电位的研究[J]. 化学研究,2004,15(2):25-28.
[20] Chao A C,Keinath T M. Influence of process loading intensity on sludge clarification and thickening characteristics[J]. Water Research,1979,13:1213-1223.
[21] Hoa P T,Nair L,Visvanathan C. The effect of nutrients on extracellular polymeric substances production and its influence on sludge properties[J]. Water SA.,2003,29:437-442.
[22] Martinez F,Lema J,Mendez R,et al. Role of exopolymeric protein on the settleability of nitrifying sludges[J]. Bioresource Technology,2004,94:43-48.
