厌氧氨氧化工艺的应用进展
2015-07-25张正哲金仁村程雅菲周煜璜布阿依谢姆古丽
张正哲,金仁村,程雅菲,周煜璜,布阿依·谢姆古丽
(1 杭州师范大学生命与环境科学学院,浙江 杭州 310036;2 杭州师范大学生态系统保护与恢复杭州市重点实验室,浙江 杭州 310036)
厌氧氨氧化(anaerobic ammonium oxidation,Anammox)工艺因其无需外加有机碳源、脱氮负荷高、运行费用低、占地空间小等优点[1-2],已被公认为是目前最经济的生物脱氮工艺之一。近年来,国内外对厌氧氨氧化工艺的研究取得了大量的实验室成果。但是,一方面由于厌氧氨氧化菌(anaerobic ammonium oxidizing bacteria,AnAOB)生长缓慢(倍增时间长达11 天)、细胞产率低[m(VSS)/m(NH4+-N)=0.11g/g)、对环境条件敏感[3],另一方面由于实际废水成分复杂,常含有AnAOB 的抑制物质,限制了厌氧氨氧化工艺在实际工程中的大规模应用。因此,有必要对近年来国内外厌氧氨氧化工艺的应用实例和经验进行系统总结,推动该工艺的进一步工业化应用,使之在污水脱氮处理领域发挥更积极的作用。本文介绍了AnAOB 的生物多样性和厌氧氨氧化工艺形式的多样性,重点综述了厌氧氨氧化技术在处理各类废水中的实验室研究和工程应用情况。
1 厌氧氨氧化菌生物多样性
迄今为止,已发现的AnAOB 有6 属18 种(表1 ), 构成了独立的厌氧氨氧化菌科(Anammoxaceae),并且AnAOB 广泛存在于自然生态系统中,如海洋沉积物[4]、淡水沉积物[5]、油田[6]、厌氧海洋盆地[7]、氧极小区[8]、红树林地区[9]、海洋冰块[10]、淡水湖[11]以及海底热泉[12]等。AnAOB的生态分布多样性是由自身的代谢多样性决定的,也正因如此,厌氧氨氧化在全球氮素循环中扮演重要角色,将其应用于不同水质含氮废水的治理也具有与生俱来的优势和不可估量的潜力。
2 厌氧氨氧化工艺形式多样性
基于厌氧氨氧化原理的工艺形式纷繁多样,包括分体式(两级系统)和一体式(单级系统)两种。一体式有CANON(completely autotrophic nitrogen removal over nitrite)、OLAND(oxygen limited autotrophic nitrification and denitrification)、DEAMOX(denitrifying ammonium oxidation)、DEMON(aerobic deammonification)、SNAP(simultaneous partial nitrification,anammox and denitrification)、SNAD(single-stage nitrogen removal using anammox and partial nitritation)等工艺;分体式主要有SHARON(single reactor for high activity ammonia removal over nitrite)-anammox 工艺。随着工程经验越来越丰富,一体化系统正日益得到青睐。相比而言,一体式工艺的基建成本较低,占地面积较小,更易运行,可避免亚硝酸盐抑制。但是一体化工艺启动时间较长,反应器内微生物间的生态关系复杂,经受负荷冲击时易失稳(详见表2)。总之,这两类工艺各有利弊,应用时需根据水质、场地、管理水平等具体情况,做到“因地制宜,因水制宜,量(水)质裁艺,因人而异”。

表1 AnAOB 的生物多样性
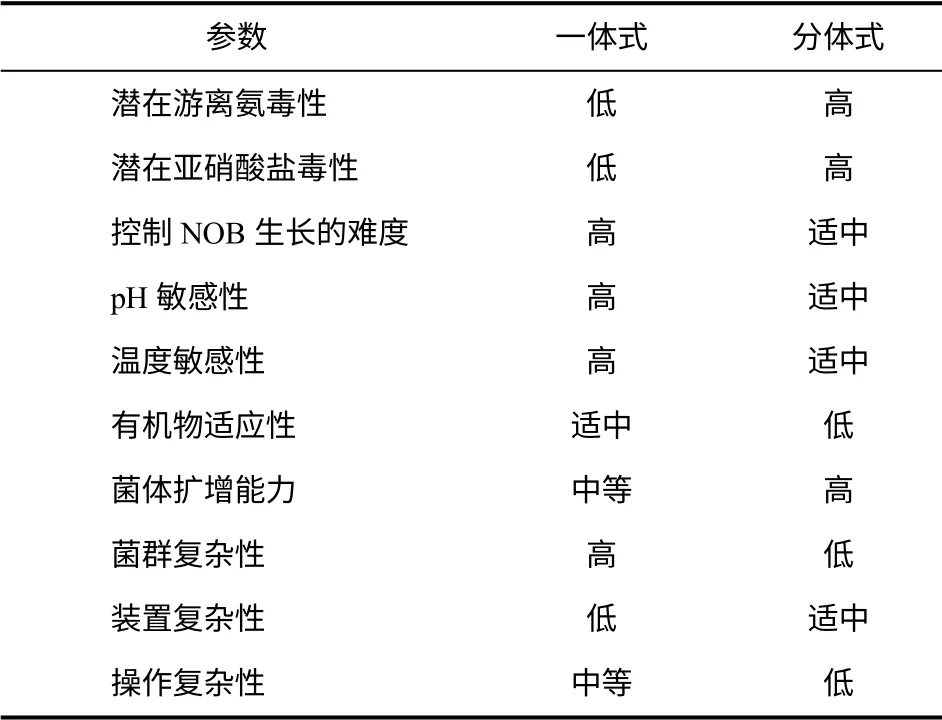
表2 一体式和分体式厌氧氨氧化工艺的运行条件比较
3 厌氧氨氧化工艺应用多样性
随着厌氧氨氧化工程的普及,到2014 年末,全球范围内的厌氧氨氧化工程超过了100 座[28]。其中大部分工程坐落于欧洲,也正日益风靡亚洲和南美洲。表3 列出了一些代表性工程实例。
目前,厌氧氨氧化生物脱氮技术已经成功应用于处理多种实际废水,包括高氨氮、低碳氮比的污泥液、厕所水、垃圾渗滤液等。其中,应用最多的无疑是污泥消化液和污泥压滤液的处理,而该技术在制革、半导体、食品加工等工业废水和垃圾渗滤液处理方面的推广也逐步展开,但针对焦化、制药、养殖、石化等高氨氮工业废水处理领域应用仍相对较少。
3.1 污泥液处理
污泥消化液和污泥压滤液是典型的低碳氮比废水,且pH 值一般为7.0~8.5,温度一般为30~37℃,基本处于AnAOB 生长的最佳温度范围内。
van Dongen 等[35]首先在实验室中探究了短程硝化-厌氧氨氧化工艺处理荷兰Dokhaven 污水处理厂消化污泥上清液的可行性,取得了显著的脱氮效果,有超过80%氨氮被转化为氮气。后来瑞士Fux等[36]又利用来自于两个不同市政污水处理厂的消化液对短程硝化-厌氧氨氧化工艺进行了中试研究,采用1600L 的序批式反应器(sequencing batch reactor,SBR)、进水氨氮620~650mg/L、pH 值为7.3~7.5、温度26~28℃时,氮容积负荷率(nitrogen loading rate,NLR)最高可达0.65kgN/(m3·d),总氮去除率(nitrogen removal efficiency,NRE)达92%,同时污泥产量也较低[36]。在此基础上,2002 年,研究人员直接将反应器放大,建成了世界上第一套生产性的短程硝化-厌氧氨氧化组合反应器,该工艺已经在Dokhaven 污水处理厂正式运行,厌氧氨氧化反应器容积70m3,处理量为750kgN/d[32]。此后,采用厌氧氨氧化工艺处理污泥液的工程开始风靡欧洲。
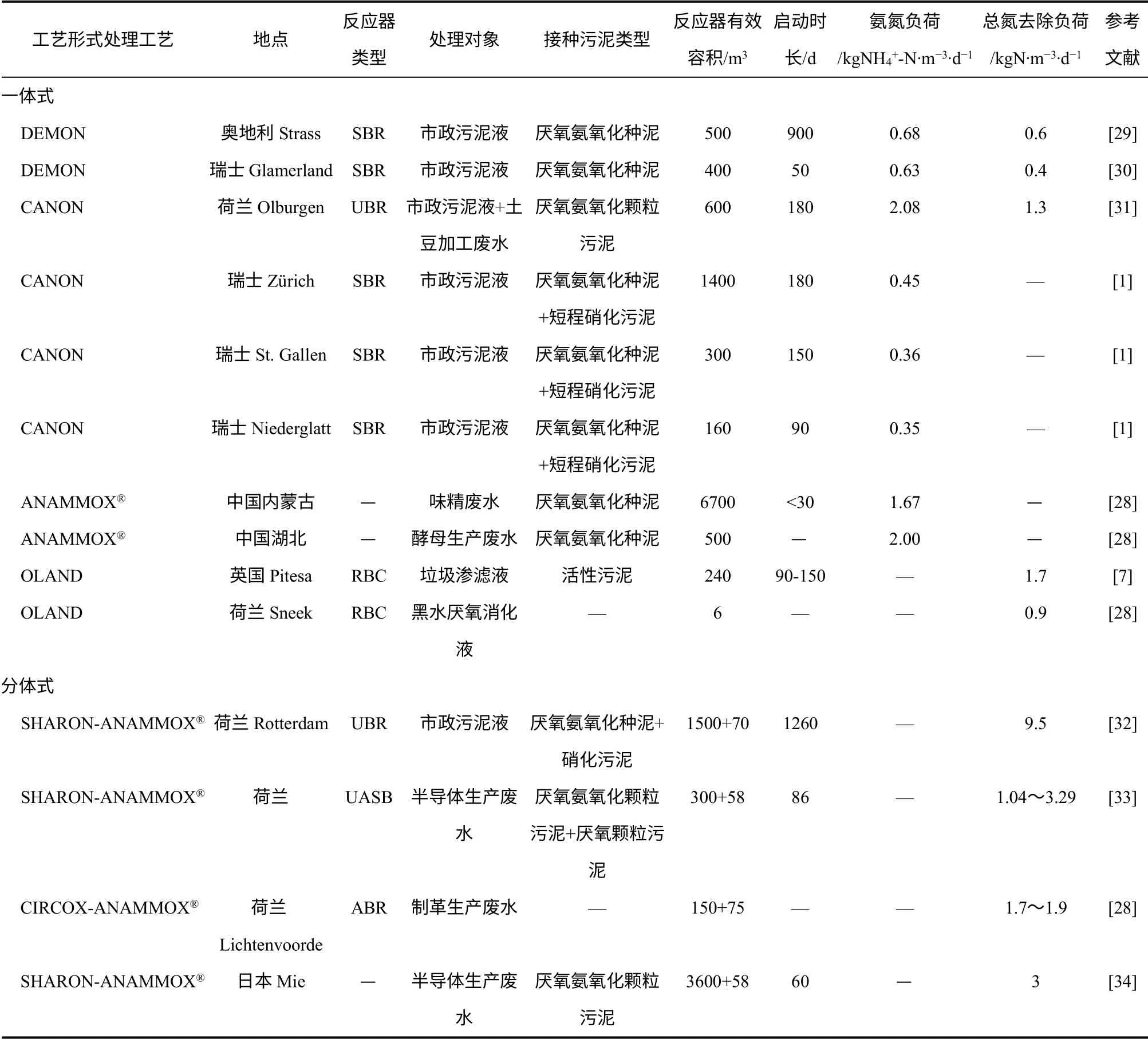
表3 厌氧氨氧化工程应用实例
污泥液因其水温高、水量小、高氨氮、低碳氮比的水质特点成为了厌氧氨氧化工艺最初的处理对象。到目前为止,全球约75%的厌氧氨氧化工程装置是用于处理污泥液的,厌氧氨氧化工艺在该领域已发展成熟且工程经验丰富[28],但仍存在一些迫切需要解决的技术难题,如厌氧消化出水中硫化物对厌氧氨氧化反应系统的影响、氮氧化物的产生环节和减排措施等。
3.2 垃圾渗滤液处理
垃圾渗滤液是一种成分复杂的废水,具有有机物浓度高、重金属等有毒物质含量高、水质变化大、氨氮含量高、可生化性差等特点。其氨氮浓度一般小于3000mg/L,在成熟的垃圾填埋场则为500~2000mg/L,而且随着堆放时间的增加,浓度会越来越高,甚至超过10000mg/L。而厌氧氨缺失的现象早期也是在处理废物填埋场渗滤液的生物转盘中发现的[37],这使得厌氧氨氧化应用于垃圾渗滤液的处理成为了可能。
Liang 等[38-39]采用“短程硝化-厌氧氨氧化-土壤渗滤”串联工艺处理城市垃圾填埋场的垃圾渗滤液,经过166 天运行,氨氮、总氮和COD 的平均去除率分别达到了97%、87%和89%,充分说明了该联合工艺的可行性,并且厌氧氨氧化对于降解垃圾渗滤液中的腐殖酸具有贡献。Liu 等[40]采用短程硝化-厌氧氨氧化工艺处理稀释后的垃圾渗滤液厌氧出水,成功稳定运行70 天,并且氨氮和亚硝氮去除率保持93%以上。目前厌氧氨氧化工艺处理垃圾渗滤液的研究相对较多,普遍采用的是短程硝化-厌氧氨氧化工艺,并且研究者在不断尝试各种组合技术,比如与反硝化[41-42]、高级氧化[43]、土壤渗滤[38]的联用。这主要是因为渗滤液中含有较多重金属等有毒物质,一定程度上抑制了厌氧氨氧化活性,为了获得稳定的运行性能不便直接进入到厌氧氨氧化反应器中,所以不同年龄的垃圾渗滤液中这些抑制性物质对微生物的抑制作用(对一体式和分体式)、菌群影响和调控对策还有待进一步研究。
3.3 畜禽养殖废水处理
畜禽养殖废水成分复杂、水质水量波动大、COD 浓度较高且存在部分有机氮[44],传统硝化-反硝化处理这类高氨氮养殖废水时,存在着能耗高、脱氮效果差、需要补充碳源、投加碱等缺点,而厌氧氨氧化工艺有望成为养殖废水脱氮的备选工艺。
Hwang 等[45]采用SHARON-厌氧氨氧化工艺处理碳氮比为1.26 的猪场废水厌氧消化液,短程硝化采用SBR 反应器,厌氧氨氧化采用升流式厌氧污泥床(up-flow anaerobic sludge blanket,UASB)反应器,在进水氨氮和亚硝氮浓度(以N 计,下同)分别为213mg/L 和323mg/L 时,最终出水氨氮和亚硝氮浓度分别为92mg/L 和77mg/L,浓度仍然较高,可能因为反应器中生物量较少。Yamamoto 等[46]研究了SHARON-厌氧氨氧化工艺处理猪场废水消化液的长期稳定性,厌氧氨氧化反应器经220 天的运行后达到稳定,平均NRE 和氮容积去除率(nitrogen removal rate,NRR)分别为55%和0.22kg/(m3·d)[46]。
现阶段应用厌氧氨氧化工艺处理猪场废水厌氧消化液的研究,普遍存在着NRR 偏低、运行不稳定等问题,而且废水中的有机物、重金属、抗生素等成分可能会对AnAOB 产生抑制,因此应侧重于工艺优化改造方面的研究,寻求抑制障碍消除对策。
3.4 味精废水处理
味精废水具有悬浮物浓度高、COD 高、生化需氧量(biochemical oxygen demand,BOD)高、NH4+-N高、SO42-高、pH 值低(2 左右)等特点[47],处理难度大、成本高,是难以治理的工业废水之一。
陈旭良等[48]研究了厌氧氨氧化工艺处理味精废水的可行性,经过71 天的运行成功启动了厌氧氨氧化反应器,最高NRR 达到0.457kg/(m3·d),但当进水浓度相对较高时,反应器去除效果波动较大。Shen 等[49]研究了不同污泥源富集AnAOB 对启动味精工业废水处理系统的影响,接种污泥取自垃圾渗滤液处理厂、市政污水处理厂和味精废水处理厂,经过360 天运行,最大比厌氧氨氧化活性分别为0.11kg/(kgVSS·d)、0.09kg/(kgVSS·d)和0.16kg/(kgVSS·d),证明了活性污泥经长期驯化可启动厌氧氨氧化工艺来处理味精废水。目前,通辽梅花味精废水Ⅰ期工程厌氧氨氧化反应器容积高达6600m3,是迄今世界上规模最大的厌氧氨氧化工程。但是味精废水中高浓度硫酸盐(5000~5500mg/L)产生强大的渗透压会大大降低污水处理单元中微生物的活性,而且硫酸盐经硫酸盐还原菌作用还会转化为硫化氢,其对AnAOB 存在显著的抑制,所以一般不采用厌氧氨氧化直接处理,只是用于后续处理(比如反硝化+短程硝化-厌氧氨氧化或厌氧消化+短程硝化-厌氧氨氧化等)。因此,这些污染物在整个联合工艺中的变化及对后续厌氧氨氧化工艺的影响还有待研究。
3.5 焦化废水处理
焦化废水含有大量的氨氮、有机物、酚、氰、硫氰化物、焦油及多环芳烃等污染物[50],毒性大,可生化性差。Toh 等[50]率先研究了厌氧氨氧化工艺应用于焦化废水脱氮的可行性,虽然一开始从实际焦化废水中富集AnAOB 并未成功,但是接种市政污泥后取得了成功。苯酚浓度从50mg/L 逐步升至500mg/L,经过15 个月的驯化和富集,最大NRR为0.062kg/(m3·d),是驯化前反应器NRR 的1.5 倍。试验表明,经驯化后的AnAOB 在苯酚浓度320~330mg/L 时(焦化废水苯酚浓度的平均水平),厌氧氨氧化活性仍然存在,反应器NRR 约为0.12kg/(m3·d)。因此,厌氧氨氧化工艺处理焦化废水潜力巨大,但是焦化废水中含有的酚[51]、氰化物、硫化物[52]、硫氰化物、难以生物降解的焦油、嘧啶等杂环化合物以及联苯、萘等多环芳香化合物对厌氧氨氧化工艺的作用还有待进一步探索。
3.6 城市生活污水处理
目前能源和成本效益以及可持续发展逐渐演变为污水处理行业的标杆,随着我国城镇化步伐的不断推进,城市生活污水的再生利用和能源回收日益成为研究焦点。城市生活污水所蕴藏的能量主要来自有机碳、氮氮、磷酸盐,据估计其能量每人分别约为23W、6W、0.8W[53],而自养型厌氧氨氧化工艺的应用有望使城市污水厂实现能源自给[54]。
对于非热带和亚热带地区的市政污水来说,较低的水温(8~15℃)对于厌氧氨氧化工艺的运行仍是一个巨大的挑战。Hu 等[55]采用一体式短程硝化-厌氧氨氧化工艺,原先25℃下运行的SBR(5L)只用了10 天就适应了12℃的低温环境,并在该温度条件下稳定运行了300 多天,没有亚硝酸盐积累且NRE 超过90%。同时,该研究还证明,高负荷反应器的污泥可作为低温低氨氮市政污水厌氧氨氧化反应器的接种污泥。本文作者课题组[56]的研究表明,实验室规模35℃下运行的厌氧氨氧化反应器,可通过逐步降温驯化、菌种流加或添加低温保护剂(甜菜碱)等方法使得反应器在9.1℃时的NRR 高达6.61kg/(m3·d)。近来,Lotti 等[57]研究证明颗粒污泥形态的AnAOB 能在市政主流污水条件下(10~20℃)生长,而且能形成新的颗粒污泥,有效持留在污泥流化床反应器中。目前,常温和低温下厌氧氨氧化工艺已有一定的研究基础,中试(4m3,19℃±1℃)研究也已取得阶段性的成功,有望使污水处理厂实现能量自给[58]。但是实际工程中如何在低温和低基质浓度条件下维持氨氧化菌(ammoniaoxidizing bacteria,AOB)和AnAOB 对亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)的竞争优势,提高低温下的菌体活性、实现低基质浓度下的菌体扩增、高流速下的菌体持留等问题仍是有待突破的瓶颈。
3.7 粪便污水的处理
粪便污水为城市生活污水贡献了近一半的有机物和大部分的氮磷营养物负荷。Vlaeminck 等[59]采用生物转盘探究了OLAND 工艺处理厌氧消化后的粪便污水的可行性,经过2.5 个月的适应期(模拟废水逐步被粪便污水替换)后,氨氮容积去除率稳定在0.7kg/(m3·d),NRE 可达76%。de Graaff 等[60]采用两段式短程硝化-厌氧氨氧化工艺对厌氧消化后的粪便污水进行了小试研究,通过添加钙离子(39mg/L)可强化厌氧氨氧化污泥的颗粒化,NRR为0.5kg/(m3·d),NRE 达87%。在该研究中,由于亚硝酸盐浓度增加,厌氧氨氧化反应不完全,导致温室气体N2O 的产生,就此研究者认为控制亚硝酸盐的积累能够阻止N2O 的产生。另外,粪便污水中含有相对较高浓度的激素和药物,de Graaff 等[61]对短程硝化-厌氧氨氧化处理后的出水中微污染物进行了检测,结果表明该工艺对乙酰氨基酚、美托洛尔、布洛芬等污染物去除效果较好,并建议对不易生物降解的双氯芬酸、卡马西平、西替利嗪可采用物化后续处理。Sliekers 等[62]采用CANON 工艺处理尿液并取得一定的进展,在限氧条件下在SBR 中以模拟含氨废水为基质连续富集培养AOB 和AnAOB,当基质变为尿素时,能够实现自养脱氮,该研究还通过批次试验证明了AnAOB 不能直接利用尿素,需要依靠AOB 分解尿素为厌氧氨氧化提供基质。Liu 等[63]的研究也表明尿素分解菌能和AnAOB 较好地共存。因此,短程硝化-厌氧氨氧化工艺处理源分离粪便污水具有巨大的优势,而且城市污水源分离是未来的一个趋势,但是目前大规模实现粪便污水分离收集的工程化还需要一定的时日[64]。
3.8 含盐废水处理
一些工业废水,比如海产品加工、纺织印染、医药和石油化工、制革以及养殖和垃圾渗滤液等含有大量的氨氮和盐[65]。Dapena-Mora 等[66]采用SHARON-厌氧氨氧化工艺处理鱼肉罐头加工废水的研究中,进水氨氮浓度700~1000mg/L,盐分8000~10000mgNaCl/L,平均NLR 为0.5kg/(m3·d),平均氨氮去除率达到68%。面对SHARON 反应器出水水质波动,厌氧氨氧化反应系统表现出较强的稳定性,NO2--N/NH4+-N 比低于1 时未见不利影响,但是当该比值高于1 时,出水亚硝氮浓度升高,而且活性未能恢复。该研究还表明,10gNaCl/L 左右的盐度对厌氧氨氧化活性和污泥特性没有长期的不利影响。但本文作者课题组[65]的研究表明,30gNaCl/L 的冲击负荷是厌氧氨氧化反应器稳定运行所能耐受的阈值。虽然目前关于厌氧氨氧化系统所能耐受的盐度负荷阈值不一(30~75gNaCl/L),但是通过长期驯化[67]、添加相容性溶质[68]等措施,应用厌氧氨氧化工艺处理高氨氮高盐度工业废水潜力巨大。
3.9 其他类型废水的处理
在其他废水处理方面,厌氧氨氧化也体现了广泛的适用性(表4)。Tang 等[69]开发出了一种菌种流加-厌氧氨氧化工艺用来处理制药废水(硫酸黏杆菌素和吉他霉素生产废水)。当出水亚硝氮浓度高于10mg/L 时,5~10mL 的厌氧氨氧化颗粒(0.3~0.6gVSS)加入反应器中来阻止反应器性能的恶化。在菌种流加速率保持在0.025gVSS/(L·d)时,NRR达到9.4kg/(m3·d),出水氨氮浓度低至50mg/L。
Chen 等[70]采用厌氧氨氧化工艺处理温室甲鱼养殖废水,通过新型低温竹炭填料的添加快速启动厌氧氨氧化反应器,研究中考察了有机物浓度对厌氧氨氧化处理效果的影响,当进水COD 浓度在194~577.8mg/L 时,NRE 大于85%,COD 去除率在56.6%左右。该研究对于氮磷含量较高的集约化水产养殖废水的深度脱氮具有重要的现实意义。
第一个工业规模的采用厌氧氨氧化工艺处理半导体工厂含氮废水的尝试也已取得成功。Tokutomi等[33]将污水厂原有硝化-反硝化工艺改造成短程硝化-厌氧氨氧化-反硝化工艺,通过高浓度碳酸氢盐选择性抑制亚硝酸氧化来实现短程硝化,在经过10个月的运行后达到稳定,厌氧氨氧化反应器NRR达到1.04~3.29kg/(m3·d),其出水再经过反硝化处理。可溶性总氮浓度为260~450mg/L 的进水经该工艺处理后,出水氨氮浓度可达8mg/L 以下,这充分证明了短程硝化-厌氧氨氧化工艺处理半导体工厂含氮废水的可行性。
Daverey 等[71]利用CANON 工艺处理高氨氮的光电工业废水,采用18L 的SBR 反应器,通过投加NaHCO3控制碱度在850mgCaCO3/L 左右,在进水氨氮浓度高达3636mg/L 时,NLR 为0.909kg/(m3·d),氨氮去除率高达98%,并且该反应系统面对17~37℃的温度波动均表现出高效的脱氮性能,说明CANON 工艺有望应用于光电工业废水的脱氮治理。
4 结语与展望
实际废水成分复杂,禽畜养殖废水中含有重金属离子和抗生素,垃圾渗滤液中重金属含量高,焦化和石化废水中含有氰化物、硫氰化物、焦油、酚类等,制革废水中含有大量有机氮和重金属离子,制药废水特别是抗生素生产废水含有生物抑制剂,海产品加工、制革、炼油、造纸、酒精发酵废水中还含有硫化物,养殖废水、粪便污水、市政、化肥、制药废水中含有浓度不等的磷酸盐。上述这些障碍因子是制约厌氧氨氧化技术应用在高浓度氨氮工业废水处理领域的关键因素。虽然目前的研究涉及基质(亚硝酸盐和氨)、有机物(包括致毒性和非致毒性)、盐度、重金属、磷酸盐及硫化物等所致抑制,但是因为菌种或实验条件等不同,抑制剂的抑制阈值不一,是否可逆也存在争议,联合作用影响尚未探明,相关调控策略的研究十分匮乏。而且目前针对不同水质的废水,一体式和分体式工艺类型的选择在理论上的探讨还未有定论,在实践上的证明还缺乏运营数据支撑。应该结合工业废水的实际情况进行工艺改造,并在实验室研究成果的基础上积极推进中试,以促进厌氧氨氧化工艺的实用化和工业化。另外,厌氧氨氧化作为新型生物脱氮工艺并不意味着是传统工艺的终结,而应该是作为现有工艺的补充和新型工艺开发的桥梁枢纽。由于厌氧氨氧化严格的反应条件,应深度研究不同水质障碍因子的影响和调控策略,提高厌氧氨氧化的工程价值。建议今后在以下几个方面开展深入的研究。
(1)基于厌氧氨氧化的多菌群耦合工艺。
的开发。
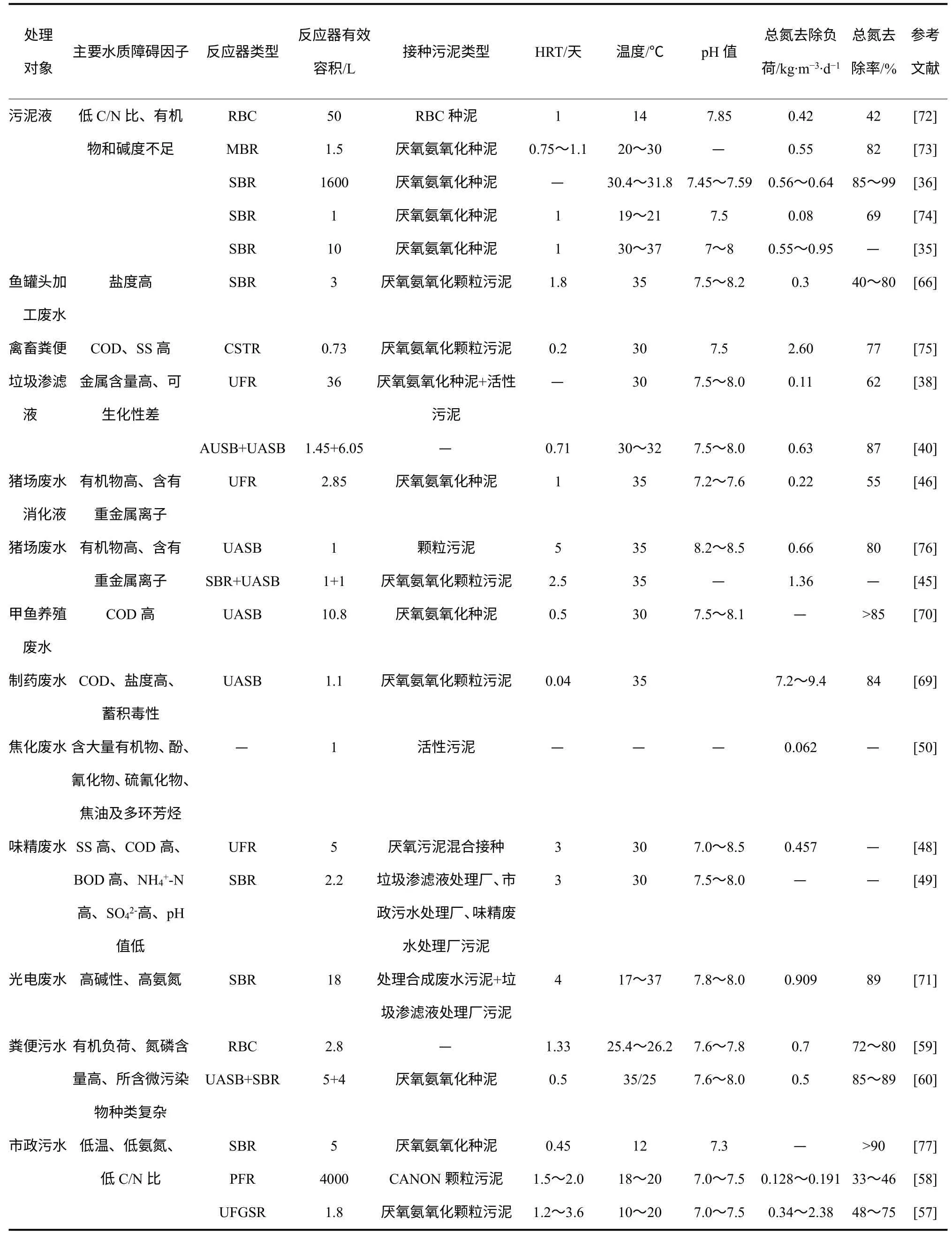
表4 厌氧氨氧化工艺应用于各种废水的实验室及中试总结
(3)不同工业废水水质障碍因子对厌氧氨氧化的长期、短期、复合影响。
(4)一体式和分体式工艺中氮氧化物的产生机理和减排措施。
(5)厌氧消化出水中溶解性甲烷的去除或利用。
[1] Joss A,Salzgeber D,Eugster J,et al. Full-scale nitrogen removal from digester liquid with partial nitritation and anammox in one SBR[J]. Environmental Science & Technology,2009,43(14):5301-5306.
[2] van der Star W R,Abma W R,Blommers D,et al.Startup of reactors for anoxic ammonium oxidation:Experiences from the first full-scale anammox reactor in Rotterdam[J].Water Research,2007,41(18):4149-4163.
[3] Strous M,Kuenen J G,Jetten M S. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology,1999,65(7):3248-3250.
[4] Thamdrup B,Dalsgaard T. Production of N2through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments[J]. Applied and Environmental Microbiology,2002,68(3):1312-1318.
[5] Penton C R,Devol A H,Tiedje J M. Molecular evidence for the broad distribution of anaerobic ammonium-oxidizing bacteria in freshwater and marine sediments[J]. Applied and Environmental Microbiology,2006,72(10):6829-6832.
[6] Li H,Chen S,Mu B,et al. Molecular detection of anaerobic ammonium-oxidizing (anammox) bacteria in high-temperature petroleum reservoirs[J].Microbial Ecology,2010,60(4):771-783.
[7] Kuypers M M,Sliekers A O,Lavik G,et al.Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J]. Nature,2003,422(6932):608-611.
[8] Hamersley M R,Lavik G,Woebken D,et al.Anaerobic ammonium oxidation in the Peruvian oxygen minimum zone[J]. Limnology and Oceanography,2007,52(3):923.
[9] Meyer R L,Risgaard-Petersen N,Allen D E. Correlation between anammox activity and microscale distribution of nitrite in a subtropical mangrove sediment[J]. Applied and Environmental Microbiology,2005,71(10):6142-6149.
[10] Rysgaard S,Glud R N,Risgaard-Petersen N,et al.Denitrification and anammox activity in Arctic marine sediments[J]. Limnology and Oceanography,2004,49(5):1493-1502.
[11] Schubert C J,Durisch Kaiser E,Wehrli B,et al. Anaerobic ammonium oxidation in a tropical freshwater system ( Lake Tanganyika)[J]. Environmental Microbiology,2006,8(10):1857-1863.
[12] Jaeschke A,Op Den Camp H J,Harhangi H,et al.16S rRNA gene and lipid biomarker evidence for anaerobic ammonium‐oxidizing bacteria(anammox)in California and Nevada hot springs[J]. FEMS Microbiology Ecology,2009,67(3):343-350.
[13] Strous M,Fuerst J A,Kramer E H,et al.Missing lithotroph identified as new planctomycete[J].Nature,1999,400(6743):446-449.
[14] Kartal B,van Niftrik L,Rattray J,et al. Candidatus ‘Brocadia fulgida’ : An autofluorescent anaerobic ammonium oxidizing bacterium[J].FEMS Microbiology Ecology,2008,63(1):46-55.
[15] Hu B,Zheng P,Tang C,et al.Identification and quantification of anammox bacteria in eight nitrogen removal reactors[J]. Water Research,2010,44(17):5014-5020.
[16] Araujo J C,Campos A C,Correa M M,et al. Anammox bacteria enrichment and characterization from municipal activated sludge[J].Water Science and Technology,2011,64(7):1428-1434.
[17] Rothrock Jr M J,Vanotti M B,Szögi A A,et al. Long-term preservation of anammox bacteria[J]. Applied Microbiology and Biotechnology,2011,92(1):147-157.
[18] Schmid M,Twachtmann U,Klein M,et al.Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation[J]. Systematic and Applied Microbiology ,2000,23(1):93-106.
[19] Hong Y,Li M,Cao H,et al.Residence of habitat-specific anammox bacteria in the deep-sea subsurface sediments of the South China Sea:Analyses of marker gene abundance with physical chemical parameters[J].Microbial Ecology,2011,62(1):36-47.
[20] Fuchsman C A,Staley J T,Oakley B B,et al. Free‐living and aggregate‐associated Planctomycetes in the Black Sea[J]. FEMS Microbiology Ecology,2012,80(2):402-416.
[21] Schmid M,Walsh K,Webb R,et al.Candidatus“Scalindua brodae”,sp.nov.,Candidatus“Scalindua wagneri”,sp.nov.,Two new species of anaerobic ammonium oxidizing bacteria[J].Systematic and Applied Microbiology,2003,26(4):529-538.
[22] Woebken D,Lam P,Kuypers M M,et al.A microdiversity study of anammox bacteria reveals a novel Candidatus Scalindua phylotype in marine oxygen minimum zones[J]. Environmental Microbiology,2008,10(11):3106-3119.
[23] van de Vossenberg J,Woebken D,Maalcke W J,et al. The metagenome of the marine anammox bacterium ‘Candidatus Scalindua profunda’ illustrates the versatility of this globally important nitrogen cycle bacterium[J].Environmental Microbiology,2013,15(5):1275-1289.
[24] Kartal B , Rattray J , van Niftrik L A , et al. Candidatus“Anammoxoglobus propionicus” a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J].Systematic and Applied Microbiology,2007,30(1):39-49.
[25] Liu S , Yang F , Gong Z , et al. Application of anaerobic ammonium-oxidizing consortium to achieve completely autotrophic ammonium and sulfate removal[J]. Bioresource Technology,2008,99(15):6817-6825.
[26] Quan Z X,Rhee S K,Zuo J E,et al. Diversity of ammonium‐oxidizing bacteria in a granular sludge anaerobic ammonium ‐oxidizing (anammox) reactor[J]. Environmental Microbiology,2008,10(11):3130-3139.
[27] Khramenkov S V,Kozlov M N,Kevbrina M V,et al. A novel bacterium carrying out anaerobic ammonium oxidation in a reactor for biological treatment of the filtrate of wastewater fermented sludge[J].Microbiology,2013,82(5):628-636.
[28] Lackner S,Gilbert E M,Vlaeminck S E,et al. Full-scale partial nitritation/anammox experiences—An application survey[J]. WaterResearch,2014,55:292-303.
[29] Wett B. Solved upscaling problems for implementing deammonification of rejection water[J]. Water Science and Technology,2006,53(12):121-128.
[30] Wett B. Development and implementation of a robust deammonification process[J].Water Science and Technology,2007,56(7):81-88.
[31] Vlaeminck S E,Terada A,Smets B F,et al. Aggregate size and architecture determine microbial activity balance for one-stage partial nitritation and anammox[J]. Applied and Environmental Microbiology,2010,76(3):900-909.
[32] van der Star W R,Abma W R,Blommers D,et al.Startup of reactors for anoxic ammonium oxidation:Experiences from the first full-scale anammox reactor in Rotterdam[J].Water Research,2007,41(18):4149-4163.
[33] Tokutomi T,Yamauchi H,Nishimura S,et al. Application of the nitritation and anammox process into inorganic nitrogenous wastewater from semiconductor factory[J]. Journal of Environmental Engineering,2011,137(2):146-154.
[34] Abma W,Schultz C,Mulder J,et al.The advance of Anammox[J].Water,2007,2(21):36-37.
[35] van Dongen U , Jetten M S , van Loosdrecht M. The SHARON®-Anammox® process for treatment of ammonium rich wastewater[J].Water Science and Technology,2001,44(1):153-160.
[36] Fux C,Boehler M ,Huber P,et al. Biological treatment of ammonium-rich wastewater by partial nitritation and subsequent anaerobic ammonium oxidation (anammox) in a pilot plant[J].Journal of Biotechnology,2002,99(3):295-306.
[37] Siegrist H,Reithaar S,Koch G,et al.Nitrogen loss in a nitrifying rotating contactor treating ammonium-rich wastewater without organic carbon[J].Water Science and Technology,1998,38(8):241-248.
[38] Liang Z,Liu J. Landfill leachate treatment with a novel process:Anaerobic ammonium oxidation (Anammox) combined with soil infiltration system[J]. Journal of Hazardous Materials,2008,151(1):202-212.
[39] Liang Z,Liu J,Li J. Decomposition and mineralization of aquatic humic substances (AHS) in treating landfill leachate using the Anammox process[J].Chemosphere,2009,74(10):1315-1320.
[40] Liu J,Zuo J,Yang Y,et al.An autotrophic nitrogen removal process:Short-cut nitrification combined with ANAMMOX for treating diluted effluent from an UASB reactor fed by landfill leachate[J].Journal of Environmental Sciences,2010,22(5):777-783.
[41] Wang C,Lee P,Kumar M,et al.Simultaneous partial nitrification,anaerobic ammonium oxidation and denitrification (SNAD) in a full-scale landfill-leachate treatment plant[J]. Journal of Hazardous Materials,2010,175(1):622-628.
[42] Lan C,Kumar M,Wang C,et al. Development of simultaneous partial nitrification,anammox and denitrification (SNAD) process in a sequential batch reactor[J].Bioresource Technology,2011,102(9):5514-5519.
[43] Anfruns A,Gabarró J,Gonzalez-Olmos R,et al.Coupling anammox and advanced oxidation-based technologies for mature landfill leachate treatment[J].Journal of Hazardous Materials,2013,258:27-34.
[44] Xian Q,Hu L,Chen H,et al.Removal of nutrients and veterinary antibiotics from swine wastewater by a constructed macrophyte floating bed system[J]. Journal of Environmental Management ,2010,91(12):2657-2661.
[45] Hwang I,Min K,Choi E,et al.Nitrogen removal from piggery waste using the combined SHARON and ANAMMOX process[J]. Water Science and Technology,2005,52(10-11):487-494.
[46] Yamamoto T,Takaki K,Koyama T,et al. Long-term stability of partial nitritation of swine wastewater digester liquor and its subsequent treatment by Anammox[J]. Bioresource Technology ,2008,99(14):6419-6425.
[47] 陈旭良. 短程硝化-厌氧氨氧化工艺处理味精废水的研究[D]. 杭州:浙江大学,2006.
[48] 陈旭良,郑平,金仁村,等. 味精废水厌氧氨氧化生物脱氮的研究[J]. 环境科学学报,2007(5):747-752.
[49] Shen L,Hu A,Jin R,et al.Enrichment of anammox bacteria from three sludge sources for the startup of monosodium glutamate industrial wastewater treatment system[J]. Journal of Hazardous Materials,2012,199:193-199.
[50] Toh S,Ashbolt N. Adaptation of anaerobic ammonium-oxidising consortium to synthetic coke-ovens wastewater[J]. Applied Microbiology and Biotechnology,2002,59(2-3):344-352.
[51] Yang G,Guo X,Chen S,et al. The evolution of Anammox performance and granular sludge characteristics under the stress of phenol[J].Bioresource Technology,2013,137:332-339.
[52] Jin R,Yang G,Zhang Q,et al.The effect of sulfide inhibition on the ANAMMOX process[J].Water Research,2013,47(3):1459-1469.
[53] Gao H,Scherson Y D,Wells G F.Towards energy neutral wastewater treatment : methodology and state of the art[J]. Environmental Science:Processes&Impacts,2014,16(6):1223-1246.
[54] van Loosdrecht M C M,Brdjanovic D.Anticipating the next century of wastewater treatment[J].Science,2014,344(6191):1452-1453.
[55] Hu Z ,Lotti T,de Kreuk M ,et al. Nitrogen removal by a nitritation-anammox bioreactor at low temperature[J]. Applied and Environmental Microbiology,2013,79(8):2807-2812.
[56] Jin R,Ma C,Yu J. Performance of an Anammox UASB reactor at high load and low ambient temperature[J]. Chemical Engineering Journal,2013,232:17-25.
[57] Lotti T,Kleerebezem R,van Erp Taalman Kip C,et al.Anammox growth on pretreated municipal wastewater[J]. Environmental Science&Technology,2014,48(14):7874-7880.
[58] Lotti T,Kleerebezem R,Kartalb B,et al.Pilot Scale evaluation of Anammox based main-stream nitrogen removal from municipal wastewater[J]. Environmental Technology,2014-11-03:1-11[Epub ahead of print].
[59] Vlaeminck S E,Terada A,Smets B F,et al.Nitrogen removal from digested black water by one-stage partial nitritation and anammox[J].Environmental Science&Technology,2009,43(13):5035-5041.
[60] de Graaff M S,Temmink H,Zeeman G,et al.Autotrophic nitrogen removal from black water:Calcium addition as a requirement for settleability[J].Water Research,2011,45(1):63-74.
[61] de Graaff M S,Vieno N M,Kujawa-Roeleveld K,et al. Fate of hormones and pharmaceuticals during combined anaerobic treatment and nitrogen removal by partial nitritation-anammox in vacuum collected black water[J]. Water Research,2011,45(1):375-383.
[62] Sliekers A O,Haaijer S,Schmid M,et al. Nitrification and anammox with urea as the energy source[J]. Systematic and Applied Microbiology,2004,27(3):271-278.
[63] Liu S,Gong Z,Yang F,et al. Combined process of urea nitrogen removal in anaerobic Anammox co-culture reactor[J]. Bioresource Technology,2008,99(6):1722-1728.
[64] Maurer M,Pronk W,Larsen T A. Treatment processes for source-separated urine[J]. Water Research,2006,40(17):3151-3166.
[65] Ma C,Jin R,Yang G,et al. Impacts of transient salinity shock loads on Anammox process performance[J]. Bioresource Technology,2012,112:124-130.
[66] Dapena-Mora A,Campos J L,Mosquera-Corral A,et al. Anammox process for nitrogen removal from anaerobically digested fish canning effluents[J]. Nutrient Management in Wastewater Treatment Processes and Recycle Streams,2006,53(12):265-274.
[67] Kartal B,Koleva M,Arsov R,et al. Adaptation of a freshwater anammox population to high salinity wastewater[J]. Journal of Biotechnology,2006,126(4):546-553.
[68] Liu M,Peng Y,Wang S,et al. Enhancement of anammox activity by addition of compatible solutes at high salinity conditions[J]. Bioresource Technology,2014,167:560-563.
[69] Tang C,Zheng P,Chen T,et al. Enhanced nitrogen removal from pharmaceutical wastewater using SBA-ANAMMOX process[J]. Water Research,2011,45(1):201-210.
[70] Chen C,Huang X,Lei C,et al. Effect of organic matter strength on anammox for modified greenhouse turtle breeding wastewater treatment[J]. Bioresource Technology,2013,148:172-179.
[71] Daverey A,Su S,Huang Y,et al. Partial nitrification and anammox process:A method for high strength optoelectronic industrial wastewater treatment[J]. Water Research,2013,47(9):2929-2937.
[72] Pynaert K,Smets B F,Beheydt D,et al. Start-up of autotrophic nitrogen removal reactors via sequential biocatalyst addition[J]. Environmental Science & Technology,2004,38(4):1228-1235.
[73] Wyffels S,Boeckx P,Pynaert K,et al. Nitrogen removal from sludge reject water by a two-stage oxygen-limited autotrophic nitrification denitrification process[J]. Water Science and Technology,2004,49(5-6):57-64.
[74] Vázquez-Padín J,Fernádez I,Figueroa M,et al. Applications of Anammox based processes to treat anaerobic digester supernatant at room temperature[J]. Bioresource Technology,2009,100(12):2988-2994.
[75] Qiao S,Yamamoto T,Misaka M,et al. High-rate nitrogen removal from livestock manure digester liquor by combined partial nitritation-anammox process[J]. Biodegradation,2010,21(1):11-20.
[76] Ahn Y,Hwang I,Min K. ANAMMOX and partial denitritation in anaerobic nitrogen removal from piggery waste[J]. Water Science and Technology,2004,49(5-6):145-153.
[77] Li J,Xiong B,Zhang S,et al. Anaerobic ammonium oxidation for advanced municipal wastewater treatment:Is it feasible?[J]. Journal of Environmental Sciences,2005,17(6):1022-1024.
