3,4-二氨基呋咱及其高能量密度衍生物合成研究进展
2015-07-25柳沛宏曹端林王建龙冯璐璐张楠秦宗扬
柳沛宏,曹端林,王建龙,冯璐璐,张楠,秦宗扬
(中北大学化工与环境学院,山西 太原 030051)
高能量密度化合物是一类重要的广泛作用于炸药、推进剂或火工品的高能量复合物。一般来说,密度达2.0g/cm3、爆压达40GPa、爆速达9.5km/s的含能化合物为高能化合物。美国在高能量密度化合物的研制方面卓有成效,已研究出包括八硝基立方烷、CL-20(六硝基六氮杂异伍兹烷)等[1]化合物,其中很多化合物有可观的应用前景。而俄罗斯学者则一直致力于杂环高能化合物的研究,Sheremetev等[2-5]以3,4-二氨基呋咱(DAF)为原料合成出了很多种呋咱含能化合物,已逐渐成为高能化合物的一个重要研究方向。
1 DAF 的合成
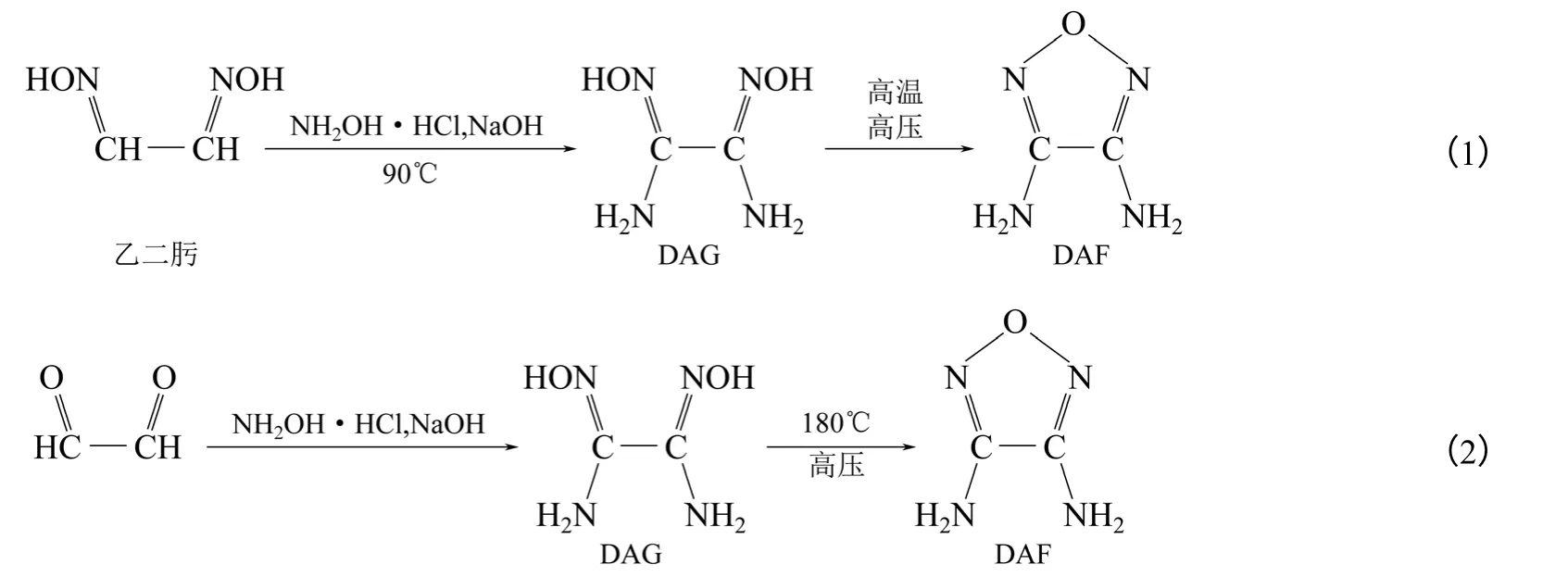
3,4-二氨基呋咱(DAF)是合成各种呋咱含能化合物的前体化合物,由Coburn[7]于1968 年首次合成出。参考国内外合成DAF 的文献发现反应过程均经历3,4-二氨基乙二肟(DAG)脱水环化的步 骤[7-11]。起初合成DAG 要用到昂贵且高毒的氰气、KCN 等,1995 年美国Gunasekaran 等[8]利用乙二肟和盐酸羟胺在NaOH 溶液中90℃胺化生成DAG,再于KOH 溶液中高温高压脱水合成DAF 产率40%。此法成本低,工艺简单,产品得率高,使DAF的合成得到了推广。其合成路线如式(1)。
Zelenin 等[9]对工艺进行了改进,在第一步制备中间体DAG 的过程中以更稳定易得的乙二醛为原料,冰浴冷却后一次性加入盐酸羟胺和NaOH 水溶液,90~100℃加热合成出DAG。然后,使DAG置于密封不锈钢反应釜中,于KOH 溶液中180℃下脱水3h,缩合成环得到DAF,以乙二醛计总得率36%。其合成路线如式(2)。用95℃的热水对粗产品进行重结晶,DAF 的纯度可以达到98%。
国内,李战雄等[10]以Gunasekaran 的方法放大 反应,实现了500g DAF 的合成。李洪珍等[11]对直接以乙二醛合成中间体DAG 作了研究,发现常温下分批加入盐酸羟胺和NaOH 溶液再加热回流,DAG 的得率稍有提高。黄明等[12]对以乙二醛为原料合成DAF 的方法作了总结,提出3 种简便合成方法:一步法、二步法和三步法。三步法的合成借鉴了Gunasekaran 的合成工艺,以乙二醛直接为原料经两步胺化得到DAG,通过高压或常压脱水环化即得到DAF。一步法合成DAF 采用乙二醛、盐酸羟胺和NaOH 水溶液为原料,引入尿素后常压下于102~108 ℃反应15 h,产品得率为43%。一步法合成操作简单、反应温和,但耗时较长。葛忠学等[13]对一步法合成进行了改进,反应过程中蒸出部分NH4Cl 溶液使反应温度提高,从而缩短了反应时间,产品得率也有所提高,为56.4%。
在DAG 脱水成环的反应步骤中,国内外学者认为最佳反应条件为在密封不锈钢反应釜中,利用KOH 溶液提供碱性环境,于180℃反应2~3 h。其中稳定的温度和碱的浓度很重要[8]。李春迎等[14]采用胶束催化和负载型固体碱催化两种催化方式使DAG 分子内脱水合成DAF,结果表明负载型固体碱催化的反应结果明显优于传统高温高压反应,反应温和,氢氧化钾的用量低,产品收率高;胶束催化操作简单,避免了高温高压的反应条件,但产品收率稍低。
2 DAF 的氧化性
呋咱环上的氨基的碱性较弱,氧化条件比较苛刻,以DAF 为基础,在不同的氧化条件下可得到不同氧化程度的产物[15-16]:若利用高锰酸钾等单电子氧化剂氧化DAF,分子一端的氨基氧化成亚硝基,与另一分子上的氨基反应可得到偶氮呋咱氧化物,如3,3′-二氨基-4,4′-偶氮呋咱(DAAF)、3,3′-二硝基- 4,4′-偶氮呋咱(DNAF);若用H2O2、(NH4)2S2O8等双电子氧化剂氧化DAF,氨基则先氧化为羟胺基,进一步氧化生成亚硝基,亚硝基和另一分子上的羟胺基缩合得到氧化偶氮氧化物或硝基氧化物,如3-氨基-4-硝基呋咱(ANF)、3,4-二硝基呋咱(DNF)、3,3′-二氨基-4,4′-氧化偶氮呋咱(DAOAF)等。具体如图1。
2.1 单呋咱氧化物
2.1.1 3-氨基-4-硝基呋咱(ANF)的合成
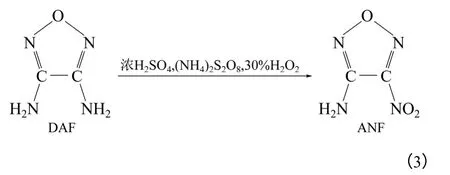
ANF 是以DAF 为基得到的一种重要的中间体,易发生氧化、取代等反应,利用ANF 可制备不对 称取代的呋咱化合物,且副产物较少。Novikova 等[17]采用以浓硫酸为介质, 30%H2O2和(NH4)2S2O8的混合氧化剂氧化DAF 得到ANF。其合成路线 如式(3)。
李洪珍等[18-19]选用甲烷磺酸,H2O2与Na2WO4或过硫酸铵混合氧化体系,ANF 的收率达到67%。与浓硫酸相比,甲烷磺酸可以很好地控制反应温度和速度,并具有较强的选择氧化性,能比较容易地得到单硝基不对称氧化物。
2007 年,张君启等[20]采用以草酸为介质的钨酸钠-草酸共催化剂氧化DAF,在室温下反应6h 得到ANF,并讨论了钨酸钠-草酸的用量对产物产率的影响,结果表明当催化剂的物质的量和DAF 一致时ANF 产率最高,达33.7%。
2.1.2 3,4-二硝基呋咱(DNF)的合成
DNF 是一种高能量密度化合物,晶体密度为1.62g/cm3,爆速9.2km/s,熔点15℃。Novikova 等[17]采用93%H2O2、Na2WO4和H2SO4氧化DAF 得到DNF。DNF 是重要的合成高能化合物的中间体,以其为原料可以得到很多性能优异的衍生物。
早期合成DNF 的氧化剂主要有H2O2、N2O5和浓硝酸。其中H2O2氧化产率高,时间短,还原产物为水,后处理简单,是合成呋咱类氧化物的一种有效的绿色氧化剂。
和ANF 的合成相比,合成DNF 时所用的H2O2浓度高,且需要的反应温度高,催化剂Na2WO4或过硫酸铵用量也多。葛忠学等[13]以50%H2O2氧化DAF,于35℃反应3h 得到DNF,产率40%。实验中探讨了DNF的反应历程,发现DAF可能先转化为ANF 和DAOAF(二氨基氧化偶氮呋咱),二者再进一步被氧化生成了DNF,其中DAOAF 向DNF 的转化还可能历经中间体DNOAF(二硝基氧化偶氮呋咱)的过程。刘昭铁等[21]在此工艺基础上利用离子液体1-丁基-3-甲基咪唑钨酸盐作催化剂,DNF的产率达到58%。
2.1.3 3,4-二硝基氧化呋咱(DNFX)的合成
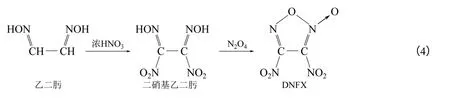
3,4-二硝基氧化呋咱(DNFX)是一个高度氧化,完全硝化了的化合物。它是一种流性液体,在室温下会缓慢分解,但是在-15 ~-20℃中稳定。Godovikova 等[22]提到DNFX 是一种敏感性炸药,其硝基活性很强,很容易发生亲核取代反应,其合成方法为:乙二肟先硝化后生成二硝基乙二肟,然后在N2O4的作用下环化脱水可得到DNFX,合成路线如式(4)。
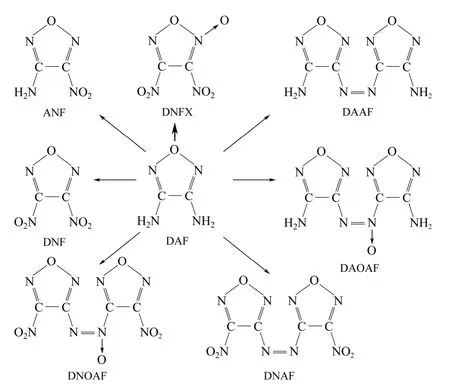
图1 几种DAF 氧化物的结构
2.2 偶氮和氧化偶氮呋咱氧化物
2.2.1 3,3′-二氨基-4,4′-偶氮呋咱(DAAF)的合成
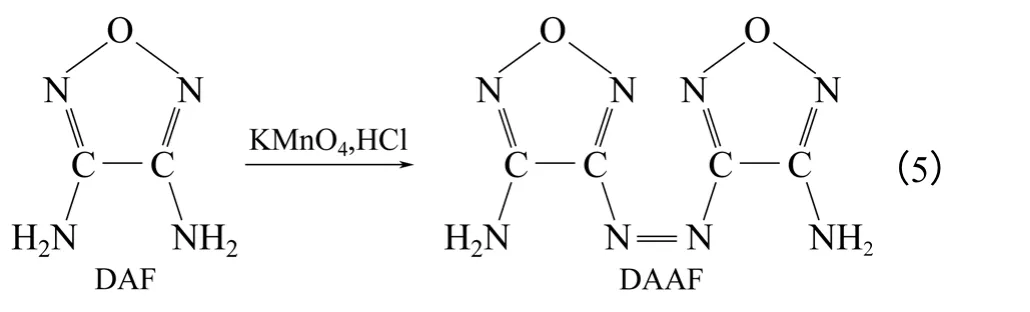
DAAF 为橙红色粉末,晶体密度为1.728g/cm3,爆压26.2GPa,爆速7.42km/s,熔点250℃,热分解温度为315℃,生成焓为536kJ/mol,分解温度高,可用作耐热炸药[23-27]。
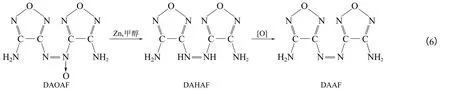
利用高锰酸钾在浓盐酸的作用下氧化DAF,于60~65℃反应2~3h 可制得DAAF[23],其收率约为57%,合成路线如式(5)。若先在甲醇溶液中利用锌粉还原DAOAF 生成中间体3,3′-二氨基-4,4′-氢化偶氮呋咱(DAHAF),然后通入空气也可以得到DAAF[24-26],粗产品得率为81%。两种工艺相比较后者得率较高且反应条件温和,但操作复杂,反应步骤较多且产物纯度低,不适宜放大生产。其合成路线如式(6)。
2.2.2 3,3′-二氨基-4,4′-氧化偶氮呋咱(DAOAF)的合成
DAOAF 为橙黄色粉末,结构与DAAF 类似。其晶体密度为 1.747g/cm3,高于 DAAF,爆压29.9GPa,爆速8.02km/s,热分解峰温为259℃,生成焓为446.3kJ/mol,略低于DAAF,但其爆轰性能比DAAF 好,二者感度相当[27-28]。
Solodyuk 等[16]氧化DAF 首次得到DAOAF,产物的纯度不高,副产物ANF 和DFT 的存在严重影响了产物的热稳定性。Chavez 等[25]优化了合成工艺,室温下利用30%H2O2/H2SO4氧化DAF 得到了DAOAF,收率约90%。李洪珍和雷晴等[29-30]采用相同方法也合成出了DAOAF。
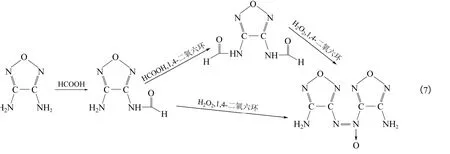
吴敏杰[31]以DAF 为原料,在甲酸溶液中先得到中间体3-氨基-4-甲酰胺基呋咱和3,4-二甲酰胺基呋咱,再以二者为反应物,以质量分数30%的双氧水为氧化剂,回流反应4 h 得到DAOAF,以DAF计反应产率分别为92%和56%。合成路线如式(7)。
高莉等[32]利用次氯酸钠和过硫酸氢钾的复合盐为氧化剂在常温下氧化DAF 得到DAAF 和DAOAF,产率分别为91%和85%,产率高,操作简单,反应过程中避免了浓H2SO4的使用,操作更安全。
2.2.3 3,3′-二硝基-4,4′-偶氮呋咱(DNAF)的合成
含硝基类的呋咱衍生物比其他化合物燃速更高,爆轰性能更好,甚至超过了HMX(奥克托今)、RDX(黑索金)等传统化合物[33]。
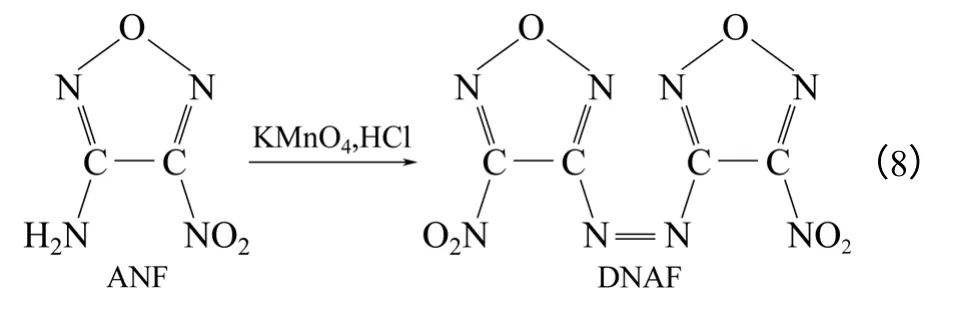
利用50%H2O2/H2SO4/过硫酸铵氧化体系氧化DAAF 可以得到DNAF,但产率较少约为11%[17]。Zelenin 等[34]用酸性高锰酸钾氧化ANF,50℃时反应2h 得到DNAF,以DAAF 计产率为51%[式(8)]。
2.2.4 3,3′-二硝基-4,4′-氧化偶氮呋咱(DNOAF)的合成
通过氧化DAOAF 的氨基可得到DNOAF。其为淡黄色固体,无氢,不含卤素,国外已用于发展新型清洁型混合固体火箭推进剂或改进型双基推进剂中。
DNOAF 的密度为1.91g/cm3,爆压45.6GPa,爆速 9.8km/s,熔点 112℃,标准生成焓为638.1kJ/mol。直接硝化DAF 可以得到DNOAF,但得率很低,为4%[35]。Gunasekaran 等[36]采用质量分数30%的H2O2/(NH4)2S2O8/H2SO4氧化体系氧化DAOAF 得到DNOAF,得率为60%。
3 大环、长链及稠环呋咱衍生物
3.1 大环、长链呋咱衍生物的合成
除了上述DAF 氧化得到的DAAF、DNOAF 等衍生物外,还可在DAF 的呋咱环体系中引入醚键、草酰胺基,得到具有高能量密度、高标准生成焓和热稳定性的衍生物。俄罗斯Zelinsky 研究所[37]利用硝基间的醚化反应成功合成出了FOF-1(3,3′-二硝基二呋咱醚)、FOF-7(四呋咱并氧杂六氮杂十五烷)等化合物,并研究了其性能。
FOF-1 能量密度高,醚键的引入有效地提高了分子的稳定性和增塑性,并降低了熔点,故在熔铸炸药方面有广阔的应用前景。FOF-1 的合成在无水乙腈溶液中进行[38],Na2CO3作催化剂作用于DNF中的一个硝基形成醚键。反应条件较苛刻,乙腈带水或Na2CO3为晶体水合物都有可能得到羟基副产物。FOF-1 也是一种重要的中间体,俄罗斯学者以FOF-1 为原料用醚交换法合成了一系列非对称呋咱醚化合物[39][式(9)]。
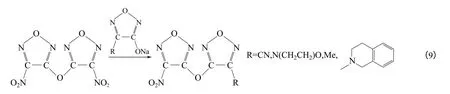
FOF-7 可作为一种无氢炸药,以DAF 为原料, 在NaCO3作用下于无水乙腈溶液中回流可制得,收率为95%[式(10)]。FOF-7 是一种呋咱类冠醚[5],有2种同分异构体,熔点分别为235~236℃和253~254℃。
李战雄[40]利用DAF 和草酰氯作用首次得到N,N′-二(氨基呋咱基)草酰胺(DAFOA)。DAFOA热稳定性很好,熔点为 299℃,标准生成焓为687.0kJ/mol,密度为1.71g/cm3,从270℃开始分解,耐热性能优良。
利用THF 作溶剂,低温下DAF 和草酰氯作用,反应2h 后升温至32℃继续反应6h 可得到产物DAFOA1.64g,得率 64.6%。采用 30%H2O2/浓H2SO4/(NH4)2S2O8氧化体系于40℃氧化DAFOA,反应5h 生成白色针状晶体N,N′-二(硝基呋咱基)草酰胺(DNFOA),得率84%。
DNFOA 也有优良的耐热性能和能量密度,其标准生成焓为303.6kJ/mol,密度为l.90g/cm3,熔点为243~244℃,热失重范围为224.9~256.8℃,理论计算表明其爆轰性能和 RDX 相当。与RDX[H50=26cm(2.5kg 落锤)]相比,DNFOA 的特性落高为H50=82cm(5kg 落锤),是一种性能良好的不敏感高能量密度炸药。
3.2 稠环呋咱衍生物的合成
用DAF、DAAF 等为原材料还可以合成一系列稠环呋咱衍生物,高能基团密集排列于稠环呋咱分子结构中,有很高的生成焓和密度。典型的稠环呋咱化合物结构如图2 所示。
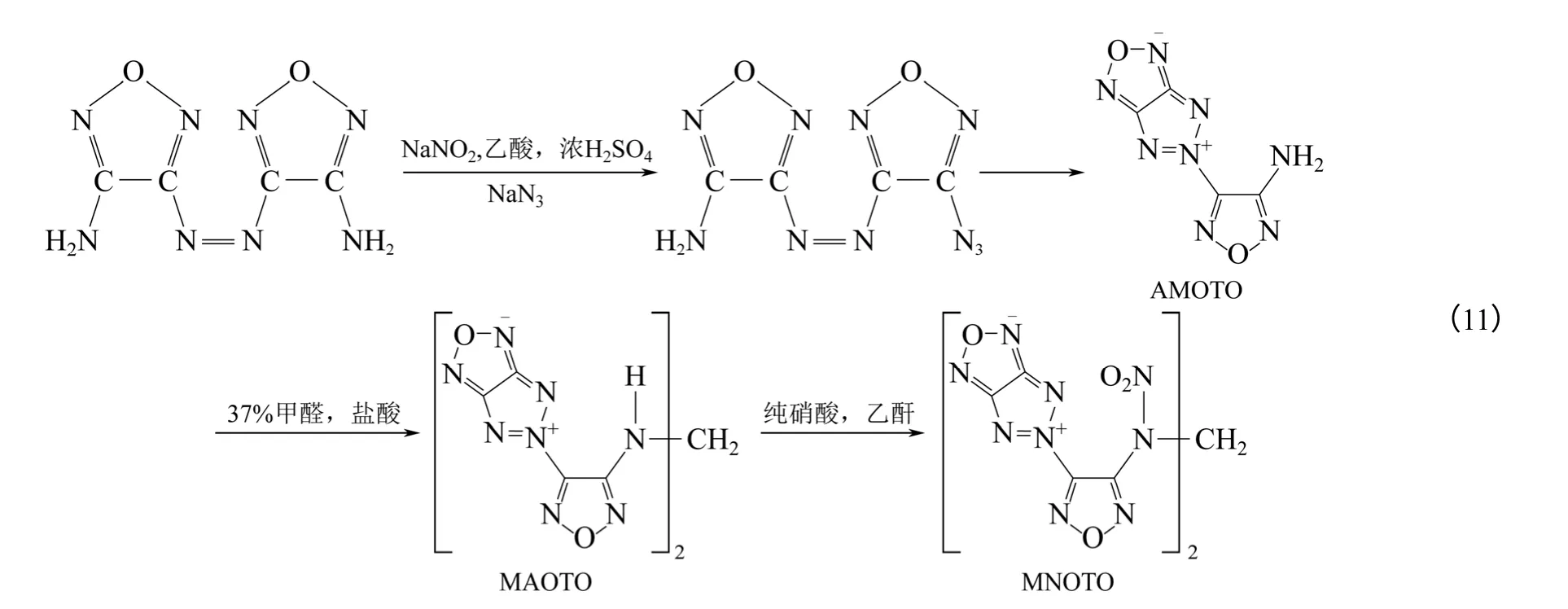
Gunasekaran 等[36]利用DAAF 在叠氮化钠的作用下得到3-氨基-3-叠氮基-4,4′-偶氮呋咱,在空气中放置生成AMOTO。用37%甲醛和盐酸的混合溶液处理AMOTO得到MAOTO,MAOTO在纯硝酸中可以继续氧化为MNOTO[式(11)]。其中MAOTO密度为1.81g/cm3,爆压34.0GPa,爆速8.54km/s,热稳定性良好,对冲击不敏感;MNOTO 密度为1.90g/cm3,爆压40.7GPa,爆速9.25km/s,爆轰性能略强于HMX(密度1.90g/cm3,爆压39.0GPa,爆速9.1km/s),但对撞击较敏感,且热稳定性较差。
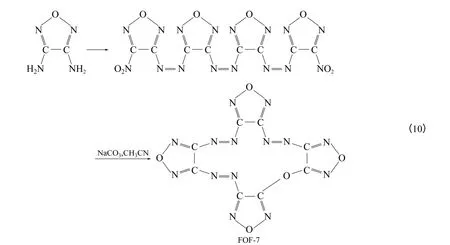
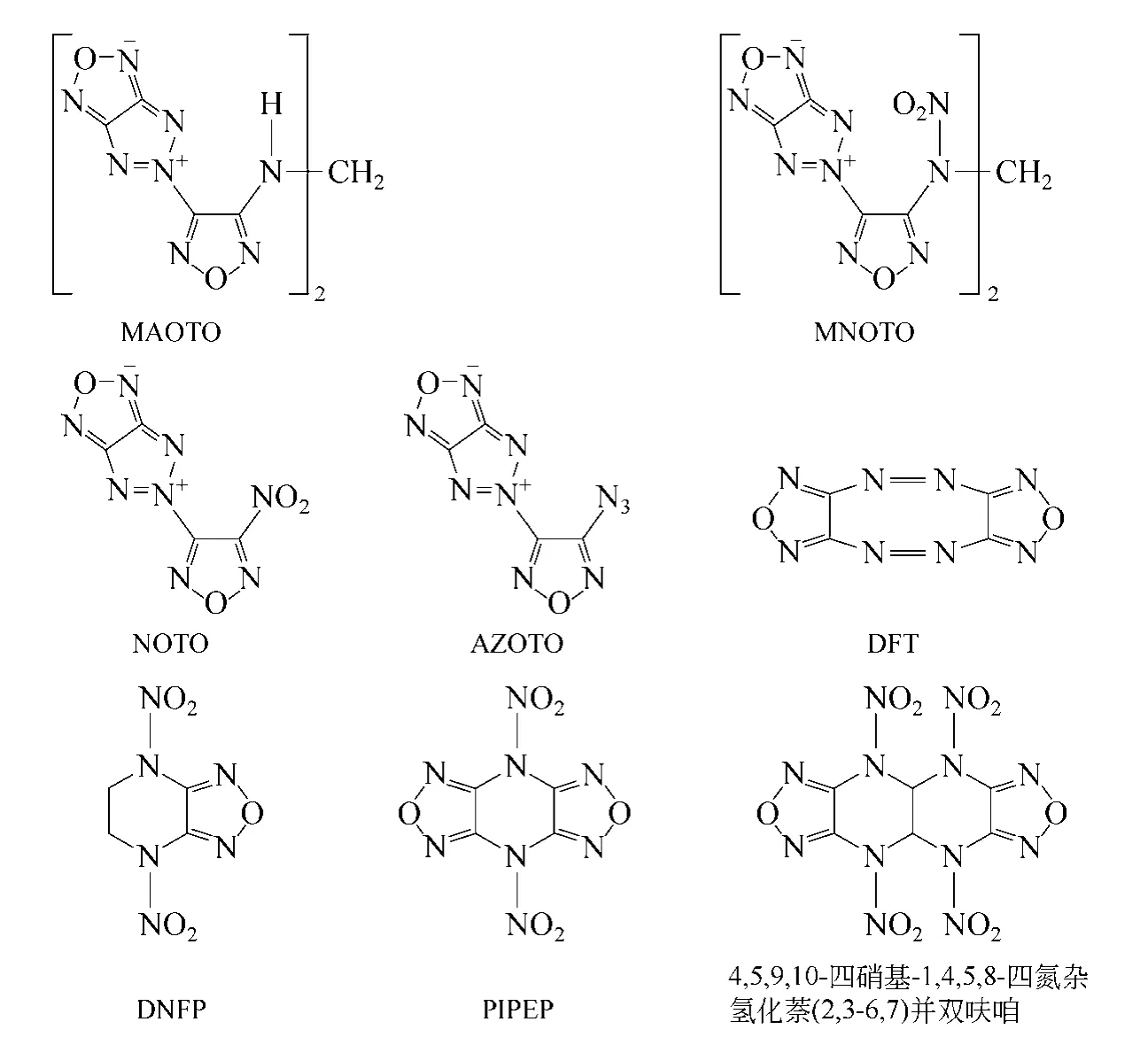
图2 几种稠环呋咱化合物的结构
AMOTO 在H2O2/H2SO4的氧化体系下可以氧化为NOTO[35],NOTO 是一种稳定性很强的含能液体材料。若DAAF 进行双叠氮化可以得到3,3′-二叠氮基-4,4′-偶氮呋咱,空气中脱氮可生成AZOTO。AZOTO 是一种性能优良的含能材料,密度为1.81g/cm3,爆速9.7km/s,爆压45.1GPa,熔点103~104℃[35]。DSC(差热分析)数据表明,曲线上存在一个吸热峰和一个放热峰,峰温分别为102℃及160℃。
1,4-二硝基呋咱并[3,4-b]哌嗪(DNFP)密度为1.82g/cm3,大于RDX,爆速和爆压与RDX 相近,是一种性能优异的钝感高能化合物。Willer 等[41]采用乙二胺和二氯乙二肟为起始原料,经缩合环化、脱水环化(形成呋咱环)、硝化等三步反应首先合成出DNFP,总收率为16.5%。毕福强等[42]以N,N′-二叔丁基乙二胺为起始原料,低温条件下与二氯乙二肟缩合环化生成1,4-二叔丁基哌嗪-2,3-二酮肟,然后在高温下脱水环化得到1,4-二叔丁基呋咱并[3,4-b]哌嗪。并自行设计了硝解反应条件,经98%硝酸和硫酸的混酸体系硝解合成出DNFP,收率32.6%。其合成路线如式(12)。

与DNFP 相似的有两类物质:二硝基二呋咱吡嗪(PIPER)和4,5,9,10-四硝基-1,4,5,8-四氮杂氢化萘(2,3-6,7)并双呋咱。PIPER 以DAF 为原材料经五步合成,已列为美国“IHPRPT 计划”中的目标化合 物[43]。4,5,9,10-四硝基-1,4,5,8-四氮杂氢化萘(2,3-6,7)并双呋咱[41]是一种新型的稠环类呋咱含能化合物,密度1.987g/cm3,爆速9.43km/s,爆压41.9GPa,爆轰性能很好但是其热稳定性极差,常温放置可释放出气体,放置长久即变成胶状物。以乙二醛、DAF进行Manish 成环,再利用浓HNO3和(Ac)2O 进行低温硝化可生成4,5,9,10-四硝基- 1,4,5,8-四氮杂氢化萘(2,3-6,7)并双呋咱。
1996 年俄罗斯科学家通过乙酰次氯酸盐和次氯酸钠氧化DAF 制得DFT,其密度为1.91g/cm3,标准生成焓为204kcal/mol,平面构型,是一种性能很好的新型起爆药[44]。美国Chaveza 等[23]采用三氯异氰脲酸氧化DAF 也得到了DFT,为船式构型,与俄罗斯报道的物质熔点不同,密度为1.758g/cm3。和平面构型相比,船式构型由于偶氮基的电子和呋咱环的电子正交,没有离域,敏感性强。
4 结 语
呋咱类含能化合物综合性能较好,生成焓高,热稳定性好且分子中存在活性氧,在高能密度材料方面有广阔的应用前景。如DAAF、DAOAF 可以作为优良的耐热炸药;DNAF 能量密度高,若取代高氯酸铵在固体推进剂中使用则能大幅度地提高推进剂的能量。但不少爆轰性能优异的化合物如DNF、MNOTO、4,5,9,10-四硝基-1,4,5,8-四氮杂氢化萘(2,3-6,7)并双呋咱等硝基取代或多呋咱环衍生物安定性差、感度高。
最近几年,我国在高能量密度化合物研究方面取得了进展,相继合成了上百种高能化合物,但在呋咱化合物方面种类较少,许多高性能化合物还未开始工业大规模生产,故设计合成钝感高能呋咱衍生物,增大开发力度将是今后的研究重点。
DAF 是合成呋咱类高能化合物的非常重要的前体化合物,在目前报告的几种合成方法中,一步法合成工艺简单、安全,产率高,但耗时较长,因此针对一步法合成DAF 的工艺优化研究非常必要。
[1] Pesce R R. Thermal decomposition of CL-20 and a CL-20 based formulation,AD-A250103[R]. 1991.
[2] Sheremetev A B. Chemistry of furazans fused to fived-memberd rings[J]. Heterocyclic Chem.,1995,32(2):371-384.
[3] Pivina T S,Sukhachev D V,Evtushenko A V. Comparative characteristic of energy content calculating methods for the furazan series as an example of energetic materials[J]. Propellants,Explosives,Pyrotechnics,1995,20:5-10.
[4] Makhova N N , Kulikov A S , Blinnikov A N , et al. 4-Amino-3-azidocarbonnylfuroxan as an universal synton for the synthesis of energetic compounds of the furoxan series[C]//30th International Annual Conference of ICT,1999:58.
[5] Sheremetev A B,Kulagina V O. Zero-hydrogen furazan macrocycles with oxy- and azo-bridges[J]. J. Org. Chem.,1996,61(5):1510-1511.
[6] Olofson R A,Michelman J S. Furazan[J]. Journal of Organic Chemistry,1965,30(6):1854-1859.
[7] Coburn M D. Picrylamino-substited heterocycles:Ⅱ. Furazan[J]. J. of Heterocycl. Chem.,1968,5(1):83-87.
[8] Gunasekaran A,Jayachandran T,Boyer J H. A convenient synthesis of diaminoglyoxime and diaminofurazan:Useful precursors for the sythesis of high desity energetic materials[J]. Journal of Heterocyclic Chemistry,1995,32(4):1405-1407.
[9] Zelenin A K,Turdell M L. A Two-step synthesis of diaminofurazan and synthesis of N-monoarylmethyl and N,N′-diarylmethyl derivatives[J]. Heteroyclic Chem.,1997(34):1057-1060.
[10] 李战雄,唐松青,刘金涛,等. 3,4-二氨基呋咱500 克级合成[J]. 含能材料,2002,10(2):72-73.
[11] 李洪珍,黄明,黄毅刚. 呋咱和氧化呋咱系3,3′-二氨基-4,4′-偶氮呋咱及其氧化偶氮呋咱的研究进展[J]. 含能材料,2005,13(3):192-195.
[12] 黄明,李洪珍,李金山. 3,4-二氨基呋咱的三种简便合成方法[J]. 含能材料,2006,14(2):114-115.
[13] 葛忠学,王锡杰,姜俊,等. 3,4-二硝基呋咱的合成[J]. 合成化学,2008,16(3):260-263.
[14] 李春迎,马洋博,薛云娜,等. 3,4-二氨基呋咱的两种催化合成新方法[J]. 含能材料,2012,20(2):151-154.
[15] Pagoria P F,Lee G S,Mitchell A R,et al. A review of energetic materials synthesis[J]. Thermochimica Act,2002,384:187-204.
[16] Solodyuk G D,Bolydrev M D,Gidaspov B V,et al. Oxidation of 3,4-diaminofurazan by some peroxidereagents[J]. Zh. Org. Khim,1981,17(4):861-865.
[17] Novikova T S,Melnikova T M,Kharitonova O V. An effective method for the oxidation of aminofurazans to nitrofurazans[J]. Mendeleev Communications,1994,6:138.
[18] 李洪珍,周小青,李金山,等. 3-氨基-4-硝基呋咱和3,3′-二硝基-4,4′-偶氮呋咱的合成研究[J]. 有机化学,2008,28(9):1646-1648.
[19] 李洪珍,周小青,黄明,等. 氨基呋咱氧化为氨基硝基呋咱的合成研究[J]. 有机化学,2009,29(5):798-801.
[20] 张君启,张 炜,朱慧,等. 一种改进的3-氨基-4-硝基呋咱合成方法[J]. 含能材料,2007,15(6):577-580.
[21] 刘昭铁,覃光明,任花萍,等. 1-丁基-3-甲基咪唑钨酸盐催化合成3,4-二硝基呋咱:中国,A 201010100886.9[P]. 2010-01-22.
[22] Godovikova T I,Golova S P,Strelenko Y A,et al. [J]. Mendeleev Communications,1994,1:7.
[23] Chaveza D,Hill L,Hiskey M,et al. Preparation and explosives properties of azo-and azoxy-furazans[J]. J. of Energetic Materials,2000,18:219-236.
[24] Hiskey , Michael A , Chavez , et al. Preparation of 3,3′-diamino-4,4′-azofurazan:US,A6552201[P]. 2003-04-22.
[25] Hiskey,Michael A,Chavez David E,Bishop Robert L. Use of 3,3′-diamino-4,4′-azoxyfurazan and 3,3′-diamino-4,4′-azofurazan as insensitive high explosive materials:US,A6358339[P]. 2009-03-19.
[26] Abdollah Bashir-Hashemi , Kurt Baum. 3,3′-Dinitro-4,4′- hydrazofurazan and methods of preparation:US,A6388087[P]. 2002-05-14.
[27] Valery Sinditskll,Manh Cuong V U,Vera S. Study on thermal decomposition and combustion of insensitive[J]. Propellants,Explosives,Pyrotechnics,1995,3:422-428.
[28] Cannizzo L F,Hamilton R S,Highsmith T K,et al. Furazan-based energetic ingredients,ADA405840/XAB[R]. 1999.
[29] 李洪珍,黄 明,周建华,等. 3,3′-二氨基-4,4′-偶氮呋咱及其氧化偶氮呋咱的性能研究[J]. 含能材料,2006,14(5):381-384.-51.
[30] 雷 晴,陶永杰,何金选. 偶氮呋咱和氧化偶氮呋咱的合成及表征[J].固体火箭技术,2006,29(5):354-357.
[31] 吴敏杰,陈树森,金韶华,等. 一种合成3,3’-二氨基-4,4’-氧化偶氮呋咱的新方法[J]. 含能材料,2013,21(2):273-275.
[32] 高莉,杨红伟,汤永兴,等. 偶氮及氧化偶氮呋咱化合物的合成与表征[J]. 火炸药学报,2013,26(1):47.
[33] Sinditskii V P,Dong H W,Serushkin V V,et al. Study on combustion of new energetic furazans[C]//Int. Annu.Conf. ICT 29th(Energetic Materials),1998,170.
[34] Zelenin A K,Steven E D,TrudeII M L. Synthesis and structure of 4-[(4-nitro-1,2,5,-oxadiazoI-3-yl)-NNO-azoxyl]-1,2,5-oxadiazol-3-am ine[J]. Structural Chemistry,1997,8(5):373-377.
[35] Gunasekaran A,Boyer J H. Dense energetic of C,H,N and O-atom,3,5-[4-nitro-(1,2,5)oxadiazolyl]-5H-[1,2,3]triazolo[4,5-C][1,2,5] oxadiazole [J]. Heteroatom Chemistry,1993,4(5):521-524.
[36] Gunasekaran A,Trudell M L. Dense energetic compounds of C,H,N [J]. Heteroatom Chemistry,1994,5(6):441-446.
[37] Sheremetev A B,Aleksandrova N S.An efficient synthesis of hydroxyfurazans[J]. Mendeleev Communications,1998,6:207-248.
[38] Sheremetev A B,Kharitonova O V,Melnikova T M,et al. Synthesis of symmetrical difurazanyl ethers[J]. Mendeleev Communications,1996,6(4):141-143.
[39] Sheremetev A B,Mantsvea E V,Dmitriev D E,et al. Transetherication of difurazanyl ethers as a route to unsymmetricalderivatives of difurazanyl ethers[J]. Russian Chemical Bulletin,International Edition,2002,51(4):659-662.
[40] 李战雄. 呋咱和氧化呋咱系含能化合物的合成、结构及性能研究[D]. 北京:北京理工大学,2001.
[41] Willer R L,Moore D W.Synthesis and chemistry of some Furazano and furoxano-[3,4-b]piperazines[J]. Org. Chem.,1985,50:5123- 5127.
[42] 毕福强,王伯周,王锡杰,等. 1,4-二硝基呋咱并[3,4-b]哌嗪(DNFP)的合成[J]. 含能材料,2009,17(5):537-540.
[43] Velarde S P,Cannizzo L F,Highsmith T K,et al. Synthetic directions in new energetic materials for advanced solid rocket propellants[R]. AD-A407278.
[44] Batog L V,Konstantinova L S,Lebedev O V,et al. Hypohalites as reagents for the macrocyclization of diamines of the furazan series[J]. Mendeleev Commun.,1996,6(5):193-195.
