二氧化碳的活化及其催化加氢制二甲醚的研究进展
2015-07-25秦祖赠刘瑞雯纪红兵蒋月秀
秦祖赠,刘瑞雯,纪红兵,蒋月秀
(1 广西大学化学化工学院,广西 南宁 530004;2 中山大学化学化工学院,广东 广州 510275)
随着工业发展及人类活动的加大,以CO2为主的温室气体排放也逐渐增大,2009—2012年全球CO2排放量每年依次为316 亿吨、335 亿吨、340亿吨及356 亿吨(该排放来源包括矿物燃料的燃烧、水泥制造和石灰石的使用等)[1],CO2排放量的增加破坏了自然界的碳循环平衡,也使人类面临生存环境不断恶化的威胁[2]。但同时CO2也是一种储量丰富、廉价易得的碳资源,将CO2清洁高效地转化为具有高附加值的化学品对解决环境污染、保持生态稳定有着重要的意义。
二甲醚是最简单的脂肪醚,室温下为无色、无腐蚀性、不致癌、混溶性佳的有机化合物。由于二甲醚的性质与液化石油气相似,具有较高的十六烷值(>55),燃烧热(气态)为1455kJ/mol,且燃烧过程无硫、无NOx、无粉尘排放,其臭氧耗减潜能值(ODP)及全球变暖潜能量(GWP)低,可替代石油液化气作为一种生态友好型燃料使用[3],此外,二甲醚作为一种重要的化工原料,具有无毒性和易挥发性,亦可替代氟氯烃作为气雾剂使用,二甲醚具有广阔的市场前景[4]。
以CO2为原料催化加氢合成二甲醚,是将CO2作为可再生资源充分利用、开发新能源、获得大宗化学品、实现自然界碳元素良性循环的有效途径。但因CO2具有较好的热稳定性和化学惰性,其活化方法及催化加氢机理尚不确切,CO2催化加氢合成二甲醚催化剂的催化性能仍需进一步提高。本文总结了目前CO2的活化方式,综述了催化CO2加氢合成二甲醚的工艺及所使用的催化剂的研究进展。
1 CO2 的活化
CO2具有热力学稳定性及动力学惰性,其分子中的碳原子为其最高氧化价态(正四价),整个分子处于最低能量状态,标准吉布斯自由能(ΔG0) 为-394.38 kJ/mol,所需转化的大多数含碳化合物的自由能均比其自由能大,故将CO2转化成其他含碳化合物非常困难。所以CO2的活化是有效利用CO2并将其转化成高附加值化学品的前提和技术难题,也是绿色化学中最重要的研究课题之一。目前活化CO2的方法主要有化学催化法[5]、生物活化法[6]、 光化学活化法[7]、电化学活化法[8]及等离子体活化法[9]等。
(1)化学催化法 是根据CO2分子的结构特征,通过金属与CO2进行配位或成键从而实现CO2活化的方法,是目前活化CO2最主要和最有效的方法,用于CO2活化的金属有Cu、Zn、Al、Ti、W、Ni 等[10]。从结构上看,CO2是典型的直线型对称分子,结构非常稳定,金属与CO2之间通过配位或插入成键两种相互作用方式,导致CO2分子线性程度降低,即可将CO2活化。CO2与单一过渡金属间常见的配位方式为线式(Ⅰ)、双齿式(Ⅱ)、桥式(Ⅲ)、单齿式(Ⅳ),如图1 所示。
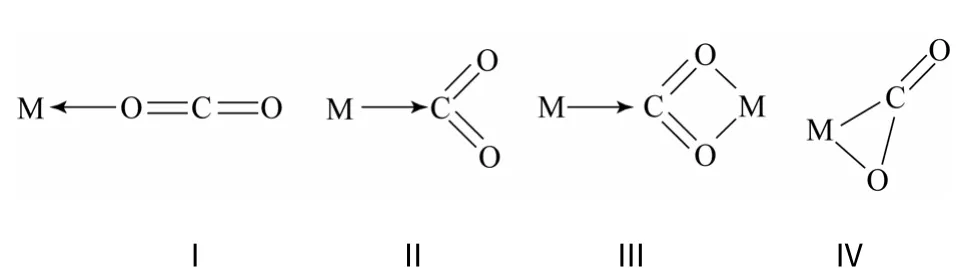
图1 CO2 与单一过渡金属的配位方式
CO2分子中缺电子的碳原子可作为电子受体接受金属提供的电子进行配位,CO2分子中氧原子的孤对电子可作为弱电子给予体与金属原子进行配位,CO2分子中的C=O 键含有的π 电子也可以和 过渡金属 d 轨道上的电子以 Dewar-Chatt- Duncanson[11]的方式配位。CO2可通过两种方式插入金属键中,如图2 所示:“正常”方式(A),CO2的碳原子与富电子端(M)成键形成类似 M—O—C=O 的羧酸酯;“反常”方式(B),CO2的碳与贫电子端(X)连接,形成M—C 键且含有羧酸的络合物。
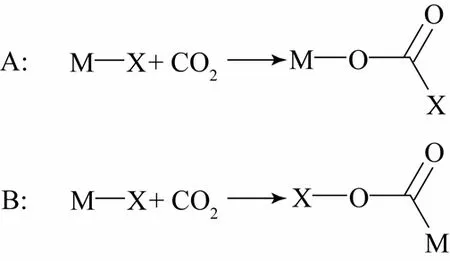
图2 CO2 对金属键M—X 的两种插入方式
化学催化法活化CO2是以吸附理论为依据的一种活化CO2的方式[12]。郭建忠等[13]发现,在不同粒径的Ni/SiO2催化剂上,CH4与CO2共吸附并被活化时,较小粒径的Ni 可以促进CO2与表面氧物种发生反应,生成单齿表面碳酸盐物种。Liu 等[14]通过研究CO2在Fe、Co、Ni 等催化剂表面的化学吸附状态,探究了CO2在过渡金属表面活化并转化成CO 的过程,研究表明CO2吸附在催化剂表面时,一部分过渡金属的电子转移给CO2,引起CO2弯曲且C—O 键伸长,形成活泼的CO2-物种,可发生进一步转化;曹新原等[15]利用原位红外手段探究了CO2在ZrO2催化剂表面的活化机理,研究表明乙醇与CO2吸附在ZrO2催化剂表面可直接进行反应生成碳酸二乙酯,该反应过程是由 CO2插入Zr-OCH2CH3结构中活化实现的。Zhang 等[16]研究了SiO2、TiO2及SiO2-TiO2等对 CuO-ZnO-Al2O3吸附活化CO2的促进作用,发现存在SiO2和TiO2时,CuO 更易被还原,而存在SiO2-TiO2时,催化剂表面的酸强度会降低但酸浓度会增加,使CO2在催化剂表面的吸附变弱,而对H2的吸附变强并解离出H物种。通过催化剂化学吸附活化CO2,通常会在高温、高压条件下进行[17-23]。
(2)生物活化法 是生物体经光合作用完成的。植物的光合作用是典型的光催化还原CO2的反应[24-25],生物体的叶绿素或生物酶等光催化体系在光照下可将CO2活化转化成为可再利用的碳水化合物或有机物。虽然生物活化法能利用廉价的光能资源、成本低,但由于植物光合作用活化能力较弱、效率较低,现代工业迅猛发展,排放CO2的量远远无法通过生态平衡来减少。另外,也可采用酶催化CO2活化[26-29],并进行反应。
(3)光化学、电化学活化法 是利用可再生的光能或电能活化CO2的方法,CO2的光化学活化法利用太阳能激发半导体光催化材料产生光生电子-空穴,以诱发氧化-还原反应实现CO2活化和转 化[30]。CO2的电化学活化法将CO2置于电解池中,阴极提供电子将CO2电离并转化成其他化合物[31]。现有的半导体光催化材料的光响应范围窄,CO2在溶液中的溶解度不高,因此限制了光化学和电化学对CO2的活化。
(4)等离子体活化技术 主要利用外加电场将大量能量输入到反应体系中,既能让稳定的CO2小分子通过与高能电子碰撞得以激活,使反应活性分子数增多,又能同时活化催化剂,从而降低反应活化能,是促进CO2活化转化的新技术[32-33]。代斌 等[34]研究认为等离子体活化CO2的机理为自由基机理,采用电子自旋共振波谱法,证实了CO2在等离子体场中能够电解产生大量高活性的中间物种(如CO2+、CO、C、O、H 等),这些活性中间物种的存在让惰性的CO2分子转化成为可能。等离子体既能活化CO2,又能与催化剂产生协同作用,最早将等离子体与催化剂协同技术应用在CO2转化方面的是1969年代斌等[34]的研究,随后在CO2活化方面应用等离子体与催化剂协同作用的研究不断深入。Amouroux 等[35]通过实验和模拟计算研究了CO2加氢制甲醇的过程,并比较了催化剂CuO/ZnO/ Al2O3单独作用、等离子体单独作用和等离子体与催化剂协同作用下的CO2转化情况,当催化剂单独作用时,在220℃表现出最高催化活性,而当等离子体与催化剂共同作用时,在100℃表现出最高催化活性,说明等离子体的引入既可活化CO2又能活化催化剂,在低温条件下达到最佳催化效果。
2 CO2 催化加氢合成二甲醚
二甲醚是高附加值的化学产品,也是优良的新燃料[36],以廉价的CO2为原料制备二甲醚是一种有效利用CO2的方法,该反应过程对利用小分子碳资源、开发新能源、环保等方面都具有重要的意义,正为各国学者广泛关注,已成为绿色化学的热门课题之一[37]。
2.1 CO2 催化加氢合成二甲醚工艺
目前,CO2制备二甲醚主要有两种工业生产工艺,即两步法和一步法[38],具体来说,两步法是先合成甲醇,再由甲醇脱水得到二甲醚,将合成甲醇及合成二甲醚两个过程依次进行;一步法是由CO2加氢直接得到二甲醚。热力学上,CO2合成甲醇反应与CO2合成二甲醚反应均为分子量减少的放热反应,在相同反应条件下,对于反应过程中的甲醇浓度,CO2合成二甲醚反应比CO2合成甲醇反应低,较低的甲醇浓度促进CO2转化过程正向进行,即直接合成二甲醚反应比合成甲醇反应的热力学限制 小[38-39];从设备投资上看,采用一步法将甲醇合成和甲醇脱水两个反应在同一个反应器中进行,一步法比两步法更具经济优势,一步法工艺是催化CO2合成二甲醚的发展趋势[40]。Sosna 等[41]采用热力学方法,分析了CO2合成甲醇、合成二甲醚的工艺流程,热力学数值计算结果表明:在合成甲醇反应中的CO2单程转化率为34.02%,在一步法合成二甲醚反应中CO2单程转化率为72.72%,CO2采用一步法转化为二甲醚将获得更大的单程转化率。
2.2 CO2 催化加氢合成二甲醚催化剂
CO2加氢一步法合成二甲醚是采用化学催化法对CO2进行配位活化实现的,CO2加氢一步法合成二甲醚工艺的关键点和难点是制备高效的CO2活化催化剂。目前,CO2加氢直接合成二甲醚采用由甲醇合成活性中心和甲醇脱水活性中心组成双功能催化剂[42]。在CO2加氢直接合成二甲醚所使用的双功能复合催化剂中,甲醇合成活性组分主要为Cu 基催化剂,甲醇脱水活性组分主要为HZSM-5、γ-Al2O3等固体酸,如表1 所示。
目前的研究中,甲醇合成催化剂以Cu-Zn 基催化剂为主,采用不同的助剂对Cu-Zn 基甲醇合成催化剂进行改性,以提高CO2的转化率及二甲醚的选择性,采用HZSM-5 分子筛进行脱水以获得二甲醚,使用该类双功能催化剂CO2转化率为15%~44%,二甲醚的选择性为40%~60%,最高达到90%[51]。一步法合成二甲醚较合成甲醇过程有更大的热力学推动力,既能获得较高的CO2转化率,水伴随着二甲醚生成又可抑制逆水煤气反应发生,从而减少生成副产物CO。除此之外,采用其他的甲醇合成催化 剂 如 Cu-Fe-Zr[52]、 Cu-Mo[53]、 Cu-Mn[54]、CuO-TiO2-ZrO2[55]等来进行CO2催化加氢合成二甲醚反应,CO2的转化率均不太高(12%~28%),但二甲醚的选择性存在较大的差别。
2.3 密度泛函理论及CO2 催化加氢合成二甲醚的反应机理
CO2合成二甲醚的过程主要包括甲醇合成反应、甲醇脱水合成二甲醚反应、逆水煤气反应,为了提高催化剂的催化性能,国内外学者致力于研究CO2合成二甲醚的反应机理,但目前该机理仍未明确[56]。用于研究CO2合成二甲醚反应机理的实验分析技术包括:原位傅里叶变换红外光谱、质谱、X射线诱导俄歇电子能谱等,由于受到中间产物复杂性及不稳定性影响,实验检测方法有一定的局限性,基于密度泛函理论的分子模拟方法的出现,也为研究化学反应机理提供了一种有效途径[57-58]。
目前结合化学实验方法和密度泛函理论计 算[59-60],对CO2在Cu 基催化剂表面催化加氢合成二甲醚的反应机理推测如下:甲醇合成反应,依据CO2、H2吸附方式不同,反应机理分为单活性位和双活性位机理,即CO2、H2竞争吸附于Cu 基催化剂的同一活性位上,或CO2、H2分别吸附于催化剂的不同活性位上。目前,对Cu 基催化剂合成甲醇过程反应机理研究较为广泛,由漫反射傅里叶变换红外光谱证实,在甲醇合成反应过程中,Cu(0)表面存在甲酸、CO、环状酯等物种[61-63],依据甲醇合成过程的主要中间体的不同,甲醇合成反应可通过3 种途径进行,即甲酸途径、CO 途径、环状酯 途径。
Yang 等[63]结合本征动力学实验和密度泛函理论,研究了CO2在Cu(111)面和Cu29纳米颗粒表面的甲醇合成过程,发现Cu 粒子的分散和金属Cu位点的稳定是提高催化剂活性的关键,提出了CO2加氢通过甲酸途径合成甲醇的机理,如式(1)~式(8)所示,“*”代表自由基,“X*”代表被吸附的物种。
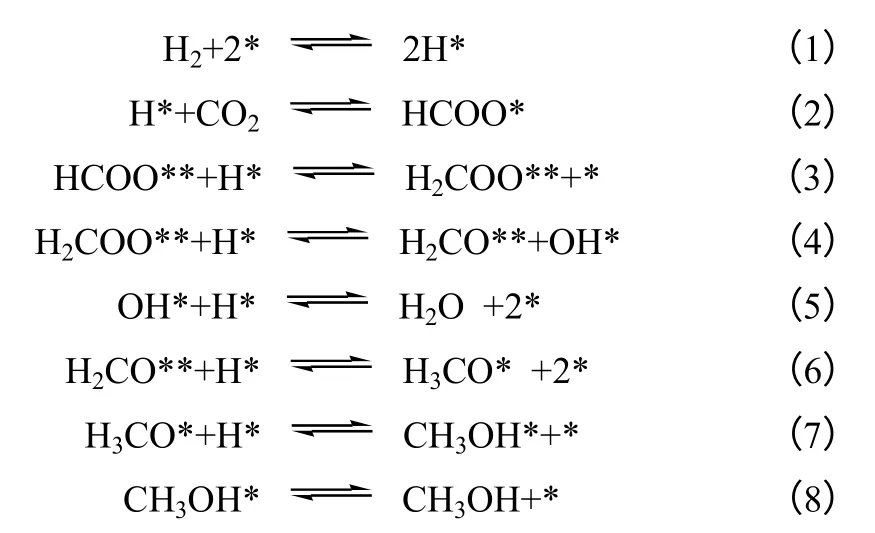
陶旭梅等[64]利用量子化学理论研究了CO2催化加氢合成甲醇过程,发现相较于甲酸途径,CO途径反应能垒更低,提出CO2加氢合成甲醇过程是遵循CO 途径进行的,如式(9)所示,CO2加氢先由逆水煤气反应合成CO 中间体,再通过CO 合成甲醇,TS 代表过渡态。
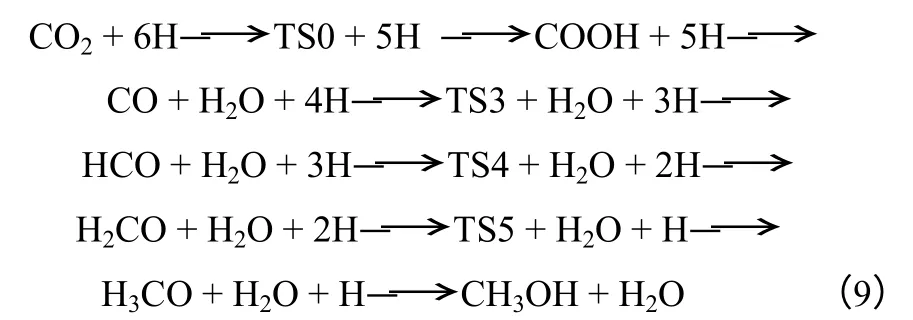
由于CO2在Cu(0)活性位上能形成稳定的环状酯中间体,且生成该中间体比生成甲酸中间体更容易, Lu 等[62]提出CO2加氢合成甲醇是主要通过环状酯中间体加氢实现的,如式(10)~式(15)所示。
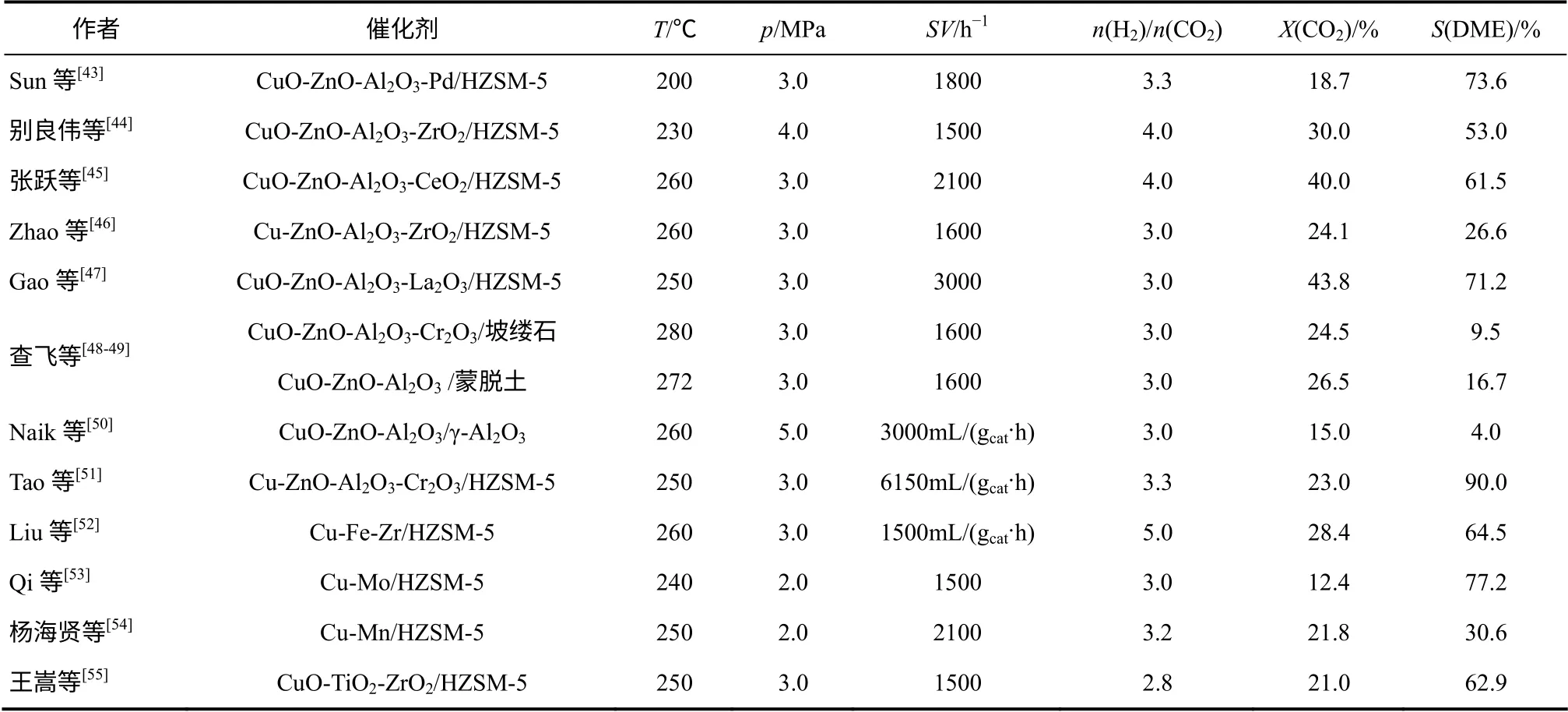
表1 CO2 加氢直接合成二甲醚双功能催化剂

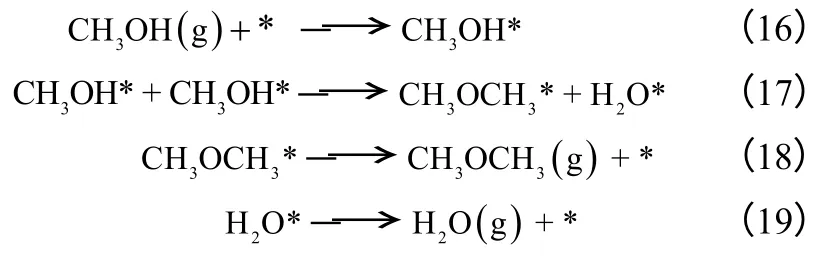
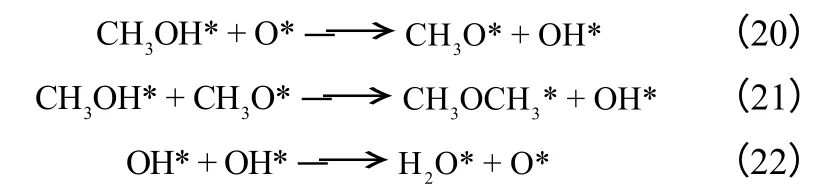
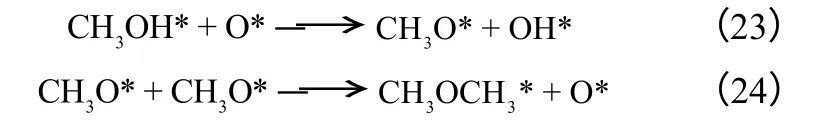
对于甲醇脱水合成二甲醚反应,胡建水等[65]依据甲醇分子吸附方式的不同,即两相邻非解离吸附的甲醇分子参与脱水反应;解离吸附的甲醇分子与相邻非解离吸附甲醇分子参与脱水反应;两相邻解离吸附的甲醇分子参与脱水反应,提出甲醇脱水合成二甲醚的三种机理分别如式(16)~式(24) 所示。
模型Ⅰ
模型Ⅱ
模型Ⅲ
2.4 CO2 催化加氢合成二甲醚本征动力学
CO2合成二甲醚的过程主要包括3 个反应,如化学反应式(25)~式(27)所示。甲醇合成
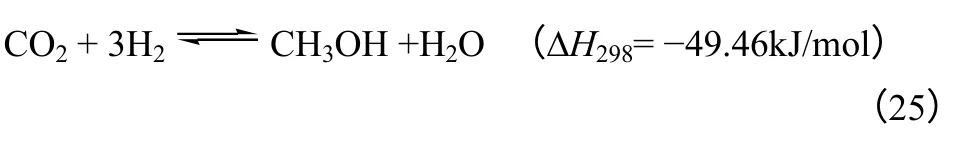
逆水煤气反应
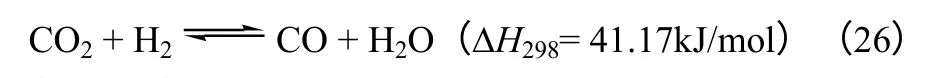
甲醇脱水合成二甲醚
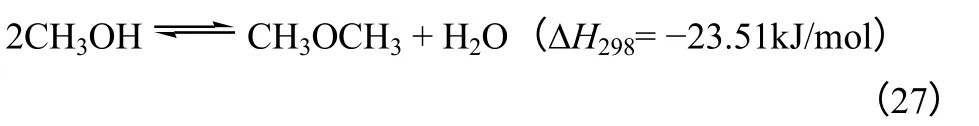
二甲醚和甲醇为目标产物,CO 为副产物,甲醇合成[式(25)]和甲醇脱水[式(27)]反应为放热的串联反应,甲醇为CO2合成二甲醚反应的重要中间体,甲醇合成[式(25)]与逆水煤气[式(26)]反应互为平行反应,表明CO 会影响甲醇的合成过程。CO2合成二甲醚的本征动力学建立在机理研究的基础上,由于其机理存在争议,导致CO2加氢合成二甲醚的本征动力学模型仍存在争议,其本征动力学研究集中在机理的探讨和速率控制步骤的确定,根据基元反应建立动力学模型,利用Langmuir- Hinshelwood (L-H)[66]机理探讨反应途径、中间体以及表面吸附、化学反应、脱附对化学反应速率的限制作用;或根据整体反应过程建立本征动力学模型,探讨动力学参数的物理意义,研究反应副产物对反应速率的影响等。An 等[67]研究了Cu-ZnO-Al2O3-ZrO2/HZSM-5 催化剂催化CO2合成二甲醚的反应过程,考虑了CO2合成甲醇反应、CO合成甲醇反应、逆水煤气反应和甲醇脱水合成反应,4 个基本反应过程的反应速率方程分别如式(28)~式(31)所示,本征动力学模型的计算值与实验值相对平均误差为6%,模型可信。

Lu 等[62]以CO2加氢合成环状酯反应作为甲醇合成反应的速率控制步骤,以两相邻非解离吸附的甲醇分子脱水合成二甲醚为甲醇脱水反应的速率控制 步 骤 , 建 立 了 流 化 床 反 应 器 中Cu-ZnO-Al2O3/HZSM-5催化CO2加氢合成二甲醚的本征动力学模型,式中K 为吸附平衡常数,P 为压力,甲醇合成反应、甲醇脱水反应、逆水煤气反应的反应速率方程分别如式(32)~式(34)所示。

胡建水等[65]依据3 种甲醇脱水机理,假设合成二甲醚的基元反应为速率控制步骤,建立3 种甲醇脱水本征动力学模型,如式(35)~式(38)所示。
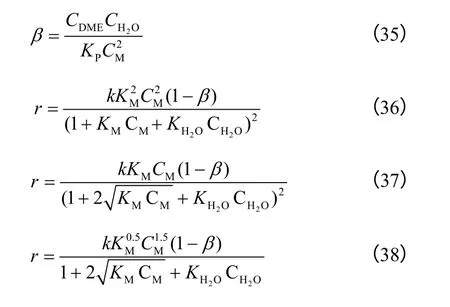
通过模型检验,式(36)模型计算值与实验值最相近,表明AlOOH 催化剂催化甲醇合成二甲醚的本征动力学模型为式(36),二甲醚合成是由非解离吸附的甲醇脱水获得的,速率控制步骤为式(37),甲醇脱水合成二甲醚反应活化能为76.65kJ/mol。
3 结 语
CO2的排放随工业化进程的加大而越来越严重,CO2的控制与转化已成为绿色化学领域的研究热点。由于CO2稳定性极强,CO2转化过程受到热力学限制,目前化学催化活化法是一种应用最广泛及最有效的CO2活化方式。采用化学催化活化CO2并将CO2催化加氢合成二甲醚是一条有效利用CO2的途径,具有化工、能源以及环保等多重意义。一步法CO2催化加氢合成二甲醚工艺为CO2合成二甲醚工艺的发展趋势,该工艺使用的催化剂为甲醇合成组分和脱水组分协同作用的双功能催化剂,其中,以Cu-Zn 基催化剂为甲醇合成组分、以固体酸HZSM-5 为脱水组分的双功能催化剂应用最广,进一步提高双功能催化剂的CO2转化率和二甲醚选择性,是利用CO2催化加氢大规模生产二甲醚的技术难题,且由于反应过程中间产物的复杂性和实验检测方法的限制,导致目前CO2催化加氢合成二甲醚反应机理尚未明确,关于CO2催化加氢合成二甲醚的研究展望如下。
(1)研究新的CO2活化方法,如等离子体活化法等,以使CO2活化后易进行反应,尤其是进行催化加氢反应,使CO2转化为甲醇、甲烷、二甲醚等附加值高的化学品。
(2)基于目前研究的Cu 基催化剂,添加适当的助剂,如Zr、La、Ce 等,并选择合适的脱水催化组分,开发活化CO2的高效催化剂,将其应用于CO2一步合成二甲醚反应过程中。CO2催化加氢为二甲醚的过程往往需要高温高压,因此需要考察工艺条件的影响,进而确定较低能耗下的最优工艺 条件。
(3)除Cu-Zn 基催化剂外,其他类型的催化剂如Cu-Fe、Cu-Mo、Cu-Mn 基的CO2催化加氢催化剂也开始得到了研究,而在不同多相催化剂上,其反应机理存在较大的差异。因而对催化CO2合成二甲醚的工艺过程进行实验研究,建立CO2合成二甲醚的本征动力学模型并研究其规律就显得格外重要,这也为提高CO2转化率和二甲醚选择性提供实验数据和理论基础;同时也应结合分子模拟计算和本征动力学实验,进一步探究催化CO2合成二甲醚的机理,为CO2转化技术提供理论指导。
符 号 说 明
Ci——组分i 的物质的量浓度,mol/L
f ——逸度
ΔG0——标准吉布斯自由能,kJ/mol
ΔH ——焓变,kJ/mol
K——吸附常数或吸附常数比
k——反应速率常数
n——物质的量,mol
P——总压
Pi——组分i 分压
r——反应速率,mol/(h·g)
Si——选择性(摩尔分数),%
SV——空速,h-1
T——反应温度,K
Xi——转化率(摩尔分数),%
下角标
i——组分
DME——甲醇脱水合成二甲醚反应
M——甲醇合成反应
RWGS——逆水煤气反应
[1] Espinal L,Poster D L,Wong-Ng W,et al. Measurement,standards,and data needs for CO2capture materials:A critical review[J]. Environ. Sci. Technol.,2013,47(21):11960-11975.
[2] Aresta M,Dibenedetto A. Utilisation of CO2as a chemical feedstock:Opportunities and challenges[J]. Dalton Trans.,2007,36(28):2975-2992.
[3] Arcoumanis C,Bae C,Crookes R,et al. The potential of dimethyl ether(DME) as an alternative fuel for compression-ignition engines:A review[J]. Fuel,2008,87(7):1014-1030.
[4] Semelsberger T A,Borup R L,Greene H L. Dimethyl ether(DME)as an alternative fuel[J]. J. Power Sources,2006,156(2):497-511.
[5] Sun Q-Y,Liu Z-P. Mechanism and kinetics for methanol synthesis from CO2/H2over Cu and Cu/oxide surfaces:Recent investigations by first-principles-based simulation[J]. Front. Chem. China,2011,6(3):164-172.
[6] Glueck S M,Gümüs S,Fabian W M,et al. Biocatalytic carboxylation[J]. Chem. Soc. Rev.,2010,39(1):313-328.
[7] Handoko A D,Li K,Tang J. Recent progress in artificial photosynthesis:CO2photoreduction to valuable chemicals in a heterogeneous system[J]. Curr. Opin. Chem. Eng.,2013,2(2):200-206.
[8] Savéant J M. Molecular catalysis of electrochemical reactions. Mechanistic aspects[J]. Chem. Rev.,2008,108(7):2348-2378.
[9] Indarto A,Yang D R,Choi J W,et al. Gliding arc plasma processing of CO2conversion[J]. J. Hazard. Mater.,2007,146(1):309-315.
[10] Song C. Global challenges and strategies for control,conversion and utilization of CO2for sustainable development involving energy,catalysis,adsorption and chemical processing[J]. Catalysis Today,2006,115(1):2-32.
[11] Correa A,León T,Martin R. Ni-catalyzed carboxylation of C(sp2)-and C(sp3)-O bonds with CO2[J]. Journal of the American Chemical Society,2013,136(3):1062-1069.
[12] 李静,邓廷云,杨林,等. CO2吸附活化及催化加氢制低碳烯烃的研究进展[J]. 化工进展,2013,32(2):340-345.
[13] 郭建忠,侯昭胤,高静,等. 不同粒径的Ni/SiO2催化剂上CH4和CO2吸附活化的漫反射傅里叶变换红外光谱研究[J]. 催化学报,2007,28(1):22-26.
[14] Liu C,Cundari T R,Wilson A K. CO2reduction on transition metal (Fe,Co,Ni,and Cu) surfaces:In comparison with homogeneous catalysis[J]. The Journal of Physical Chemistry C,2012,116(9):5681-5688.
[15] 曹新原,王玮,马新宾. 乙醇和CO2直接合成碳酸二乙酯的原位红外研究[J]. 化学工业与工程,2009,26(1):44-49.
[16] Zhang L,Zhang Y,Chen S. Effect of promoter SiO2,TiO2or SiO2-TiO2on the performance of CuO-ZnO-Al2O3catalyst for methanol synthesis from CO2hydrogenation[J]. Applied Catalysis A:General,2012,415-416:118-123.
[17] Wang S,Mao D,Guo X,et al. Dimethyl ether synthesis via CO2hydrogenation over CuO-TiO2-ZrO2/HZSM-5 bifunctional catalysts[J]. Catalysis Communications,2009,10(10):1367-1370.
[18] Zhang Q,Zuo Y-Z,Han M-H,et al. Long carbon nanotubes intercrossed Cu/Zn/Al/Zr catalyst for CO/CO2hydrogenation to methanol/dimethyl ether[J]. Catalysis Today,2010,150(1-2):55-60.
[19] Krogman J P,Foxman B M,Thomas C M. Activation of CO2by a Heterobimetallic Zr/Co Complex[J]. Journal of the American Chemical Society,2011,133(37):14582-14585.
[20] Yin S,Swift T,Ge Q. Adsorption and activation of CO2over the Cu-Co catalyst supported on partially hydroxylated γ-Al2O3[J].
Catalysis Today,2011,165(1):10-18.
[21] Drees M,Cokoja M,Kühn F E. Recycling CO2? Computational considerations of the activation of CO2with homogeneous transition metal catalysts[J]. Chem. Cat.:Chem.,2012,4(11):1703-1712.
[22] Ashley A,O’Hare D. FLP-mediated activations and reductions of CO2and CO[J]. Top Curr. Chem.,2013,344:191-217.
[23] Liu R W,Qin Z Z,Ji H B,et al. Synthesis of dimethyl ether from CO2and H2using a Cu-Fe-Zr/HZSM-5 catalyst system[J]. Industrial and Engineering Chemistry Research,2013,52(47):16648-16655.
[24] Chae S R,Hwang E J,Shin H S. Single cell protein production of Euglena gracilis and carbon dioxide fixation in an innovative photo-bioreactor[J]. Bioresource Technology,2006,97(2):322-329.
[25] Hiroshi H,Satoshi Y,Masahiro D,et al. Selectivity control of CO2reduction in an inorganic artificial photosynthesis system[J]. Applied Physics Express,2013,6(9):097102.
[26] Glueck S M,Gumus S,Fabian W M F,et al. Biocatalytic carboxylation[J]. Chemical Society Reviews,2010,39(1):313-328.
[27] Kumar A,Ergas S,Yuan X,et al. Enhanced CO2fixation and biofuel production via microalgae : Recent developments and future directions[J]. Trends in Biotechnology,2010,28(7):371-380.
[28] Li S,Ma S. CO2-activation for γ-butyrolactones and its application in the total synthesis of (±)-heteroplexisolide E[J]. Chemistry:An Asian Journal,2012,7(10):2411-2418.
[29] Beller M,Bornscheuer U T. CO2fixation through hydrogenation by chemical or enzymatic methods[J]. Angewandte Chemie International Edition,2014,53(18):4527-4528.
[30] Habisreutinger S N,Schmidt-Mende L,Stolarczyk J K. Photocatalytic reduction of CO2on TiO2and other semiconductors[J]. Angewandte Chemie International Edition,2013,52(29):7372-7408.
[31] Benson E E,Kubiak C P,Sathrum A J,et al. Electrocatalytic and homogeneous approaches to conversion of CO2to liquid fuels[J]. Chemical Society Reviews,2009,38(1):89-99.
[32] Pham M H,Goujard V,Tatibouet J M,et al. Activation of methane and carbon dioxide in a dielectric-barrier discharge-plasma reactor to produce hydrocarbons-Influence of La2O3/γ-Al2O3catalyst[J]. Catalysis Today,2011,171(1):67-71.
[33] Holzer F,Roland U,Kopinke F-D. Combination of non-thermal plasma and heterogeneous catalysis for oxidation of volatile organic compounds:Part 1. Accessibility of the intra-particle volume[J]. Applied Catalysis B:Environmental,2002,38(3):163-181.
[34] 代斌,宫为民,张秀玲,等. 等离子体催化二氧化碳转化的研究进展[J]. 化学进展,2002,14(3):225-230.
[35] Amouroux J,Cavadias S,Doubla A. Carbon dioxide reduction by non-equilibrium electrocatalysis plasma reactor[J]. IOP Conference Series:Materials Science and Engineering,2011,19:12005-12019.
[36] Sezer I. Thermodynamic,performance and emission investigation of a diesel engine running on dimethyl ether and diethyl ether[J]. International Journal of Thermal Sciences,2011,50(8):1594-1603.
[37] 靳治良,钱玲,吕功煊. 二氧化碳化学——现状及展望[J]. 化学进展,2010,22(6):1102-1115.
[38] Jia G-X,Tan Y-S,Han Y-Z. A comparative study on the thermodynamics of dimethyl ether synthesis from CO hydrogenation and CO2hydrogenation[J]. Industrial & Engineering Chemistry Research,2006,45(3):1152-1159.
[39] Ereña J,Sierra I,Aguayo A T,et al. Kinetic modelling of dimethyl ether synthesis from (H2+ CO2) by considering catalyst deactivation[J]. Chemical Engineering Journal,2011,174(2):660-667.
[40] Rahimpour M R,Farniaei M,Abbasi M,et al. Comparative study on simultaneous production of methanol,hydrogen,and DME using a novel integrated thermally double-coupled reactor[J]. Energy & Fuels,2013,27(4):1982-1993.
[41] Sosna M K,Sokolinskii Y A,Shovkoplyas N Y,et al. Application of the thermodynamic method to developing the process of producing methanol and dimethyl ether from synthesis gas[J]. Theoretical Foundations of Chemical Engineering,2007,41(6):809-815.
[42] Flores J H,Peixoto D P B,Appel L G,et al. The influence of different methanol synthesis catalysts on direct synthesis of DME from syngas[J]. Catalysis Today,2011,172(1):218-225.
[43] Sun K,Lu W,Wang M,et al. Low-temperature synthesis of DME from CO2/H2over Pd-modified CuO-ZnO-Al2O3-ZrO2/HZSM-5 catalysts[J]. Catalysis Communications,2004,5(7):367-370.
[44] 别良伟,王华,高文桂,等. 浆态床中CO2加氢直接合成二甲醚的双功能催化剂[J]. 化工进展,2009,28(8):1365-1370.
[45] 张跃,李静,严生虎,等. Ce 助剂对 CuO-ZnO-Al2O3/HZSM-5在CO2加氢合成二甲醚中的性能影响[J]. 化工进展,2011,30(3):542-546.
[46] Zhao Y-Q,Chen J-X,Zhang J-Y. Effects of ZrO2on the performance of CuO-ZnO-Al2O3/HZSM-5 catalyst for dimethyl ether synthesis from CO2hydrogenation[J]. Journal of Natural Gas Chemistry,2007,16(4):389-392.
[47] Gao W,Wang H,Wang Y,et al. Dimethyl ether synthesis from CO2hydrogenation on La-modified CuO-ZnO-Al2O3/HZSM-5 bifunctional catalysts[J]. Journal of Rare Earths,2013,31(5):470-476.
[48] 查飞,李治霖,陈浩斌,等. CuO-ZnO-Al2O3-Cr2O3/改性坡缕石催化二氧化碳加氢合成二甲醚的研究[J]. 应用化工,2009,28(2):185-188.
[49] 查飞,马小茹,陈浩斌,等. CuO-ZnO-Al2O3/蒙脱土催化二氧化碳加氢合成二甲醚[J]. 可再生能源,2013,31(3):81-85.
[50] Naik S P,Ryu T,Bui V,et al. Synthesis of DME from CO2/H2gas mixture[J]. Chemical Engineering Journal,2011,167(1):362-368.
[51] Tao J L,Jun K W,Lee K W. Co-production of dimethyl ether and methanol from CO2hydrogenation:Development of a stable hybrid catalyst[J]. Applied Organometallic Chemistry,2001,15(2):105-108.
[52] Liu R W,Qin Z Z,Ji H B,et al. Synthesis of dimethyl ether from CO2and H2using a Cu-Fe-Zr/HZSM-5 catalyst system[J]. Industrial & Engineering Chemistry Research,2013,52(47):16648-16655.
[53] Qi G-X,Fei J-H,Zheng X-M,et al. DME synthesis from carbon dioxide and hydrogen over Cu-Mo/HZSM-5[J]. Catalysis Letters,2001,72(1-2):121-124.
[54] 杨海贤,贾立山,方维平,等. Cu-Mn/HZSM-5 合成二甲醚催化活性的研究[J]. 天然气化工,2008,33(1):1-5.
[55] 王嵩,毛东森,郭晓明,等. CuO-TiO2-ZrO2/HZSM-5 催化CO2加氢制二甲醚[J]. 物理化学学报,2011,27(11):2651-2658.
[56] Lim H-W,Park M-J,Kang S-H,et al. Modeling of the kinetics for methanol synthesis using Cu/ZnO/Al2O3/ZrO2catalyst:Influence of carbon dioxide during hydrogenation[J]. Industrial & Engineering Chemistry Research,2009,48(23):10448-10455.
[57] Leach A R. Molecular Catalysis of Electrochemical Reactions[M]. Pearson Education,2001.
[58] Grabow L C,Mavrikakis M. Mechanism of methanol synthesis on Cu through CO2and CO hydrogenation[J]. ACS Catalysis,2011,1(4):365-384.
[59] Cramer C J,Truhlar D G. Density functional theory for transition metals and transition metal chemistry[J]. Physical Chemistry Chemical Physics,2009,11(46):10757-10816.
[60] Nørskov J K,Bligaard T,Rossmeisl J,et al. Towards the computational design of solid catalysts[J]. Nature Chemistry,2009,1(1):37-46.
[61] Wang W,Wang S-P,Ma X-B,et al. Recent advances in catalytic hydrogenation of carbon dioxide[J]. Chemical Society Reviews,2011,40(7):3703-3727.
[62] Lu W-Z,Teng L-H,Xiao W-D. Simulation and experiment study of dimethyl ether synthesis from syngas in a fluidized-bed reactor[J]. Chemical Engineering Science,2004,59(22-23):5455-5464.
[63] Yang Y-X,Evans J,Rodriguez J A,et al. Fundamental studies of methanol synthesis from CO2hydrogenation on Cu(111),Cu clusters,and Cu/ZnO (0001)[J]. Physical Chemistry Chemical Physics,2010,12(33):9909-9917.
[64] 陶旭梅,孙晋良,柳文杰,等. CO2和H2合成甲醇的量子化学模拟[J]. 天然气化工:C1 化学与化工,2013,38(3):57-61.
[65] 胡建水,王程俊,刘雷,等. 完全液相法催化剂上甲醇脱水合成二甲醚的动力学及DFT 研究[J]. 化工学报,2012,63(3):819-825.
[66] Shim H M,Lee S J,Yoo Y D,et al. Simulation of DME synthesis from coal syngas by kinetics model[J]. Korean Journal of Chemical Engineering,2009,26(3):641-648.
[67] An X,Zuo Y-Z,Zhang Q,et al. Dimethyl ether synthesis from CO2hydrogenation on a CuO-ZnO-Al2O3-ZrO2/HZSM-5 bifunctional catalyst[J]. Industrial & Engineering Chemistry Research,2008,47(17):6547-6554.
