注射用复合维生素中草酸的HPLC法测定
2015-07-24李志伟夏瑾何庆国赵丽荣李潇
李志伟,夏瑾,何庆国,赵丽荣,李潇
(1.河北科技大学 化学与制药工程学院,河北 石家庄 050018;2.河北爱尔海泰制药有限公司,河北 石家庄 051000;3.石家庄市食品药品监督管理局,河北 石家庄 051000)
草酸,又名乙二酸,是人类代谢的终产物,不再分解.人体内的草酸主要有2个来源:1)肠道吸收食物中的草酸;2)体内代谢生成.尿草酸排泄量的60%以上为内生性草酸.草酸的体内生成主要基于2种形式:1)维生素C可不需酶的作用直接转变成草酸,约占排出草酸的40%;2)由乙醛酸代谢产生,占40%~50%.由于维生素C可转化为草酸,因此,认为维生素C是草酸钙结石的可能危险因子.而高草酸血症涉及骨、视网膜、动脉血管中层、周围神经、皮肤和心脏.体内草酸过多会影响心肌或传导系统,并能诱发心力衰竭和致命性心律失常[1-2].因此在注射用复方维生素中控制草酸很有必要.中国药典[3]中采用滴定的方法检测维生素C中的草酸,文献[4-6]报道的草酸测定方法大多采用反相高效液相色谱法,以C18柱进行分析,而注射用复合维生素中组分多,干扰对草酸的测定.本文建立了一种新的高效液相色谱法,用于注射用复合维生素中草酸残留量的测定,该方法灵敏、准确.
1 仪器与试剂
仪器:Agilent LC1260型液相色谱,配有G1311C1260型泵,G1314B1260型检测器,柱温箱,G1329F1260型自动进样器.色谱柱为Phenomenex Rezex ROA-Organic acid 3.7mm×150mm 的强阳离子交换柱(H+型).
样品:自制批号:20101001,20101002,20101003;草酸对照品:中国药品生物制品检定所,批号:101097-201101.
2 方法与结果
2.1 溶液配制
1)供试品试液的制备
取本品一瓶(约相当于维生素C 200mg),置100mL量瓶中,加水溶解并稀释至刻度,摇匀,作为供试品溶液.
2)对照品试液的制备
取草酸对照品适量,精密称定,加水溶解并定量稀释制成每1mL中约含草酸10μg的溶液,作为对照品溶液.另分别取维生素C,维生素B1,维生素B2,甘氨酸,分别按照处方量配置各组分的溶液、空白溶剂.
2.2 色谱条件
色谱柱Phenomenex Rezex ROA-Organic acid 3.7 mm×150 mm 的强阳离子交换柱(H+型).柱温60 ℃;检测波长210nm,流速0.6mL/min;进样量20μL.在此色谱条件下,各溶剂的保留时间见表1.各组分不干扰草酸的检出,并且分离度均大于1.5,色谱图见图1.
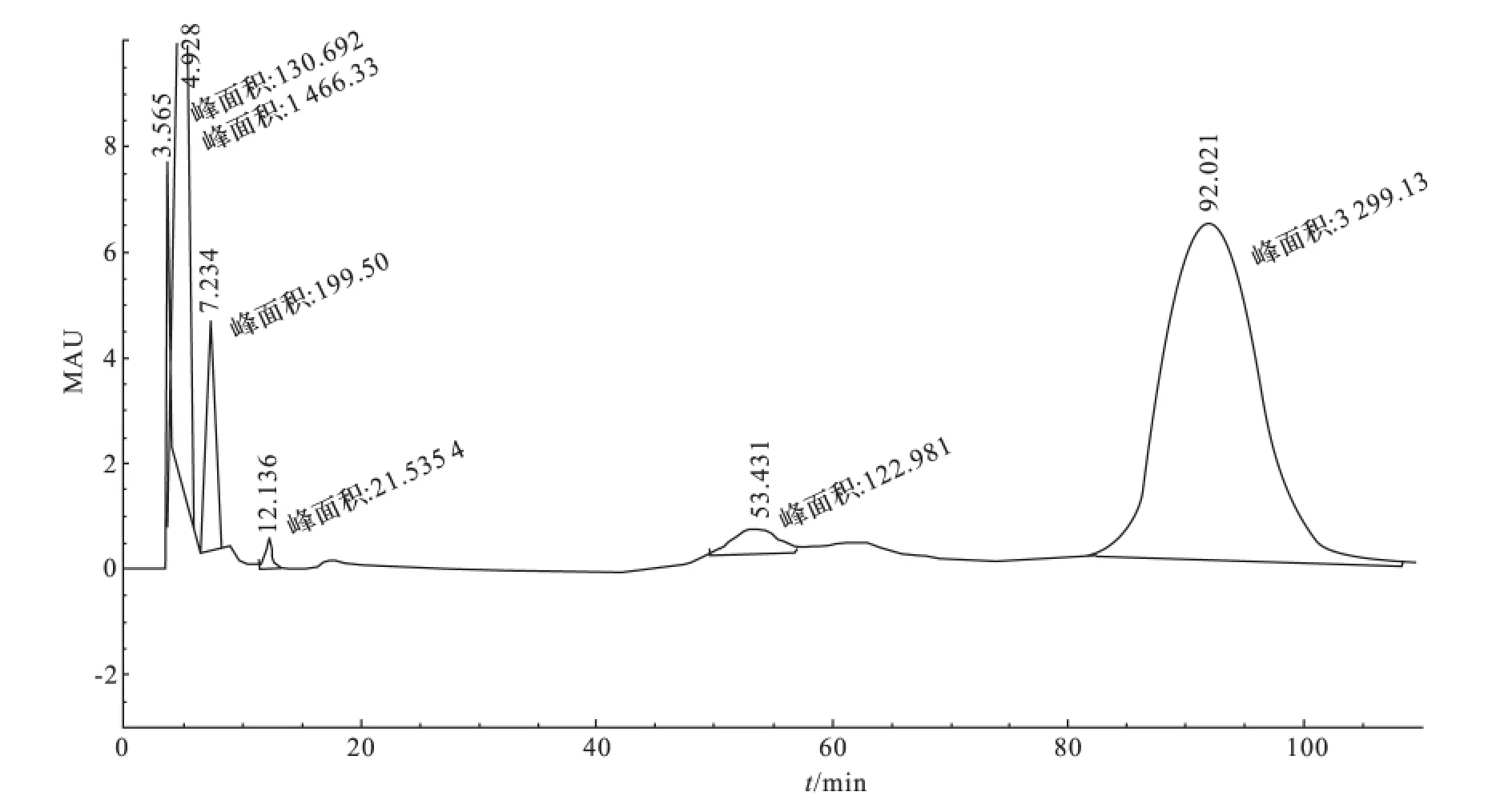
图1 各组分的液相色谱Fig.1 Chromatography of every compounds

表1 注射用复合维生素各组分出峰时间Tab.1 Retention time of Vitamin complex injection
2.3 线性实验
取草酸对照品,用水稀释配置1.0mg/mL的标准储备液,逐步稀释配置质量浓度为50,40,30,20,10,5,1μg/mL的溶液,进行分析,测定其线性关系,结果见表2,图2.
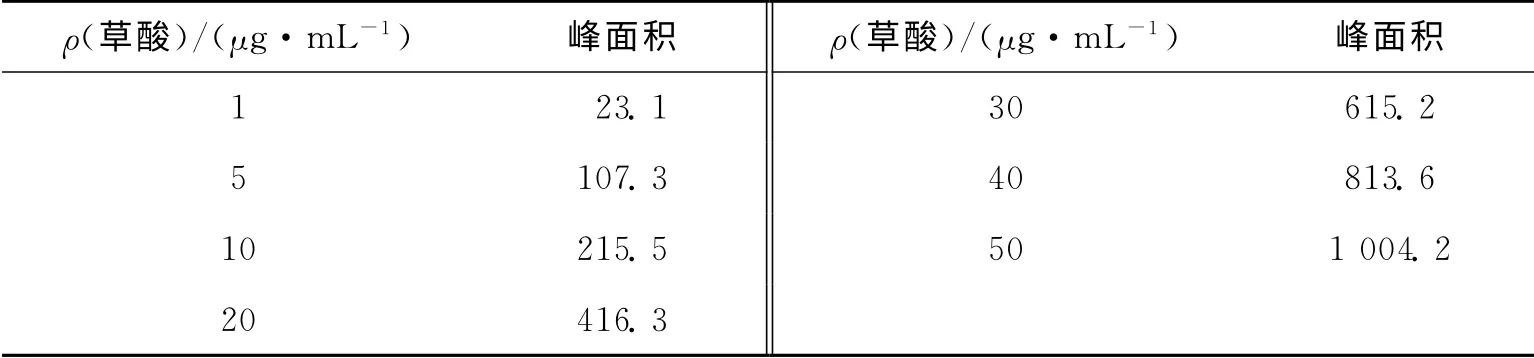
表2 草酸的线性关系Tab.2 Liner relationship of oxalic acid
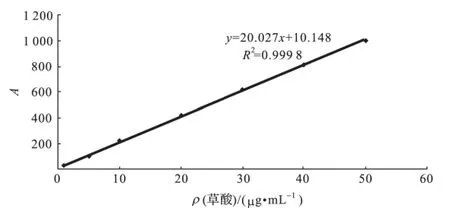
图2 草酸的线性关系Fig.2 Linearity curve of oxalic acid
结果表明,草酸在1.0~50μg/mL的溶液中呈线性关系,线性相关系数为0.999 8.逐步稀释草酸溶液,进样量20μL,进行检测限和定量限测定,结果显示在S/N=3时的草酸检测限为0.015μg/mL,在S/N=10时的草酸定量限为0.065μg/mL.
2.4 精密度实验
配置6份10μg/mL的草酸溶液,分别进行液相色谱分析,结果见表3.由表3可见此法精密度良好.

表3 草酸的精密度结果Tab.3 Precision result of oxalic acid
2.5 回收率实验
分别配制低(8.0μg/mL)、中10(μg/mL)、高(12μg/mL)3种不同质量浓度的对照品溶液,以“2.1”项下的对照品溶液作为对照.精密称取供试品适量,分别加入上述不同浓度的对照溶液适量溶解,进行液相色谱分析,计算回收率.结果显示,平均回收率为98.82%.
2.6 样品测定
取长期留样的样品20101001,20101002,20101003按照上述方法进行了草酸的测定.
实验结果表明,本品3 批样品中草酸均低于定量限峰面积,小于积分值,因此认为是未检出,均不过0.2%,符合规定.
3 讨论
3.1 色谱柱的选择
由于草酸属于离子型化合物,因此选择离子交换型的色谱柱易于其保留并与其他组分分离,分别考察了Phenomenex Rezex ROA-Organic acid 3.7 mm×150 mm 的强阳离子交换柱(H+型)、阴离子交换树脂、SCX 等不同类型的色谱柱,结果表明,只有在Phenomenex Rezex ROA-Organic acid 3.7mm×150mm 的强阳离子交换柱(H+型)色谱柱能够实现各个组分的分离,并且分离度均大于1.5.
3.2 流动相的选择
考察了不同浓度硫酸、磷酸等流动相对分离度的影响,结果表明,在0.01mol/L的硫酸溶液中分离效果最好,并且各个组分均不干扰草酸的测定.
3.3 检测波长的选择
以0.01mol/L的硫酸为对照溶液,配置20μg/mL的溶液,进行紫外分光光度计扫描结果见图3.

图3 草酸的吸收波长Fig.3 Absorption wavelength of oxalic acid
考虑到草酸为限度检查,液相色谱检测器的使用情况等,为了提高其检测灵敏度,故选择检测波长为210nm.
3.4 柱温的选择
考虑到色谱柱ROA-Organic acid强阳离子交换柱(H+型)的最佳使用温度,选择了45,50,55,60 ℃等温度下的分离情况,结果表明温度升高,加快组分的洗脱,在不影响分离检测的情况下,选择60 ℃作为分析条件.
因此,最终确定的色谱条件:Phenomenex Rezex ROA-Organic acid 3.7mm×150mm 的强阳离子交换柱(H+型),0.01mol/L硫酸溶液为流动相,检测波长为210nm,柱温为60 ℃.
4 结论
建立了一种H+阳离子交换的离子色谱分析方法,用于复合维生素中草酸的检测,该方法有效地避免了维生素组分对草酸检测的干扰,方法的专属性好,灵敏度高,能有效地对实际样品进行检测,有望将该方法列入此类药品中草酸检测的标准方法.
致谢:感谢河北科技大学化学与制药工程学院大学生自主实验室对本课题的支持.
[1] 卢锋.内生性草酸代谢及影响因素研究进展[J].医学综述,2012,18(1):40-43.LU Feng.Research advances in endogenous oxalic acid metabolism and its influencing factors[J].Medical Recapitulate.2012,8(1):40-44.
[2] 姚浔平,周江谨.离子排阻色谱法同时测定尿中草酸和柠檬酸研究[J].中国卫生检验杂志,2011,21(11):2625-2626.YAO Xunping,ZHOU Jiangjin.Study on the determination of oxalic acid and citric acid in urine by ionic exclusion chromatography[J].Chinese journal of health laboratory technology,2011,21(11):2625-2626.
[3] 国家药典委员会,中国药典[M].2部.2010版.中国医药科技出版社,2010.
[4] 刘树彬,陆敏,张星辰,等.乙醛酸和草酸的高效液相色谱分析[J].应用化工,2007,36(10):1027-1029.LIU Shubing,LU Min,ZHANG Xingchen,et al.Determination of glyoxalic acid and oxalic acid by high performance liquid chromatography[J].Applied Chemical Industry,2007,36(10):1027-1029.
[5] 彭婕,葛卫红,谈恒山,等.高效液相色谱法测定人尿液中草酸的含量[J].中国医院药学杂志,2006,26(3):299-301.PENG Jie,GE Weihong,TAN Hengshan,et al.HPLC determination of oxalate in human urine[J].Chinese Hospital Pharmaceutical Journal.2006,26(3):299-301.
[6] 李永庆.食品中草酸的测定[J].广东化工,2007,34(10):117-118.LI Yongqing.Detection of oxalic acid in foods[J].Guangdong Chemical,2007,34(10):117-119.
