例析电化学中多池问题的类型及解答要点
2015-07-22王开山
王开山
类型一、原电池型
原电池型是指多池构成原电池.根据电极及电解质溶液分析清楚正负极和电解质溶液中阴阳离子定向移动的方向是关键.
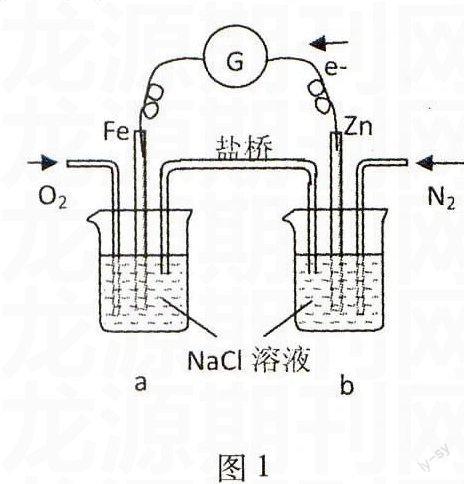
例1根据图1,下列判断中正确的是( ).
A.烧杯a中的溶液pH升高
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-H2
D.烧杯b中发生的反应为2Cl--2e-Cl2
解析由图分析,外电路为负极Zn失去电子发生氧化反应:Zn-2e-Zn2+,O2在正极Fe上得到电子发生还原反应:O2+4e-+2H2O4OH-;内电路为盐桥中阴阳离子定向移动(阳离子向a烧杯移动,阴离子向b烧杯移动).
答案:AB
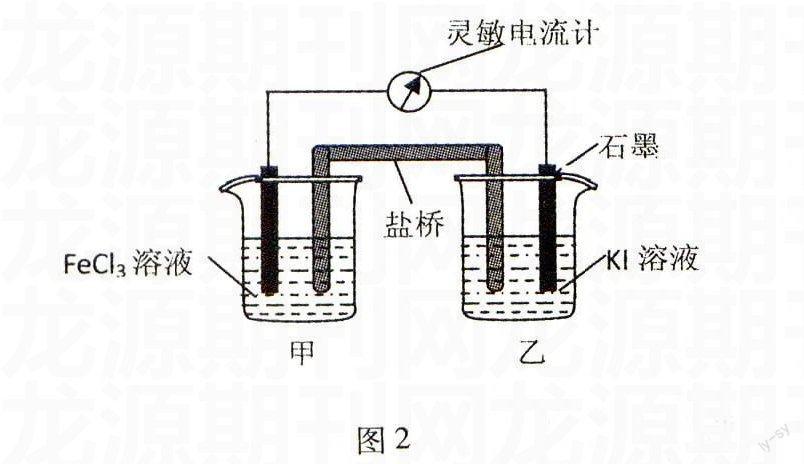
例2控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如图2所示的原电池.下列判断不正确的是( ).
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
解析由图分析,反应开始时,I-在乙中石墨电极上失去电子,即2I--2e-I2,发生氧化反应,为负极.Fe3+在甲中石墨电极上得到电子.即2Fe3++2e-2Fe2+,发生还原反应,为正极.当2Fe3++2I-2Fe2++I2建立平衡时,电流计读数为零.在甲中溶入FeCl2固体,Fe2+浓度增大,平衡向逆反应方向移动,甲烧杯中的Fe2+在石墨上失去电子发生氧化反应,为负极.乙烧杯中的I2得到电子发生还原反应,为正极.
答案:D.
类型二、外接电源电解池型
外接电源电解池型是指外接的一个电源,电解多个串联在一起的烧杯中的电解质溶液.每个烧杯中电子转移的数目相等.
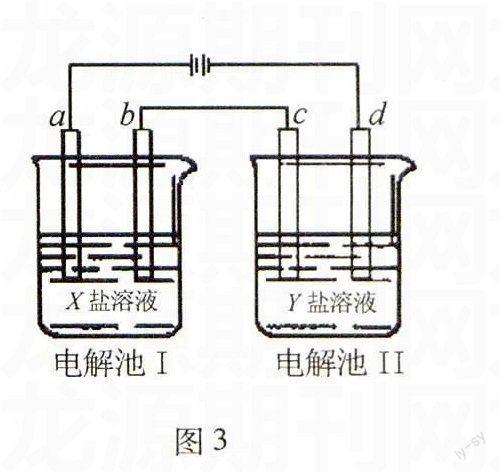
例3图3所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b 选项XY A MgSO4CuSO4 B AgNO3Pb(NO3)2 CFeSO4Al2(SO4)3 D CuSO4AgNO3 解析图中整套装置为电解池,两个烧杯为串联,两个烧杯中电子转移的数目相等.根据电解池工作原理,四个选项逐个代入,符合题意的只有D项. 答案:D 例4图4所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极. 图4 (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: ①电源的N端为 极; ②电极b上发生的电极反应为 ; ③列式计算电极b上生成的气体在标准状态下的体积 ; ④电极c的质量变化是 g; ⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因: 甲溶液 ; 乙溶液 ; 丙溶液 ; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 解析图中整套装置为电解池,三个烧杯为串联,三个烧杯中电子转移的数目相等.根据c电极质量增加,可知c极上发生了Cu2++2e-Cu的反应,c极为阴极,则a极为阴极,b极为阳极,d极为阳极.电源的N端就为正极.电极b上发生的电极反应为:4OH--4e-O2+2H2O.经过一段时间后,测得丙中K2SO4浓度从10%变为10.47%.设电解掉的水为m g,即100×10%=(100-m)× 10.47%,解得m=4.5 g. 可建立如下关系式: 2H2O ~ 4e- ~O2 ~ 2Cu 36 22.4 128 4.5 g V m(Cu) 解得:V=2.8 Lm(Cu)=16 g 电解甲烧杯相当于电解水,NaOH溶液的浓度会增大,溶液的碱性增强; 电解乙烧杯会生成H2SO4,溶液的酸性增强; 电解丙烧杯相当于电解水,K2SO4溶液的浓度会增大,溶液的酸碱性不变. 电解过程中铜全部析出后,乙烧杯中的溶液为稀硫酸,电解过程还会继续,此时相当于在电解稀硫酸溶液. 答案:⑴①正极;②4OH--4e-O2+2H2O;③2.8L;④增重16g;⑤电解甲烧杯相当于电解水,NaOH溶液的浓度会增大,溶液的碱性增强; 电解乙烧杯会生成H2SO4,溶液的酸性增强; 电解丙烧杯相当于电解水,K2SO4溶液的浓度会增大,溶液的酸碱性不变. (2)电解能继续进行.因为当电解过程中铜全部析出后,乙烧杯中的溶液为稀硫酸,此时相当于在电解稀硫酸溶液(实质是电解水). 类型三、电解外部电解质溶液型 电解外部电解质溶液型是指多个池构成一个电源电解外部的电解质.分析清楚多个池构成电源的正负极是解答这一类试题的关键. 例5将图5所示实验装置的K闭合,下列判断正确的是( ). A.Cu电极上发生还原反应 B.电子沿Zn→a→b→Cu路径流动 C.片刻后甲池中c(SO2-4)增大 D.片刻后可观察到滤纸b点变红色 解析甲、乙两个烧杯构成原电池(电源)电解滤纸上的电解质溶液.其中Zn为负极,发生氧化反应:Zn-2e-Zn2+;Cu为正极,发生还原反应: Cu2++2e-Cu.a为阴极,a点处发生还原反应:2H++2e-H2,b为阳极,b点处发生氧化反应:4OH--4e-O2+2H2O .外电路电子的移动方向为Zn→a,b→Cu,内电路离子的移动方向为盐桥中阴离子向甲烧杯移动,阳离子向乙烧杯移动;滤纸上的H+向a点移动,OH-向b点移动.
答案:A
类型四、自身电解型
自身电解型是指一部分池构成电源电解另外一部分池中的电解质,整套装置为电解池.分析清楚电源的正负极以及电子的数目是解答这一类试题的关键.
例6新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图6所示:
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 ;
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F=9.65×104C·mol-1,列式计算),最多能产生的氯气体积为 L(标准状况).
解析 该装置是两个串联的燃料电池电解NaCl饱和溶液.CH4燃料电池的电解质溶液为KOH碱性环境,则正负极反应式分别为:2O2+4H2O+8e-8OH-,CH4+10OH--8e-CO2-3+7H2O.闭合K开关后,a电极为阳极,发生的电极反应式为:2Cl--2e-Cl2↑,b电极为阴极,发生的电极反应式为:2H++2e-H2↑.总反应式为:2NaCl+2H2O电解2NaOH+H2↑+Cl2↑.
根据通入甲烷的量和电子转移的数目,可知理论上通过电解池的电量为:
1 L22.4 L·mol-1×8×
9.65×104C·mol-1,最多能产生氯气的量为通入甲烷量的4倍,即4 L.
答案:(1) 2O2+4H2O +8e-8OH-
CH4+10OH--8e-CO2-3+7H2O
(2)H2
2NaCl+2H2O电解2NaOH+H2↑+Cl2↑
(3) 1L22.4 L·mol-1×8×9.65×104C·mol-1=3.45×104C 4 L
例7某同学组装了图7所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( ).
A. 电流方向:电极Ⅳ→A→电极Ⅰ
B. 电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极Ⅲ的电极反应:Cu2++2e- Cu
解析由题意可知,该装置的Ⅰ、Ⅱ是原电池的两极,Ⅰ是负极,Ⅱ是正极,Ⅲ、Ⅳ是电解池的两极,其中Ⅲ是阳极,Ⅳ是阴极,所以电流方向:电极Ⅳ→电流计→电极Ⅰ,A正确;电极I是原电池的负极,发生氧化反应,B错误;电极Ⅱ是原电池的正极,发生还原反应,有Cu析出,C错误;电极Ⅲ是阳极,发生氧化反应,电极反应是Cu-2e-Cu2+,D错误. 答案:A
解答要点
(1)通过分析外电路电子的定向移动和内电路离子的定向移动,判断整套多池装置是原电池还是电解池;
(2)在进行分析时要注意:“电子不下水,离子不上岸”的工作原理.如例6中电子的数目不能计算成2L甲烷产生的.
(3)多池装置进行计算时,电子是其中的桥梁,通过电子的数目可搭建起已知量和未知量之间的关系.
跟踪练习:
1.铅蓄电池的工作原理为:Pb+PbO2+2H2SO42PbSO4+2H2O研读右图,下列判断不正确的是( ).
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-PbO2+4H++SO2-4
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中SO2-4向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
答案:C
(收稿日期:2015-01-10)
