哮喘小鼠肺组织Nuocytes增多与GITR-GITRL表达的关系
2015-07-22张梦莹徐芸芸吴静张盼张淡宜彭静静齐晨纪晓昀夏圣苏兆亮王胜军许化溪
张梦莹,徐芸芸,吴静,张盼,张淡宜,彭静静,齐晨,纪晓昀,夏圣,苏兆亮,王胜军,许化溪
(江苏大学医学院免疫学与免疫检验系,江苏镇江212013)
哮喘小鼠肺组织Nuocytes增多与GITR-GITRL表达的关系
张梦莹,徐芸芸,吴静,张盼,张淡宜,彭静静,齐晨,纪晓昀,夏圣,苏兆亮,王胜军,许化溪
(江苏大学医学院免疫学与免疫检验系,江苏镇江212013)
目的:检测哮喘小鼠肺组织中Nuocytes相关指标和GITR-GITRL的表达,探讨哮喘时Th2极化微环境的改变。方法:选择8只Balb/c小鼠,随机分为2组,模型组于第1天,第11天用OVA致敏,第22至26天用2%OVA溶液雾化激发,对照组用PBS处理;采用流式细胞术检测小鼠肺组织内GITR表达和Nuocytes细胞数量;qRT-PCR法检测Foxp3、RORα、ICOS、ST2、IL-5、IL-13和GITR及其配体GITRL的mRNA表达水平;对GITR-GITRL和Nuocytes及其相关分子的表达水平进行相关性分析。结果与对照组相比,模型组小鼠肺组织中Nuocytes细胞数和GITR表达均升高,且GITRL、Foxp3、RORα、ICOS、ST2以及IL-5和IL-13 mRNA表达水平均明显上调;GITR与RORα和ST2、IL-5、IL-13的表达水平均呈正相关。结论:哮喘小鼠肺组织中Nuocytes和GITR-GITRL表达增高,提示哮喘时GITR-GITRL上调的T细胞免疫应答可能与Th2主导的免疫失衡和Nuocytes极化相关。
Nuocytes;GITR;GITRL;哮喘;小鼠
哮喘是一种慢性过敏性气道炎症,病理特征主要表现为急性可逆性支气管气流受限、支气管-肺组织高反应性、气道嗜酸粒细胞浸润、黏液分泌增多等。目前,普遍认为机体哮喘时的免疫状态向Th2型偏倚[1],表现为2型细胞因子和转录因子IL-4、GATA3等表达水平升高。
近来发现一新型固有淋巴细胞Nuocytes[2-3]或称Ⅱ型固有免疫细胞(Group 2 innate lymphoid cells,ILC2s),在哮喘疾病中起重要作用。Nuocytes经IL-25、IL-33刺激活化,产生和分泌大量细胞因子,如IL-5和IL-13等。Nuocytes不表达T/B细胞、巨噬细胞、树突状细胞、嗜碱性粒细胞、嗜酸性粒细胞、肥大细胞等特异性标志,可诱导共刺激分子(inducible costimulator,ICOS)为阳性[4-5],维甲酸相关孤核受体α(retinoid acid receptor related orphan receptorα,RORα)是其分化和发挥生物学作用必需的转录因子。Nuocytes主要免疫作用是参与Th2应答过程,其极化可能是构成Th2细胞优势分化的重要因素。
糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced TNF receptor family related protein,GITR)是肿瘤坏死因子受体(TNFR)超家族成员之一[6-8],为Ⅰ型跨膜蛋白,1997年由Nocentini等在杂交瘤细胞株上克隆出,其配体即GITRL。表达有GITR的Treg细胞能有效地发挥免疫抑制作用,控制和维持机体的免疫平衡。而当GITR与其配体GITRL共表达时,GITR-GITRL的相互作用则可消除Treg细胞的免疫抑制功能,并作为免疫应答的正向协同刺激信号,参与免疫性疾病的炎症损伤过程。本研究拟通过检测哮喘小鼠肺组织GITRGITRL和Nuocytes的分布以及相关细胞因子的表达水平,分析GITR-GITRL对Nuocytes及其相关分子表达水平的影响,从区域免疫学的角度了解哮喘时Th2极化微环境的变化。
1 材料与方法
1.1 小鼠哮喘模型的建立
SPF(Specific pathogen-free)级雌性Balb/c小鼠(6~8周龄)8只,购自扬州大学比较医学中心,动物合格证号:No.201403201。随机分为对照组和模型组,每组4只。模型组建模方法参照文献[9]并加以改进,即于第1天和第11天腹腔注射致敏液0.1 mL[50μg鸡卵清蛋白(OVA)+10%氢氧化铝凝胶2 mg],第22天至第26天以无菌PBS配制的2%OVA溶液超声雾化吸入60 min,最后一次雾化吸入24 h后处死小鼠。对照组用PBS处理。
1.2 试剂
OVA(Sigma公司),Trizol试剂(Invitrogen公司);反转录试剂盒、SYBR Premix Ex TaqTM(TaKaRa公司);GITR和Lin单克隆抗体(eBioscience公司),ST2、ICOS单克隆抗体(Biolegend公司)。
1.3 流式细胞术检测小鼠肺组织GITR的表达和Nuocytes细胞数
取小鼠肺组织,剪碎并用胶原酶消化,筛网过滤和ACK裂解液裂解红细胞,细胞计数后用抗GITRAPC或抗Lineage-FITC、抗ICOS-PerCP/Cy5.5和T1/ST2-PE作荧光抗体染色,然后用C6流式细胞仪分析。
1.4 RNA提取、引物设计及qRT-PCR
剪取约1/4肺组织块冲洗,剪碎后加1 mL Trizol提取总RNA,反转录成cDNA,再以cDNA为模板进行qRT-PCR(反转录和定量试剂均为TaKaRa公司产品)。实验过程中每份标本均设3个复孔并作3次重复检测。引物均用Oligo 6软件设计(表1),由上海生工生物技术公司合成。

表1 引物序列及产物长度
1.5 统计学分析
统计学分析采用GraphPad软件。组间数据比较用独立样本t检验,相关性分析用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 哮喘小鼠模型诱导结果
建模后哮喘小鼠表现为烦躁不安,弓背且腹部鼓动明显,点头样喘息,呼吸加深加快等;HE染色镜下可见哮喘小鼠肺泡间及伴行血管周围有大量炎症细胞浸润、黏膜皱壁减少、杯状细胞肥大增生,见图1。与对照组相比,OVA模型组血清总IgE水平明显升高(t=2.427,P<0.05)。见图2。
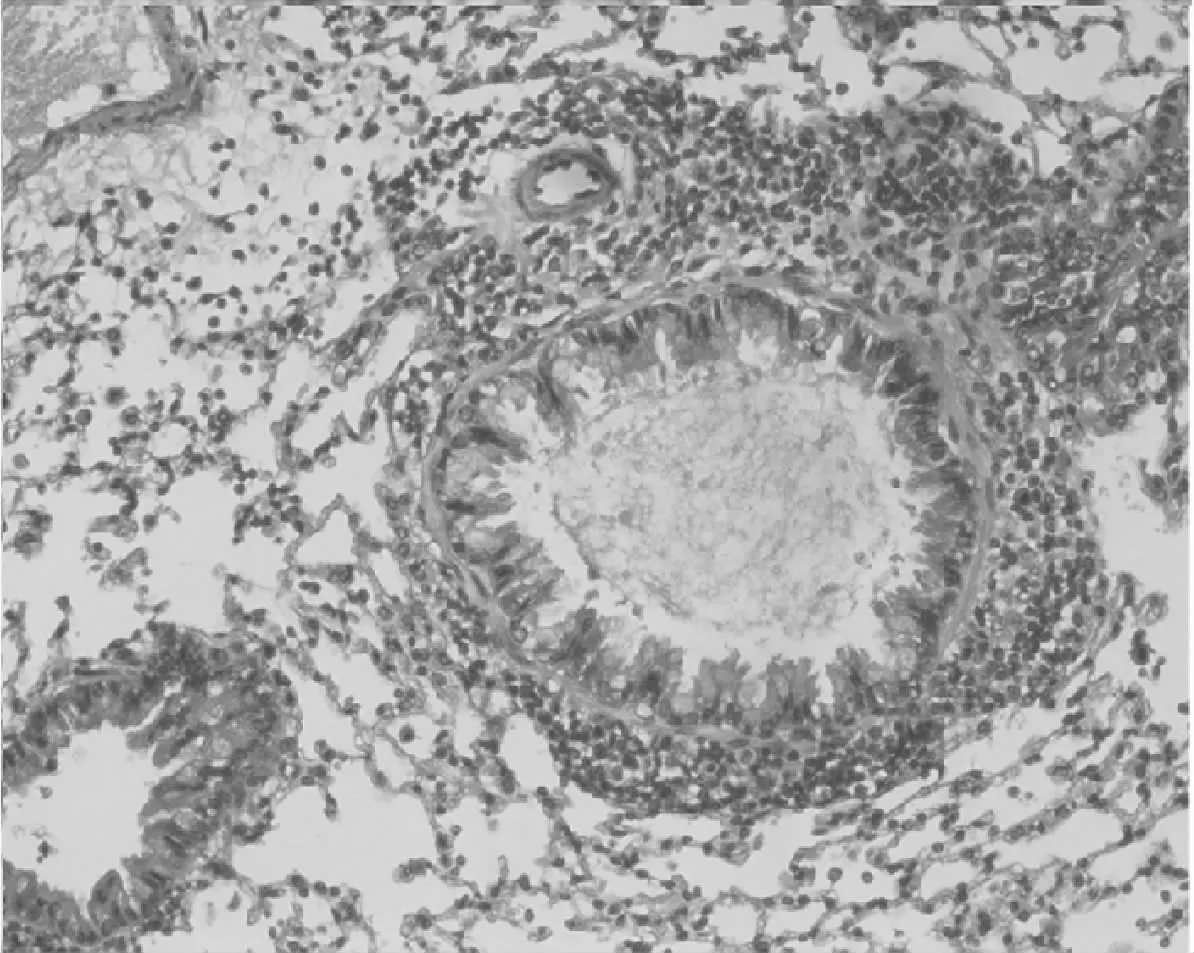
图1 模型组小鼠肺组织的病理改变(HE染色×10)
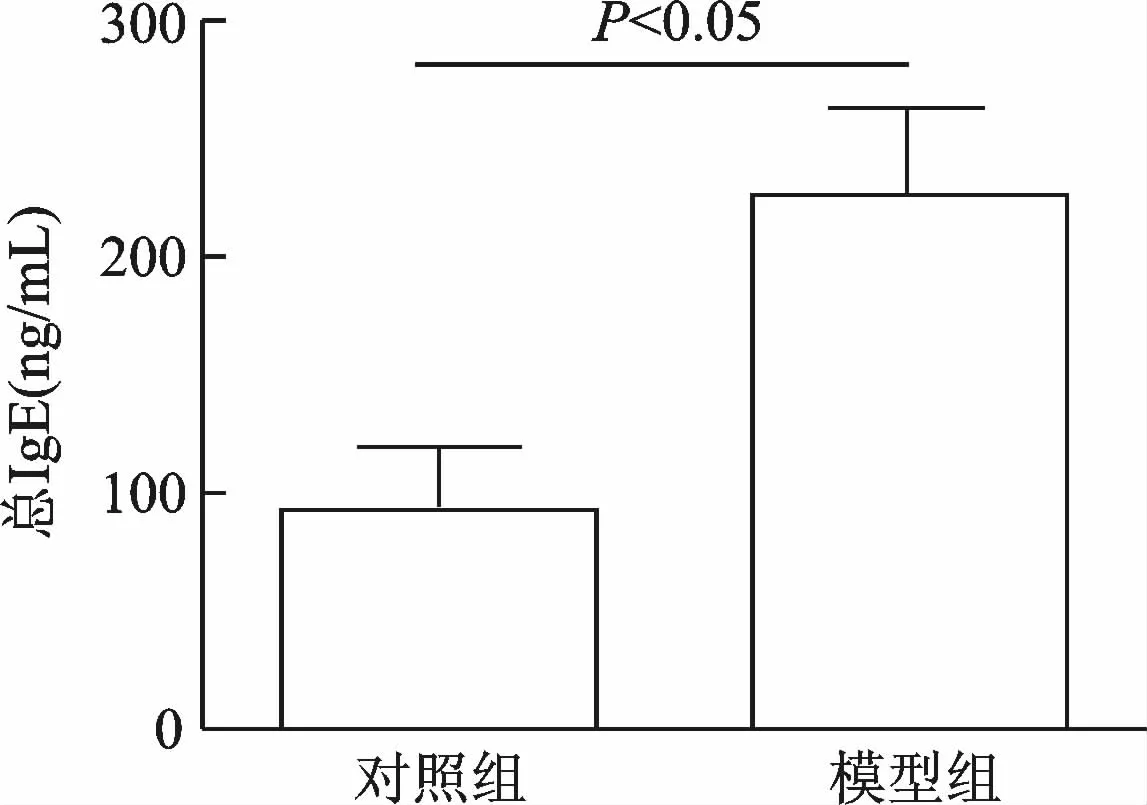
图2 小鼠血清总IgE水平比较
2.2 肺组织Nuocytes数量和GITR表达水平的改变
流式细胞术检测结果显示,与对照组比较,模型组小鼠肺组织内GITR阳性细胞增加,且伴有Nuocytes细胞数增多;免疫荧光抗体染色结果也显示GITR表达增强;qRT-PCR检测结果显示,与对照组比较,模型组小鼠肺组织GITR mRNA表达水平明显升高。见图3。
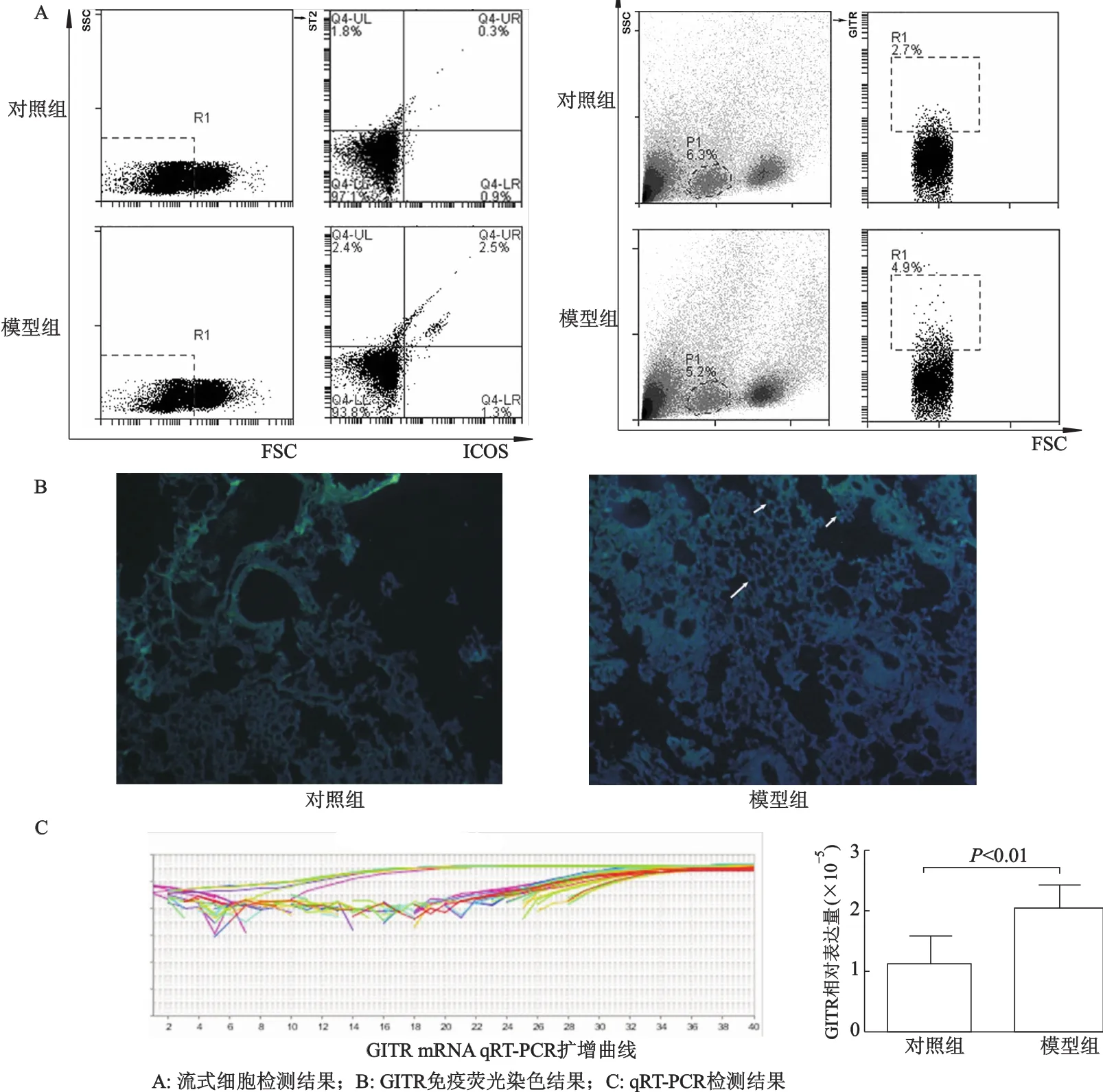
图3 小鼠肺组织内GITR表达和Nuocytes细胞数量
2.3 哮喘小鼠肺组织GITRL和Nuocytes相关分子的表达
qRT-PCR检测结果显示,模型组小鼠肺组织中GITRLmRNA水平明显高于对照组;此外,Foxp3以及Nuocytes细胞相关分子ICOS、ST2、RORα、IL-5和IL-13 mRNA表达水平均明显高于对照组(P均<0.05)。见图4。
2.4 哮喘小鼠肺组织GITR与Nuocytes相关分子表达水平的相关性分析
相关性分析结果表明,GITR表达与RORα,ST2,IL5和IL-13的表达呈明显正相关(P均<0.05)。见图5。

图4 GITR-GITRL和Nuocytes相关分子的mRNA表达

图5 GITR与nuocytes相关分子表达水平的相关性分析
3 讨论
支气管哮喘是以气道过敏性炎症为主要病理特征的免疫性疾病,近年来欧共体呼吸健康调查(ESRHS)和国际儿童哮喘与变态反应研究机构(ISAAC)的流行病学调查研究均显示,哮喘患病率明显升高。迄今为止,哮喘的病理机制尚不完全清楚。研究表明,哮喘患者体内Th1/Th2细胞处于失衡状态,Th2细胞呈优势分化[10]。Nuocytes可分泌大量的IL-5和IL-13,支撑和维持着Th2细胞的极化状态,促进哮喘的发展。
GITR组成性地高表达于Treg细胞表面,而静息的初始CD4+T细胞表面表达量相对较低,当抗原刺激活化T细胞后,Treg和CD4+T细胞表面的GITR表达量均会增高[11-13]。在缺乏足够GITRL时,高表达GITR的Treg细胞具有负向免疫调控作用,而GITR与其配体GITRL结合则构成T细胞活化的协同刺激信号,GITR-GITRL的相互作用影响Treg细胞的增殖及其免疫抑制功能[8-9]。
本研究显示,哮喘小鼠肺组织内GITR表达和Nuocytes数量升高;GITR及其配体GITRLmRNA表达水平相伴上调,同时nuocytes相关分子ICOS、ST2、IL-5、IL-13及转录因子RORα的mRNA水平也明显升高;GITR-GITRL表达量与Nuocytes细胞相关的细胞因子或转录因子水平呈正相关。由此推测,GITR和GITRL相伴高表达,一方面可阻碍Treg细胞的负向调控作用,另一方面可能对Th2细胞极化发挥促进作用。有研究表明,Th2细胞的特异性转录因子GATA3是炎症条件下稳定Foxp3(Treg转录因子)表达及功能的正调控因子[14-15],而Treg细胞中Foxp3也可通过上调去泛素化酶USP21的转录和表达,从而维持GATA3蛋白的稳定性[16]。本研究结果显示,哮喘小鼠肺组织Foxp3 mRNA呈高表达,由此可见其促进Th2细胞的极化。GITR-GITRL高表达与Nuocytes相关细胞因子或转录因子的上调呈正相关,可能是直接地相互影响,也可能是间接作用的结果,但最终都导致Th2细胞极化之微环境,构成哮喘的免疫失衡状态,其具体机制仍待进一步研究。
[1] Hams E,Fallon PG.Innate type 2 cells and asthma[J].Curr Opin Pharmacol,2012,12(4):503-509.
[2] Halim TY,Steer CA,Math L,et al.Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation[J].Immunity,2014,40(3):425-435.
[3] Barlow JL,Bellosi A,Hardman CS,et al.Innate IL-13-producing nuocytes arise during allergic lung inflammation and contribute to airways hyperreactivity[J].J Allergy Clin Immunol,2012,129(1):191-198,e191-194.
[4] Neill DR,McKenzie AN.Nuocytes and beyond:new insights into helminth expulsion[J].Trends Parasitol,2011,27(5):214-221.
[5] Neill DR,Wong SH,Bellosi A,et al.Nuocytes represent a new innate effector leukocyte thatmediates type-2 immunity[J].Nature,2010,464(7293):1367-1370.
[6] Joetham A,Ohnishi H,Okamoto M,et al.Loss of T regulatory cell suppression following signaling through glucocorticoid-induced tumor necrosis receptor(GITR)is dependent on c-Jun N-terminal kinase activation[J].JBiol Chem,2012,287(21):17100-17108.
[7] Lommatzsch M,Julius P,Kuepper M,etal.The course of allergen-induced leukocyte infiltration in human and experimental asthma[J].J Allergy Clin Immunol,2006,118(1):91-97.
[8] Motta AC,Vissers JL,Gras R,et al.GITR signaling potentiates airway hyperresponsiveness by enhancing Th2 cell activity in a mouse model of asthma[J].Respir Res,2009,10(1):93.
[9] Fallon PG,Ballantyne ST,Mangan NE,et al.Identification of an interleukin(IL)-25-dependent cell population that provides IL-4,IL-5,and IL-13 at the onset of helminth expulsion[J].J Exp Med,2006,203(4):1105-1116.
[10] Cooper MA,Fehniger TA,CaligiuriMA.The biology of human natural killer-cell subsets[J].Trends Immunol,2001,22(11):633-640.
[11] Shimizu J,Yamazaki S,Takahashi T,etal.Stimulation of CD25+CD4+regulatory T cells through GITR breaks immunological self-tolerance[J].Nat Immunol,2002,3(2):135-142.
[12] Kanamaru F,Youngnak P,Hashiguchi M,et al.Costimulation via glucocorticoid-induced TNF receptor in both conventional and CD25+regulatory CD4+T cells[J].J Immunol,2004,172(12):7306-7314.
[13] Stephens GL,McHugh RS,Whitters MJ,et al.Engagement of glucocorticoid-induced TNFR family-related receptor on effector T cells by its ligand mediates resistance to suppression by CD4+CD25+T cells[J].J Immunol,2004,173(8):5008-5020.
[14] Nocentini G,Riccardi C.GITR:a modulator of immune response and inflammation[J].Adv Exp Med Biol,2009,647:156-173.
[15] Wohlfert EA,Grainger JR,Bouladoux N,etal.GATA3 controls Foxp3+regulatory T cell fate during inflammation inmice[J].JClin Invest,2011,121(11):4503-4515.
[16] Zhang J,Chen C,Hou X,et al.Identification of the E3 deubiquitinase ubiquitin-specific peptidase 21(USP21)as a positive regulator of the transcription factor GATA3[J].JBiol Chem,2013,288(13):9373-9382.
Relationship between increased nuocytes and GITR-GITRL expression levels in lung tissue of asthmatic m ice
ZHANGMeng-ying,XU Yun-yun,WU Jing,ZHANG Pan,ZHANG Dan-yi,PENG Jing-jing,QIChen,JIXiao-yun,XIA Sheng,SU Zhao-liang,WANG Sheng-jun,XU Hua-xi
(Department of Immunology,School of Medicine,Jiangsu University,Zhenjiang Jiangsu 212013,China)
Objective:To detect the changes of numbers of nuocytes and levels of GITR-GITRL in the lung of asthmaticmice,analyze the relationship between them,then to explore the changes of Th2-polarized micro-environment at the locus of allergic inflammation when with asthma.M ethods:Eightmice were devided into 2 groups randomly,asthmamodelswere sensitized with OVA on 1st,11st day,then nebulized inhalation with OVA on day 22-26,control group with PBS.Flow cytometry was used to detect numbers of nuocytes and cellswhich express GITR;qRT-PCR was also used to test themRNA levels of GITR-GITRL,molecules and cytokines associated with nuocytes;pearson correlation analysiswas used to detect the correlation between GITR-GITRL and nuocytes.Results:Compared with the control group,model group showed high levels of nuocytes and GITR-GITRL,meanwhile,with increased mRNA levels of GITRL,Foxp3,RORα,ICOS,ST2,IL-5 and IL-13;and there was a positive correlation between GITR expression and RORα,ST2,IL-5,IL-13 expression.Conclusion:Nuocytes and the expression of GITR-GITRL increased synchronously in lung of asthmaticmice,which suggested that the up-regulation of T cell-mediated immune response by GITR-GITRLmay be associated with Th2-biased response and polarization of nuocytes.
nuocytes;GITR;GITRL;asthma;mice
张梦莹(1990—),女,硕士研究生;苏兆亮(通讯作者),副教授,博士生导师,E-mail:szl30@yeah.net;许化溪(通讯作者),教授,博士生导师,E-mail:xuhx@ujs.edu.cn
R562.25
A
1671-7783(2015)04-0277-05
10.13312/j.issn.1671-7783.y150099
国家自然科学基金资助项目(31270947)
2015-05-06 [编辑] 刘星星
