MicroRNA-195与Smad7靶向关系的研究
2015-07-22孔彪沈冬丽芮涛张国辉
孔彪,沈冬丽,芮涛,张国辉
(江苏大学附属人民医院心内科,江苏镇江212002)
MicroRNA-195与Smad7靶向关系的研究
孔彪,沈冬丽,芮涛,张国辉
(江苏大学附属人民医院心内科,江苏镇江212002)
目的:构建含有Smad7基因3′-UTR区的荧光素酶报告基因载体,利用双荧光素酶报告基因验证MicroRNA195与其潜在靶基因Smad7的靶向关系。方法:PCR扩增出Smad7基因3′-UTR区片段,以此构建含3′-UTR的荧光素酶报告基因载体(wild type,WT);将miRNA-195与荧光素酶报告重组子共转染至293T细胞中,双荧光素酶报告基因系统检测荧光素酶活性;构建含Smad7基因3′-UTR突变体(mutant,Mut)的荧光素酶报告基因质粒,检测荧光素酶活性变化。结果:测序结果表明,含有Smad7基因3′-UTR区的荧光素酶报告基因载体构建正确;荧光素酶活性实验表明,与对照组相比,miRNA-195可使含Smad7基因3′-UTR区的荧光素酶报告重组子的荧光素酶活性降低40%左右;而定点突变Smad7基因3′-UTR的荧光素酶报告重组子荧光活性未有明显变化。结论:成功构建了Smad7基因3′-UTR区的荧光素酶报告基因载体,而miRNA-195可以直接作用于Smad7基因3′-UTR区,抑制其荧光素酶活性。
MicroRNA195;Smad7基因;荧光素酶报告基因;3′-UTR
微小RNA(miRNA)是一种小的内源性非编码RNA分子,大约由18~24个核苷酸组成。它可与靶基因mRNA的3′端非编码区(3′-UTR)结合,通过翻译水平的抑制或断裂靶标mRNAs而调节基因的表达[1]。miRNA影响其目标蛋白的生物学功能,对细胞增殖与分化进行调节,并可加速细胞凋亡,从而实现对疾病病理生理进程的调控。国内外大量基础和临床研究已证实,多种miRNA在心血管疾病的发生发展过程中扮演重要角色[2-3]。van Rooij等[4]研究发现,心脏特异性的miRNA-195在哺乳动物的肥大心肌中表达上调。目前尚未确定miRNA-195作用的靶基因,其介导心脏病变的机制也不明确。利用Target scan 5.1预测软件,我们发现Smad7是miRNA-195的潜在靶基因之一,本研究旨在利用荧光素酶实验验证二者间的靶向关系,为进一步研究心肌病心肌细胞肥大病理生理改变的机制奠定基础。
1 材料与方法
1.1 材料
胚肾细胞HEK293T细胞株、大肠埃希菌TOP10菌株由本实验室保存,miRNA mimics购买于上海吉码公司,转染试剂Fugene HD(Roche公司),经改造的双荧光素酶报告基因质粒(pLUC载体)购自华安平康公司,引物由Invitrogen公司合成。PCR试剂盒(TaKaRa公司),质粒提取试剂盒(OMEGA公司),XhoⅠ、NotⅠ、T4DNA连接酶(Fermentas公司),双荧光报告系统(Promega公司),细胞裂解液(Promega公司)。
1.2 方法
1.2.1 构建野生型和突变型Smad7荧光素酶报告基因质粒 Smad7基因3′-UTR序列从NCBI数据库中获得,设计成对PCR扩增引物。Smad7上游引物:5′-GTGGGGAGAAGAGGACAGGAC-3,下游引物:5′-GTGGTACCCACTTTCGCACA-3′。以基因组DNA作为模板进行PCR扩增反应,获得3′-UTR基因片段。经1.5%琼脂糖凝胶电泳分离PCR产物。将经NotⅠ和XhoⅠ酶切纯化后的具有相同酶切位点的pLUC与3′-UTR PCR片段相连接,22℃连接2 h后转化到感受态细胞TOP10,取适量转化产物涂布于LB平板上,37℃培养箱倒置培养16 h,观察菌落生长情况。将经菌落PCR和质粒PCR鉴定正确的克隆菌液送测序,验证重组克隆插入片段的序列信息,含有目的序列的正确质粒命名为(Luc-Smad7-WT)。定点突变该Smad7 3′-UTR中的核心序列(UGCUGCU),构建含Smad7 3′-UTR突变体的荧光素酶报告基因质粒(Luc-Smad7-Mut)。
1.2.2 miRNA-195与Luc-Smad7-WT/Luc-Smad7-Mut共转染293T细胞 胰酶消化HEK293T细胞,计数,每1/96孔种2×104(100μL)细胞,将处理好的细胞均匀加于各孔中,置于37℃,5%CO2培养箱培养约24 h。每孔添加的试剂量:0.2μg Luc-Smad7-WT/Luc-Smad7-Mut,0.3μL Fugene HD,0.45μgmiRNA mimics,miRNA NC作为对照,一组实验3个复孔。30μL Opti-MEM培养基稀释质粒,最后加入0.9μL Fugene HD,混匀后室温静置15 min。将混合物取10μL均匀滴加于每孔细胞中,每3个孔为一实验组,置于37℃,5%CO2培养箱继续培养。
1.2.3 荧光素酶活性检测 转染完成48 h后,采用Luciferase Reporter Assay System进行检测。吸除转染各孔内的培养基,于各孔中加入80μL稀释后的1×细胞裂解液,置于脱色摇床上振荡1 h,收集各孔的细胞裂解液,12 000 r/min,离心1 min沉淀杂质。取上述细胞裂解液于不透明96孔板各孔中,按照说明书依次加入萤火虫荧光素酶及海肾荧光素酶底物,通过Tecan Infinite F200/M200型多功能酶标仪检测。
1.3 统计学方法
2 结果
2.1 miRNA-195与Smad7基因3′-UTR区互补结合位点预测
从Target scan 5.1预测软件获取miRNA-195与Smad7基因3′-UTR区互补结合位点,并以此构建miRNA-195种子区突变体(种子区突变为相互互补的碱基),见图1。
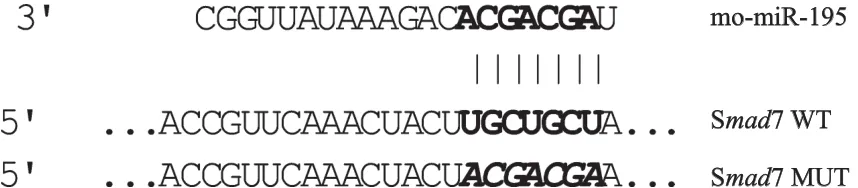
图1 m iRNA195与Smad7靶位点配对示意图
2.2 Smad7基因3′-UTR区的PCR扩增
以基因组DNA作为模板进行PCR扩增反应,获得Smad7基因3′-UTR基因片段384 bp,DNA凝胶电泳结果显示与预计大小相符(图2)。
图2 Smad7基因3′-UTR区的PCR扩增结果
2.3 荧光素酶报告基因载体的构建
上述3′-UTR PCR片段纯化后经NotⅠ和XhoⅠ双酶切处理,克隆到具有相同酶切位点的pLUC载体中,将经PCR鉴定为阳性的重组质粒进行进一步酶切鉴定,结果显示重组质粒含有与Smad7基因3′-UTR基因片段大小相符合的插入片段(384 bp,图3)。重组克隆插入片段经测序鉴定证实为Smad7基因3′-UTR区(图略)。
图3 荧光素酶报告基因载体的构建
2.4 miRNA-195对Smad7基因3′-UTR区的调控
结果表明,rno-miR-195与含Smad7基因3′-UTR片段的双荧光素酶报告基因共转染验证实验相对于负对照(mimics NC与含Smad7基因3′-UTR片段的双荧光素酶报告基因共转染)有极显著性差异(t=13.291,P=0.006),同时荧光比值为负对照的56.30%。说明rno-miR-195对Smad7 3′-UTR的基因表达水平有显著抑制作用(图4)。
rno-miR-195与含Smad7基因3′-UTR突变体片段的双荧光素酶报告基因共转染验证实验相对于负对照(mimics NC与含Smad7基因3′-UTR突变体片段的双荧光素酶报告基因共转染)差异无统计学意义(t=0.626,P=0.595),同时荧光比值为负对照的103.02%。说明rno-miR-195对Smad7基因3′-UTR突变体的基因表达水平无抑制作用(图4)。
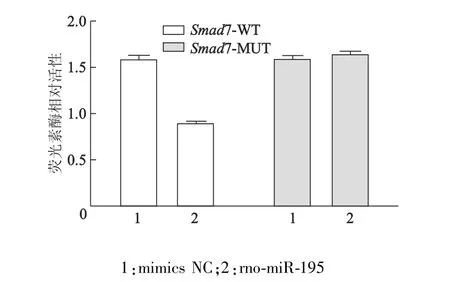
图4 m iRNA-195对Smad7基因3′-UTR的表达调控
3 讨论
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者的主要心脏并发症之一,以心肌肥大和心肌纤维化为主要特征性病理改变,是导致糖尿病患者心血管系统疾病的高发生率和高病死率的重要原因,其发病机制、诊断治疗已成为基础和临床研究的热点。近年来,对心脏相关的miRNAs及多种病理条件下miRNAs差异性表达的研究,揭示了它在心血管疾病中重要的调节作用。miRNA-195参与了多种病因引起的心肌肥大的病理生理过程[3]。刁雪红等[5]研究发现,miRNA-195在糖尿病小鼠模型的心肌组织中的表达明显上调。而本课题组前期工作中同样发现在高糖培养的心肌细胞中,miRNA-195表达也上调,因此推测miRNA-195在高糖引起的心肌细胞肥大中发挥重要作用,但其靶基因及其在糖尿病心肌病发生、发展过程中的作用机制尚不清楚。
我们利用生物信息学软件预测miRNA-195潜在靶基因,结果发现miRNA-195种子序列可与Smad7的3′-UTR片段上的一段碱基序列完全配对。Smad7可通过阻断TGF-β1受体与受体调节型Smad s或共同调节型Smads的结合抑制TGF-β1信号通路的传导,从而阻断TGF-β1的生物学效应[6]。研究发现,糖尿病大鼠心肌组织中Smad7表达减少,且其变化与糖尿病心脏病变相关,提示Smad信号系统失衡可能与糖尿病心肌病发生发展存在密切关联。同时发现TGF-β1介导的心肌重构可被Smad7阻断,说明以Smad7为代表的抑制型Smad s可发挥保护作用[7]。
荧光素酶报告基因实验作为一种重要的miRNA靶位点鉴定方法,常被用来验证miRNA是否直接作用于其潜在靶基因的3′-UTR[8]。为了验证Smad7是否直接受miRNA-195的调控,我们将含有大鼠miRNA-195种子序列的Smad7的3′-UTR片段克隆到报告基因载体中,得到Luc-Smad7-WT报告载体,并且构建了含有突变序列的载体Luc-Smad7-Mut。然后将构建成功的重组质粒和miRNA-195瞬时共转染293T工具细胞,利用双荧光素酶报告基因系统检测Luciferase荧光值。若能观察到含有Smad7基因3′-UTR片段的外源性质粒载体与miRNA-195寡核苷酸在工具细胞中相互作用,可认为该作用机制具有普遍性[9]。结果显示,在293T细胞中,野生型Smad7 3′-UTR+miRNA-195报告基因载体的荧光素酶活性较对照组显著降低,而种子区突变体则无显著差异。后期,课题组在高糖培养的心肌细胞中通过转染miRNA-195抑制剂,发现miRNA-195表达下调的同时,Smad7蛋白表达水平增加,推测miRNA-195通过TGF-β1/Smad通路参与糖尿病心肌病时的心肌肥大。上述结果充分证明Smad7确实为miRNA-195的靶基因。
综上所述,miRNA-195可通过靶向抗心肌重构基因Smad7,调控其表达水平,参与糖尿病心肌病心肌细胞肥大的发生、发展过程。本研究进一步完善了糖尿病心肌病的发病机制。在未来的临床研究中,miRNA-195或许可作为糖尿病心肌病新的治疗靶点。
[1] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[2] Zhao Y,Samal E,Srivastava D.Serum response factor regulates amuscle-specificmicroRNA that targets Hand2 during cardiogenesis[J].Nature,2005,436(7048):214-220.
[3] van Rooij E,Sutherland LB,Liu N,et al.A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure[J].Proc Natl Acad Sci U SA,2006,103(48):18255-18260.
[4] van Rooij E,Sutherland LB,Qi X,et al.Control of stress-dependent cardiac growth and gene expression by a MicroRNA[J].Science,2007,316(5824):575-579
[5] 刁雪红,申锷.糖尿病小鼠心肌组织microRNA表达谱分析[J].上海交通大学学报:医学版,2010,10(2):1194-1198.
[6] Massaque J,Seoane J,Wotton D.Smad Transcription factors[J].Genes Dev,2005,19(23):2783-2810.
[7] 李龙英,肖谦,高原,等.Smad3、Smad7在糖尿病大鼠心肌组织的表达[J].中国老年学杂志,2009,29(2):132-134.
[8] Enright AJ,John B,Gaul U,et al.MicroRNA targets in Drosophila[J].Genome Biol,2003,5(1):R1.
[9] 王瑜,付洁,程龙,等.靶向FHL1microRNA初步筛选研究[J].军事医学,2013,37(6):423-426.
Investigating the relationship between M icroRNA-195 and Smad7
KONG Biao,SHEN Dong-li,RUITao,ZHANGGuo-hui
(Department of Cardiology,the Affiliated People′s Hospital of Jiangsu University,Zhenjiang Jiangsu 212002,China)
Objective:The luciferase reporter vector containing 3′-UTR of Smad7 was constructed.Dual luciferase reporter gene system was applied to determine the association between miRNA-195 and its target gene Smad7.M ethods:The 3′-UTR of Smad7 fragment amplified by PCR was cloned into luciferase vector.MiRNA-195 and the luciferase reporters containing 3′-UTR(Smad7-3′UTR-WT)or mutant 3′-UTR(Smad7-3′UTR-Mut)of Smad7 were co-transfected into HEK293T cells and dual luciferase reporter gene system was applied to test luciferase activity.Results:DNA sequencing showed that the sequences of the cloned regions were correct.The luciferase activity of Smad7-3′UTR-WT plasmid treated with miRNA-195 was decreased to about 40%compared with control.Themutant3′-UTR were no longer repressed bymiRNA-195.Conclusion:The Smad7 3′-UTR luciferase reporter vector has been constructed successfully.MiRNA-195 can repress the luciferase activity of the reporter gene and had direct effect on Smad7 3′-UTR.
MicroRNA195;Smad7;luciferase reporter gene;3′-UTR
R393
A
1671-7783(2015)04-0286-04
10.13312/j.issn.1671-7783.150049
孔彪(1986—),男,硕士研究生;张国辉(通讯作者),博士,主任医师,硕士生导师,E-mail:13338812776@189.cn
2015-03-19 [编辑]何承志
