肝细胞肝癌多层螺旋CT征象与肿瘤血管生成相关性的研究*
2015-07-22川北医学院附属医院放射科医学影像四川省重点实验室四川南充637000湖北省宜昌市夷陵医院放射科湖北宜昌443100
1.川北医学院附属医院放射科(医学影像四川省重点实验室) (四川 南充 637000) 2.湖北省宜昌市夷陵医院放射科(湖北 宜昌 443100)
熊义富1,2张小明1杨 林1闵旭立1 彭 娟1杨 科1
肝细胞肝癌多层螺旋CT征象与肿瘤血管生成相关性的研究*
1.川北医学院附属医院放射科(医学影像四川省重点实验室) (四川 南充 637000) 2.湖北省宜昌市夷陵医院放射科(湖北 宜昌 443100)
熊义富1,2张小明1杨 林1闵旭立1彭 娟1杨 科1
目的 探讨肝细胞肝癌(Hepatocellular carcinoma, HCC)的多层螺旋CT(Multislice computed tomography, MSCT)征象与肿瘤血管生成的相关性。方法 运用免疫组织化学Elivison法检测41例HCC组织缺氧诱导因子-1α(Hypoxia-inducible factor-1α, HIF-1α)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)的表达及微血管密度(Microvessel density, MVD)。所有病例术前均行MSCT平扫及增强扫描。结果 HIF-1α、VEGF表达及MVD值在瘤体直径≤5cm组和>5cm组的差异均无统计学意义(P>0.05);在边缘假包膜欠完整或无假包膜组和假包膜完整组、侵袭转移高危组和侵袭转移低危组、以及动脉供血和双重供血组的差异均有统计学意义(P<0.05)。结论 HCC的MSCT征象与HIF-1α、VEGF表达及MVD值密切相关;MSCT征象可以反映HCC病理及生物学特性。
肝细胞癌;多层螺旋CT;微血管密度;缺氧诱导因子-1α
肝细胞肝癌(Hepatocellular carcinoma, HCC)是人体常见的富血供实体恶性肿瘤之一,其肿瘤血管生成伴随着肿瘤形成、生长和转移的全过程[1],并影响其预后。肿瘤血管生成促进因子如缺氧诱导因子-1α(Hypoxia-inducible factor, HIF-1α)、血管内皮生长因子(Vascular endothelial growth factor, VEGF)与肿瘤血管生成密切相关[2-4]。MSCT能够有效评价肿瘤血管生成[5-7]。研究肝癌的MSCT征象与HIF-1α、VEGF表达及肿瘤微血管密度(microvessel density MVD)值的关系,对提高HCC的诊治水平具有重要的意义。
1 材料与方法
1.1 临床资料收集我院手术切除并经病理证实的HCC标本41例,其中,男33例,女8例,年龄28~67岁,平均52.0岁。所有病例均未进行化学、介入等抗肿瘤治疗,术前均行CT平扫及多期增强扫描。肿瘤最大径平均6.8cm。术后所有标本均经10%中性缓冲福尔马林固定,常规石蜡包埋,行连续切片,疫组化染色。
1.2 免疫组织化学染色采用Elivison法进行免疫组化染色。HIF-1α、VEGF阳性判定及MVD计数参照文献[8-12]。
1.3 MSCT扫描参照文献[13]采用Aquilion16 16层螺旋CT机进行MSCT扫描,观察癌灶大小、假包膜类型、侵袭转移、强化类型等影像指标。
1.4 统计学分析应用统计软件包SPSS13.0进行统计处理。计量资料采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
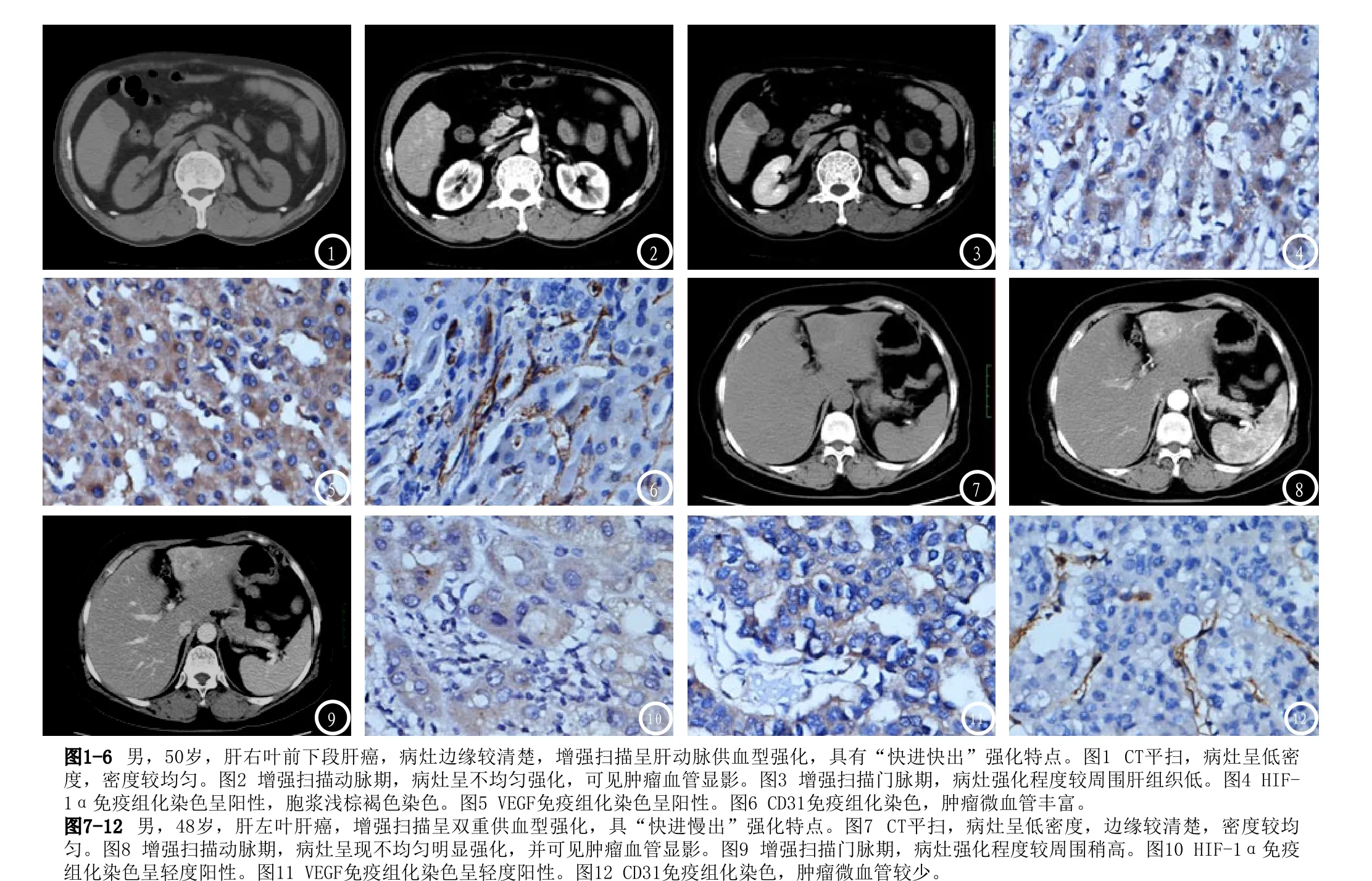
本组41例HCC中,肿瘤直径≤5cm者15例,>5cm者26例;具有较完整假包膜者14例,假包膜不完整或无假包膜27例;侵袭转移21例;伴有肝硬化30例;MSCT增强扫描:肝动脉供血型26例,占63.4%(26/41),肝动脉和门静脉双重供血型11例,占26.8%(11/41),少血供型4例,占9.8%(4/41)。HIF-1α阳性表达34例,阳性率82.9%;VEGF阳性表达33例,阳性率80.5%;MVD平均值41.0±20.2。HIF-1α、VEGF表达及MVD值在瘤体直径≤5cm组和>5cm组的差异均无统计学意义(P>0.05);在边缘假包膜欠完整或无假包膜组和假包膜完整组、侵袭转移高危组和侵袭转移低危组、以及动脉供血和双重供血组的差异均有统计学意义(P<0.05)(表1)(图1-12)。
本组仅收集到少供血型4例,其HIF-1α、VEGF阳性表达率及MVD值分别为25.0%(1//4)、0.0%(0/4)和11.30±2.52,均分别低于动脉供血型与双重供血型两组。由于例数较少,未与前两组进行统计分析。
3 讨 论
3.1 HIF-1α/VEGF与肿瘤血管生成HCC属实体肿瘤,当肿瘤体积超过3mm3时,肿瘤内部即处于缺氧状态;缺氧细胞通过自身内源基因表达的变化来适应缺氧微环境,其中HIF-1是调节肿瘤细胞对缺氧反应的重要转录因子[14-16],HIF-1生理活性主要取决于α亚基的表达[17-19]。当细胞处于缺氧状态时,HIF-1α由于不能被羟化、泛素化而不能被降解,转运至核内与HIF-1β结合形成异二聚体HIF-1,然后同其他转录因子及辅助活化因子结合并与目的基因结合,转录激活包括VEGF及VEGF受体FLT-1和FLK-1等促血管生成因子在内的一系列目的基因,导致促血管生成因子失衡,开启血管生成“开关”,促进肿瘤新生血管生成,肿瘤从休眠静止期进入血管形成期[20,21]。熊义富等报道,在肝癌组织中,HIF-1α、VEGF表达及MVD值显著高于癌旁肝组织,提示HIF-1α及VEGF与肿瘤血管生成密切相关[10]。肿瘤血管生成增多,氧及营养物质供应充分,癌细胞生长活跃。新生血管基底膜不完整,肿瘤细胞更易进入血液循环系统,导致肿瘤发生侵袭和转移[22,23]。
3.2 HCC形态特征与HIF-1α/VEGF/MVD的关系本实验结果显示:(1)假包膜欠完整/无假包膜组HCC HIF-1α、VEGF表达率及MVD值高于假包膜完整组,原因可能是肿瘤缺氧程度较高和(或)范围较大,HIF-1α、VEGF高表达,诱导肿瘤血管生成较多,肿瘤呈侵润性快速持续生长,癌组织周围纤维结缔组织增生较少甚或无纤维结缔组织增生,CT扫描则肿瘤边缘不清。(2)侵袭转移高危组HIF-1α、VEGF表达率及MVD值均高于侵袭低危组,可能是在HCC快速进展过程中,缺氧肿瘤细胞HIF-1α、VEGF高表达,诱导了大量肿瘤新生血管生成,肿瘤新生血管由于为肿瘤输送氧及营养物质、增加了脱落的肿瘤细胞进入循环的机率、降低了肿瘤细胞穿透血管壁时的阻力、有助于肿瘤细胞脱落,从而导致肿瘤的侵袭、转移能力增强;HIF-1α、VEGF与肿瘤侵袭的生物学特性相关[22-25]。以上研究结果与文献一致。(3)李月明等研究研究表明HIF-1α和VEGF的表达与HCC的大小具有相关性[25]。本组结果显示:肿瘤直径≤5cm组、直径>5cm组HIF-1α、VEGF阳性表达和MVD值无显著差异。本研究结果与文献不一致,可能与以下因素有关:一般认为实体肿瘤细胞缺氧状态诱导了HIF-1α转录、表达,继而调控VEGF等一系列下游因子转录、翻译、活化,这些因子诱导肿瘤新生血管生成,促进肿瘤的生长;但是,由于肿瘤的异质性,肿瘤细胞分化、增殖并非均匀一致,部分肿瘤细胞增殖过快,肿瘤新生血管相对不足,导致这部分肿瘤细胞因氧及营养物质的缺乏而增殖降低乃至凋亡或坏死,从而限制了肿瘤的生长;部分肿瘤细胞呈高分化状态而增殖相对缓慢,该区域肿瘤生长速度较慢;肿瘤的大小取决于肿瘤细胞增殖速度与肿瘤新生血管生成速度之间的平衡状态、肿瘤细胞分化程度以及肿瘤生长时间等多种因素,HIF-1α、VEGF表达与肿瘤体积增长非直线相关;另外,本研究样本量较小,且肿瘤直径较大,分组上有偏倚,可能没有准确反映HCC大小与血管生成之间的关系。
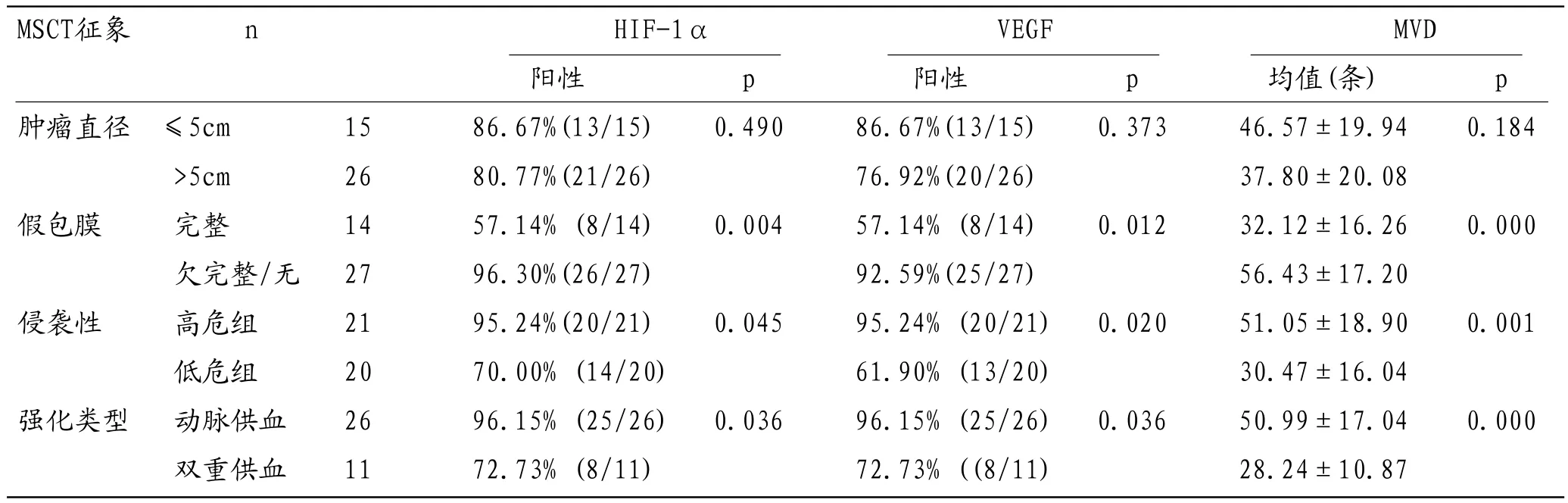
表1 肝细胞癌MSCT征象与HIF-1α/VEGF/MVD的关系
3.3 HCC强化类型与HIF-1α/VEGF及MVD的关系HCC由高分化到低分化的发展过程中,诱导血管生成的能力增强,新生血管的生成是HCC血供动脉化、多样化的关键环节,使HCC血供中动脉供血逐渐占主导,决定了HCC血供类型;动态多期MSCT增强扫描HCC动脉期强化主要受肿瘤血管生成影响,门脉期、平衡期强化主要与血管的通透性和血管外间隙有关[26]。HCC MSCT强化特点与促进HCC血管生成的HIF-1α、VEGF表达及反映HCC血管生成情况的MVD之间存在内在联系[27]。HCC病理分级、肿瘤血管的生成是HCC的MSCT强化特点的病理基础,HCC的MSCT强化特点反映肿瘤的血管病理生理改变,动脉供血占主导的低分化HCC在动脉期的强化程度要高于高分化的HCC[26]。
在本组病例中,动脉血供型HCC在动脉期可以看到肿瘤均匀/或不均匀明显强化或/和异常血管显影,CT值较平扫明显增高,门脉期肿瘤CT值迅速降低,肝动脉和门静脉双重血供型HCC强化持续时间较动脉供血型稍长,少血供型HCC增强扫描不强化。本组资料显示,免疫组化显示肝动脉供血型和肝动脉与门静脉双重供血型的HCC中HIF-1α与VEGF的阳性表达率及MVD值有显著性差异,少血供型HCC中HIF-1α与VEGF的阳性表达率及MVD值均依次低于动脉供血型和肝动脉与门静脉双重供血型(由于病例数较少,未进行统计分析),提示肿瘤通过HIF-1α、VEGF表达,诱导大量微血管生成并动脉化而血供丰富,增强扫描动脉期HCC明显强化;HIF-1α与VEGF表达对HCC富血供化起重要作用,影响MSCT动态增强扫描HCC强化特点;MSCT动态增强扫描HCC强化特点能够反映肿瘤新生血管情况及HIF-1α与、VEGF等肿瘤血管生成相关因子的表达。
综上所述,HCC的MSCT征象与HIF-1α、VEGF表达及MVD值密切相关,表明MSCT征象可以反映HCC肿瘤血管生成。
[1] Weidner N. Tumoural vascularity as a prognostic factor in cancer patients: the evidence continues to grow[J]. Pathol. 1998, 184(2): 119-122.
[2] 陈红,郭长义,杨林,等.肝细胞癌弥散加权成像与肿瘤血管生成的相关性.中国CT和MRI杂志[J].2014,12(2): 66-70.
[3] Xu JM, Weng MZ, Song FB, et al. Blockade of the cxcr6 signaling inhibits growth and invasion of hepatocellular carcinoma cells through inhibition of the VEGF expression. Int J Immunopathol Pharmacol. 2014,27(4): 553-561.
[4] Yao DF, Jiang H, Yao M, et al. Quantitative analysis of hepatic hypoxia-inducible factor-1alpha and its abnormal gene expression during the formation of hepatocellular carcinoma[J]. Hepatobiliary Pancreat Dis Int. 2009, 8(4): 407-413.
[5] 杨林,张小明,周翔平,等.兔VX2肝癌血流灌注的MDCT灌注成像评价[J].当代医学.2009,15(23):464-467.
[6] 杨林,张小明,董国礼,等.肝细胞癌血流灌注与血管内皮生长因子的相关性.中国CT和MRI杂志[J].2010,8(2): 22-24.
[7] 解云川,周翔平,周桥,等.原发性肝细胞癌螺旋CT血供分型与血管内皮生长因子表达水平的相关性研究[J].四川大学学报(医学版). 2006,37(2):274-277.
[8] 郑青平,陈龙华,石玉生,等.肝癌组织VEGF、HIF-1α和MMP-2表达的临床研究[J].广西医学.2008, 30(03): 308-311.
[9] 郑立,孙嵩洛.HIF-1α与VEGF在肝细胞肝癌中的表达及其临床意义[J].河南大学学报(医学版). 2007, 26(03): 40-42.
[10]熊义富,李丽,徐浩,等.HIF-1α/ VEGF在肝细胞癌的表达及其与肿瘤血管生成的关系.川北医学院学报.2013,28(6):530-533.
[11]姚红霞.肝细胞癌螺旋CT征象与MVD及VEGF表达间关系的研究.临床放射学杂志.2010,29(05): 611-615.
[12]Hu X, Xing L, Wei X, et al. Nonangiogenic function of VEGF and enhanced radiosensitivity of HeLa cells by inhibition of VEGF expression [J]. Oncol Res. 2012,20 (2-3): 93-101.
[13]杜勇,兰鹰,周华藻,等.螺旋CT肝脏动态扫描技术参数的选择[J].川北医学院学报. 1999, 14(03):58-60.
[14]Pan K, Luo F, Liu X, et al. The inhibition of VEGF expression induced by HIF-1alpha RNA interference[J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi. 2007, 24(5): 1133-1136.
[15]张鹏华,陈兰英.低氧诱导因子-1的转录活性调控及其信号传导[J].生物化学与生物物理进展. 2002, 29(06): 863-867.
[16]Pyr dRS, Delaive E, Demazy C, et al. Identification of DH IC-2 as a HIF-1 independent protein involved in the adaptive response to hypoxia in tumor cells: A putative role in metastasis[J]. Biochim Biophys Acta. 2009, 1793(11): 1676-90.
[17]郑立,刘超,胡军红.IGF-1、HIF-1a在肝细胞肝癌中的表达及其临床意义.中国误诊学杂志[J].2007, 7(30): 7227-7229.
[18]Takahashi Y, Nishikawa M, Takakura Y. Inhibition of tumor cell growth in the liver by RNA interference-mediated suppression of HIF-1alpha expression in tumor cells and hepatocytes[J]. Gene Ther. 2008, 15(8): 572-82.
[19]Bao B, Ahmad A, Kong D, et al. Hypoxia induced aggressiveness of prostate cancer cells is linked with deregulated expression of VEGF, IL-6 and miRNAs that are attenuated by CDF[J]. PLOS ONE. 2012, 7(8): e43726.
[20]李月明,姚登福.缺氧诱导因子-1分子组成、活化机制及肝癌靶向治疗[J].世界华人消化杂志. 2008, 16(27): 3070-3076.
[2 1]H a r p e r J, M o s e s M A. Molecular regulation of tumor angiogenesis: mechanisms and therapeutic implications[J]. EXS. 2006, (96): 223-68.
[22]朱争艳,杜智,齐之丽,等.应用组织微阵列技术检测肝癌中血管内皮生长因子及P16和P53的表达及意义[J].中华肝胆外科杂志.2004, 10(03): 40-42.
[23]Pluda JM. Tumor-associated angiogenesis: mechanisms, clinical implications, and therapeutic strategies[J]. Semin Oncol. 1997, 24(2): 203-218.
[24]To M, Yamamura S, Akashi K, et al. Defect of adaptation to hypoxia in patients with COPD due to reduction of histone deacetylase 7[J]. Chest. 2012, 141(5): 1233-1242.
[25]李月明,姚登福,姜华,等.肝癌组织中HIF-1α的表达与HIF-1α mRNA的扩增分析[J].胃肠病学和肝病学杂志. 2009, 18(04): 327-331.
[26]杨军妍.肝细胞性肝癌VEGF、PLGF的表达与螺旋CT增强征象的关系的研究[D].大连医科大学硕士论文.2010-04-01.
[27]常宏,穆庆岭,靖昌庆.VEGF与MMP-2在肝细胞肝癌中的表达及其临床意义.山东医药[J].2003,43(27): 14-15.
(本文编辑: 张嘉瑜)
A Study of the Correlation between the Features of Multislice Computed Tomography and Angiogenesis in Hepatocellular Carcinomas*
XIONG Yi-fu1,2, ZHANG Xiao-ming1, YANG Lin1,et al., 1 Department of Radiology, Sichuan Key Laboratory of Medical Imaging, the Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, China; 2 Department of Radiology, Yichang Yiling Hospital, Yichang 443100, China
Objective To explore the correlation between multislice computed tomography (MSCT) features and angiogenesis in hepatocellular carcinoma (HCC).Methods Fortyone cases of surgically excised HCC tissue samples that were pathologically diagnosed were analyzed by Elivisonimmunohistochemistry to detect the expression of hypoxiainducible factor-1α (HIF-1α) and vascular endothelial growth factor (VEGF) and assess microvessel density (MVD). All of the patients were preoperatively examined with plain and enhanced CT.Results The differences of positive expression rates of HIF-1α and VEGF and the MVD values in HCC with a tumor diameter ≤ 5cm and >5 cm were not statistically significant (P>0.05). The positive expression rates of HIF-1α and VEGF and the MVD values in tumors with ruptured pseudocapsules or without pseudocapsules, a high risk of metastasis and invasion, and arterial blood were higher than those in tumors with intact capsules, a low risk of metastasis and invasion, and double blood supply, the group differences were statistically significant(P<0.05).Conclusion MSCT manifestations of HCC with HIF-1 alpha, closely related to the expression of VEGF and MVD value; MSCT signs can reflect HCC pathological and biological characteristics.
Hepatocellular Carcinoma; Multislice Computed Tomography; Hypoxiainducible Factor-1α; Vascular Endothelial Growth Factor; Microvessel Density
R814.42;R735.7
A
四川省科技厅项目(2008JY 0088-2);四川省教育厅重点项目(07ZA030)
10.3969/j.issn.1672-5131.2015.11.015
杨 林
2015-10-07
