黑曲霉发酵过程中菌体形态的分析方法建立及应用
2015-07-19唐文俊夏建业储炬庄英萍张嗣良
唐文俊,夏建业,储炬,庄英萍,张嗣良
黑曲霉发酵过程中菌体形态的分析方法建立及应用
唐文俊,夏建业,储炬,庄英萍,张嗣良
华东理工大学生物反应器工程国家重点实验室,上海 200237

唐文俊, 夏建业, 储炬, 等. 黑曲霉发酵过程中菌体形态的分析方法建立及应用. 生物工程学报, 2015, 31(2): 291–299.Tang WJ, Xia JY, Chu J, et al. Development and application of morphological analysis method in Aspergillus niger fermentation. Chin J Biotech, 2015, 31(2): 291–299.
丝状真菌 (Filamentous fungi) 的发酵生产通常具有较高的工业应用价值,但其菌体形态是一个区别于其他非丝状菌的一个重要发酵指标。针对目前形态分析的瓶颈,本研究使用琼脂糖凝胶对黑曲霉菌形进行固定,利用平板实现菌球样本的大量制备,并结合图形处理软件自建自动化处理程序,实现了大量准确可靠的菌体形态参数的获得,大大增加了形态数据处理通量及准确度。应用该方法于黑曲霉发酵生产糖化酶过程中不同供氧水平及剪切水平下菌体形态的研究,通过大量形态数据定量阐明了黑曲霉在不同剪切水平下的分区域形态分布特性,为进一步工业过程的形态优化提供了重要的研究方法。
黑曲霉,菌体形态,图形分析,形态控制
丝状真菌 (Filamentous fungi) 是一类被广泛应用于工业生物过程的微生物,其中黑曲霉由于具有较高的代谢活性及产物分泌能力而成为一个典型,被应用于各种内源及外源产物的生产,例如有机酸、酶、抗体等的生产[1]。
然而,丝状真菌的液体培养往往伴随着高度非牛顿特性以及菌体形态的变化,其中菌体形态的变化不仅仅较难检测及控制,并且其变化会伴随着发酵液流变特性、传质特性及混合特性的变化[2]。通常来说,丝状真菌的形态可以分为分散菌丝 (Dispersed mycelia)、聚集成簇 (Clumps)、成团结球 (Dense pellets) 三类[3]。对于不同的黑曲霉发酵最终产物,往往有着不同的最佳菌体形态。例如,对于发酵生产糖化酶 (Glucoamylase),通常认为菌球是最优的过程形态,而对于柠檬酸的发酵生产则更多地偏向菌丝形态[4-5]。
对于菌体形态的控制往往也是发酵过程中的一个难点。目前有文献报道的影响菌体形态的因素包括接种量、接种方式、培养基组分、溶氧水平、环境pH、温度、搅拌转速、发酵罐规模、发酵罐形式、搅拌形式与功率输入等[3,6-11]。与其他离线参数不同,形态参数由于其特殊性,需要有大量的数据支撑才能获得较为合理可信的结果。然而,菌形数据的获取往往需要跨学科的图形分析技术,加之样品制备的困难,最终导致了菌形数据差异性较大、相对偏差较大,难以进行准确的定量分析[12]。
为了解决菌形数据获取的困难与菌形数据重要性的矛盾,本文就丝状真菌发酵过程中的菌体形态建立了大样本的样品制备方法和自动图形分析方法,大大增加图形分析的效率以及数据可信度。本文应用该方法对黑曲霉在不同搅拌水平与耗氧水平下的形态分布进行了研究,为今后菌体形态的研究提供了技术手段。
1 材料与方法
1.1 菌株
本文使用作为研究菌株。
1.2 培养基组分
固体培养基:固体土豆培养基 (CM0139,Oxoid,UK)
发酵培养基:45.1 g/L 一水葡萄糖,10 g/L 麦芽糖糊精,0.1 g/L CaCl2·2H2O,1.0 g/L MgSO4·7H2O,2 g/L柠檬酸,3 g/L (NH4)2SO4,3 g/L KH2PO4,1.5 g/L NaH2PO4·H2O,0.04 g/L MnSO4·H2O,0.02 g/L ZnCl2,0.015 g/L CuSO4·5H2O,0.015 g/L CoCl2·6H2O,0.3 g/L FeSO4·7H2O。
补料培养基:同发酵培养基,其中一水葡萄糖浓度增加为163.9 g/L。
1.3 主要仪器及软件
5 L高级生物反应器 (上海国强生化工程技术有限公司),AE2000倒置显微镜 (Motic),5DMarkII数码单反相机 (Canon),Image-Pro Plus v6.0 (Media Cybernetics)。
1.4 发酵培养
使用固体土豆培养基富集孢子。孢子使用灭菌超纯水洗入无菌摇瓶,使用血球计数板技术。最终接种浓度为105个/mL。
反应器发酵采用平行发酵,对于不同耗氧水平研究固定转速为400 r/min,分别通入含氧气20%、40%、60%的富氧空气;对于不同转速进行考察,固定转速分别为300 r/min、450 r/min、500 r/min和600 r/min。发酵周期均为144 h。
1.5 菌丝观察
选取与菌球分离的菌丝样品,稀释后使用乳酸酚棉兰染剂进行染色,染色后直接观察。
1.6 自动菌球形态分析方法的建立
1.6.1 取样与形态固定化
固定剂由40% (/) 甲醛与60% (/) 乙醇组成,取1 mL固定剂并与样品1∶1体积混合后于4 ℃保存。固定剂中的甲醛及乙醇成分可以灭活菌体,停止胞内的代谢反应。避免由于菌体继续生长或死亡自溶而对形态分析结果产生影响[13]。
1.6.2 样品分离、洗涤与稀释
取一定量样品,稀释至10 mL。静置5 min使菌球与菌丝结构分离。小心吸取上部菌丝样品,重新加入去离子水多次洗涤。重复4−5次后可获得较为纯净菌球样品。最终定容体积5 mL。
1.6.3 菌球拍摄
将菌球与菌丝样品分别小心倒至一次性平皿中。配置20 mL 0.5% (/) 琼脂糖凝胶溶液,加热至溶液呈完全透明。将琼脂糖凝胶倒入菌球与菌丝样品中,覆盖全部平板并立即将其混合均匀。静置于室温中直至完全凝固。由于琼脂糖凝胶凝结后呈浅白色,因此凝胶层不宜太厚,以覆盖平板为准。
对于菌球样品,首先使用数码相机对整个平皿进行拍摄,用于菌球浓度计算。其后使用倒置显微镜对单个固定的菌球进行拍摄,用于菌球结构分析。
对于菌丝样品,则使用倒置显微镜对菌丝团进行拍摄,用于菌丝结构分析。
1.6.4 自动化图形分析与数据输出
本文的图形分析及数据输出全部使用Image Pro Plus v6.0 (Media Cybernetics, Singapore) 软件。
菌球浓度统计:利用标尺预先确定拍摄照片的像素点与实际长度比例。调用“Contrast enhancement”手动调节对比度,增加菌球与背景的差异性。随后调用“Segmentation”,选择“HIS”方式。通过调整合适的亮度阈值进行二值化,使菌球与背景分别呈全白色与全黑色。最后利用“Count/Size”工具统计后得到菌球直径 (Marco-D) 以及菌球个数 (N)。
菌球结构分析:利用显微测微尺预先确定拍摄照片的像素点与实际长度比例。利用“Best fit equalization”对全图进行自动优化。在“Segmentation”中选择HSI设置合适的亮度阈值进行二值化,将识别对象标记为白色,背景标记为黑色。最后同样利用“Count/Size”设置所需参数,进行统计。通常的统计参数包括菌球直径 (Micro-D)、菌球核心直径 (Core-D)、菌球投影面积 (A)、圆形度 (R) 等。
Image Pro-Plus软件可以将过程中所有的操作记录为函数进行调用,函数语法为Basic。在确定图形处理过程中参数值后,可以利用函数编辑分析所用函数,形成宏代码,并嵌套于循环中可以实现自动连续的图形处理及数据输出。循环部分的代码如下:
Dim numDocs As Integer
Dim i As Integer
ret= IpDocGet (GETNUMDOC,0,numDocs)
For i=0 To numDocs-1
......
Next i
1.6.5 形态参数定义
不同形态参数的定义包括于表1与表2内。这里归纳的参数大都为直接参数,即可以直接由Image Pro Plus给出。其中Filamentous Length (Fl) 与Filamentous Ratio (Fr) 是衡量菌球结构主要的参数,与菌球的比表接触面积及产物产量直接关联。而Growth Rate (G) 则可以用于表述菌丝的生长活性,表征了丝状真菌在反应器内的老化程度。

表1 常规菌球形态参数

表2 常规菌丝形态参数
2 结果与分析
2.1 方法比较
传统的菌形观察方式较为简易,主要流程包括:1) 取样后稀释;2) 选取单个菌球于载玻片;3) 烘烤定型;4) 显微观察并拍摄。
其中可能包括的问题有:1) 没有灭活步骤,样品会因为持续的代谢反应发生形态变化;2) 针对单个菌球进行操作,可能由于操作原因造成菌球结构被改变或破坏;3) 较为极端的定型方式 (烘烤),会导致菌丝及菌球结构发生变化;4) 单个载玻片上可以准备的样品量有限,对于单个取样点需要花费较长的时间处理。其中1)和4) 可以通过取样后立即测定及花费更多精力得以克服,但2) 和3) 会对整个菌形分析结果产生不可逆的影响。
如图1所示,传统烘烤方法制作的菌球样品,其菌丝结构因烘烤而收缩卷曲,失去了原有的形态特征。同时,相较于琼脂糖固定法,烘烤法得到的菌球结构干瘪,已经无法得到其原有的菌球半径,只能以变形后的圆半径作为近似值。从图2中可以看出,对于同一条件下的菌球样本,烘烤法获得的菌球直径略大于琼脂糖固定法,这可能就是由于采用圆半径而非球半径而产生的误差。
对于一个菌球样本来说,由于在其发酵过程中菌球的直径分布并不均一,因此需要有足够的样本点来获取可信的菌球结构信息。从图2中可以发现,当仅以5或10个菌球为参考时,其半径分布范围较大 (在图中表现为较大的误差线),而在获取50及更多菌球样本后可以发现其统计值已经逐渐稳定。因此,对于一个取样点,需要至少50个菌球样本以获取该点的平均菌球结构信息。
本文建立的琼脂糖凝胶固定法,相比传统的烘烤法不仅通过对整个样品进行统一操作,固定立体菌球结构,解决了传统烘烤法中存在的问题,同时可以一次性制备200甚至更多的菌球样本,大大地降低了在样品制备及预处理过程中所花费的时间及人力。加之自动化图形分析的应用,使得整个图形分析的通量大大增加,从而使得菌球形态的分析更为高效、准确。
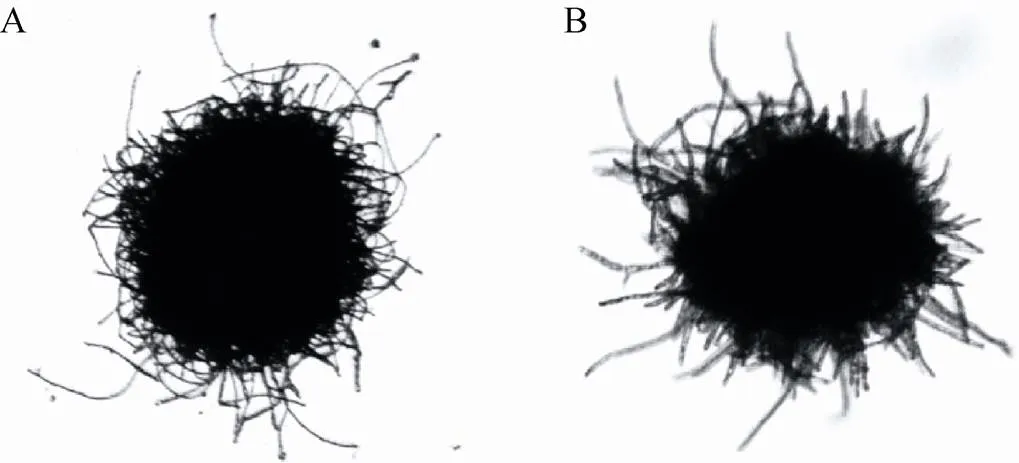
图1 不同预处理方法下微观菌球结构对比
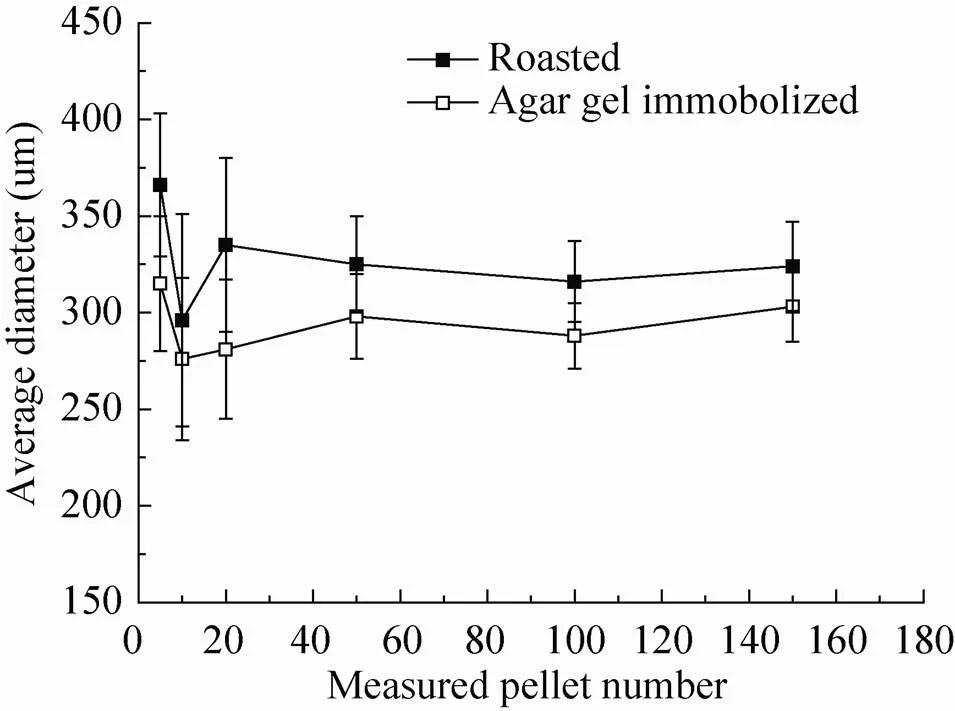
图2 不同预处理方法及菌球测定次数对于菌形定量数据的影响(实心:烘烤法,空心:琼脂糖固定法)
2.2 菌形分析实例1:不同耗氧条件下黑曲霉形态变化
在5 L搅拌式生物反应器中,控制搅拌速率恒定,调节进气中不同氧气比例[14-16]可以严格地考察供氧对于菌球形态的影响。不同的菌体形态会显著地影响发酵液流变特性,影响罐体的混合及传氧特性[17-19]。
每个供氧水平选取100个以上菌球进行定量图形分析,获取菌球核心半径与菌球外菌丝长度,结果如图3所示,其中的误差线代表菌球半径及外围菌丝长度的分布范围。可以看出,菌球在不同供氧条件下其核心平均半径均为90 μm左右,其外围的菌丝长度也较为一致,为125 μm左右。这是由于在较大的菌球中,处于核心部分的菌体会由于缺乏足够的氧气及底物而发生菌体自溶,使菌球分散为数个较小的菌球。有文献报道氧气在菌球中传递的临界长度为50−75 μm[20],这与我们观测到的平均半径相一致。
测定不同供氧水平下的糖化酶酶活,发现最终的效价随供氧的增加而增加,说明糖化酶的合成在此阶段受到供氧的限制。作为一种典型的分泌型酶,糖化酶的合成需要大量的ATP用于合成氨基酸、肽键及蛋白折叠。这可能是不同供氧条件下糖化酶产量差异的主要原因。但是通过计算糖化酶相对底物及氧气的得率,发现其并没有明显区别。
最终结果表明,不同供氧水平下黑曲霉形态没有发生明显变化,其产酶效率并没有明显提高。

图3 不同供氧水平下菌球半径与菌球外菌丝长度分布
2.3 菌形分析实例2:不同转速条件下黑曲霉形态变化
从不同供氧条件下黑曲霉形态变化的结果中我们可以知道,供氧水平对于菌体形态的影响非常有限。因此,忽略搅拌过程中的不同供氧水平,设计不同的搅拌强度来模拟不同的剪切环境下菌球形态的分布情况。
图4表现了在相同接种条件但搅拌水平不同的情况下黑曲霉菌球形态的分布。通过对大量菌球样本进行定量分析,可以看到其分布与搅拌转速相关的明显区域性分布,菌球核心半径与菌球外菌丝比例均随剪切水平的增加而明显降低。在最低的剪切强度下,菌球半径的分布较为分散 (表现为较大的误差线),最大的菌球核心半径达到300 μm,并且其菌球外菌丝长度在150−250 μm之间。在逐步增加转速的过程中,可以发现菌球的半径及外围菌丝长度分布趋于集中。在600 r/min时,其平均外围菌丝长度仅为75 μm,菌球半径普遍小于100 μm。造成这一形态分布特征的主要原因是丝状真菌的菌球直径与流场中形成的小涡在长度尺度上相一致[21],因此小涡的剪切作用在丝状真菌上体现得更为明显。而更小的细菌或者酵母则不易受到小涡的影响。
将产酶期不同时间点黑曲霉的菌体形态相比较 (图5),可以发现其菌球半径有一个明显的生长过程,但外围的菌丝长度却没有发生变化。由于其核心半径的增加,外围菌丝的比表接触面积也相应增加,理论上有利于糖化酶的合成与分泌。然而,发酵中后期的菌丝出现明显的老化,表现为组成菌球的菌丝结构变细、不易染色 (图6),此时单位菌体的酶合成能力明显降低。因此,对于菌形的分析不能仅仅局限于对于图形数据的理解,同时还需要考虑菌体作为细胞的生长特性,才能实现真正的发酵优化及放大[22-23]。最终最佳控制转速为450 r/min,总产量比最低的300 r/min批次提高了65.66%。在最优的菌球形态下底物得率提高了37.53%,在96 h达到最高比产物形成速率。
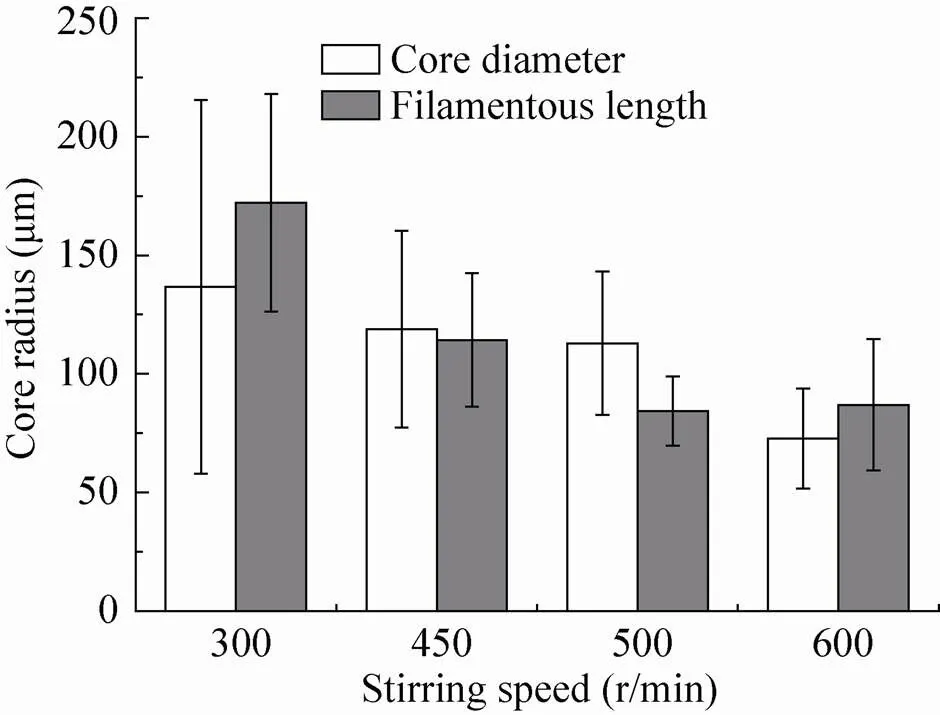
图4 不同剪切水平下黑曲霉菌球半径与菌球外菌丝长度分布
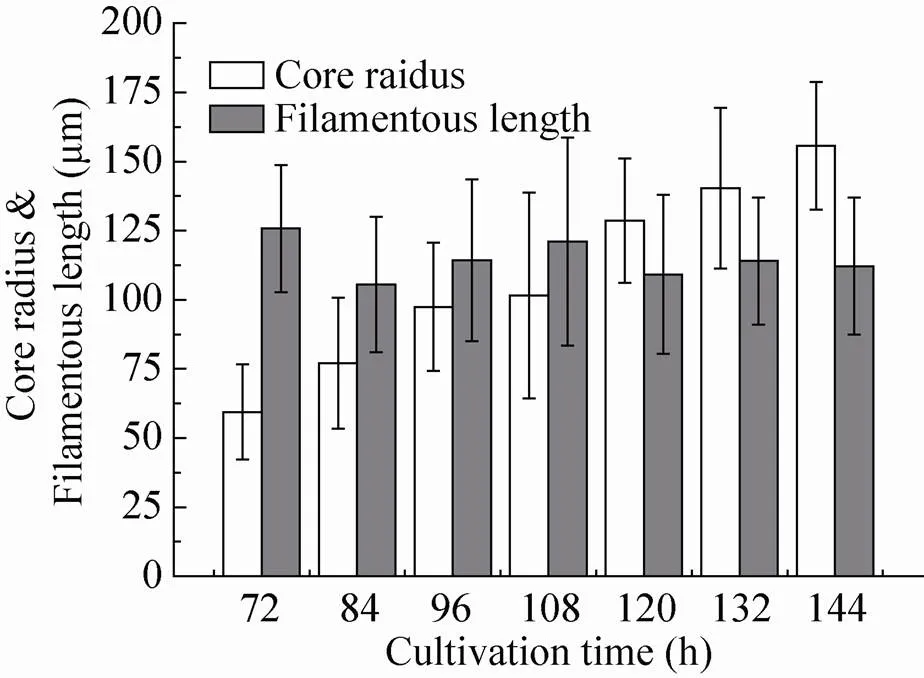
图5 450 r/min转速下不同阶段菌球半径与菌球外菌丝长度分布

图6 不同发酵周期菌丝形态对比
3 讨论
菌球形态数据的收集及处理是目前形态学研究的一个重点,在发酵过程中获取大量且准确的丝状真菌的菌体形态数据是实现形态控制及发酵液流变特性控制的一个前提条件[6-7,24-25]。本文建立的琼脂糖凝胶固定法实现了对于立体菌球结构的固定,相较于原始的载玻片法不仅仅减小了样品处理过程中所引入的误差,大大增加了样品处理的通量,结合自建的图形分析程序,使得短时间内获取真实可靠的形态分布数据成为可能。
通过大量形态数据的分析,我们发现在黑曲霉产糖化酶的发酵过程中,其形态主要受到搅拌带来的剪切输入的影响。过低的剪切会使得菌球的直径分布过于分散、形态不一,增加了生物过程的不均一性。剪切的逐步增加一方面缩小了菌球直径的分布范围,另一方面也减小了菌球外菌丝的长度。通过控制其剪切水平在一个合理的范围内可以确保丝状真菌形成大小及比表接触面积都较为合适的菌球结构。今后的研究将以此为基础,探明在工业规模发酵生产过程中不均一的剪切分布流场对于黑曲霉发酵形态的影响,结合CFD模型优化工业规模发酵过程。
REFERENCES
[1] Archer DB, Peberdy JF. The molecular biology of secreted enzyme production by fungi. Crit Rev Biotechnol, 1997, 17(4): 273–306.
[2] Yu L, Chao Y, Wensel P, et al. Hydrodynamic and kinetic study of cellulase production bywith pellet morphology. Biotechnol Bioeng, 2012, 109(7): 1755–1768.
[3] Metz B, Kossen NWF. The growth of molds in the form of pellets–a literature review. Biotechnol Bioeng, 1977, 19(6): 781–799.
[4] Xu J, Wang L, Ridgway D, et al. Increased heterologous protein production infermentation through extracellular proteases inhibition by pelleted growth. Biotechnol Prog, 2000, 16(2): 222–227.
[5] Rinas U, El-Enshasy H, Kleine J. Agitation effects on morphology and protein productive fractions of filamentous and pelleted growth forms of recombinant. Process Biochem, 2006, 41(10): 2103–2112.
[6] Papagianni M. Fungal morphology and metabolite production in submerged mycelial processes. Biotechnol Adv, 2004, 22(3): 189–259.
[7] Krull R, Cordes C, Horn H, et al. Biosystems engineering II: linking cellular networks and bioprocesses//Advances in Biochemical Engineering-Biotechnology. Berlin: Springer- Verlag, 2010: 1–21.
[8] Cui YQ, Van Der Lans RGJM, Luyben KCAM. Effect of agitation intensities on fungal morphology of submerged fermentation. Biotechnol Bioeng, 1997, 55(5): 715–726.
[9] Seviour RJ, Gibbs PA, Schmid F. Growth of filamentous fungi in submerged culture: Problems and possible solutions. Crit Rev Biotechnol, 2000, 20(1): 17–48.
[10] Liu H, Wang P, Gong GH, et al. Morphology engineering ofby RNA silencing of chitin synthase gene. Biotechnol Lett, 2013, 35(3): 423–429.
[11] Xie MH, Xia JY, Zhou Z, et al. Power consumption, local and average volumetric mass transfer coefficient in multiple-impeller stirred bioreactors for xanthan gum solutions. Chem Eng Sci, 2014, 106(17): 144–156.
[12] Barry DJ, Williams GA. Microscopic characterization of filamentous microbes: towards fully automated morphological quantification through image analysis. J Microsc, 2011, 244(1): 1–20.
[13] Barry DJ, Chan C, Williams GA. Morphological quantification of filamentous fungal development using membrane immobilization and automatic image analysis. J Ind Microbiol Biot, 2009, 36(6): 787–800.
[14] Amanullah A, Blair R, Nienow AW, et al. Effects of agitation intensity on mycelial morphology and protein production in chemostat cultures of recombinant. Biotechnol Bioeng, 1999, 62(4): 434–446.
[15] Justen P, Paul GC, Nienow AW, et al. Dependence ofgrowth, morphology, vacuolation, and productivity in fed-batch fermentations on impeller type and agitation intensity. Biotechnol Bioeng, 1998, 59(6): 762–775.
[16] Justen P, Paul GC, Nienow AW, et al. A mathematical model of agitation-induced fragmentation of. Bioprocess Eng, 1998, 18(1): 7–16.
[17] Garcia-Ochoa F, Gomez E. Bioreactor scale-up and oxygen transfer rate in microbial processes: An overview. Biotechnol Adv, 2009, 27(2): 153–176.
[18] Kemblowski Z, Kristiansen B. Rheometry of fermentation liquids. Biotechnol Bioeng. 1986, 28(10): 1474–1483.
[19] McNeil B, Harvey LM. Viscous Fermentation Products. Crit Rev Biotechnol, 1993, 13(4): 275–304.
[20] Rinas U, El-Enshasy H, Emmler M, et al. Model-based prediction of substrate conversion and protein synthesis and excretion in recombinantbiopellets. Chem Eng Sci, 2005, 60(10): 2729–2739.
[21] Yeoh SL, Papadakis G, Yianneskis M. Numerical simulation of turbulent flow characteristics in a stirred vessel using the LES and RANS approaches with the sliding/deforming mesh methodology. Chem Eng Res Des, 2004, 82(7): 834–848.
[22] Chu J, Li YR. The Control of Modern Industrial Fermentation. Beijing: Chemical Industry Press, 2006: 41–50 (in Chinese).储炬,李友荣. 现代工业发酵调控学: 化学工业出版社, 2006: 41–50.
[23] Zhang SL, Chu J. Multi-Scale Microbial Process Optimization. Beijing: Chemical Industry Press, 2003: 110–138 (in Chinese).张嗣良,储炬. 多尺度微生物过程优化: 化学工业出版社, 2003: 110–138.
[24] Wucherpfennig T, Kiep KA, Driouch H, et al. Morphology and rheology in filamentous cultivations. Adv Appl Microbiol, 2010, 72: 89–136.
[25] Metz B, Kossen NWF, Suijdam JC. The rheology of mould suspensions//Advances in Biochemical Engineering. Berlin: Springer Berlin Heidelberg, 1979: 103–156.
(本文责编郝丽芳)
Development and application of morphological analysis method infermentation
Wenjun Tang, Jianye Xia, Ju Chu, Yingping Zhuang, and Siliang Zhang
State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China
Filamentous fungi are widely used in industrial fermentation. Particular fungal morphology acts as a critical index for a successful fermentation. To break the bottleneck of morphological analysis, we have developed a reliable method for fungal morphological analysis. By this method, we can prepare hundreds of pellet samples simultaneously and obtain quantitative morphological information at large scale quickly. This method can largely increase the accuracy and reliability of morphological analysis result. Based on that, the studies ofmorphology under different oxygen supply conditions and shear rate conditions were carried out. As a result, the morphological responding patterns ofmorphology to these conditions were quantitatively demonstrated, which laid a solid foundation for the further scale-up.
, fungal morphology, image analysis, process control
April 22, 2014; Accepted:July 4, 2014
Ju Chu. Tel: +86-21-62453021; E-mail: juchu@ecust.edu.cn
Supported by:Specialized Research Fund for the Doctoral Program of Higher Education (No. 20110074110015).
高等学校博士学科点专项科研基金(No. 20110074110015) 资助。
网络出版时间:2014-08-20
http://www.cnki.net/kcms/doi/10.13345/j.cjb.140240.html
