高通量筛选具有催化活性和立体选择性羰基还原酶
2015-07-19张航陈曦冯进辉鲍锦库吴洽庆朱敦明
张航,陈曦,冯进辉,鲍锦库,吴洽庆,朱敦明
高通量筛选具有催化活性和立体选择性羰基还原酶
张航1,陈曦2,冯进辉2,鲍锦库1,吴洽庆2,朱敦明2
1 四川大学生命科学学院生物资源与生态环境教育部重点实验室,四川成都 610064 2 中国科学院天津工业生物技术研究所工业酶国家工程实验室天津市生物催化技术工程中心,天津 300308

张航, 陈曦, 冯进辉, 等. 高通量筛选具有催化活性和立体选择性羰基还原酶.生物工程学报, 2015, 31(2): 220–230.Zhang H, Chen X, Feng JH, et al. High throughput screening of active and stereoselective carbonyl reductases. Chin J Biotech, 2015, 31(2): 220–230.
根据羰基还原酶催化可逆氧化还原反应的原理,利用与偶氮还原酶催化偶氮染料还原反应耦合的颜色变化,建立了一种新的羰基还原酶筛选方法。由于羰基还原酶在催化醇底物氧化反应时会产生NAD(P)H,当在反应体系中加入偶氮还原酶AzoB和偶氮染料金橙Ⅰ的时候,偶氮还原酶可以利用NAD(P)H作为电子的供体与底物金橙Ⅰ发生反应,导致反应体系颜色的变化,这样就能够根据明显的颜色变化推断出该羰基还原酶是否对所选底物表现出特定的活性,进而可以筛选出有活性的羰基还原酶。同时,使用不同构型的手性醇作为底物时,根据体系的颜色变化,可以实现羰基还原酶的活性和立体选择性的同时筛选。
手性醇,羰基还原酶,偶氮还原酶,偶氮染料,筛选方法
手性醇是一类非常重要的化合物,广泛应用于药物研发、有机合成、材料科学、毒理学以及环境化学等众多领域。手性醇可以直接通过化学不对称催化和生物不对称转化相应的酮底物获得,能够实现手性醇合成的生物催化剂是羰基还原酶。羰基还原酶是氧化还原酶的一种,能够将酮还原为手性醇 (醛还原为一级醇) 或将手性醇氧化为酮 (一级醇氧化为醛)[1-3]。在氧化反应过程中,酶能够催化底物的氢转移至辅因子,生成还原态NAD(P)H。羰基还原酶的研究与应用已经有了飞速的发展,来源于酵母和马肝的羰基还原酶均有商品供应,可以像有机催化试剂一样购买。羰基还原酶在还原脂肪酮底物,特别是当羰基两边的取代基团相差不大时,表现出了化学催化剂不具有的高立体选择性。但是由于酶本身的特点,在催化一些非天然底物的时候会出现酶活性低,立体选择性差等问题。目前针对这些问题的解决方法主要是野生酶的大规模筛选以及酶的定向进化与改造,在此过程中,液相色谱(HPLC) 和气相色谱(GC) 是两种最常用的检测立体选择性的方法[4-8],但是这两种方法目前都无法对羰基还原酶的立体选择性实现高通量筛选。
偶氮染料一般具有明亮的颜色,偶氮还原酶是细菌降解偶氮染料的关键酶。一种偶氮还原酶可作用于一种或几种偶氮染料,它通过还原特定的偶氮染料的偶氮键而使染料的颜色褪去[9-11]。目前人们已经在许多细菌中发现了对氧不敏感的偶氮还原酶的基因,如球形芽胞杆菌ssp. OY1-2[12]、金黄色葡萄球菌[13]、大肠杆菌[14]、球形红细菌[15]、铜绿假单胞菌[16]以及粪肠球菌[17]等,并且已经克隆、表达与鉴定了很多基因。这些对氧不敏感的偶氮还原酶主要分为核黄素依赖型偶氮还原酶和非核黄素依赖型偶氮还原酶两类[18]。B是从K24中克隆并鉴定的一种偶氮还原酶基因[18-19]。它编码一种由203个氨基酸组成的21 295 Da的非核黄素依赖型的偶氮还原酶AzoB。该酶可以利用NAD(P)H作为电子供体,还原偶氮染料金橙Ⅰ的偶氮键使其颜色消失。该酶对其他的偶氮染料如甲基红、金橙Ⅱ、苋菜红、丽春红S等都没有活性。上述的偶氮染料除金橙Ⅰ外都可以被在粪肠球菌中发现的偶氮还原酶AzoA所还原[17]。
根据羰基还原酶催化可逆的氧化还原反应的原理,本文利用羰基还原酶可以在NAD(P)+存在的条件下催化相应的醇类底物生成对应的酮类物质以及NAD(P)H,而偶氮还原酶则利用羰基还原酶生成的NAD(P)H,作用于偶氮染料,引起偶氮染料的颜色变化,利用目测的方式可以直接实现羰基还原酶活性和立体选择性的高通量筛选 (图1)。

图1 筛选方法的作用机制
1 材料与方法
1.1 药品及试剂
偶氮染料金橙Ⅰ、金橙Ⅱ、甲基红、苋菜红、丽春红S,均购自国药集团化学试剂有限公司;NAD(P)+、NAD(P)H购自罗氏公司;筛选实验所选底物购自美国Sigma公司及日本TCI公司;其他试剂均为国产分析纯。
限制性内切酶、T4连接酶购自Thermo公司;质粒提取试剂盒、凝胶回收试剂盒购自Omega公司;表达载体购自Stratagene公司。
1.2 菌株培养、表达与纯化
大肠杆菌菌株BL21(DE3) AzoB-pET-11a在含有氨苄青霉素(50 µg/mL) 的LB培养基中37 ℃培养12 h。按照Omega公司试剂盒的说明对该菌株进行质粒提取。利用Ⅰ和HⅠ对提取的质粒进行双酶切处理,并利用T4连接酶将目的基因连接到同样处理过的表达载体pET-28a (带有组氨酸标签) 上,转化至BL21(DE3)感受态细胞中进行功能表达。BL21(DE3) AzoB-pET-28a在含有卡那霉素(50 µg/mL) 的LB培养基中37 ℃培养12 h后,以10%的接种量进行转接,继续培养2 h后加入异丙基--d-硫代半乳糖苷 (IPTG,0.1 mmol/L) 进行诱导,37 ℃再培养2.5 h。6 000×低温离心收集细胞后利用高压匀浆机对细胞进行破碎处理。12 000×低温离心20 min去除细胞碎片,上清液用HisTrap HP亲和层析柱(5 mL) 进行纯化。层析柱在上样前用含有250 mmol/L NaCl的20 mmol/L Tris-HCl (pH 6.8) 缓冲液进行平衡。上样后,用含有500 mmol/L咪唑的上述缓冲液进行线性梯度洗脱,分别收集各个洗脱峰,通过SDS-PAGE电泳检测各个洗脱峰及蛋白纯度。
1.3 酶活验证
偶氮还原酶AzoB的酶活测定根据文献中的描述进行[18]。通过测定室温(23 ℃) 下偶氮染料金橙Ⅰ在482 nm波长下光吸收值(ε482 = 22.3 mmol/(L·cm) 的减少,来计算偶氮还原酶的酶活。每分钟消耗1 µmol金橙Ⅰ所需要的酶量定义为一个酶活力单位,反应在200 µL 100 mmol/L磷酸盐缓冲液(pH 6.8) 中进行,反应体系中含有200 µmol NADPH,0.15 mmol/L金橙Ⅰ以及72 µg AzoB。
羰基还原酶的酶活测定通过检测室温下NADPH在340 nm波长下光吸收值(ε340= 6.22 mmol/(L·cm) 的变化。反应在96孔板中进行,反应体系共200 µL (100 mmol/磷酸盐缓冲液(pH 6.8)、7.0 mmol/L底物(,)-3-甲基环己醇、0.5 mmol/L NADP+以及50 µg纯化的羰基还原酶SSCR M242F/Q245T) 每分钟生成 1 µmol NADPH所需要的酶量定义为一个酶活力单位。没有加入羰基还原酶的反应体系作为空白组,加入对该底物没有活力的羰基还原酶CMCR设置为对照组[20-21]。
羰基还原酶与偶氮还原酶的耦合反应在200 µL 100 mmol/L磷酸盐缓冲液(pH 6.8) 中进行,反应体系中含有5.0 mmol/L ()-3-甲基环己醇、0.5 mmol/L NADP+、0.15 mmol/L金橙Ⅰ以及50 µg SSCR M242F/Q245T和72 µg AzoB。
1.4 筛选方法的建立与优化
为了探究筛选方法中的组分偶氮染料或偶氮还原酶是否会影响羰基还原酶的活力,设计A、B、C、D四组实验。A组含有100 mmol/L磷酸盐缓冲液(pH 6.8)、5.0 mmol/L底物(,)-3-甲基环己醇、0.5 mmol/L NADP+以及 50 µg羰基还原酶SSCR M242F/Q245T;B组为A组加入72 µg的偶氮还原酶AzoB;C组为A组加入偶氮染料金橙Ⅰ(0.15 mmol/L AzoB的底物);D组为B组加入偶氮染料金橙Ⅰ (0.15 mmol/L)。
为了优化偶氮染料金橙Ⅰ的加入时间,设计6组实验。6组反应体系中均含有100 mmol/L磷酸盐缓冲液(pH 6.8)、5.0 mmol/L底物(,)-3-甲基环己醇、0.5 mmol/L NADP+、50 µg羰基还原酶SSCR M242F/Q245T以及72 µg偶氮还原酶AzoB。反应不同时间 (0,1,2,3,4,5 min) 后,加入金橙Ⅰ,使其终浓度为 0.15 mmol/L,2 min后,测定482 nm下光吸收值。采用同样的方法,对羰基还原酶底物浓度 (5.0 mmol/L、6.0 mmol/L、7.0 mmol/L)、NADP+浓度 (0.1 mmol/L、0.3 mmol/L、0.5 mmol/L) 以及金橙Ⅰ浓度 (0.15 mmol/L、0.3 mmol/L、 0.45 mmol/L) 进行优化。
1.5 羰基还原酶的活性筛选
为了检测该方法的活性筛选可行性,选用实验室保存的16种羰基还原酶以及5种醇类或手性醇类底物进行方法验证。5种底物分别为(,)-3-甲基环己醇、()-1-苯基-1,2-乙二醇、1-苯基-1,2-乙二醇、1,2-戊二醇以及(-)-薄荷醇。反应在96孔板中进行,反应体系200 µL (100 mmol/L磷酸盐缓冲液(pH 6.8)、 5.0 mmol/L底物、0.5 mmol/L NADP+以及50 µg纯化的羰基还原酶) 2 min后,加入72 µg纯化的偶氮还原酶AzoB,以及偶氮染料金橙Ⅰ(终浓度0.15 mmol/L),反应2 min。不同羰基还原酶对不同底物的活力可以通过颜色反应直观地看到。
1.6 羰基还原酶的立体选择性筛选
为了验证该方法在立体选择性筛选的可行性,以羰基还原酶CMCR作用不同构型的1-苯基-1,2-乙二醇的结果验证。反应在96孔板中进行,反应体系200 µL (100 mmol/L磷酸盐缓冲液(pH 6.8)、5.0 mmol/L底物 (()-1-苯基-1,2-乙二醇或()-1-苯基-1,2-乙二醇)、0.5 mmol/L NADP+以及50 µg纯化的羰基还原酶),2 min后,加入72 µg纯化的偶氮还原酶AzoB,以及偶氮染料金橙Ⅰ (终浓度0.15 mmol/L),反应 2 min。观察颜色变化。
1.7 羰基还原酶的活性、立体选择性酮底物还原验证
为了验证该方法筛选的羰基还原酶是否具有活性及立体选择性,以()-3-甲基环己酮和a-羟基苯乙酮为底物,利用筛选得到的羰基还原酶进行还原。反应体系为1 mL磷酸盐缓冲液 (100 mmol/L,pH 6.8) 中含酮底物10 mmol/L、NADP+0.5 mg、葡萄糖脱氢酶0.5 mg、葡萄糖 30 mmol/L和羰基还原酶1 mg,30 ℃过夜反应。等体积乙酸乙酯萃取,无水硫酸钠干燥后,产物用GC或HPLC与相应的手性标准品对照检测。
2 结果与分析
2.1 偶氮还原酶AzoB的纯化
利用限制性内切酶Ⅰ和HⅠ对偶氮还原酶基因B进行酶切,连接到表达载体pET-28a上,并成功转化至BL21 (DE3) 中进行功能表达。BL21 (DE3) AzoB-pET- 28a在含有卡那霉素(50 µg/mL) 的LB培养基中培养、诱导表达,经离心、破菌处理后,利用ÄKTA蛋白纯化仪器进行镍柱亲和层析。结果如图2所示,SDS蛋白电泳显示目的蛋白在表达宿主BL21(DE3)中得到了成功表达,蛋白主要存在于上清液中。
2.2 酶活验证
羰基还原酶与偶氮还原酶的耦合实验表明,羰基还原酶SSCR M242F/Q245T对底物(,)-3-甲基环己醇表现出了较高的酶活力,反应体系颜色消失;而CMCR对该底物没有表现出任何活力,反应体系仍为橙色 (图3)。
2.3 筛选方法的建立与优化
为了探究偶氮染料或者偶氮还原酶是否会影响羰基还原酶的活力,设计A、B、C、D四组实验。羰基还原酶的酶活通过测定室温下NADPH在340 nm波长下光吸收值的变化来计算。结果如表1,由A组和B组实验可知,偶氮还原酶AzoB对羰基还原酶的活力影响不大,其中A组为9.0 U/mg,B组为7.6 U/mg。对比A组、C组和D组可知,偶氮染料金橙Ⅰ的存在明显影响了羰基还原酶的活力,导致NADPH的生成量减少,为偶氮还原酶提供的电子不足,因而偶氮染料不能被完全降解。
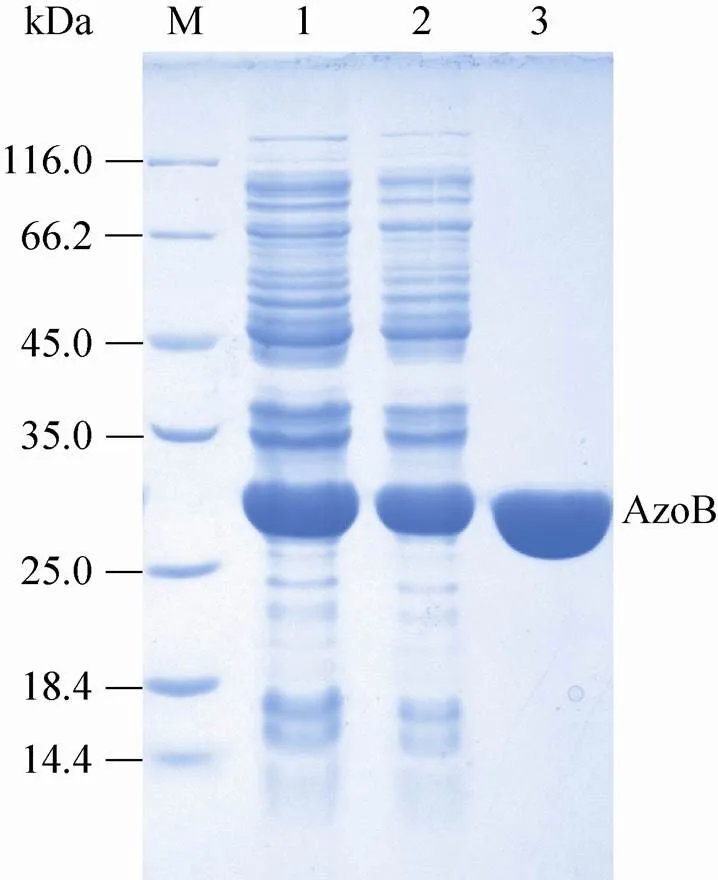
图2 偶氮还原酶AzoB的纯化

图3 酶活验证及筛选方法建立

表1 偶氮还原酶AzoB和偶氮染料金橙Ⅰ对羰基还原酶活力的影响
由于金橙Ⅰ的存在明显影响了羰基还原酶的酶活力,设计了6组实验进行优化,即在不同的反应时间(0、1、2、3、4、5 min) 后再加入金橙Ⅰ。实验结果如表2所示,如果在加入金橙Ⅰ以及AzoB之前反应2 min或更长时间,482 nm下的光吸收值已经低至0.3以下,说明偶氮染料几乎被全部降解,同时从反应体系的颜色上也可以看到颜色的消失 (图4)。反应时间不足2 min的,482 nm下的光吸收值在1.0以上 (分别为1.270和1.013),说明还有大量偶氮染料没有被降解,因而反应体系的颜色没有发生明显的变化。
同样,采取设计对照实验的方法对NADP+浓度(0.1 mmol/L、0.3 mmol/L、0.5 mmol/L) 以及金橙Ⅰ浓度(0.15 mmol/L、0.30 mmol/L、 0.45 mmol/L) 进行优化。当NADP+的浓度为 0.5 mmol/L时,反应体系颜色会在2 min之内很快消失,当NADP+的浓度降低至0.3 mmol/L甚至0.1 mmol/L时,反应需要6 h甚至更长的时间才实现颜色的褪去。当金橙Ⅰ的浓度为 0.15 mmol/L时,反应体系会在2 min之内很快消失,当金橙Ⅰ的浓度增加到0.30 mmol/L甚至0.45 mmol/L时,反应需要更长的时间才能实现颜色的明显消失。

表2 不同的反应时间对筛选结果的影响
All of the reactions were detected at 482 nm after 2 min.

图4 不同的反应时间对筛选结果的影响
AzoB可以利用羰基还原酶生成的NADPH作为电子供体还原偶氮染料,同时生成NADP+,和羰基还原酶形成循环反应,并且AzoB可以利用的NADPH浓度可以低至1 µmol/L[18],理论上不需要额外添加NADP+,但如表1所示,金橙Ⅰ的存在抑制了羰基还原酶SSCR M242F/ Q245T的活力,同时也影响了该循环反应的正常进行。同时,随着金橙Ⅰ的浓度增加,反应体系颜色会变深,颜色反应会更明显;但随着金橙Ⅰ浓度的增加,金橙Ⅰ对羰基还原酶活力的影响会增加,同时降解金橙Ⅰ所需要的NADPH的量也会增大。在本研究中,在加入金橙Ⅰ和AzoB之前给予2 min的反应时间,如果羰基还原酶的活力明显或提高羰基还原酶的用量,反应所积累的NADPH量足够降解0.15 mmol/L的金橙Ⅰ。另外,由于羰基还原酶底物是过量的,5.0 mmol/L的底物浓度也较为合适。
2.4 羰基还原酶的活性筛选
按照上文所述的方法,设计筛选实验,选择5种底物,对16种羰基还原酶的活性及立体选择性进行筛选并对该方法的可行性进行验证。所有的反应体系均在96孔中进行,筛选结果如图5所示。

图5 利用AzoB和OrangeⅠ进行的筛选实验
所选羰基还原酶对(-)-薄荷醇都没有表现活力;共有9种羰基还原酶对(,)-3-甲基环己醇表现出明显活力,包括SSCR、SSCR Q245H、SSCR Q245L、SSCR N207L、SSCR M242C、SSCR M242L/Q245T、SSCR M242C/Q245L、SSCR M242F/Q245T以及Ymr226c;检测结果和相应酮底物还原的气相色谱检测结果一致 (表3),并且没有假阳性结果出现。但是,阴性结果中有错误发生。例如,SSCR N207Q、Gre2的GC结果都显示有活性,而通过本方法却没有检测到活性。原因推测为SSCR N207Q和Gre2的活力较低 (无法用NADPH在340 nm波长下光吸收检测酶活) 。另外还有其他的3种底物也用于了本实验的筛选,其中只有CMCR对它们表现出了活性,其他羰基还原酶由于酶活力较低,该方法没有检测出,但是建立羰基还原酶的还原反应,延长反应时间,可以检测出相应的产物。
由于偶氮染料对羰基还原酶催化反应的抑制作用,导致本方法对一些活性较低的羰基还原酶不能检测到活性,降低了其灵敏度。因而,我们对其他的偶氮染料如金橙Ⅱ、甲基红、苋菜红、丽春红S也同样进行了研究,利用粪肠球菌中的偶氮还原酶AzoA对这些偶氮染料进行还原。实验发现,金橙Ⅱ、苋菜红以及丽春红S都不会对实验所用的羰基还原酶产生抑制作用。然而,AzoA尽管可以利用NADPH,但偏好NADH[17],当用在此方法时,需要更长的反应时间 (8 h以上) 才能实现对偶氮染料的降解,其检测结果和GC结果相符 (表4)。
2.5 羰基还原酶的立体选择性筛选
按照上述的方法,验证CMCR对()-1-苯基-1,2-乙二醇和()-1-苯基-1,2-乙二醇的立体选择性,结果如图6A所示,()-1-苯基-1,2-乙二醇的颜色明显褪去,而()-1-苯基-1,2-乙二醇则没有颜色变化。HPLC的检测结果表明,CMCR还原a-羟基苯乙酮产生()-1-苯基-1,2-乙二醇,本结果与之相符,表明该方法同样可以应用于立体选择性的筛选。1-苯基-1,2-乙二醇的消旋体及羰基还原酶CMCR还原a-羟基苯乙酮产物的HPLC结果见图6B和6C。
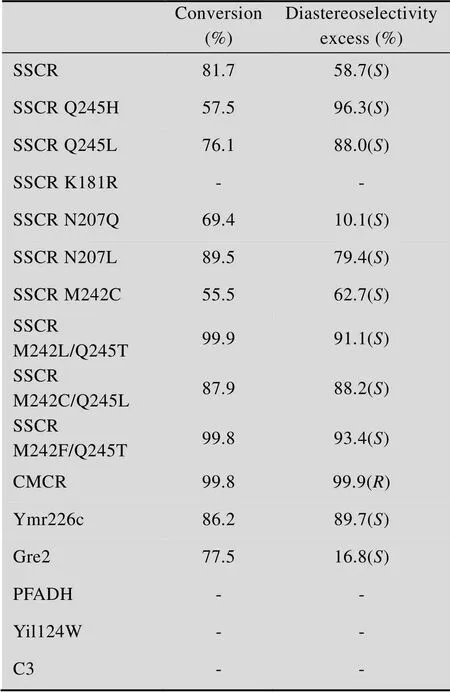
表3 气相色谱测定羰基还原酶的活性及立体选 择性
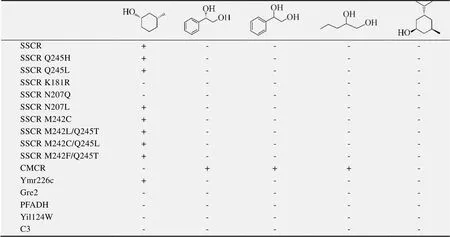
表4 利用AzoA和苋菜红进行的活性与对映性筛选
+: had the activity; -: no activity.

图6 CMCR对(R)-1-苯基-1,2-乙二醇和(S)-1-苯基-1,2-乙二醇的活性及对映体选择性筛选实验
3 结论
在本研究中,利用偶氮染料金橙Ⅰ、偶氮还原酶AzoB与羰基还原酶及其相应的底物耦合,基于偶氮染料还原的颜色变化,提出并建立了一种新的羰基还原酶筛选方法,并对该方法进行了验证。这种新的筛选方法快速、有效,筛选结果直观,当所筛选的羰基还原酶对特定底物有活性时,会产生明显的颜色变化,如果所用的羰基还原酶底物为手性醇,能初步实现快速的手性筛选,因而该方法在一定程度上可以代替HPLC和GC来完成大规模筛选工作。利用偶氮还原酶AzoA与其他偶氮染料对NADH依赖的羰基还原酶的高通量筛选正在进行中。相信未来会发现对羰基还原酶没有抑制作用的偶氮染料及相应的NAD(P)H倾向型偶氮还原酶,将提高本方法的灵敏度,使其完善。
致谢:感谢National Center for Toxicological Research, Food and Drug Administration (美国) 的Dr. Huizhong Chen无私馈赠A和B基因。
REFERENCES
[1] Kataoka M, Kita K, Wada M, et al. Novel bioreduction system for the production of chiral alcohols. Appl Microbiol Biotechnol, 2003, 62(5/6): 437–445.
[2] Goldberg K, Schroer K, Lütz S, et al. Biocatalytic ketone reduction—a powerful tool for the production of chiral alcohols—part I: processes with isolated enzymes. Appl Microbiol Biotechnol, 2007, 76(2): 237–248.
[3] Goldberg K, Schroer K, Lütz S, et al. Biocatalytic ketone reduction—a powerful tool for the production of chiral alcohols—part II: whole-cell reductions. Appl Microbiol Biotechnol, 2007, 76(2): 249–255.
[4] Vozka J, Kalíková K, Janečková L, et al. Chiral HPLC separation on derivatized cyclofructan versus cyclodextrin stationary phases. Anal Lett, 2012, 45(16): 2344–2358.
[5] Paik MJ, Kang JS, Huang BS, et al. Development and application of chiral crown ethers as selectors for chiral separation in high-performance liquid chromatography and nuclear magnetic resonance spectroscopy. J Chromatogr A, 2013, 1274(25): 1–5.
[6] Gassmann E, Kuo JE, Zare RN. Electrokinetic separation of chiral compounds. Science, 1985, 230(4727): 813–814.
[7] Cavazzini A, Pasti L, Massi A, et al. Recent applications in chiral high performance liquid chromatography: a review. Anal Chim Acta, 2011, 706(2): 205–222.
[8] Jibuti G, Mskhiladze A, Takaishvili N, et al. HPLC separation of dihydropyridine derivatives enantiomers with emphasis on elution order using polysaccharide-based chiral columns. J Sep Sci, 2012, 35(19): 2529–2537.
[9] Liu G, Zhou J, Meng X, et al. Decolorization of azo dyes by marine Shewanella strains under saline conditions. Appl Microbiol Biotechnol, 2013, 97(9): 4187–4197.
[10] Pandey A, Singh P, Iyengar L. Bacterial decolorization and degradation of azo dyes. Int Biodeterior Biodegrad, 2007, 59(2): 73–84.
[11] Stolz A. Basic and applied aspects in the microbial degradation of azo dyes. Appl Microbiol Biotechnol, 2001, 56(1/2): 69–80.
[12] Suzuki Y, Yoda T, Ruhul A, et al. Molecular cloning and characterization of the gene coding for azoreductase fromsp. OY1-2 isolated from soil. J Biol Chem, 2001, 276(12): 9059–9065.
[13] Chen H, Hopper SL, Cerniglia CE. Biochemical and molecular characterization of an azoreductase from, a tetrameric NADPH-dependent flavoprotein. Microbiology, 2005, 151(Pt5): 1433–1441.
[14] Nakanishi M, Yatome C, Ishida N, et al. Putative ACP phosphodiesterase gene (acpD) encodes an azoreductase. J Biol Chem, 2001, 276(49): 46394–46399.
[15] Bin Y, Jiti Z, Jing W, et al. Expression and characteristics of the gene encoding azoreductase fromAS1.1737. FEMS Microbiol Lett, 2004, 236(1): 129–136.
[16] Wang CJ, Hagemeier C, Rahman N, et al. Molecular cloning, characterisation and ligand-bound structure of an azoreductase from. J Mol Biol, 2007, 373(5): 1213–1228.
[17] Chen H, Wang RF, Cerniglia CE. Molecular cloning, overexpression, purification, and characterization of an aerobic FMN-dependent azoreductase from. Protein Expres Purif, 2004, 34(2): 302–310.
[18] Chen H, Feng J, Kweon O, et al. Identification and molecular characterization of a novel flavin-free NADPH preferred azoreductase encoded byB inK24. BMC Biochem, 2010, 11: 13–22.
[19] Blumel S, Stolz A. Cloning and characterization of the gene coding for the aerobic azoreductase fromK24. Appl Microbiol Biotechnol, 2003, 62(2/3): 186–190.
[20] Zhu DM, Ankati H, Mukherjee C, et al. Asymmetric reduction β-Ketonitriles with a recombinant carbonyl reductase and enzymatic transformation to optically pure β-Hydroxy carboxylic acids. Org Lett, 2007, 9(13): 2561–2563.
[21] Zhu DM, Yang Y, Ling H. Stereoselective enzymatic synthesis of chiral alcohols with the use of a carbonyl reductase fromwith anti-Prelog enantioselectivity. J Org Chem, 2006, 71(11): 4202–4205.
(本文责编 陈宏宇)
High throughput screening of active and stereoselective carbonyl reductases
Hang Zhang1, Xi Chen2, Jinhui Feng2, Jinku Bao1, Qiaqing Wu2, and Dunming Zhu2
1,,,,610064,,2,,,,300308,
In this study, a fast carbonyl reductases colorimetric screening method for discovering stereoselective carbonyl reductases was established by combining the reverse alcohol oxidation with the azoreductase-catalyzed reduction of azo dye. When azo dye (OrangeⅠ, 4-(4-hydroxy-1-naphthylazo) benzenesulfonic acid) and azoreductase (AzoB) were added into the reaction system of alcohol oxidation catalyzed by carbonyl reductase, the produced NAD(P)H served as electron donor for the azoreductase to reduce the azo dye, resulting the color fade. Hence, the carbonyl reductases can be screened by the obvious color change. When chiral alcohol was used as the substrate, the activity and stereoselectivity of carbonyl reductases can be screened at the same time.
chiral alcohol, carbonyl reductase, azoreductase, azo dye, screening method
May 4, 2014; Accepted: May 30, 2014
Jinhui Feng. Tel: +86-22-24828734; E-mail: feng_jh@tib.cas.cn Jinku Bao. Tel:+86-28-85415171; E-mail: baojinku@scu.edu.cn
Supported by:Key Research Program of the Chinese Academy of Sciences (No. KSEZ-EW-Z-021-2), National Basic Research Program of China (973 Program) (No. 2011CB710800).
中国科学院重点部署项目 (No. KSEZ-EW-Z-021-2),国家重点基础研究发展计划(973计划) (No. 2011CB710800) 资助。
