ALX-R和NF-κBp65在口腔扁平苔藓病灶中的表达研究
2015-07-19宋典坤关为群王学莹刘瑜佳
宋典坤,关为群,王学莹,刘瑜佳
(福建医科大学附属协和医院,福建福州350001)
ALX-R和NF-κBp65在口腔扁平苔藓病灶中的表达研究
宋典坤,关为群,王学莹,刘瑜佳
(福建医科大学附属协和医院,福建福州350001)
目的通过检测脂氧素A4受体(ALX-R)及核因子-κBp65(NF-κBp65)在口腔扁平苔藓(OLP)病灶黏膜中的表达情况,探讨二者在OLP发病机制中的可能作用。方法采用免疫组化法检测30例OLP组织(糜烂型OLP组16例,非糜烂型OLP组14例)与10例正常口腔黏膜组织(对照组)中ALX-R和NF-κBp65蛋白的表达情况。结果(1)ALX-R蛋白,在糜烂型与非糜烂型OLP组织中表达阳性率比较,差异无统计学意义(P>0.05);OLP组织中,糜烂型组NF-κBp65蛋白表达阳性率高于非糜烂型组,差异有统计学意义(P<0.05);(2)OLP组ALX-R蛋白表达阳性率低于对照组,NF-κBp65蛋白表达阳性率高于对照组,差异均有统计学意义(P<0.01);(3)OLP组和对照组中ALX-R与NF-κBp65的蛋白表达均呈负相关(r=-1,P<0.01)。结论ALX-R与NF-κBp65表达异常可能与OLP的发病机制密切相关。
扁平苔癣,口腔; 受体,细胞表面; 脂氧素类; NF-κB; 免疫组织化学
口腔扁平苔藓(oral lichen planus,OLP)是一种在口腔黏膜病中仅次于复发性阿弗他溃疡的第二大常见疾病,发病率高,为0.11%~4.00%,常好发于中年女性[1]。OLP被世界卫生组织列为癌前状态,OLP患者癌症发生率增高,主要见于久治不愈的萎缩糜烂型[2]。目前OLP病因不明,多数研究支持其与自身免疫异常相关。脂氧素(lipoxins,LXs)具有促使炎症消退和调节免疫的作用,其抗炎作用50%通过核因子κB(nuclear factor-κB,NF-κB)信号途径,LXs的家族成员中最具有代表性的是LXA4,其主要通过与其受体ALX-R结合而发挥生物学效应。本研究通过检测OLP患者口腔黏膜组织中ALX-R与NF-κBp65蛋白的表达,探讨二者在OLP发生、发展中的作用。
1 材料与方法
1.1 材料
1.1.1 试剂耗材 兔抗人ALX-R多克隆抗体(北京博奥森),小鼠抗人NF-κBp65单克隆抗体(美国Santa Cruz公司),小鼠超敏二步法免疫组化试剂盒pv-9002、兔超敏二步法免疫组化试剂盒pv-9001、二氨基联苯胺(3,3′-diaminpbenzidine,DAB)显色试剂盒(北京中杉金桥生物技术公司),倒置相差显微镜(Nikon TS-100,Japan)等。
1.1.2 病例选择 本研究获得福建医科大学附属协和医院伦理委员会批准,获取的标本得到患者知情同意。选取福建医科大学附属协和医院2012~2013年口腔门诊就诊的OLP患者(诊断参照人民卫生出版社版《口腔黏膜病学》第3版),经活检确诊30例,根据临床特征将30例OLP病损黏膜分为糜烂型组(16例)和非糜烂型组(14例)。另取10例正常口腔黏膜作为对照组。所选病例均符合以下排除标准:(1)患有免疫系统性疾病,如系统性红斑狼疮、天疱疮等;(2)患有肿瘤或其他部位的癌前病变;(3)需长期服药以控制病情的慢性疾病,如冠心病、高血压、糖尿病等;(4)患有血液系统疾病,如白血病、贫血等;(5)3个月内使用过激素、免疫制剂者;(6)伴有其他口腔黏膜疾病或重度牙周病患者;(7)某些银汞合金充填物或药物可能引起苔藓样反应者;(8)妊娠期及哺乳期妇女。
1.2 方法
1.2.1 口腔黏膜组织ALX-R及NF-κBp65蛋白的检测 采用SP法进行免疫组化染色。ALX-R和NF-κBp65工作浓度均为1∶50,以磷酸盐缓冲液代替一抗作为阴性对照,以已知阳性切片作为阳性对照。用DAB显色试剂盒显色,苏木素轻度复染,系列乙醇脱水,二甲苯透明,封片,显微镜下观察免疫组化染色结果。
1.2.2 判断标准 采用着色强度和阳性细胞率综合分析法。着色强度计分:按阳性细胞着色无、弱(淡黄)、中(棕黄)、强(棕褐)分别计0、1、2、3分;每张切片随机选取5个400倍视野观察,按阳性细胞占总细胞数比例计分:0~25%、>25%~50%、>50%~75%、>75%分别计0、1、2、3、4分。0~1分为阴性(-);2~3分为弱阳性(+);4~5分为中等阳性(++);6~7分为强阳性(+++)。
1.3 统计学处理 应用SPSS13.0统计软件进行数据分析,计量资料以±s表示,多组间均数值比较采用方差分析,非参数检验采用秩和检验;相关关系采用Pearson及Spearman相关检验;组间差异的显著性检验采用单因素方差分析,两组间比较采用成组t检验;P<0.05为差异有统计学意义。
2 结 果
2.1 HE染色 OLP表现为上皮不全角化,粒层明显,上皮钉突呈现不规则延长,下端有时变尖呈锯齿状。基底细胞排列紊乱,基底膜界限模糊不清,基底细胞液化变性明显者可形成上皮下疱。棘层、基底层或固有层内可见嗜酸性红染的胶样小体及固有层有密集淋巴细胞浸润带,见图1。
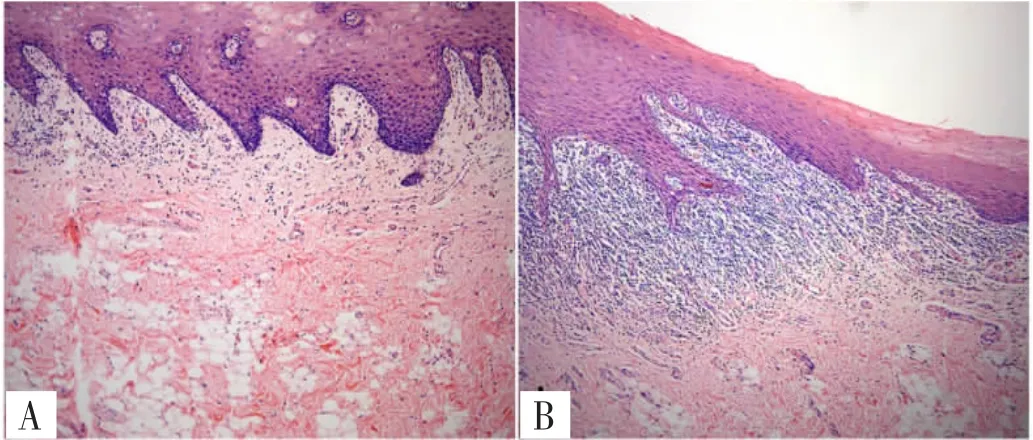
图1 正常口腔黏膜组织和OLP组织染色(HE,100×)
2.2 ALX-R和NF-κBp65免疫组化染色
2.2.1 ALX-R免疫组化结果 ALX-R蛋白表达于黏膜角质形成细胞和炎性浸润细胞,定位于胞浆和胞膜,其在OLP组表达阳性率为43.3%(13/30),在对照组为90.0%,OLP组ALX-R蛋白表达强度显著低于对照组,差异有统计学意义(P<0.05),但非糜烂型组和糜烂型组比较,差异无统计学意义(P>0.05),见表1、图2。

表1 ALX-R免疫组化结果
2.2.2 NF-κBp65免疫组化结果 在OLP组织中NF-κBp65的阳性染色定位于角质形成细胞及炎性浸润细胞的胞浆和胞核,其中以黏膜上皮棘细胞和基底细胞的胞核中表达较强,呈棕黄色颗粒,总表达阳性率为83.3%(25/30),10例正常口腔黏膜组织表达阳性率为20.0%,二者比较,差异有统计学意义(P<0.01);其在非糜烂型组表达阳性率为64.3%,糜烂型组为100.0%,两组表达阳性率比较,差异有统计学意义(P<0.05),见表2、图2。
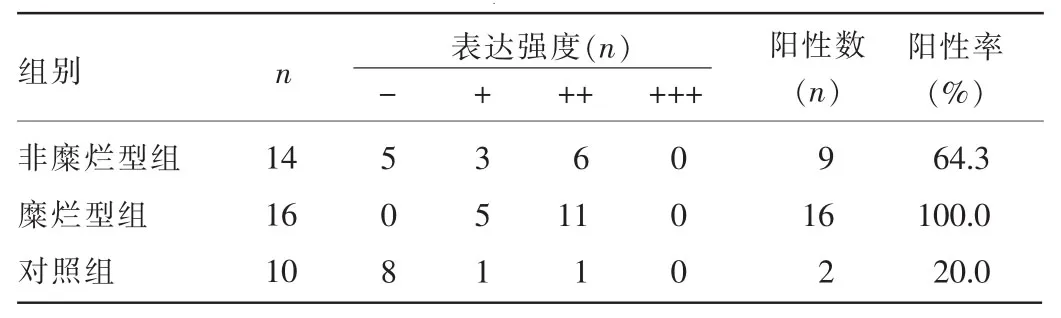
表2 NF-кBp65免疫组化结果

图2 NF-кBp65、ALX-R蛋白在各组织中的表达(SP法,200×)
2.3 ALX-R、NF-κBp65蛋白表达的相关分析 经秩和检验,OLP组织中ALX-R与NF-кBp65蛋白表达呈负相关(r=-1,P<0.01),见表3;对照组中ALX-R与NF-кBp65蛋白表达呈负相关(r=-1,P<0.01),见表4。

表3 OLP组织中ALX-R、NF-кBp65免疫组化相关性分析结果(n)
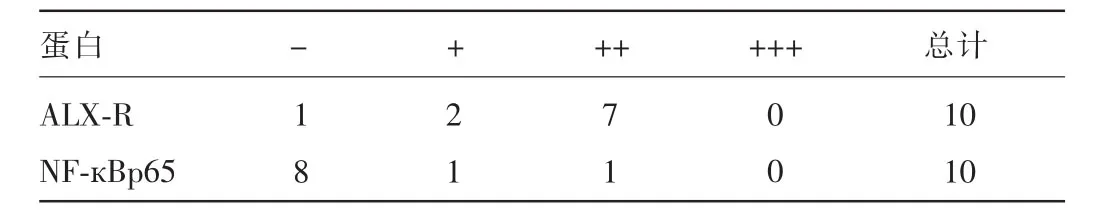
表4 对照组中ALX-R、NF-кBp65免疫组化相关性分析结果(n)
3 讨 论
OLP主要是由细胞免疫功能异常导致的一种非特异性炎症疾病[3]。ALX-R属于G蛋白偶联受体超家族的成员,其主要与LXA4结合在免疫炎性反应中发挥重要作用。微观上,转录及翻译水平调节ALX-R的表达,宏观上,促炎与抗炎介质能调节ALX-R的表达,同时用药及疾病状态对其也有一定的影响[4]。ALX-R可表达于T淋巴细胞[5]、涎腺上皮细胞[6]、肠上皮细胞[7]、支气管上皮细胞[8]、子宫内膜细胞[9]及关节滑膜组织等[10]。Gewirtz等[11]运用cDNA芯片技术发现,LXA4能与ALX-R结合后抑制NF-κBp65信号通路,从而抑制促炎基因的表达,炎症因子表达量减少,炎症免疫反应减轻。ALX-R在口腔黏膜上皮是否表达未见报道。本研究发现,ALX-R蛋白在OLP口腔病损黏膜上皮组织中表达较正常黏膜下降,推测ALX-R表达的下调可能减弱了细胞对保护因子LXA4的反应,从而LXA4对NF-κBp65信号通路依赖的促炎基因的抑制作用减弱,这可能是导致OLP发生、发展的机制之一。
近年来,许多研究把NF-кBp65作为药物治疗的靶点,有研究表明NF-кBp65导致了OLP炎性反应迁延不愈,受NF-кBp65调控的炎症因子,如TNF-α、IL-6等又会影响NF-кBp65的活性加速细胞的坏死,造成NF-кBp65的进一步激活,以上正反馈调控可加重OLP及其他炎症疾病局部的炎性反应,导致炎症的恶性循环,造成局部炎性反应慢性迁延[12-13],因此通过抑制 NF-кBp65来治疗OLP已得到广泛关注[14]。本研究结果显示,NF-кBp65在OLP中的表达明显高于对照组,差异有统计学意义(P<0.01),提示NF-кBp65的异常高表达可能参与了OLP的发病过程。另外,对NF-кBp65在OLP不同临床分型的表达差异分析表明,NF-кBp65在糜烂型的表达显著高于非糜烂型,差异有统计学意义(P<0.05),其机制可能是活化的NF-кBp65介导大量炎症因子,如IL-6、TNF-α等的表达,而炎症因子又反馈性活化NF-кBp65,形成一个慢性迁延的过程,因而萎缩-糜烂型OLP会发生更严重的持续上皮损害。
NF-кBp65信号通路与机体多种免疫性疾病的发病机制密切相关,NF-кBp65能够调节免疫应答细胞发生、发育、成熟及凋亡等过程[15]。Zhou等[16]发现在OLP病损黏膜中NF-кBp65及其调控的下游炎症因子的表达水平增高。综上可推测,在OLP发病机制中,可能通过NF-кBp65的激活参与过度炎症免疫反应的过程。由于NF-кBp65是许多炎症介质的基因转录调节因子,因此抑制其活性有望控制炎症疾病的发展及恶化。而国内外许多研究已证实,LXA4能抑制LPS诱导的人中性粒细胞和单核细胞中NF-кBp65和AP-1的核转位,并可下调IL-8表达。本研究通过探讨ALX-R和NF-κBp65蛋白在OLP病灶中的表达特征及相互关系,发现二者表达呈显著负相关,这表明ALX-R和NF-κBp65可能参与了OLP的发生、发展。王素梅等[17]发现子痫前期妇女胎盘症状越严重患者胎盘ALX-R表达越低而NF-κBp65越高,这与本研究结果是相似的。本研究结果表明,ALX-R、NF-κBp65可能参与了OLP的发生、发展,为进一步研究OLP的发病机制和将LXA4应用于治疗OLP提供了新的启发。
Wu等[18]将LXs的稳定类似物15(R/S)-甲基-LXA4应用于治疗小儿湿疹,发现其能显著缓解症状,促进病变好转,提高了患者的生活质量,并证明所有安全参数保持在正常范围内,无不良反应的发生。这给LXA4应用于OLP的治疗提供了一个新的思路。
[1]Serhan CN,Hamberg M,Samuelsson B.Lipoxins:novel series of biologically active compounds formed from arachidonic acid in human leukocytes[J].Proc Natl Acad Sci,1984,81(17):5335-5339.
[2]Rödström PO,Jontell M,Mattsson U,et al.Cancer and oral lichen planus in a Swedish population[J].Oral Oncol,2004,40(2):131-138.
[3]Thornhill MH.Immune mechanisms in oral lichen planus[J].Acta Odontol Scand,2001,59(3):174-177.
[4]常瑞,刘婷.脂氧素A4受体在炎症中的作用[J].中国组织化学与细胞化学杂志,2013,22(4):320-327.
[5]Ariel A,Chiang N,Arita M,et al.Aspirin-triggered lipoxin A4 and B4 analogs block extracellular signal-regulated kinase-dependent TNF-alpha secretion from human T cells[J].J Immunol,2003,170(12):6266-6272.
[6]Odusanwo O,Chinthamani S,McCall A,et al.Resolvin D1 prevents TNF-αmediated disruption of salivary epithelial formation[J].Am J Physiol Cell Physiol,2012,302(9):C1331-1345.
[7]Gronert K,Gewirtz A,Madara JL,et al.Identification of a human enterocyte lipoxin A4 receptor that is regulated by interleukin(IL)-13 and interferon gamma and inhibits tumor necrosis factor alpha-induced IL-8 release[J].J Exp Med,1998,187(8):1285-1294.
[8]Bonnans C,Fukunaga K,Levy MA,et al.Lipoxin A(4)regulates bronchial epithelial cell responses to acid injury[J].Am J Pathol,2006,168(4):1064-1072.
[9]Macdonald LJ,Boddy SC,Denison FC,et al.A role for lipoxin A4as an anti-inflammatory mediator in the human endometrium[J].Reproduction,2011,142(2):345-352.
[10]Conte FP,Menezes-de-Lima O Jr,Verri WA Jr,et al.Lipoxin A(4)attenuates zymosan-induced arthritis by modulating endothelin-1 and its effects[J].Br J Pharmacol,2010,161(4):911-924.
[11]Gewirtz AT,Collier-Hyams LS,Young AN,et al.Lipoxin a4 analogs attenuate induction of intestinal epithelial proinflammatory gene expression and reduce the severity of dextran sodium sulfate-induced colitis[J].J Immunol,2002,168(10):5260-5267.
[12]Santoro A,Majorana A,Bardellini E,et al.NF-kappaB expression in oraland cutaneous lichen planus[J].J Pathol,2003,201(3):466-472.
[13]Barnes PJ,Karin M.Nuclear factor-kappaB:a pivotal transcription factor in chronic inflammatory diseases[J].N Engl J Med,1997,336(15):1066-1071.
[14]Rhodus NL,Cheng B,Bowles W,et al.Proinflammatory cytokine levels in saliva before and after treatment of(erosive)oral lichen planus with dexamethasone[J].Oral Dis,2006,12(2):112-116.
[15]Siebenlist U,Brown K,Claudio E.Control of lymphocyte development by nuclear factor-kappaB[J].Nat Rev Immunol,2005,5(6):435-445.
[16]Zhou G,Xia K,Du GF,et al.Activation of nuclear factor-kappa B correlates with tumor necrosis factor-alpha in oral lichen planus:a clinicopathologic study in atrophic-erosive and reticular form[J].J Oral Pathol Med,2009,38(7):559-564.
[17]王素梅,唐卉,苏莎,等.ALX-R在子痫前期患者胎盘组织中的表达及其与NF-κB p65的相关性[J].现代妇产科进展,2013,22(6):477-480.
[18]Wu SH,Chen XQ,Liu B,et al.Efficacy and safety of 15(R/S)-methyllipoxin A(4)in topical treatment of infantile eczema[J].Br J Dermatol,2013,168(1):172-178.
Study on expression of lipoxin A4 receptor and nuclear factor-κbp65 in lesions of oral lichen planus
Song Diankun,Guan Weiqun,Wang Xueying,Liu Yujia
(Affiliated Union Hospital,Fujian Medical University,Fuzhou,Fujian 350001,China)
Lichen planus,oral; Receptors,cell surface; Lipoxins; NF-κB; Immunohistochemistry
10.3969/j.issn.1009-5519.2015.20.002
A
1009-5519(2015)20-3050-03
2015-07-09)
福建省自然科学基金面上项目(2013J01314)。
宋典坤(1988-),男,福建福州人,硕士研究生,主要从事口腔内科临床工作;E-mail:175685210@qq.com。
关为群(E-mail:gwqluck@126.com)。
【Abstatct】ObjectiveTo detect the expression of lipoxin A4 receptor(ALX-R)and the transcription nuclear factor κBp65(NF-κBp65)in oralmucosallesion of the patients with orallichen planus(OLP)and to investigate their possible roles in the pathogenesis of OLP.MethodsImmunohistochemistry was adopted to detect the expression of ALX-R and NF-κBp65 protein in the oral mucosa of 30 OLP patients(including 16 cases of erosive type and 14 cases of non-erosive type)and 10 cases of normal oral mucosa(control group).Results (1)The positive rate of ALX-R protein expression had no statistical difference between the erosive type OLP tissue and the non-erosive type OLP tissue(P>0.05);in OLP oral mucosa tissue,the positive rate of NF-κBp65 protein expression in the erosive type group was higher than that in the non-erosive type group,the difference was statistically significant(P<0.05);(2)the positive rate of ALX-R protein expression in the OLP group was lower than that in the control group(P<0.05),but the positive rate of NF-κBp65 protein expression in the OLP group was significantly higher than that in the control group,the difference was statistically significant(P<0.01);(3)the ALX-R protein expression in the OLP group and the control group was negatively correlated with the NF-κBp65 protein expression=-1,P<0.01).ConclusionThe abnormal expressions of ALX-R and NF-κBp65 in oral mucosa may be closely related with the pathogenesis of OLP.
