化学平衡图像类型及解答要点
2015-07-13王开山
王开山

图像题以其信息量大、直观、简明并能很好地考查学生的读图能力、分析能力等特点成为化学学科中的重要题型之一,尤其在化学平衡中得到了很好地体现。
笔者将化学平衡中的图像题进行了归类并给出了每一类图像题的解答要点,与各位同行交流。
一、常规图像(例题略)
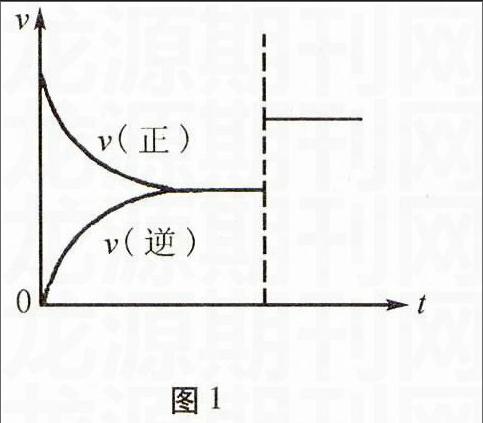
类型一:速率-时间图像(如图1所示)
解答要点速率时间图可根据正逆反应速率相对大小来判断平衡的移动方向或是否达到平衡状态。
类型二:物质参数-时间图像(如图2、图3所示)
解答要点物质参数可以是物质的量、质量、质量分数、物质的量分数、转化率等。依据这些参数随时间的变化可以确定平衡的建立过程、判断平衡的移动方向或判断反应是否已经达到平衡状态。
类型三: 物质参数-时间-温度/压强图像(如图4、图5所示)
解答要点解答该类型图像的主要原则是先拐先平(温度高或压强大),再根据物质参数随温度或压强的变化来判断反应的焓变或气体分子数的变化。
类型四:物质参数-温度/压强-压强/温度图像(如图6、图7所示)
解答要点这一类型图像最常见的解答方法是定一议一。即固定压强不变分析温度对物质参数的影响进而确定该反应的焓变;然后固定温度不变分析压强的改变对物质参数的影响进而确定反应前后气体分子数目的变化。
二、非常规图像
类型一:全程速率- 时间图像
例1向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应
速率随时间变化的示意图如图8所示。由图可得出的正确结论是( )。
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
解析这是一个反应前后体积不变的可逆反应,所以在本题中的两个变量就为温度和浓度。
由图可以看出随着反应的进行正反应速率逐渐增大,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应速率却是增大的,这说明此时温度的影响是主要的。由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快,所以选项C不正确;但当到达c点后正反应速率反而减小,说明此时反应物浓度的影响是主要的,因为反应物浓度越来越小了。但反应不一定达到平衡状态,所以选项A、B均不正确;正反应速率越快,同样时间段内消耗的SO2就越多,因此选项D是正确的。
答案:D
解答要点全程速率-时间图要考虑影响化学反应的所有因素,进而判断出某一时间段影响速率的主导因素是什么,最终得出结论。
类型二:v正(v逆)-压强(温度)图像
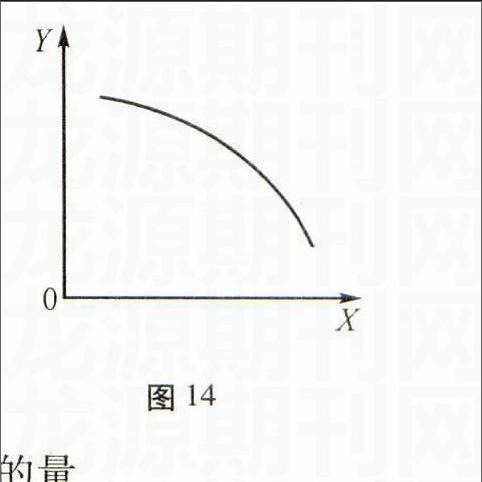
例2下列反应符合图9中v-p变化曲线的是( )。
A.H2(g)+I2(g)2HI(g)
B.3NO2(g)+H2O(l)2HNO3(l)+NO(g)
C.4NH3(g)+5O2(g)4NO(g)+6H2O(g)
D.CO(g)+C(s)2CO(g)
解析由图像可知,随着压强的增大,正逆反应速率均增大,且后一阶段正反应速率大于逆反应速率,即平衡向正反应方向移动。符合这一过程的为B选项。
解答要点v正(v逆)-压强(温度)图重在通过压强或温度的变化对正逆反应速率的影响结果来选出符合图像要求的反应。
类型三:物质参数-温度图像
例3已知可逆反应:X(g)+Y(g)E(g),现将X和Y
按一定比例混合,其他条件不变时,在不同温度下,反应混合物中X体积分数的变化曲线如图10所示。请分析图象并回答下列问题:
(1)B点v正与v逆的大小关系是,曲线BC(不包括B点和C点)v正与v逆的大小关系是。
(2)达到平衡后,升高温度,化学反应速率增大程度较小的是(填“v正”或“v逆”)。(3)此可逆反应的正反应是(填“放热反应”或“吸热反应”)。
解析由图可知,B之前X的体积分数从最大逐渐降低,而B之后X的体积分数增大,说明B之前是反应没有达到平衡状态,而B点时恰好平衡,B点之后是温度升高使平衡向左移动,所以逆反应是吸热反应。
(1)B点处于平衡状态,则v正=v逆;曲线BC(不包括B点和C点)表示升高温度,X%增大,平衡向逆反应方向发生移动,故v正 (2)由于逆反应方向为吸热反应,达到平衡后,升高温度,平衡向逆反应方向移动,故v正 (3)B点时恰好平衡,B点之后温度升高使平衡向左移动,所以逆反应是吸热反应,故正反应为放热反应。 答案:(1)则v正=v逆; v正 (2)v正 (3)放热反应 类型四:物质参数 - 物质的量图像 例4某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图11所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是 ( )。 A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a B.若T2>T1,则正反应一定是放热反应 C.达到平衡时A2的转化率大小为:b>a>c D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb 解析由图可知,横坐标为B2的物质的量,增大一种反应物的量必然会促进另一种反应物的转化。则B2越大,达到平衡时A2的转化率越大,生成物的物质的量越大,则平衡时AB3的物质的量大小为:c>b>a,故A正确。
若T2>T1,由图像可知温度升高AB3的物质的量增大,说明升高温度平衡向正反应方向移动,则正反应方向为吸热,故B错误。
由图可知,横坐标为B2的物质的量,增大一种反应物的量必然会促进另一种反应物的转化,则B
2越大,达到平衡时A2的转化率越大,生成物的物质的量越大,则平衡时A2的转化率大小为:c>b>a,故C错误。
温度越高速率越快,温度T2>T1,达到平衡时b、d点的反应速率为vd 答案:A 解答要点物质参数-物质的量图不能根据点的高低来判断某些量的大小关系,应根据横坐标物质的量的增加对该反应其他物质转化率或平衡的移动来判断。 类型五:转化率-压强、温度图像 例5如图12,条件一定时,反应2NO(g)+O2(g)2NO2(g)中NO的转化率α与T变化关系曲线图,图中有a、b、c、d 4个点,其中表示未达到平衡状态,且v正 A. a B. b C. c D. d 解析在曲线上,当温度一定时,NO的转化率也一定,所以曲线上任意一定表示该温度下的平衡状态。而曲线外的任意一定都未达到平衡状态。在曲线下方的任意一定,要想达到同温度下的平衡状态,即向上引垂直线到曲线上的一点,这样NO 的转化率要增大,平衡向右移动。同理,曲线上方的任意一点,要想达到同温度下的平衡状态,即向下引垂线到曲线上的一点,这样NO的转化率要减小,平衡向左移动。 答案:D 解答要点转化率-压强、温度图中曲线上的任意一点都是平衡点,曲线上方或下方的点要根据改点与垂线方向上曲线上的点进行对比进而判断平衡的移动方向和速率的相对大小。 类型六:与面积有关的图像 例6在容积固定的密闭容器中,进行可逆反应: X(g)+2Y(g)2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反 应速率v正、v逆与时间t的关系如图13,如图13图中阴影部分面积表示( )。 A.X的浓度的减少 B.Y的物质的量的减少 C.Z的浓度的增加 D.X的物质的量的减少 解析分析该试题时,我们事先应该知道各个面积所表达的意义,借助图13可以分析出,S(abco)表示Y向正反应方向进行时减少的浓度或Z增加的浓度,而S(boc)则表示Y向逆反应方向进行时增大的浓度或Z减少的浓度,所以,S(aob)=S(abco)- S(boc)表示的是Y向正反应方向进行时“净”减少的浓度或Z“净”增加的浓度。 答案:C 解答要点面积图主要是根据横纵坐标以及速率的变化从正逆反应双方来确定具体区域对应的物质浓度的变化,进而进行解答。 类型七:开放型图像 例7在一定条件下,固定容积的密闭容器中反应: 2NO2(g)O2(g)+2NO(g);ΔH>0 达到平稳。当改变其中一个条件X,Y随X的变化符合图14中曲线的是( )。 A.当X表示温度时,Y表示NO2的物质的量 B.当X表示压强时,Y表示NO2的转化率 C.当X表示反应时间时,Y表示混合气体的密度 D.当X表示NO2的物质的量时,Y表示O2的物质的量 解析A.温度越高,NO2的物质的量越小。B.压强越大,NO2的转化率越小越小。C.由于质量不变,体积不变,所以密度不变。D. NO2的物质的量越多,O2的物质的量越多。 答案:A、B 例9.右图Ⅰ、Ⅱ、Ⅲ分别代表反应①③、②、④,则Y轴是指( ) ①N2(g)+3H2(g) 2NH3(g);△H=-Q ②H2(g)+I2(g) 2HI(g); △H=+Q ③CO(g)+2H2(g) CH3OH(g); △H=-Q ④2SO3(g)2 2SO2(g)+O2(g); △H=+Q A.平衡混合气中一种生成物的百分含量 B.平衡混合气中一种反应物的百分含量 C.平衡混合气中一种生成物的转化率 D.平衡混合气中一种反应物的转化率 解析如y轴表示平衡混合气中一种生成物的百分含量,①③增大压强,平衡向正反应方向移动,则生成物的百分含量增大;②增大压强,平衡不一定,则生成物的百分含量不变;④增大压强,平衡向逆反应方向移动,则生成物的百分含量减小,所以符合图像。A正确。 如y轴表示平衡混合气中一种反应物的百分含量,①③增大压强,平衡向正反应方向移动,反应物的含量减小;④增大压强,平衡向逆反应方向移动,则反应物的含量增大,与图像不符合。B错误。 如y轴表示平衡混合气中一种生成物的转化率,①③增大压强,平衡向正反应方向移动,生成物的转化率减小;④增大压强,平衡向逆反应方向移动,则生成物的转化率增大,与图像不符合。C错误。 如y轴表示平衡混合气中一种反应物的转化率,①③增大压强,平衡向正反应方向移动,反应物的转化率增大;④增大压强,平衡向逆反应方向移动,则反应物的转化率减小,与图像符合。 答案:D 解答要点开放型图像经常采用的方法是代入法,根据平衡移动原理及影响因素逐个代入后得出符合图像的反应。 (收稿日期:2015-01-15)
