预混指示剂的PCR系统使用与评测
2015-07-13金磊
金磊
摘要[目的]研究预混系统对于PCR以及其下游试验是否会产生影响。 [方法]采用“dye”及“density”预混的PCR系统与正常PCR系统进行PCR以及下游试验,使用琼脂糖凝胶电泳及NanoDrop2000检测。[结果]预混系统与正常系统对于PCR产物的特异性以及质量未见明显差别。[结论]预混系统也完全适合于下游的转化、连接、酶切试验。
关键词PCR;预混系统;正常系统
中图分类号S188文献标识码
A文章编号0517-6611(2015)07-021-02
聚合酶链式反应(Polymerase Chain Reaction, PCR)是体外扩增特异性DNA片段的技术,是DNA重组技术的一次飞跃。近30年间出现许多衍生的PCR技术,如多重PCR、PCR单链构象多态性、实时荧光定量PCR技术,这些技术大大促进了分子克隆的发展,尤其是实时荧光定量PCR技术的发展结合蛋白质定量分析,为研究基因表达及相关蛋白质功能分析提供了有力手段[1-2]。实时荧光定量PCR系统将染色剂SYBR Green I 预混在PCR系统中进行PCR反应,SYBR Green I与双链DNA结合而激发荧光的特性来定量检测[3]。在PCR系统中预混指示剂、聚蔗糖等使得PCR反应完毕后可直接上样检测,使用方便,但对于PCR下游的分子克隆如连接、酶切是否会产生影响尚不明确。笔者使用预混“dye”及“density”的PCR系统(以下简称预混系统)进行PCR以及下游的连接、酶切试验进行验证,正常PCR系统(以下简称正常系统)作为参照,研究预混系统对于PCR以及其下游试验是否会产生影响。
1材料与方法
1.1主要试剂
DNA ladder、限制性内切酶(Hind Ш、Nco I)、T4 DNA连接酶购买于NEB公司,PCR Master Max、p-EGMT载体琼脂糖购买于promega公司,Green PCR Master Max购买于Thermo scientific公司,LB培养基、LB琼脂均购自Invitrogen公司,PCR纯化试剂盒、柱式质粒DNA提取试剂盒、特异性引物购买于生工(上海)生物工程有限公司。
载体与菌株:pGEM-T载体、大肠杆菌JM101为徐州医学院医学生物化学与分子生物学教学实验中心保存。
1.2试验方法
1.2.1PCR反应。50 μl PCR体系:质粒1 μl,2xPCR Master Mix 25 μl,上下游引物各5 μl,无核酶水14 μl。反应条件:94 ℃预变性2 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸1 min,25个循环;最后72 ℃延伸5 min。
1.2.2PCR产物纯化。使用生工(上海)生物工程有限公司的柱式PCR产物纯化试剂盒,标准操作步骤参见操作手册。
1.2.3连接。取1 μl PCR纯化产物加入含有p-EGMT载体以及T4 DNA连接酶的体系,16 ℃ 水浴连接4 h。
1.2.4转化。取5 μl连接产物,将连接产物加入100 Ul感受态细胞JM101中,冰浴30 min,立即转入42 ℃水浴1 min,然后再转移至冰浴2 min,加入300 μl LB,37 ℃培养1 h后取50 μl涂布于准备好的含有氨苄青霉素的平板,倒置于37 ℃ 培养箱过夜培养。
1.2.5酶切。取10 μl质粒,加入含有Hind Ш、Nco I的双酶切体系,37 ℃ 培养箱酶切1 h。
2结果与分析
2.1PCR产物定量检测
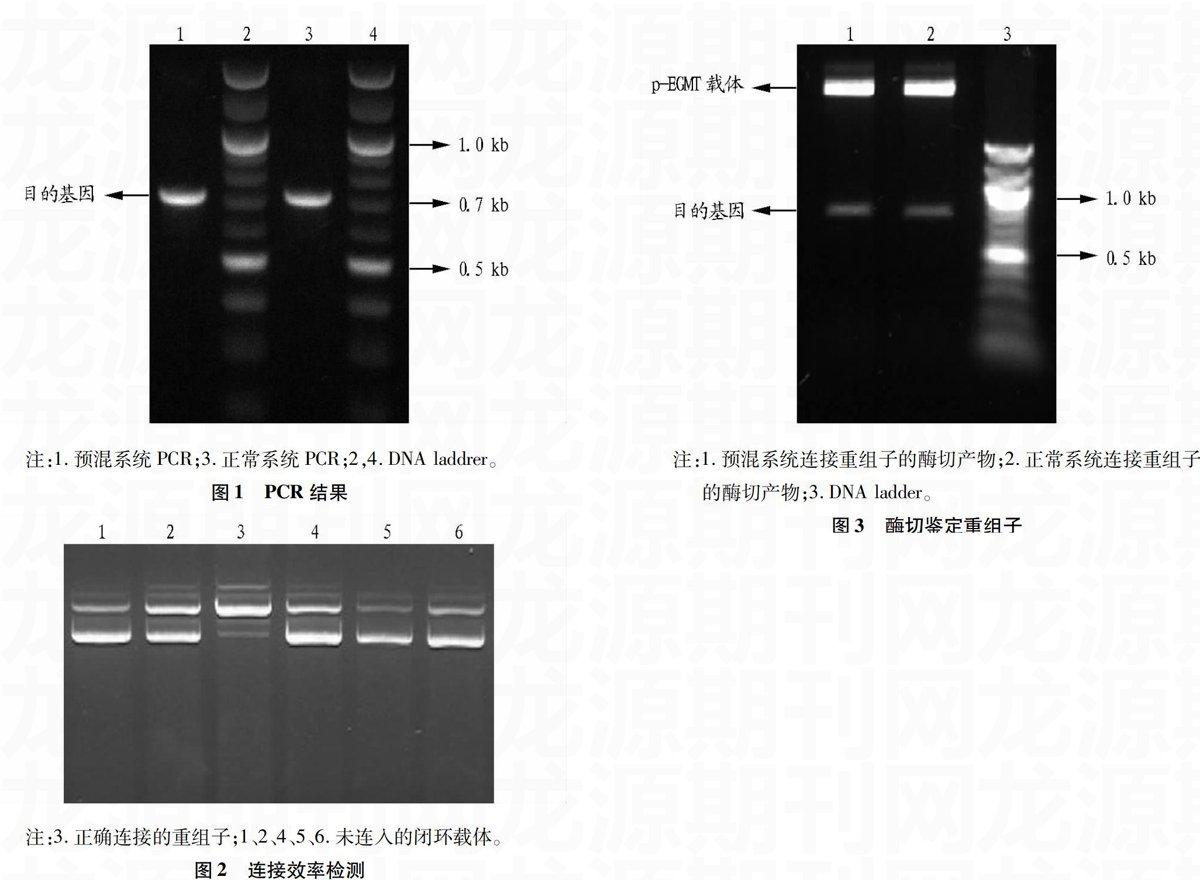
为了检测预混系统对于PCR反应是否产生影响,使用PCR预混系统及正常系统克隆同一个目的基因(711 bp)(图1),仅有目的基因出现在700 bp左右,2种系统的PCR产物均无非特异性条带,使用Nanodrop2000 测定其浓度,3次试验结果平均值分别为73与77 ng/μl,无明显差异。因此,预混系统及正常系统在PCR的特异性及PCR的产量方面无明显差异。
注:1.预混系统PCR;3.正常系统PCR;2,4.DNA laddrer。
图1PCR结果
2.2PCR 产物连接效率检测
为了验证预混系统对于PCR产物的连接有无影响,使用2种系统的PCR产物进行连接,连接产物转化后涂布于具有氨苄抗性的LB琼脂平板,过夜培养后随机挑选6个菌落进行质粒DNA的小量制备,然后用琼脂糖凝胶电泳检测其大小,结果见图2,由图2可知,3号质粒的移动较其余质粒慢,表示形成重组质粒的可能性较大,经过酶切鉴定确认为正确的重组子。此试验重复5次,得出预混系统与正常系统的连接效率分别为23.3%、26.7%,两者并无明显差别,因此,认为预混系统与正常系统对PCR下游连接试验无明显差异。
注:3.正确连接的重组子;1、2、4、5、6.未连入的闭环载体。
图2连接效率检测
2.3酶切鉴定重组子
使用酶切法鉴定重组子,选择预混系统与正常系统转化的重组子,在设计引物时上下游引物中分别加入酶切位点Hind Ш与Nco I,因此使用Hind Ш、Nco I进行双酶切可以将目的基因切下。由图3可知,预混系统与正常系统转化的重组子酶切结果有2条亮带,分子量较大的是p-EGMT载体,分子量较小的是目的基因,因不明原因使得DNA ladder中条带分辨不清,但仍可以判断目的基因(711 bp)在500~1 000 bp,考虑到双酶切且无非特异性条带,因此可以断定500~1 000 bp的条带是目的基因。对于PCR下游的酶切反应,预混系统与正常系统无明显差异。
3讨论
PCR 技术是现代分子生物学和生物工程技术的里程碑,由于研究目的、技术要求不同,商品化的PCR试剂盒也根据实
际需要作适当的调整,形成了适合现代科学研究的技术平台。
注:1.预混系统连接重组子的酶切产物;2.正常系统连接重组子的酶切产物;3.DNA ladder。
图3酶切鉴定重组子
该研究针对预混“dye”及“density”的PCR系统进行了多项检测,未发现和正常PCR系统的差异,且可以直接上样检测,在操作上简化了步骤,特别适合试验教学的开展。
另外,PCR系统经过不断创新出现了大量的衍生品试剂盒,对于PCR操作的成功率以及便利性具有很大提高,如DNA Taq酶经冻融多次后仍具有很高的活性,可以将DNA Taq酶、Mg2+ 、dNTP等按照一定比例混合在缓冲液中,大大简化了PCR操作步骤,提高Mg2+ 浓度可以拮抗染色剂、指示剂等对于PCR系统的抑制,出现了SYBR等染色剂预混的实时定量PCR试剂盒,对于核酸与蛋白质功能的研究提供了新的手段[4];针对模板链的特点也出现了一些PCR试剂盒,如高GC含量PCR试剂盒、超长链PCR试剂盒、热启动PCR试剂盒等。随着技术的发展及不断创新,PCR 技术正向简便、快捷、个性化、高质量、智能化的方向发展,同时PCR 技术的应用也将不断深入到科学研究的更多方面。
参考文献
[1]
郑景生,吕蓓.PCR 技术及实用方法[J].分子植物育种,2006,1(3): 381-394.
[2] 李玉梅,姚纪元,吴静.PCR-SSCP 技术的研究及应用进展[J].生物技术通报,2007(6):71-74.
[3] 刘歆,徐根明,郭江峰,等.基于SYBR Green I的双链DNA定量方法[J].中国生物工程杂志,2008,28(1): 55-60.
[4] TUMA R S,BEAUDET M P,JIN X K,et al.Characterization of SYBR Gold Nucleic Acid Gel Stain:A Dye Optimized for Use with 300-nm Ultraviolet Transillu minators[J].Analytical Biochemistry,1999,268:278-288.