抗锰细菌的分离鉴定及其对生猪养殖粪水中锰的去除效果
2015-07-13许爱清向言词杨光玺郭盈希宋早文
许爱清,向言词,杨光玺,郭盈希,宋早文
(1.湖南科技大学生命科学学院,湖南 湘潭 411201;2.江门出入境检验检疫局,广东 江门 529000)
锰(Mn)是生物体必需的矿质元素。人体缺锰会导致多种疾病的发生,但过量的锰对人体健康和人们的生活质量都有很大的危害[1–2]。锰矿废弃地、锰矿尾渣和电解金属锰、二氧化锰、钢铁冶炼等产生的含锰废物及高锰含量的地下水、地表水等是锰污染的主要来源[3]。中国湖南、重庆和贵州3 地交界处的锰矿产业十分发达,是当今世界名列前茅的电解锰和锰矿石生产基地,当地环境锰污染严重。湖南湘潭锰矿经历了近1个世纪的开采,锰污染已经对当地儿童的生长发育造成了一定程度的不利影响[4]。对锰污染地区进行治理已显得极为迫切。
在生猪规模化养殖过程中有大量粪污废水产生。这些废水含有丰富的有机质、氮磷以及铜、锌、砷等重金属元素,易对环境造成污染和破坏[5]。在畜牧业和饲料工业中,锰元素通常以硫酸锰、蛋氨酸锰、叶绿素铁锰盐等形式添加到动物饲料中,以促进畜禽的良好发育,取得催肥效果。猪饲料中过量的锰元素大部分随粪便或尿液排出体外。目前,关于生猪规模化养殖过程导致的锰污染防治鲜见报道。
1913年,Beijerinck 首次报道细菌对锰(II)的氧化作用,现已发现在水体、土壤和沉积物中均含有丰富的锰氧化菌[6]。锰氧化菌能使可溶性低价态锰(Mn2+)氧化生成不溶氧化态锰,如MnO2。这一自然现象能为锰污染的微生物修复提供指引。笔者研究抗锰细菌的分离鉴定与生猪养殖粪污废水的除锰方法,旨在为生猪养殖粪污废水的沉降除锰处理提供参考。
1 材料与方法
1.1 材料
从湘潭锰矿的矿石和锰尾矿坝的杂草根际采集土壤样本,保存于密封塑料袋中,用于抗锰菌种的筛选、分离。生猪养殖粪污废水采集于湘潭市某生猪养殖场。
牛肉膏蛋白胨固体平板培养基用牛肉膏5g、蛋白胨10g、氯化钠5g、琼脂20g、去离子水1 000mL 配制。抗锰菌选择性固体平板培养基以0.1%(或0.5%) MnSO4·H2O 替代牛肉膏蛋白胨平板中的氯化钠(下文分别称其为抗锰菌(0.1%)选择性固体平板和抗锰菌(0.5%)选择性固体平板)。
1.2 主要仪器与试剂
主要仪器有MycyclerTMThermal Cycler PCR 仪(美国伯乐公司,Bio–Rad)、PowerPacTMBasic 电泳仪(美国伯乐公司,Bio–Rad)、Kodak Gel Logic 212凝胶成像系统(Carestream Health INC.,USA)、尼康E100 生物显微镜系统(NIKON)和AA–7000 原子吸收分光光度计(日本岛津)。
含锰培养液用牛肉膏5g、蛋白胨10g、MnSO4·H2O 1~50g、去离子水1 000mL 配制而成。TaKaRa TaqTMDNA 多聚酶试剂盒(含TaKaRa Taq和10× PCR 缓冲液购于宝生物(大连)工程有限公司。16S rDNA PCR 通用引物对27F(5’–AGA GTT TGA TCM TGG CTC AG–3’)和1492R(5’–GGY TAC CTT GTT ACG ACT T–3’)由北京鼎国昌盛生物技术有限责任公司合成。dNTPs (各2.5 mmol/L)购于北京鼎国昌盛生物技术有限责任公司。亮柏蓝I(Leucoberbelin blue I,LBB)试剂为安耐吉化学产品。Mn2+标准溶液(1 000μg/mL)为国家有色金属及电子材料分析测试中心产品。
1.3 方法
1.3.1 抗锰菌株的分离与纯化
取土壤样品1g 加入到99mL 灭菌生理盐水中,配成稀释度 1∶100 的土壤悬液,轻微振荡,静置10min 后,用灭菌移液管移取其上层液体进行10 倍系列梯度稀释,得到稀释度1∶100、1∶1 000、1∶10 000 的悬液。分别移取0.2mL 稀释菌液涂布于牛肉膏蛋白胨固体平板和抗锰菌(0.1%)、抗锰菌(0.5%)选择性固体平板,置于28℃恒温培养箱中培养2~3 d。每组重复3次。采用菌落计数法计数土壤中细菌总数和抗锰细菌的数量。从抗锰菌(0.5%)选择性固体平板上挑取单菌落数个,分别转接到空白的抗锰菌(0.5%)选择性固体平板上,用划线分离单菌落,28℃培养2~3 d,得到抗锰细菌纯菌种,转接于试管斜面,28℃培养,待长满斜面后4℃保存备用。选取1 株在抗锰菌(0.5%)选择性固体平板表面产生黄红色色素的抗锰菌,用于后续研究。
1.3.2 所选取菌株的形态学特征观察
用肉眼直接观察所选取菌株在固体平板生长的菌落形态和在液体培养基中的生长特性。挑取试管斜面上的菌苔制成涂片,经结晶紫简单染色后,在普通光学显微镜油镜下观察菌体细胞的形态。
1.3.3 所选取菌株的16S rRNA 基因序列分析
28℃下,在牛肉膏蛋白胨培养液中接种所选取菌株,振荡培养36~48 h 后,将培养液10 000 r/min离心10min,收集菌体细胞。采用SDS 碱裂解法抽提细菌基因组DNA,以1.0%琼脂糖电泳检测DNA质量,-20℃保存,备用。用细菌16 S rDNA 特异性通用引物27F/1492R 扩增菌株的16S rRNA 基因片段。PCR 反应体系:10×Buffer(Mg2+plus)5.0 μL、dNTPs (各2.5 mmol/L) 1.0 μL、引物27F (20 μmol/L)和1492R(20 μmol/L)各1.0 μL、TaKaRa Taq (5 U/μL) 0.25 μL、DNA 模板1.0 μL,向体系中加入PCR 水至50 μL。PCR 产物经琼脂糖电泳检测,然后委托生工生物工程(上海)股份有限公司测序,得到该菌株的16S rDNA 大部分序列。在GenBank 数据库(http://www.ncbi.nlm.nih.gov/genbank) 中, 通 过BlastN 程序进行相似序列的搜索对比,以E 值 (expectation values)<1.0e–05 为标准判别同源比对的显著性意义。通过 BankIt 软件提交序列到GenBank 中。参照LPSN 数据库(http://www.bacterio. net/)中沙雷氏菌属的菌种名和模式菌株的16 S rDNA 序列登录号,从GenBank 的nucleotide 数据库中搜索,并选择适当的模式菌株的16S rDNA 序列。将所选取菌株和模式菌株的16S rDNA 序列在ClustalW1.83 程序中进行多序列比对,然后再利用分子进化遗传分析软件MEGA5.10 构建N–J 系统发育树(Neighbor–Joining tree)。系统发育树可靠性检测的自举值设定为1 000次。以大肠杆菌的模式菌株为外群[7]确定所选取菌株的系统发育地位。
1.3.4 所选取菌株对MnSO4耐受能力的测定
配制含Mn2+培养液各20mL,分别以0、0.05%、0.10%、0.20%、0.30%、0.40%、0.50%、0.60%、0.70%、0.80%、0.90%、1.00%、2.00%、3.00%、4.00%和10.00% MnSO4·H2O 替代牛肉膏蛋白胨液体培养基中0.5%的NaCl。将接种量为1%且培养18 h 后的液体菌种接种到不同MnSO4含量的培养液中,28℃培养箱中150 r/min 振荡培养48 h。根据菌体的生长浊度和产生色素的情况来评价所选取菌株对锰的耐受能力。
1.3.5 所选取菌株对Mn2+吸附沉降作用的测定
分别配制MnSO4浓度0.005、0.010、0.015、0.020 mol/L 的牛肉膏蛋白胨培养液,分别取20mL 盛装于100mL 三角瓶中,2个重复。接种培养18 h 的菌种到各培养液中,分别置于28、37℃振荡培养,48 h 后,以10 000 r/min 离心15min,收集上清液,用去离子水适当稀释上清,使其中Mn2+的质量浓度在火焰原子吸收光谱法测定的线性范围内(0~5mg/L 或0~0.09 mmol/L),采用火焰原子吸收光谱法测定上清液中Mn元素的质量浓度(M1)。根据M1与稀释倍数(N)之积计算出培养液中的锰残留量(M2)。M2与最初培养液中添加的Mn2+质量(M0)之差(ΔM)为锰去除量,ΔM 与M0之比为锰去除率。根据锰去除率的大小评价菌体对锰的吸附沉降能力。
1.3.6 所选取菌株对Mn2+氧化作用的测定
采用LBB 指示剂法[8]检测氧化锰是否生成及其生成的量,测定原理为:环境中的锰离子被锰氧化细菌氧化,生成氧化锰,将培养液离心后,生成的氧化锰与菌体一起沉淀下来。当存在高价锰(III~VII)时,LBB 的显色基团被氧化,生成蓝色物质,而且LBB 的显色反应不受Mn2+或Fe2+等其他离子的干扰。分别配制含0.01 mol/L MnSO4和0.01 mol/L MnCl2的牛肉膏蛋白胨培养液,接种所选取菌株,在28℃振荡培养后,10 000 r/min 离心,收集菌体和黑褐色沉淀物。用0.045 mol/L 的醋酸配制0.04%的LBB 溶液25mL。取沉淀物,用40mL超纯水悬浮后各取1.0mL,将其与5mL 的 0.04% LBB 混合,并轻微振荡,混匀,置于黑暗处过夜,观察溶液颜色的变化。
1.3.7 所选取菌株对生猪养殖粪污废水锰去除作用的测定
将温度、pH、接种量3个因素进行L9(34) 正交试验。取生猪养殖粪污废水50mL 分装于三角瓶,直接接种所选取菌株的液体菌种,150 r/min 振荡培养48 h 后,以10 000 r/min 离心15min,收集上清液,用原子分光光度计检测上清液中Mn2+的含量。以锰去除率为响应指标对正交试验数据进行方差分析。
2 结果与分析
2.1 所筛选菌株的形态特征
稀释涂布平板法计数结果表明,土壤样品中细菌总数、抗0.1% MnSO4的细菌数以及抗0.5% MnSO4的细菌数都约为3×105CFU/g。平板上生长的菌落形态有多种,挑取含 0.5% MnSO4平板上的1个略显红色的菌落,经划线分离纯化后,得到1 株抗锰菌细菌,将其定名为KM01。28℃下培养48 h,该菌株在牛肉膏蛋白胨斜面上产生鲜红的红色素(图1)。将KM01 在牛肉膏蛋白胨培养液中培养48 h,在28℃下菌液呈鲜红色,在37℃下不产生红色素(图2)。在油镜下染色观察,KM01 为杆菌。据此生长形态特性,初步判断KM01 为粘质沙雷氏菌。

图1 抗锰菌KM01 的斜面状态 Fig.1 Slant of Mn-resistant strain KM01

图2 在温度28℃(左)和37℃(右)下抗锰菌KM01培养液的颜色 Fig.2 Broth color of the Mn-resistant strain KM01 under 28 ℃ and 37℃
2.2 KM01 的16S rRNA 基因序列分析
提取KM01 的基因组DNA,采用细菌16S rDNA特异性通用引物27F/1492R 对其16S rDNA 进行PCR 扩增,扩增后的产物经测序,得到1 462 nt 核苷酸序列,提交到GenBank 数据库中的登录号为KF206118。将该序列在GenBank 中用BLAST 程序进行搜索对比,结果表明,它与沙雷氏菌属(Serratia)中一些菌株的16S rDNA 序列的一致性高达99%。系统发育分析结果显示,KM01 与粘质沙雷氏菌(Serratia marcescens)聚类在一个分支(图3),二者之间的亲缘关系最近,因此,可以确定KM01 是一种沙雷氏菌,定名为Serratia sp. KM01。

图3 基于16 S rRNA基因构建的N–J系统发育树指示菌株KM01与沙雷氏菌属的亲缘关系 Fig.3 Neighbor-joining phylogenetic consensus tree based on the 16S rRNAgene sequences showing the relationships between strain KM01 and type strains of thegenus Serratia
2.3 KM01 对MnSO4的耐受能力
以 1%接种量接种液体菌种于含 0 ~10% MnSO4的培养液中,在28℃、150 r/min 振荡培养48 h 后,在含0~4% MnSO4的培养液中,菌体细胞悬液浓密浑浊,而且随Mn2+含量的增大,菌液颜色由红色变成黄色,表明菌株KM01 能耐受4%的MnSO4。
2.4 KM01 对Mn2+的吸附沉降作用
依据锰元素的火焰原子吸收光谱法测定的标准曲线(图4),计算出培养液上清中锰的残留量和去除率(表1),结果表明,在培养液中Mn2+质量浓度低于825mg/L(亦即0.015 mol/L)、28℃下培养时,菌株KM01 对锰的去除率在89%以上。各组在28℃培养时的沉降除锰能力比在37℃时的强,表明28℃更适宜菌体生长与除锰能力的发挥。
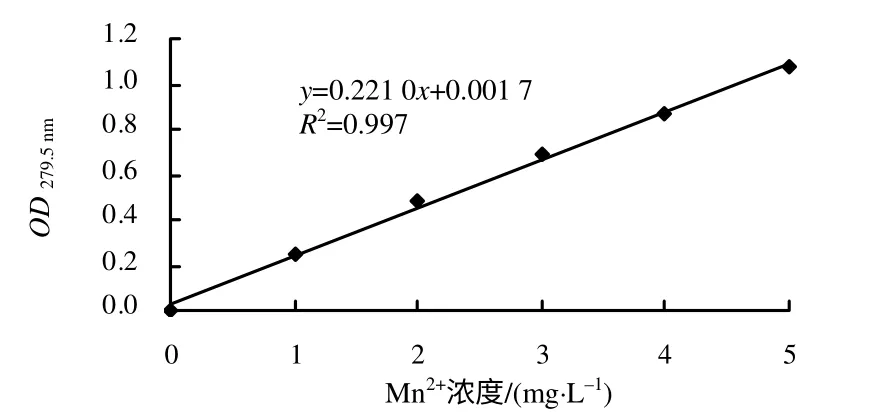
图4 火焰原子吸收光谱法测定Mn2+含量的标准曲线 Fig.4 Standard curve for Mn2+ concentration detected by flame atomic absorption spectroscopy
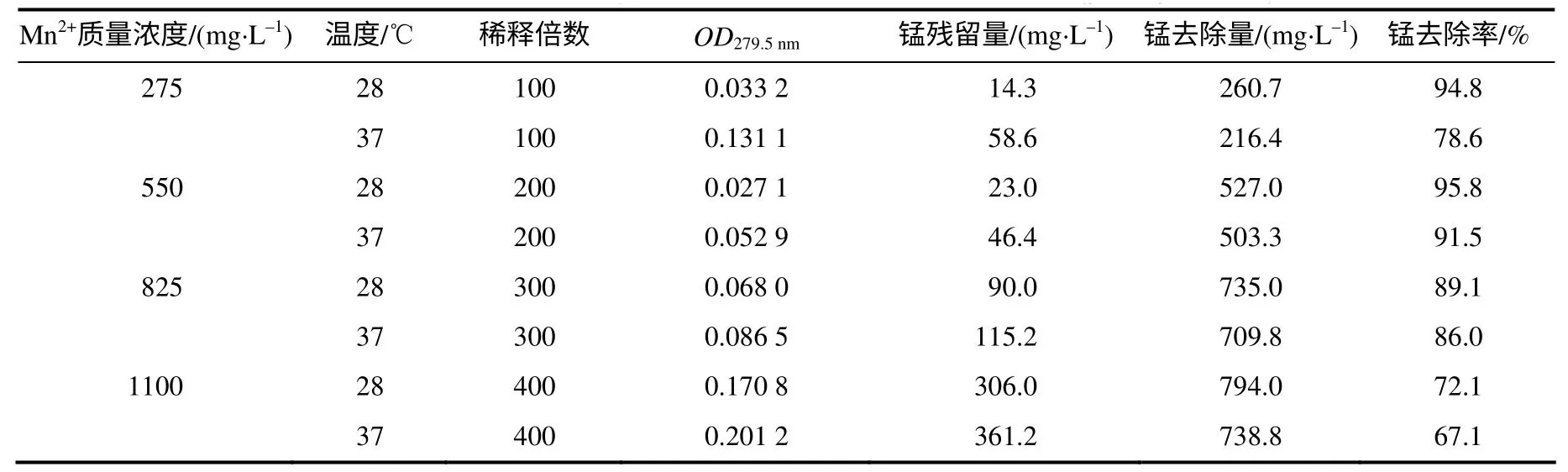
表1 火焰原子吸收光谱法测定的上清液中锰的残留量 Table 1 Mn residue in the supernatant detected by flame atomic absorption spectroscopy
2.5 KM01 对Mn2+的氧化作用
抗锰菌KM01 在含MnSO4和MnCl2的牛肉膏蛋白胨培养液中生长时产生沉淀物。KM01 在含0.01 mol/L MnSO4培养液中培养,10 000 r/min 离心15min 后,得到红色的上清液(图5–A 左)和黑色沉淀(图5–A 右);KM01 在含0.01 mol/L MnCl2培养液中培养,离心后得到淡红色的上清液(图5–B 左)和褐色沉淀(图5–B 右)。将沉淀物用去离子水重悬浮后,加入LBB 试剂,混合液避光放置24 h 后,未呈现阳性反应的蓝色,因此,KM01 对Mn2+的氧化作用为阴性结果,表明菌株KM01 在培养过程中产生的黑褐色沉淀物不含氧化锰,可排除菌株KM01 对Mn2+的氧化能力。菌株KM01 产生含锰沉淀物的机理可能是:细菌在生长过程中通过生物吸附作用将Mn2+吸附在细胞表面,还通过生物积累作用将Mn2+富集到细胞内部吸收利用,因此,单个细胞的密度增大而容易发生沉降,最终聚集成富含锰的细胞沉淀物。

图5 抗锰菌KM01 在含锰培养液中产生的沉淀物 Fig.5 Precipitate produced after Mn–resistant strain KM01growing in Mn–containing broth
2.6 KM01 对生猪养殖粪污废水中锰的去除作用
火焰原子吸收光谱法测定结果表明,生猪养殖粪污废水原液中Mn2+的含量为0.192 8mg/L。由正交试验结果(表2、表3)可知,pH 值、温度、接种量对锰的去除率依次减小,但3个因素对响应变量(锰去除率)的影响无统计学意义(P>0.05),锰去除效率最高的因素组合为pH 7、28℃和1%接种量。此试验条件下,锰去除率为80.5%。

表2 正交试验结果 Table 2 Results of the orthogonal experimental design
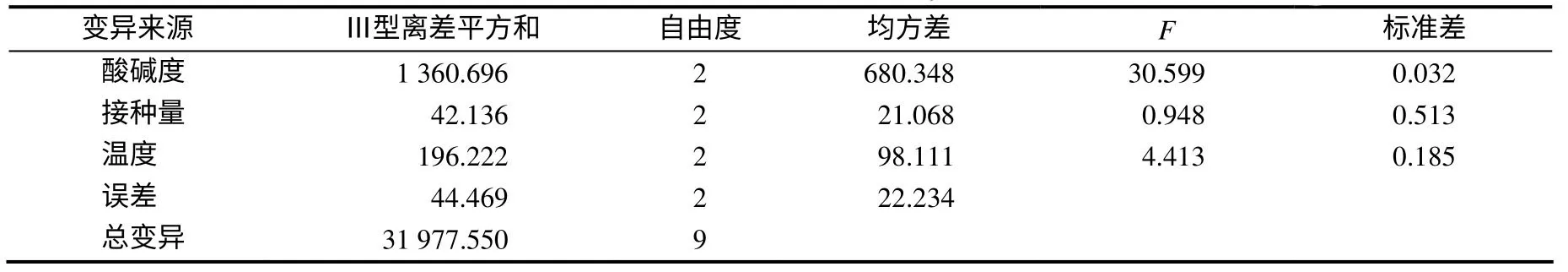
表3 以锰去除率为响应指标的正交试验方差分析结果 Table 3 Results of analysis of variance for orthogonal experimental design using removal rate of Mn as response factor
接种抗锰菌KM01 之前,生猪养殖粪污废水原液是具有恶臭的黑褐色有机废水;接种抗锰菌KM01 后,废水的颜色从黑褐色变成浅灰色,色度明显降低,且恶臭气味消失。
3 结论与讨论
1) 从湘潭锰矿采集土壤样本,经分离纯化,得到1 株抗锰细菌KM01。该菌在28℃产生红色素,而在37℃不产色素,结合16S rDNA序列(KF206118)分析和系统发育分析,鉴定该菌为一种沙雷氏菌(Serratia sp. KM01)。
2) 抗锰沙雷氏菌KM01 对Mn2+有很强的抗性和吸附沉降能力。28℃时,KM01 在含0~4% MnSO4的牛肉膏蛋白胨培养液中都能正常生长,所产生的色素随MnSO4浓度的升高而由红变黄。KM01 在含MnSO4和MnCl2的培养液中生长,能产生含锰的沉淀物。经火焰原子吸收光谱法检测分析,KM01 在含MnSO4(<0.015 mol/L)培养液中28℃振荡培养48 h,锰去除率在89%以上。
3) 将抗锰沙雷氏菌KM01 接种于含Mn2+0.192 8mg/L 的生猪养殖粪污废水原液中,在pH 7、28℃和1%接种量的试验条件下,锰去除率为80.5%。
粪污废水中Mn2+含量(0.192 8mg/L)接近自然湖水水体中 Mn2+含量的上限(0.004 ~0.200mg/L)[9]。直接排放未经处理的粪污废水在农村生猪养殖业中比较常见。时间一长,环境中的锰就会累积起来 。本试验中分离的抗锰沙雷氏菌KM01,在相当温和的培养条件(即只需调整生猪养殖废水的pH 值至中性)接种培养后即可以使其中的锰去除率达80%以上,表明抗锰菌KM01 在含锰生猪养殖粪污废水的除锰处理方面具有应用潜力。
[1] 姜义,张吉库.地下水中铁、锰的存在形式及去除技术探讨[J].环境保护科学,2003,29(1):32-34.
[2] 荆俊杰,谢吉民.微量元素锰污染对人体的危害[J].广东微量元素科学,2008,15(2):6–9.
[3] 凌薇薇,吴晓芙,陈永华,等.除锰微生物的筛选及其除锰特性研究[J].中南林业科技大学学报:自然科学版,2011,31(6):152-165.
[4] 曾锡莲,阳富强.湖南省湘潭锰矿596名儿童发锰含量的调查报告[J].广东微量元素科学,1995,2(4):32–35.
[5] 谭莹,李大胜.生猪的规模化养殖与环境保护:困境及选择——基于美国生猪产业养殖经验[J].中国农学通报,2010,26(13):20–22.
[6] 张震,李林,刘凡.细菌氧化锰的分子机制[J].微生物学报,2011,51(2):170-177.
[7] 许爱清,周士镭,冯杏杏,等.1株墨鱼干源中度嗜盐菌的系统发育分析与生长特性[J].食品工业科技,2013,34(21):175-179.
[8] Krumbein V E,Altmann H J.New method for detection and enumeration of manganese oxidizing and reducing microorganisms[J].Helgolander Wiss Meeresunters,1973,25:347-356.
[9] 郝瑞霞.锰的微生物地球化学[M].北京:冶金工业出版社,2000:44.
