三磷酸腺苷对小鼠内源性β防御素2表达的作用研究
2015-07-12刘爱红沈桢巍
刘爱红, 沈桢巍, 雷 撼
(1. 同济大学医学院,上海 200092;2. 同济大学附属东方医院重症监护室,上海 200120; 3. 同济大学附属东方医院呼吸科, 上海 200120)
·基础研究·
三磷酸腺苷对小鼠内源性β防御素2表达的作用研究
刘爱红1, 沈桢巍2, 雷 撼3
(1. 同济大学医学院,上海 200092;2. 同济大学附属东方医院重症监护室,上海 200120; 3. 同济大学附属东方医院呼吸科, 上海 200120)
目的 研究三磷酸腺苷(ATP)对小鼠内源性β防御素2(mice β-defensin-2 mBD-2)表达的影响,探讨提高机体抗感染防御能力的途径和方法。方法 取60只小鼠为研究对象,随机分为对照组(N,30只)和实验组(T,30只),实验组小鼠每只体内注入相同剂量的ATP,对照组小鼠注射等剂量的生理盐水,于注射后不同时间段12h(T1组)、24h(T2组)、36h(T3组)分别(10只/组)提取小鼠肺组织,检测内源性mBD-2mRNA的表达,同时制作肺组织病理标本,用免疫组化法检测各组小鼠肺组织中mBD-2蛋白的表达。结果 与对照组相比,经ATP处理后,实验组小鼠内源性mBD-2 mRNA的表达出现不同程度的上调,差别有统计学意义(P<0.01)。实验组间比较,T2组mBD-2 mRNA表达水平较T1组高,差别有统计学意义(P<0.01);T2组mBD-2 mRNA表达水平较C组高,差异具有统计学意义(P<0.05);mBD-2 mRNA表达水平在T1组和T3组之间无差异,无统计学意义(P>0.01)。免疫组化结果提示经ATP作用后,实验组小鼠肺组织中mBD-2蛋白表达上调,在24h达强阳性,与12h和36h相比有显著差异(P<0.05)。结论 体内注射外源性ATP可以上调小鼠肺组织mBD-2 mRNA的表达,且mBD-2 mRNA及mBD-2蛋白的表达随ATP作用时间的不同而不同,其在24h时表达水平达到峰值。
三磷酸腺苷; β-防御素2; mRNA; 小鼠
防御素(defensin)具有抗细菌、抗病毒、抗真菌、抗肿瘤等多种生物学活性,其独特的杀菌机制不易诱导产生耐药菌株,具有作为新型抗生素的潜在应用前景,成为近年来抗感染研究领域的一个热点。β防御素2是防御素中重要的一种,具有可诱导表达的特性[1],其主要的可能机制和途径是细胞内钙离子浓度升高导致信号通路的激活。ATP具有调节细胞内外钙离子浓度的作用,本研究旨在探讨外源性ATP对小鼠肺组织mBD-2基因表达的影响以及两者之间时效关系。
1 材料与方法
1.1 实验动物
BALB/c小鼠60只,清洁级,4~6周龄,体质量20~30g,雌雄不限,购自上海同济大学实验动物中心,在普通清洁级条件下饲养,自由取水、摄食。随机分为对照组(30只)和实验组(30只),再按照注射药物后作用时间的不同,分别将实验组、对照组小鼠分为3个亚组,即对照组: N1(12h)、N2(24h)、N3(36h);实验组: T1组(12h)、T2组(24h)、T3组(36h),每组10只。
1.2 主要试剂
Trizol试剂、RNA提取试剂盒(上海华舜有限公司),M-MLV First Stand Kit、Platinum SYBR Green qPCR SuperMix-UDG、trizol、引物(invitrogen公司),B-防御素2及内参B-Actin的合成(上海生工生物工程公司),DNA Mraker DL2000(TAKARA公司),三磷酸腺苷(ATP)(上海第一生化药业有限公司)。
目标基因mBD-2引物序列如下: 上游引物: 5′-GAA CTT GAC CAC TGC CAC ACC-3′,下游引物: 5′-GCT CTA GAT TAT CAT TTC ATG TAC TTG CAC C-3′,内参基因为β-actin引物序列为: 上游引物: 5′-AAC AGT CCG CCT AGA AGC AC-3′,下游引物: 5′-GGT TGA CAT CCG TAA AGA CC-3′(委托上海生工生物技术公司合成)。
1.3 主要器材
荧光定量PCR仪Bio-rad IQ5System,紫外分光光度计(Bio-rad, SmartSpec TM 3000,美国);Biofuge 28RS低温高速离心机(Heraeus,德国);680l酶标仪、凝胶图象分析系统(Bio-RAD,美国),Labofuge400R高速冷冻离心机(Heraus德国)。
1.4 试验方法
1.4.1 动物处理 将小鼠分别称重,按照ATP人用剂量80mg/kg折算,小鼠ATP用量为 16mg/kg。固定小鼠,经尾静脉进行药物注射,A组小鼠在12h后处死,B组小鼠在24h后处死,C组小鼠在36h后处死,提取各组小鼠肺组织备检。
1.4.2 提取小鼠肺组织总RNA 取小鼠肺组织 70~80mg,在液氮中研磨,直至样品成细粉状;加 1ml Trizol到每个空管中,将研磨好的样品放入Trizol中,轻混后4℃放置10min,离心半径10cm 10000g离心 10min,取上清液,弃沉淀,上清液转入新的EP管;每管加入200μl氯仿混匀,室温静置 7~8min,离心半径10cm,12000g离心15min;收集上清液约400~600μl,注意不要吸到中下层;上清液转管加入250μl异丙醇,轻混静置10min,12000g离心15min,离心半径10cm。弃上清液;加入无水乙醇1ml洗沉淀,轻混,离心半径10cm 12000g离心15min,收集沉淀,加入90%无水乙醇(900μl无水乙醇+100μl DEPC水)洗沉淀,轻混,离心半径10cm,12000g离心 15min;收集沉淀,加入75%乙醇1ml轻混,离心半径10cm, 12000g离心15min;吸干管中残留液体,吹干 (2min),直至管中无酒精气味;加入适量(最少 20μl)DEPC水溶解沉淀,-80℃保存。
1.4.3 RNA浓度与纯度鉴定 (1) 电泳鉴定: 吸取5μl总RNA经1%琼脂糖凝胶电泳,100V电压30min,凝胶成像仪照像,检测总RNA的完整性与纯度,见图1。(2) RNA浓度测定: 取2μl经过TE缓冲液10倍稀释的RNA样品,核酸蛋白测定仪检测总RNA的浓度,OD260/OD280的比值和OD260/OD230的比值。
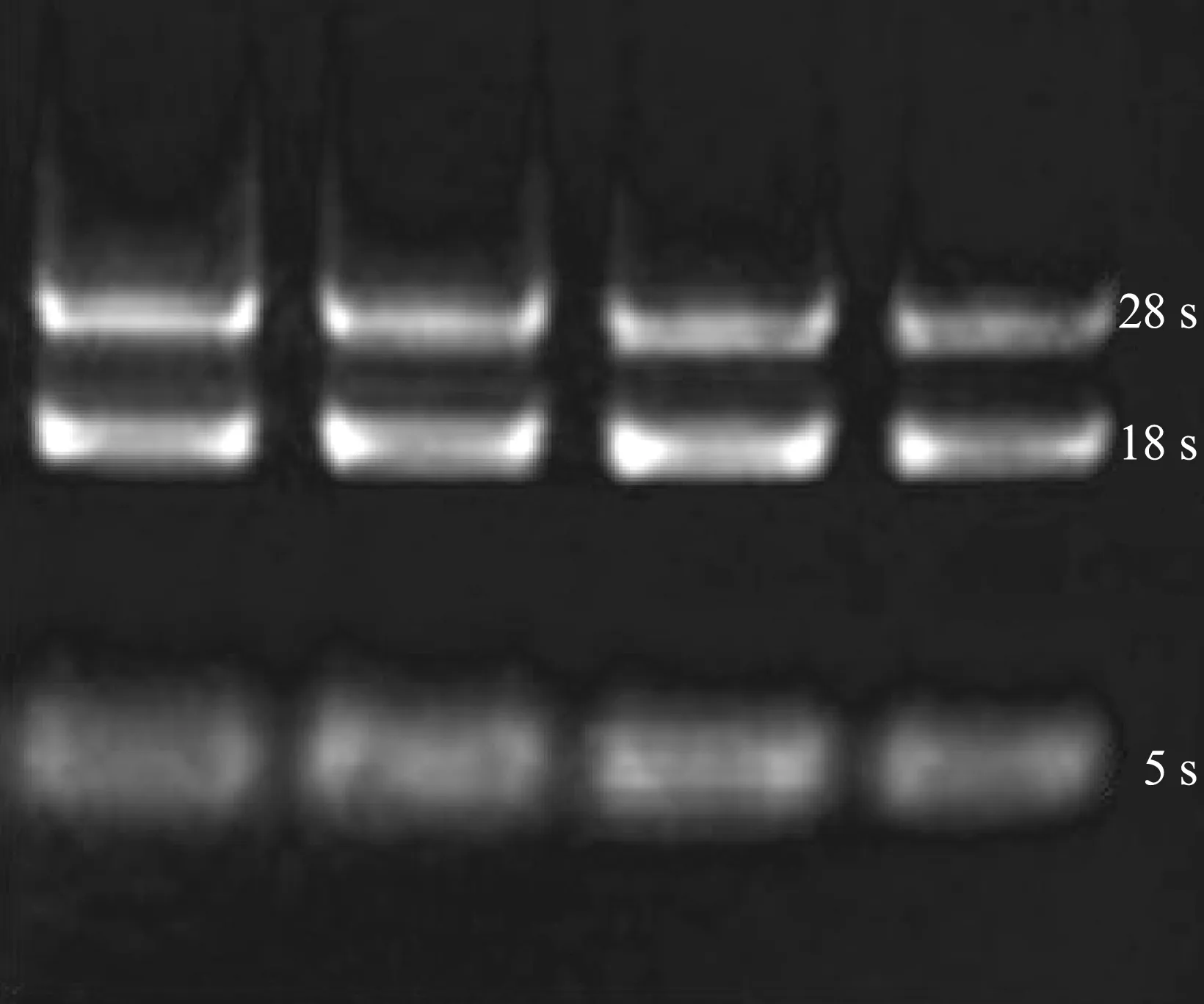
图1 小鼠肺脏组织总RNA电泳图Fig.1 Electrophoregram of total RNA from mouse lung tissue
1.4.4 将RNA反转录成cDNA 按照试剂盒说明书进行操作,步骤: (1) 将以下组分加入无核酸酶的微量离心管中: Oligo(dT) 1μl;总RNA 2μg;10m mol dNTP 1μl;加入灭菌蒸馏水至 12μl;(2) 混合物在65℃加热5min后,迅速置于冰上冷却。短暂离心后,加入以下组分: 5×第一链合成缓冲液 4μl;0.1m DTT 2μl;(3) 在离心管中轻轻将各种成分混合,并在37℃下孵育2min;(4) 在室温下加入1μl(200U)M-MLV反转录酶,轻轻吹打混匀;(5) 在37℃孵育50min;(6) 在70℃加热15min以终止反应。
1.4.5 荧光定量PCR检测mBD-2 mRNA的表达 反应体系: ddH2O 5.3μl;酶10μl;上游引物0.35μl;下游引物0.35μl;cDNA模板4μl。目标基因β-BD-2反应条件为: 95℃预变性2min,95℃变性20s,59℃退火30s,72℃延伸30s,39个循环。内参基因β-actin反应条件为: 95℃预变性2min,95℃变性 20s,56℃退火30s,72℃延伸30s,39个循环。采用 2-ΔΔCT法计算β-BD-2 mRNA的表达水平。
1.4.6 组织病理学检测 各组小鼠均取左肺上叶,剪取一小块组织,标本均经4%中性甲醛溶液充分固定,常规石蜡包埋,每个标本连续切片2张做免疫组织化学,观察肺组织中mBD-2蛋白的表达情况。切片厚度4μm。采用SP法免疫组织化学染色,一抗: 兔抗鼠mBD-2单克隆抗体按1∶100稀释。结果判读: 每张病理组织切片选5个视野,拍摄200×的数码照片,各组共拍摄150张照片。凡细胞浆内未着色者为0分、浅棕色者为1分、棕色者2分、深棕色者为3分;整块切片中阳性细胞占所有细胞中的比例<30%为1分、30%~70%为2分、>70%为3分、无细胞着色为0分。根据上述两项指标的积分数分为4级,0分为阴性(-),2~3分为弱阳性(+),4分为阳性(++),5~6分为强阳性 (+++)。
1.5 统计学方法
2 结 果
2.1 小鼠内源性mBD-2 mRNA的检测
经ATP处理后,与对照组相比,实验组小鼠内源性mBD-2 mRNA的表达出现不同程度的上调,差异有显著意义。实验组内的24h组mBD-2 mRNA表达水平较12h组(12h)高,差别有统计学意义(P<0.01);24h组mBD-2 mRNA表达水平较36h组高,差异具有统计学意义(P<0.05);mBD-2 mRNA表达水平在12h组(12h)和36h组(36h)之间,差异无统计学意义(P>0.01),见表1。

表1 ATP作用不同时间小鼠内源性β-BD-2mRNA的相对表达量
实验组内B与A组相比,**P<0.01,B组与C组相比,**P<0.01,A组与C组相比,*P>0.01
2.2 免疫组织化学染色
对照组小鼠肺组织见各级支气管腔黏膜层表达少量mBD-2(图1: N1-N3),在各时间段均呈弱阳性;实验组小鼠肺组织见各级支气管腔黏膜上皮表达大量mBD-2,在12h为阳性,在24h达强阳性,在36h为阳性(图1: T1-T3)。
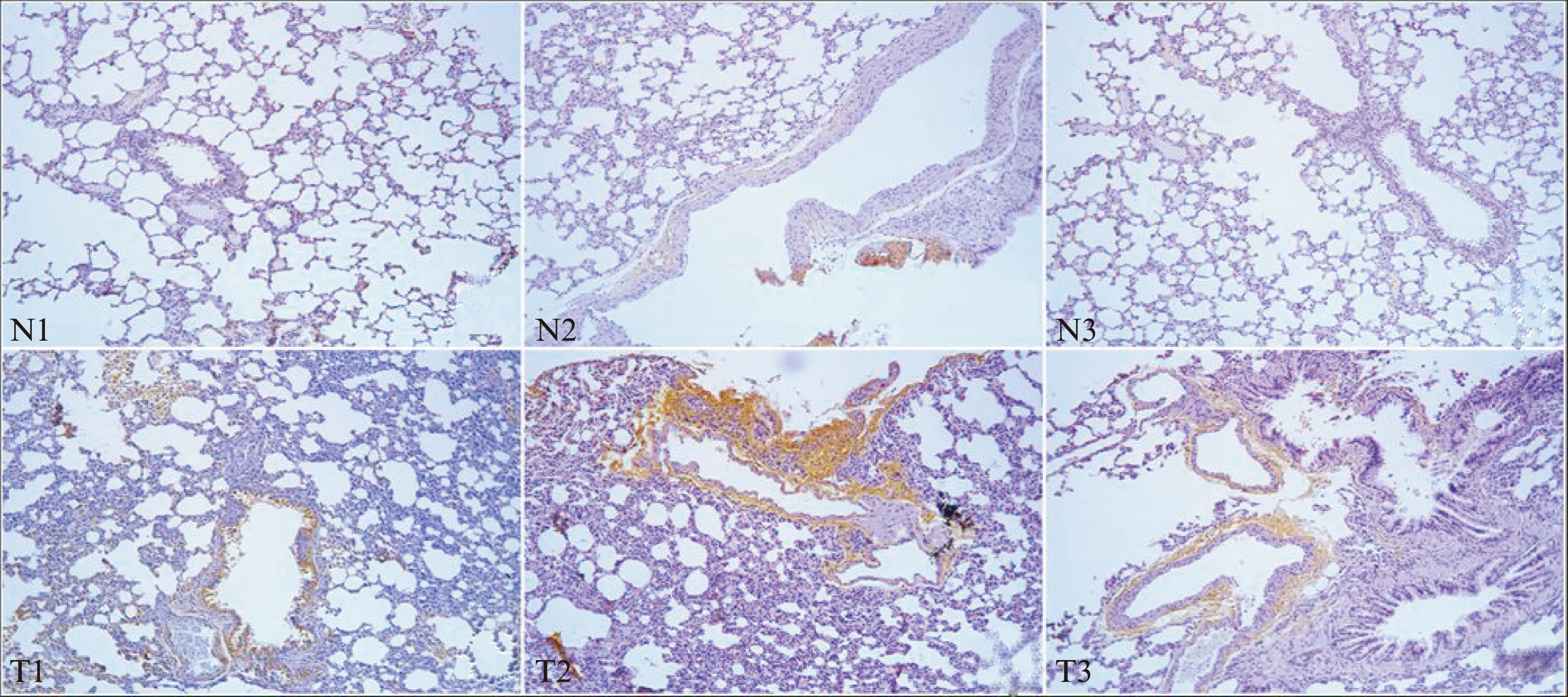
图2 各组小鼠肺组织中mBD-2的表达×200Fig.2 Expression ofmBD-2 protein in mouse lung tissue at different time points after ATP treatment demonstrated by immunohistochemisry
3 讨 论
β防御素2具有抗细菌、抗病毒、抗真菌、抗肿瘤等多种生物学活性,不仅可以直接抵抗病原微生物的感染,而且还可以通过启动获得性免疫系统来提高机体抵抗微生物感染的免疫水平,在皮肤、黏膜,尤其是气道黏膜的抗感染免疫防御中具有重要作用[2-3]。
β防御素2的杀菌谱很广,包括金黄色葡萄球菌、肺炎链球菌、大肠杆菌、绿脓杆菌和嗜血杆菌等[2],其抗微生物活性主要是通过破坏细菌脂质膜的完整性,引起细胞膜渗透性发生改变而起作用。有相关动物实验显示,rBD-2高表达能显著提高大鼠对金色葡萄球菌攻击的耐受性,抑制大鼠呼吸道rBD-2表达量,可使呼吸道对抗细菌感染的能力大大降低;王玉爱等[4]研究发现,在培养的唾液支原体中加入不同浓度的β防御素2,唾液支原体的抑制率可达90%。β防御素2具有可诱导表达的特性,可能通过多种信号途径被诱导,前期研究发现NF-κB参与并促进了诱导物诱导β防御素2基因的转录,细胞内钙离子浓度升高从而激活NF-kB信号通路是β防御素2诱导表达的关键因素。
ATP是体内的高能化合物,参与体内脂肪、蛋白质、糖、核酸及核苷酸等物质的代谢,是各种生物体内不可或缺的重要能量物质。近年,研究发现ATP还具有抗感染作用,可以通过对炎症细胞如中性粒细胞、巨噬细胞、树突状细胞等的趋化、募集、激活作用,诱导体内细胞因子和炎症介质释放和增加参与机体宿主抗感染免疫的过程[5-6]。Xiang等发现,ATP可诱导小鼠骨髓来源的巨噬细胞分泌释放IL-1和其他趋化因子,促进中性粒细胞向腹腔的募集[7]。Lee发现病毒感染使机体ATP生成显著增加,ATP通过与P2Y(2)受体的结合诱导各种炎症介质的释放,促进抗感染免疫反应的进行。ATP还具有细胞间信息传递功能,是非特异性钙调节剂,可通过影响细胞内外钙离子水平调节细胞的多种生物学功能,前期在培养的人原代气道细胞研究中发现,ATP可通过动员细胞内钙库释放和细胞外钙内流引起细胞内钙离子浓度升高,使NF-κB激活而引起β防御素2表达升高。另外,ATP是临床广泛使用的基础药物,安全可靠容易获得。因此,选择ATP作为诱导剂来探讨ATP对动物的内源性β-防御素2的影响。
本研究以小鼠为对象,静脉注射相同剂量的ATP,不同时间点提取小鼠肺组织,对内源性mBD-2 mRNA的表达量进行测定。结果显示在注射ATPY 12、24、36h后,小鼠肺组织中mBD-2 mRNA的表达均显著上调,同时mBD-2蛋白的表达也显著上调,两者的表达水平均在24h达到峰值。实验结果与前期细胞水平的研究相一致,但外源性ATP诱导体内β-防御素2的表达机制可能是多方面的,除了ATP通过影响细胞内钙离子水平激活NF-kB信号通路上调β-防御素2表达外,还可能: (1) ATP注射后增加了小鼠体内的基础代谢,使各项生命活动加强,mBD-2合成得以增加;(2) ATP引起细胞钙离子水平显著增加,进而激活一系列钙依赖的细胞因子和炎症介质释放和增加,间接诱导mBD-2的合成。经ATP刺激后,机体尚处于固有免疫的早期阶段,β-防御素2的合成与释放处于持续状态,并在24h达到高峰,之后合成与释放均减少,其表达下调。
综上所述,本研究证实外源性ATP对小鼠肺组织mBD-2及其蛋白的表达有一定的诱导作用,其机制可能是通过信号传导的调控和机体功能代谢实现的,ATP可以通过提高mBD-2参与机体的抗感染免疫过程。今后需对其具体的作用机制开展深入研究和探讨,对ATP诱导β防御素2预防、治疗感染性疾病的效果开展研究,为临床应用提供思路和方法。
[1] Shen Z, Lei H. Expression of hBD-2 induced by 23-valemt pneumococcal polysaccharide vaccine, Haemophilus influenza type b vaccine and split influenza virus vaccine[J]. Molecular Med Reports, 2012(7): 733-738.
[2] 颜露春,黄星,游琼,等.LPS介导滋养层细胞TLR4信号传导通路对HBD-2表达的影响[J].免疫学杂志,2011,03(5): 243-245.
[3] 黎观红,洪智敏,贾永杰,等.鼠李糖乳酸杆菌LG_A对鸡小肠上皮细胞β-防御素-9基因表达的影响[J].畜牧兽医学报,2012,04(6): 634-641.
[4] 王玉爱,刘志杰.人β防御素-2抗唾液支原体活性研究[J].当代医学,20l0,16(10): 10-11.
[5] 李明,马嫚,李岩,等.补中益气汤对小鼠肠道HBD-2表达的影响[J].中药新药与临床药理,2012,05(6): 511-514.
[6] 陈洁,陈莉莉.肿瘤坏死因子α诱导人皮肤角质形成细胞β-防御素的体外表达[J].中国组织工程研究,2012,50(6): 9431-9436.
[7] 沈桢巍,方路,姜敏敏,等.β防御素2对大鼠肺部炎症细胞因子的影响[J].成都医学院学报,2013,08(1): 17-20.
Effect of adenosine triphosphate on expression of endogenousβ-defensin 2 in mice
LIUAi-hong1,SHENZhen-wei2,LEIHan3
(1. Tongji University, Medical College, Shanghai 200092, China; 2. East Hospital, Tongji University ICU, Shanghai 200120, China;3. East Hospital, Tongji University Department of respiration, Shanghai 200120, China)
Objective To investigate the effect of adenosine triphosphate(ATP) on expression of endogenous β-defensin-2(β-BD-2) in mince. Methods Sixty BABL/c mice were divided into control group(N=30) and test group (T=30). Mice in test group received tail intravenous injection of 0.12mg/10g ATP, and the same volume of normal saline was given to mice in control group. Ten mice were sacrificed at 12h(T1), 24h (T2) and 36h (T3) after injection in both groups, respectively; and the lung samples were collected. The expression of mβ-BD-2 mRNA and protein in lung tissue was detected by RT-PCR and immunohistochemistry, respectively. Results Compared with control group, the expression of mβ-BD-2 mRNA was increased after ATP administration in test group. In test group the expression of β-BD-2 mRNA was higher at T2 than that at T1 and also higher that in control group at T2(bothP<0.01). There was no difference in expression of mβ-BD-2 mRNA between T2 and T3 in test group(P>0.01). Immunohistochemistry demonstrated that mβ-BD-2 protein was up-regulated at T2, the protein levels at T2 were higher than those at T1 and T3(P<0.01). Conclusion The expression of endogenous mβ-BD-2 mRNA can be up-regulated by ATP, and the effects vary at different time points of ATP administration.
adenosine triphosphate; βdefense element; mRNA
10.16118/j.1008-0392.2015.03.002
2014-06-02
上海市卫生局青年科研项目(20124Y113);浦东新区卫计委科研项目(PW2011A-7)
刘爱红(1977—),女,主治医师,学士.E-mail: lah818@sohu.com
雷 撼.E-mail: leihan@sina.com
R 758.63
A
1008-0392(2015)03-0006-04
