RNA干扰技术对HeLa细胞hTERT基因的抑制作用
2015-07-12高晓龙王培军邵志红王国良李铭华
高晓龙, 王培军, 邵志红, 王国良, 李铭华
(同济大学附属同济医院医学影像科,上海 200065)
·基础研究·
RNA干扰技术对HeLa细胞hTERT基因的抑制作用
高晓龙, 王培军, 邵志红, 王国良, 李铭华
(同济大学附属同济医院医学影像科,上海 200065)
目的 探讨RNA干扰对宫颈癌HeLa细胞人端粒酶反转录酶基因的抑制效应。方法 化学合成靶向于hTERT基因的siRNA,用阳离子脂质体转染法将其导入宫颈癌细胞内。实验分组: 转染组siRNA-1、siRNA-2、siRNA-3、siRNA-4、阴性对照组(siRNA-NC)、空白对照组(Blank)。通过RT-PCR和Western Blot方法分别检测宫颈癌细胞转染后细胞hTERT mRNA和蛋白水平,MTS法检测细胞生长增殖,流式细胞仪检测细胞凋亡情况。结果 siRNA-3 组的端粒酶活性明显下降,hTERT mRNA表达水平显著下降,hTERT蛋白表达明显下降,细胞凋亡率明显升高,与其他各组比较,差异有统计学意义(P<0.01)。结论 运用RNAi干扰技术,以hTERT基因为靶点的siRNA能特异性抑制宫颈癌HeLa细胞hTERT基因,下调hTERT mRNA及蛋白表达水平,抑制宫颈癌细胞生长增殖,促进宫颈癌细胞凋亡,为宫颈癌的基因治疗研究提供实验依据。
宫颈肿瘤; 人端粒酶反转录酶; Hela细胞; RNA干扰; 小干扰RNA
RNA干扰(RNA interference, RNAi)将外源性或内源性双链RNA(dsRNA)导入细胞后,可引起与该段RNA同源的mRNA产生特异性降解,其相应的基因也受到抑制,这种发生在转录后的基因沉默(post transcriptional gene silencing, PTGS)现象被称之为RNA干扰。各种体内外实验证实,21~23个Nt的短dsRNA,即siRNA(short interference RNA, siRNA),可在哺乳动物细胞组织内引起基因封闭作用,其结构稳定并且比用核酶或反义RNA更有效、更彻底,是一种全新的基因治疗手段。研究证明hTERT为端粒酶活性的必需和限速成分,端粒酶的激活与宫颈癌的发生密切相关[1-4]。本实验以hTERT基因为作用靶点,设计合成siRNA,并通过阳离子脂质体将其转染入宫颈癌Hela细胞,研究其抑制hTERT基因表达的效应及其对Hela细胞生长增殖的影响,为宫颈癌的基因治疗研究提供实验依据。
1 材料与方法
1.1 材料
人宫颈癌细胞Hela购自中国科学院上海生命科学研究院;DMEM培养基及胎牛血清购自美国GIBCO公司;siRNA试剂盒购自上海吉玛制药技术有限公司;LipofectamineTM2000购自美国Invitrogen公司;端粒酶活性检测试剂盒购自上海杰美基因医药科技有限公司;hTERT兔抗人多克隆抗体购自美国Sigma公司;MTS比色法细胞繁殖KIT购自上海杰美基因医药科技有限公司;Annexin-V/PI凋亡检测试剂盒购自BD Pharmingen公司。
1.2 方法
1.2.1 Hela细胞培养 宫颈癌细胞株Hela,用含100U/ml双抗,10%胎牛血清的DMEM全培养基进行培养,培养环境为: 37℃、5% CO2、100%湿度,约2~3d换全培养基一次。选取指数生长期细胞进行试验。
1.2.2 靶向hTERT基因的siRNA的制备 根据hTERT(Gene Bank编号NM003219: 2326-2344)的碱基序列按照Ambion公司siRNA设计软件设计其序列,经Blast Search检索确认与hTERT 基因以外的人类已知基因序列无同源性。序列如下:
siRNA-1正义链5′-CGGUGUACGCCGAGA-CCAATT-3′,反义链5′-UUGGUCUCGGUGUACA-CCGGG-3′;siRNA-2正义链5′-AUGCGGCCCCU-GUUUCUGGTT-3′,反义链5′-GAGCCAGUCUC-ACCUUCAATT-3′;siRNA-3正义链5′-CCAGAA-ACAGGGGCCGCAUTT-3′,反义链5′-UUGAAG-GUGAGACUGGCUCTG-3′;siRNA-4正义链5′-CAUGCGUCGCAAACU-CUUUTT-3′,反义链5′-AAAGAGUUUGCGACGCAUGTT-3′;siRNA-NC正义链5′-UUCUCCGAACGUGUC-ACGUTT-3′,反义链5′-ACGUGACACGUUCG-GAGAATT-3′。
所有序列由上海吉玛制药技术有限公司利用化学合成法合成。
1.2.3 转染 根据LipofectamineTM2000 reagent 说明书的实验步骤,用无血清培养液将siRNA与LipofectamineTM2000分别稀释至工作浓度。两者均匀混合,室温下作用20min。分别接种入48孔板,包括实验组siRNA-1, siRNA-2, siRNA-3, siRNA-4,对照组siRNA-NC,空白对照组Blank,每组设8个复孔,每孔siRNA的终浓度为 50nmol/L。
1.2.4 细胞形态学观察及细胞计数 取上述转染完毕细胞,于转染后12、24、48、72h计数细胞,并利用荧光显微镜观察HeLa细胞的生长状态,并拍照记录结果。
1.2.5 MTS法测定siRNA hTERT对Hela细胞增殖的影响 MTS是继MTT和XTT染料检测后的更新换代的产品。转染后分别进行48h后按照MTS试剂盒操作说明,在酶标仪上测波长492nm的吸光度(OD)值,计算细胞增殖抑制率。实验重复3次。
1.2.6 AnnexinV-FITC/PI双染检测Hela细胞凋亡 细胞转染48h后收集处理后的细胞培养液于流式专用管。采用CELL QUEST分析软件及DNA CELL CYCLE ANALYSIS软件分析细胞凋亡率,流式细胞仪检测结果以点状二维图(dot plot)表示。
1.2.7 RT-PCR检测hTERT基因的表达 细胞转染48h后,加胰酶消化离心收集细胞,采用TRIzol试剂提取各组的总RNA,进行RT-PCR,检测hTERT mRNA的水平。cDNA的合成严格按Fermentas公司protocol进行。以ACTB基因为内参照,PCR引物序列: hTERT基因上游: 5′-CTACGGCG-ACATGGAGAACAAGC-3′,下游: 5′-CGCAGCCA-TACTCAGGGACAC-3′;内参照基因ACTB上游: 5′-CCTGGCACCCAGCACAATGAAG-3′,下游: 5′-GGGGCCGGACTCGTCATACTC-3′。PCR反应条件为95℃变性30s,72℃退火1min,72℃延伸1min,循环30次后。于72℃延伸10min。PCR产物经1.5%琼脂糖凝胶电泳,紫外图像分析仪摄像,并应用天能分析软件对凝胶图像进行半定量分析,检测各组hTERT mRNA RT-PCR产物与其对应的内参ACTB mRNA RT-PCR产物的A值,并将AhTERT/AACTB的比值进行统计学分析。
1.2.8 蛋白印迹(Western blot)技术检测hTERT蛋白 将兔抗人β-Actin多克隆抗体(工作浓度为1∶5000),Western二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗(工作浓度为1∶1000),进行蛋白印迹法分析。将转染完毕细胞培养48h,裂解液提取总蛋白,进行SDS-PAGE凝胶电泳,通过电转移法将蛋白从聚丙烯酰胺凝胶转移至PVDF膜上,一抗封闭过夜,洗膜;二抗封闭2h,ECL发光,进行灰度分析。
2 结 果
2.1 荧光显微镜下细胞形态学变化
将各组细胞转染48h后置于倒置显微镜下观察: Blank组、siRNA-NC组、LIP组细胞贴壁生长,细胞轮廓清楚,细胞间结构紧密,细胞折光性强,细胞质清亮,很少见到颗粒,细胞核仁清晰。siRNA-3组细胞数量明显减少,贴壁性差,形状不规则,细胞皱缩,颗粒增多,细胞周围碎片增加,见图1、2。
2.2 通过MTS实验比较各组对宫颈癌Hela细胞生长抑制作用
细胞转染48h后按照GENMED-MTS细胞繁殖定量检测试剂说明书,在酶标仪上测波长492nm的D值,计算细胞增殖抑制率,见图3。
从图3可见,siRNA-3组转染后细胞抑制率与siRNA-1、siRNA-2、siRNA-4、siRNA-NC、Blank组空白对照组比较,细胞增殖明显减慢,有统计学意义(P<0.01)。而siRNA-NC组和Blank组比较,细胞增殖无明显变化(P>0.05)。
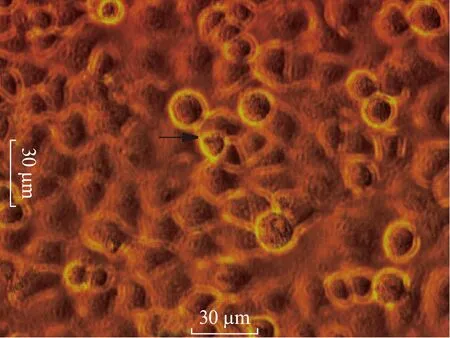
图1 未转染宫颈癌Hela细胞光镜图(400×)细胞轮廓清楚,折光性强,细胞核仁清晰(黑箭头)Fig.1 Optical microscopic diagraph of untransfected Hela cells(200×): clear cell outline, strong light reflection and clear nucleolus(black arrow)

图2 转染后48h宫颈癌Hela细胞光镜图(200×)细胞皱缩,颗粒增多,碎片增多(红箭头)Fig.2 Optical microscopic diagraph of HeLa cells transfected for 48h(200×): shrunken cells, increased particles and fragments(red arrow)
2.3 AnnexinV-FITC/PI双染检测Hela细胞凋亡
流式细胞仪检测结果以点状二维图(dot plot)表示,纵坐标为PI,横坐标为AnnexinV-FITC。左下象限为AnnexinV(-)PI(-)双阴性细胞群,代表正常细胞群;右下象限为AnnexinV(+)PI(-)单阳性细胞群,代表早期凋亡细胞群;右上象限为AnnexinV(+)PI(+)双阳性细胞群,代表晚期凋亡细胞群或死亡细胞群。流式细胞仪检测分析结果以百分比表示,细胞的凋亡程度通过AnnexinV/PI双染色进行分析。siRNA-3组、Blank组、siRNA-NC组细胞凋亡率分别为(48.21±4.25)%、(8.64±0.28)%、(8.67±0.40)%,siRNA-3组凋亡率较高,与Blank组和siRNA-NC组比较,有统计学意义(P<0.01),见图4。

图3 MTS检测不同组别Hela细胞生长增殖抑制,siRNA-3组转染后48h后,细胞增殖明显受到抑制(**P<0.01)Fig.3 Inhibition on HeLa cell proliferation in different groups and at different times by MTS: cell growth was inhibited significantly in siRNA-3 group, as compared with other groups (**P<0.01)

图4 流式细胞仪检测宫颈癌Hela细胞各组凋亡率Fig.4 Apoptosis rate of HeLa cells in different groups by flow cytometry右下象限为AnnexinV(+)PI(-)单阳性细胞群,代表早期凋亡细胞群;右上象限为AnnexinV(+)PI(+)双阳性细胞群,代表晚期凋亡细胞群或死亡细胞群;siRNA-3组与其他各组相比,凋亡率明显升高(P<0.01)
2.4 RT-PCR法检测hTERT mRNA含量
用LipofectamineTM2000介导siRNA转染入宫颈癌细胞中,hTERT mRNA在siRNA-1、siRNA-2、siRNA-3、siRNA-4、siRNA-NC、Blank组中的相对表达量分别为0.891±0.10、0.728±0.16、0.463±0.14、0.786±0.08,0.987±0.14、0.987±0.13,siRNA-3组与其他5组相比,hTERT mRNA表达水平显著下降,差异有统计学意义(P<0.01),见图5。
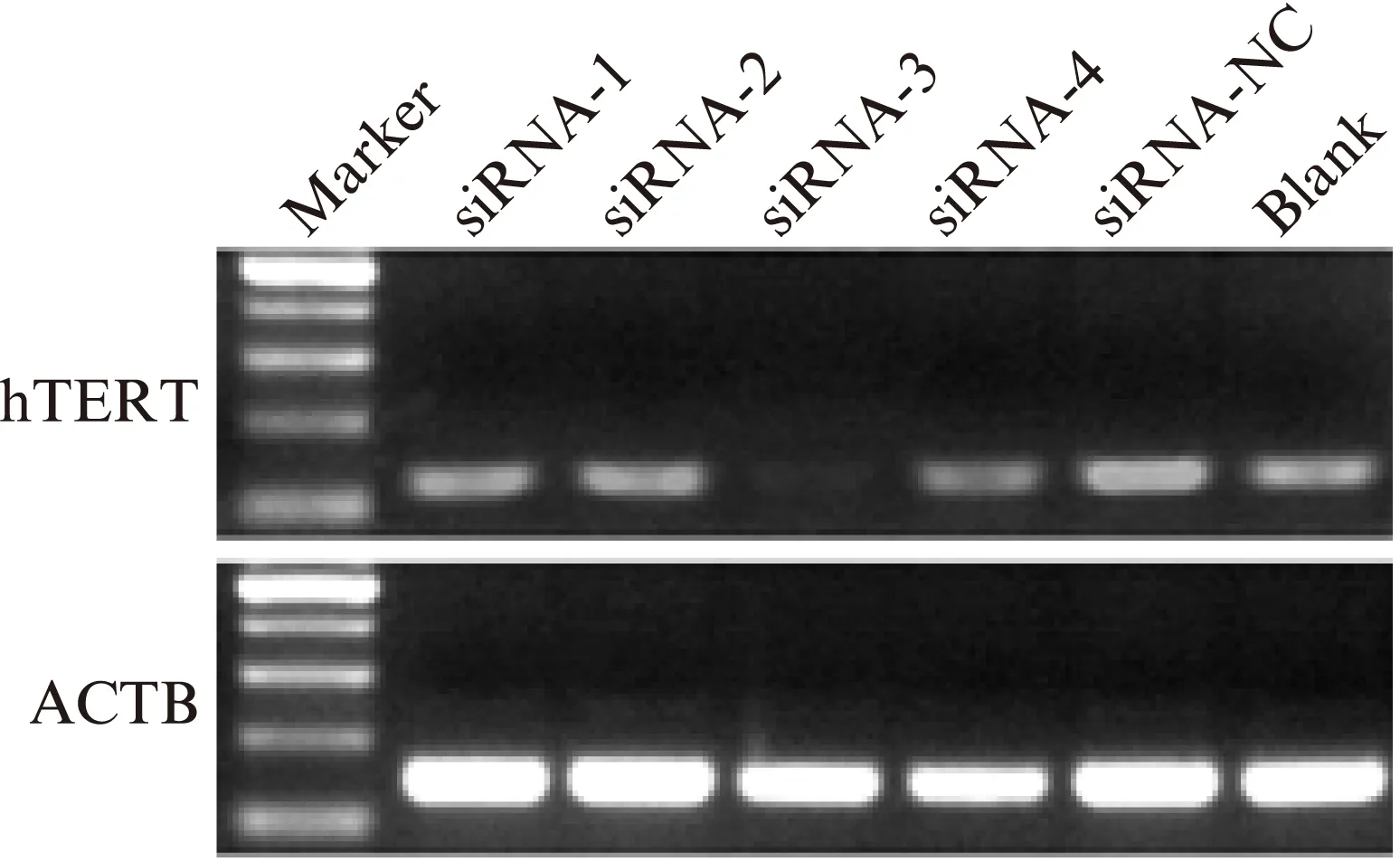
图5 RT-PCR检测siRNA转染后各组宫颈癌hela细胞中hTERT mRNA的相对表达Fig.5 RT-PCR detection of hTERT mRNA expression in cervical carcinoma HeLa cells siRNA-3组与对照组相比,亮度明显降低(P<0.01)
2.5 Western blot检测hTERT蛋白量
用LipofectamineTM2000将siRNA转染入宫颈癌细胞中,hTERT蛋白在siRNA-1、siRNA-2、siRNA-3、siRNA-4、siRNA-NC、Blank中的相对表达分别为(85.64±3.28)%、(70.67±3.40)%、(38.64±5.28)%、(88.87±3.39)%、(89.64±4.18)%、(99.67±5.40)%,siRNA-3组hTERT蛋白表达明显下降,与其他5组相比,差异有统计学意义(P<0.01,图6)。

图6 Western Blot检测宫颈癌hela细胞的hTERT蛋白相对表达Fig.6 Western blotting detection of hTERT protein expression in cervical carcinoma Hela cells siRNA-3组灰度与其他各组相比,明显下降(P<0.01)
3 讨 论
1989年,在人宫颈癌Hela细胞中发现了具有活性的端粒酶,而正常宫颈组织中无表达。端粒酶的激活是宫颈癌发生的关键步骤,在肿瘤细胞获得永生中起着重要的作用。宫颈癌组织中hTERT表达,与端粒酶活性呈明显正相关[5-7]。
目前,肿瘤基因治疗的三大手段包括: 反义核苷酸技术、RNAi技术、核酶技术。有学者已成功运用反义寡核苷酸和核酶等技术实现对肿瘤基因的抑制,在对人宫颈癌的研究中发现存在Survivin高表达的293例细胞均表现出放射抵抗,而通过采用反义核苷酸技术抑制其细胞中Survivin表达,具有肿瘤抑制的效果。用靶向Survivin 3′端CUA110三联体的锤头状核酶构建的重组质粒转染两类恶性黑色素瘤细胞株,分别为JR8和M14,可明显抑制Survivin基因的表达,使凋亡率比其母系细胞显著提高,并且使原本对放射线耐受的恶性黑色素瘤细胞对γ射线的敏感性明显提高。Zhang等[9]利用RNAi靶向抑制生存素基因,从而抑制移植瘤生长并促进其调亡,并通过增加X线放射治疗诱导的细胞调亡,增强放射治疗对移植瘤的生长抑制,进而提高移植瘤的放射敏感性。Sioud等[8-9]用RNAi沉默环氧合酶-2基因抑制宫颈癌Hela细胞的生长。Seo等[10]利用RANi技术沉默caspase-activated DNase基因抑制hela细胞的生长。但是运用RANi技术靶向宫颈癌hTERT基因的特异性抑制目前尚缺乏相关研究。本实验以hTERT为作用靶点,化学合成靶向于hTERT的小干扰RNA(small interfering RNA, siRNA),通过阳离子脂质体转染宫颈癌Hela细胞,发现宫颈癌Hela细胞转染后端粒酶活性明显降低。
RNAi技术是近年来发现和发展起来的一门新兴的基因阻断技术,目前,利用RNAi对肝癌、胃癌、肺癌的治疗已取得一定进展,成功沉默相关基因的表达。本研究以hTERT为作用靶点,按照siRNA序列设计原则,化学合成siRNA-1、siRNA-2、siRNA-3、siRNA-4、siRNA-NC小干扰RNA,理论上都有效,都能够抑制hTERT基因,本研究结果发现唯独siRNA-3组能够抑制宫颈癌细胞hTERT基因、蛋白表达,增加转染后宫颈癌细胞的凋亡率。结果说明,siRNA诱导RNAi,特异性降解同源mRNA,针对靶基因不同位点所设计的siRNA在诱导RNAi的作用效力是不同的。但是我们认为siRNA-3序列对hTERT基因表达起到关键作用,这与Sakaguchi报道相一致[11。
研究报道,端粒酶抑制剂对细胞增殖抑制可能与诱导凋亡有关。端粒酶抑制剂诱导细胞凋亡可能通过两条途径: (1) 端粒酶活性被抑制导致端粒酶延伸障碍,端粒长度不能维持,通过P53等凋亡调节蛋白诱导细胞凋亡;(2) 端粒酶活性被抑制,导致一些已经处于极短的端粒不能维持功能,细胞染色体发生端粒、融合、DNA破坏,引起细胞凋亡[12-15]。
外源性siRNA引发RNAi是短时效应,在多数哺乳动物细胞中,转染人工合成的siRNA后,基因抑制的高峰时间在转染48h后。本实验设计siRNA-1、siRNA-2、siRNA-3、siRNA-4、Blank组、NC组,并在转染后48h运用MTS法测定细胞增殖抑制率。结果显示,siRNA-3组与siRNA-1、siRNA-2、siRNA-4、Blank组、NC组相比,其细胞凋亡率增高,生长增殖受到抑制[16-17]。
综上所述,RNAi技术能特异性沉默宫颈癌细胞hTERT基因,下调hTERT基因mRNA及蛋白表达水平,降低端粒酶活性,抑制癌细胞生长增殖,从而促进宫颈癌细胞凋亡,为宫颈癌的基因治疗提供了实验依据。
[1] Tan J, Zhou XH, Zhu H. hTERT-siRNA could potentiate the cytotoxic effect of gemcitabine to pancreatic cancer cells Bxpc-3[J]. Exp Clin Transplant, 2012,10(4): 386-393.
[2] Hase T, Sato M, Yoshida K, et al. Pivotal role of epithelial cell adhesion molecule in the survival of lung cancer cells[J]. Cancer Sci, 2011,102(8): 1493-1500.
[3] 李正东,傅韵,成晓林,等.siRNA抑制Ki-67表达对乳腺癌MCF-7/ADR细胞阿霉素耐药性的研究[J].同济大学学报: 医学版,2011,32(3): 11-14,19.
[4] 刘娜,严海东,李雪竹.MCP-1siRNA真核表达载体的构建及其对HKC MCP-1基因沉默效应的鉴定[J].同济大学学报: 医学版,2007,28(2): 42-46.
[5] Liu XQ, Huang HZ, Wang JG, et al. Dendrimers-delivered short hairpin RNA targeting hTERT inhibits oral cancer cell growthinvitroandinvivo[J]. Biochem Pharmacol, 2011,82(1): 17-23.
[6] Ge LH, Shao WL, Zhang YD, et al. RNAi targeting of hTERT gene expression induces apoptosis and inhibits the proliferation of lung cancer cells[J]. Oncology Letters, 2011,2(6): 1121-1129.
[7] Zhang WX, Xing LN. RNAi gene therapy of SiHa cells via targeting human TERT induces growth inhibition and enhances radiosensitivity[J]. Int J Oncol, 2013,43(4): 1228-1234.
[8] Wang L, Shi JJ, Zhang HL, et al. Synergistic anticancer effect of RNAi and photothermal therapy mediated by functionalized single-walled carbon nanotubes[J]. Biomaterials, 2013,34(1): 262-274.
[9] Sioud M. Engineering better immunotherapies via RNA interference[J]. Hum Vacc Immunother, 2014,10(11): 3165-3174.
[10] Seo KS, Kim JS, Park JH, et al. PMA synergistically enhances apicularen A-induced cytotoxicity by disru-pting microtubule networks in HeLa cells[J]. BMC Cancer, 2014,14: 36.
[11] Sakaguchi M, Watanabe M, Kinoshita R, et al. Dramatic increase in expression of a transgene by insertion of promoters downstream of the cargo gene[J]. Mol Biotechnol, 2014,56(7): 621-630.
[12] Bilsland AE, Stevenson K, Liu Y, et al. Mathematical model of a telomerase transcriptional regulatory network developed by cell-based screening: analysis of inhibitor effects and telomerase expression mechanisms[J]. Plos Comput Biol, 2014,10(2): e1003582.
[13] Li J, Zhang GY, Liu T, et al. Construction of a novel vector expressing the fusion suicide gene yCDglyTK and hTERT-shRNA and its antitumor effects[J]. Exp Ther Med, 2012,4(3): 442-448.
[14] 王建军,刘彧,王宏卫,等.siRNA抑制survivin的表达诱导人卵巢癌SKOV-3细胞凋亡的研究[J].同济大学学报: 医学版,2007,28(2): 14-18.
[15] 修冰,陈敬德,黄滨滨,等.构建shRNA慢病毒载体抑制U937细胞株VEGFR-1基因的表达[J].同济大学学报: 医学版,2010,31(1): 12-16.
[16] Xu H, Gong X, Zhang HH, et al. Targeting human telomerase reverse transcriptase by a simple siRNA expression cassette in hepG2 cells[J]. Hepat Mon, 2015,15(3): e24343.
[17] Xie MX, Chen Q, He SY, et al. Silencing of the human TERT gene by RNAi inhibits A549 lung adenocarcinoma cell growth in vitro andinvivo[J]. Oncol Rep, 2011,26(4): 1019-1027.
Effect of RNA interference targeting hTERT gene on cel apoptosisin cervical carcinoma HeLa cells
GAOXiao-long,WANGPei-jun,SHAOZhi-hong,WANGGuo-liang,LIMing-hua
(Dept. of Radiology, Tongji Hospital, Tongji University, Shanghai 200065, China)
Objective To investigate the effect of RNA interference(RNAi) targeting human telomerase reverse transcriptase(hTERT) gene on cell apoptosis in cervical carcinoma HeLa cells. Methods Short interfering RNAs(siRNAs) targeting hTERT gene were synthesized, and siRNAs were transfected into Hela cells by cationic lipofection. Cervical carcinoma Hela cells were divided into six groups: blank control group, siRNA-NC group(negative group), siRNA-1, siRNA-2, siRNA-3, and siRNA-4 groups(RNA interference groups). The telomerase hTERT mRNA and hTERT protein were detected by reverse transcriptase polymerase chain reaction(RT-PCR) and Western blot, respectively. The proliferation of the Hela cell was analyzed by MTS and cell apoptosis was examined by flow cytometry. Results The hTERT mRNA of siRNA-1, siRNA-2, siRNA-3, and siRNA-4 groups, siRNA-NC group and blank group were 1.779±0.42,1.408±0.16,0.463±0.14,0.986±0.08,0.987±0.08,1.717±0.08, respectively. Compared to the other groups, the relative expression level of the hTERT mRNA of siRNA-3 group was declined markedly(P<0.01). The relative activities of the hTERT protein of siRNA-1, siRNA-2, siRNA-3, and siRNA-4 groups, siRNA-NC group and blank group were(85.64±3.28)%,(70.67±3.40)%,(38.64±5.28)%,(88.87±3.39)%,(89.64±4.18)%,(99.67±5.40)%, respectively. In comparison with other groups, the expression level of hTERT protein in siRNA-3 group was declined significantly (P<0.01). The apoptosis rate of siRNA-3, siRNA-NC group and blank group were(48.21±4.25)%,(8.67±0.40)%,(8.64±0.28)%, respectively. Compared with other groups, the apoptosis rate of siRNA-3 group was elevated significantly(P<0.01). Conclusion RNAi can specifically silence the hTERT gene of cervical carcinoma Hela cells by down-regulating the expression of hTERT.
cervical carcinoma; human telomerase reverse transcriptase; HeLa cell; small interfering RNA
10.16118/j.1008-0392.2015.03.004
2015-02-10
国家自然基金(30670611);上海市科学技术委员会基础研究重点项目(07jc14054)
高晓龙(1978—),男,主治医师,博士研究生.E-mail: gao_xiaolong@tongji.edu.cn
王培军.E-mail: tjpjwang@sina.com
R 737.3
A
1008-0392(2015)03-0015-06
