DNA甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷的抗胃肠道肿瘤机制研究
2015-07-07李伟施明亮毕京鹏周春林陆楠
李伟,施明亮,毕京鹏,周春林,陆楠
(1.莱芜市人民医院 普外科,山东 莱芜 271199;2.莱芜市人民医院 肿瘤科,山东 莱芜 271199;3.北京协和医学院 临床内科,北京 100000;4.山东大学 临床医学系,山东 济南 250100)
DNA甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷的抗胃肠道肿瘤机制研究
李伟1,施明亮2,毕京鹏1,周春林3,陆楠4
(1.莱芜市人民医院 普外科,山东 莱芜 271199;2.莱芜市人民医院 肿瘤科,山东 莱芜 271199;3.北京协和医学院 临床内科,北京 100000;4.山东大学 临床医学系,山东 济南 250100)
目的 观察DNA甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)对胃癌细胞生长的影响。方法 将野生型P53人胃癌细胞株AGS细胞,加入不同浓度的5-Aza-CdR,体外培养至不同时间。MTT法检测细胞增殖活性;平板细胞克隆形成实验检测细胞长期增殖活性(0~2.5 μM);流式细胞仪检测细胞周期变化(25 μM,0、12、48、96 h);Annexin V/PI双染实验检测细胞凋亡情况(2.5 μM,0、12、48、96 h);比色法检测Caspase-3活力、Western blot检测Caspase-3前体蛋白及PARP(poly ADP-ribose polymerase,PARP)蛋白的含量(2.5 μM,0、12、48、96 h)。结果 随着5-Aza-CdR浓度增加,对肿瘤细胞的抑制作用亦增强,在50 μM作用72 h时,细胞存活率达最低值(31.9%);随着药物处理时间的延长,胃癌AGS细胞凋亡增多,96 h的2.5 μM 5-Aza-CdR作用下,细胞的生长抑制达到了最高峰(44.4%),且其抑制作用表现为浓度和时间依赖性。5-Aza-CdR对肿瘤细胞长期生长有影响,克隆形成抑制率呈线性增加。流式细胞仪分析结果显示,随5-Aza-CdR作用时间延长,G2期细胞比例从0 h的(5.7±0.2)%增加到96h的(28.5±0.2)%。随着药物作用时间的累加,其凋亡率逐渐增加,各时间组的细胞凋亡率与空白对照组之间的差异均具有统计学意义(P<0.05)。与空白对照组比较,Caspase-3活力在药物处理48、96 h后显著提高(P<0.05),但12 h AGS细胞的Caspase-3活力无变化;48 h Caspase-3前体比12 h和未用5-Aza-CdR时明显减少,96 h减少最为明显;PARP在AGS细胞内经5-Aza-CdR作用48 h后亦被活化,96 h后几乎检测不到PARP的存在。结论 5-氮杂-2′-脱氧胞苷,能增强肿瘤细胞对化疗药的敏感性,可作为一种有效的抗胃肠道肿瘤药,。
5-氮杂-2′-脱氧胞苷;凋亡;Caspase-3;p53;DNA甲基转移酶
在肿瘤形成过程中多种调节细胞凋亡的基因表达被抑制[1-3]。5-氮杂-2′-脱氧胞苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)通过不同的信号通路诱导细胞分化和凋亡[4]。有学者[5-6]已经证明5-Aza-CdR可有效抑制细胞生长,其对凋亡的诱导独立于caspase通路。但详细的作用机制,特别是5-Aza-CdR在胃肠道肿瘤中对DNA甲基转移酶和沉默基因的影响至今仍未完全明了[7-8]。本实验选取野生型p53的胃癌细胞株AGS,检测其在不同时间和剂量的5-Aza-CdR作用下,胃癌AGS 细胞的生长活性以及各细胞周期的变化。
1 材料与方法
1.1 材料 胃癌细胞株AGS(购于中国科学院细胞库);DMSO、5-氮杂-2′-脱氧胞苷酸(购于上海赢瑞化学科技有限公司);DNA Marker DL-2000(Takara公司,日本);DMEM培养基(Gibco公司);青霉素、链霉素、溴化乙啶、溴酚蓝(美国Sigma公司),磷酸盐缓冲液(PBS)、台盼蓝、结晶紫、ECL 液、显影定影液(上海碧云天生物技术有限公司);脱脂奶粉(购于北京索莱宝生物技术有限公司);硝酸纤维素膜(美国Millipore公司),小牛血清(Gibco公司);胰蛋白酶(Sigma公司);蛋白分子量标准(Fermentas);细胞凋亡检测试剂盒Annexin V(上海前尘生物科技有限公司);ECL试剂盒、抗Caspase-3、抗PARP、actin特异抗体、PI抗体、MTT检测试剂盒、二抗(Santa cruz,美国);Caspases活性检测试剂盒(碧云天生物技术公司)。
流式细胞仪(美国BD公司);752紫外分光光度计(北京精密科学仪器有限公司);二氧化碳培养箱(美国Thermo forma公司);96孔培养板(上海生物工程公司)。
1.2 方法
1.2.1 细胞培养:人胃癌细胞株AGS培养于含10%小牛血清、100 kU/L青霉素、100 kU/L链霉素的DMEM培养液中,培养条件为37 ℃,饱和湿度,5%CO2。
1.2.2 分组及处理:将处于对数生长期的人胃癌细胞株AGS细胞以适宜密度接种(4~5)×105个/mL,加入不同浓度(0、0.01、0.1、0.5、1、2.5、5、10、25、50 μM)的5-Aza-CdR的DMEM培养基至不同时间(12、24、48、72、96 h)。5-Aza-CdR不稳定,储存液放在-80 ℃储存,每24 h更换新鲜药液。
1.2.3 检测方法:①MTT:法检测细胞增殖活性:将1.2.2中不同浓度(0~50μM)5-Aza-CdR培养72 h的细胞,加入5%MTT 20 μL,置于37 ℃、5%CO2培养箱中继续培养4 h。然后丢弃培养液,加入150 μL DMSO于室温下振荡15 min,然后对结晶物进行物理溶解。在酶联免疫检测仪570 nm处检测每个孔的吸光度值(A值)。②使用平板细胞克隆形成实验检测细胞长期增殖活性:将1.2.2中细胞0~2.5 μM 5-Az培养结束后用胰酶消化细胞,用PBS洗。在6孔板中以30~70个细胞的密度种下,每组设3个复孔,细胞在培养箱持续培养14 d取出,将培养液舍弃之后用pH 7.4的PBS轻度漂洗细胞3次。酒精固定后用姬姆萨染色液染色约30~40 min。水洗培养板后进行细胞计数,平均以50个细胞以上为1个克隆,按下述公式进行计算:克隆形成抑制率=(空白对照组的克隆形成率-实验组的克隆形成率)/对照组克隆形成率×100%。③流式细胞仪检测细胞周期:(4~5)×105个细胞接种于6孔板于37 ℃培养。待其有70%~80%汇合时用2.5 μM 5-Aza-CdR处理0~96 h;胰酶消化后,800 r/min离心5 min收集药物处理的细胞;4 ℃预冷的PBS洗2次。-20 ℃预冷的80%乙醇悬浮、固定细胞4 h以上或-20 ℃过夜;800 r/min×5 min,4 ℃预冷的PBS洗2次。用1 mL PI溶液(0.1% trixton-100,50 μg PI和200 μg RNase A)重悬细胞,并于37 ℃孵育15~20 min。在1 h内以流式细胞仪进行细胞周期及凋亡率的测定。实验重复3次。④Annexin V/PI 双染实验检测细胞凋亡情况:收集经过2.5 μM药物分别处理的胃癌AGS细胞培养0、12、48、96 h,用冷的PBS洗涤2次后,取5×106个细胞,1500 r/min离心5 min,弃上清,用400 μL 1×Binding Buffer重悬细胞;分成a、b、c、d 4管,每管1×106个细胞。此4管作为对照,a管不加入任何试剂,作为阴性对照管,b管加入Annexin V/PI作为阳性对照,c管只加入10 μL的PI液并避光孵育15 min,d管只加入5 μL的Annexin V并避光孵育15 min;在样本管和对照管中各加入400 μL 1×Binding Buffer,上机检测。⑤比色法检测Caspase-3活力、Western blot检测Caspase-3前体蛋白及PARP蛋白的含量:AGS细胞用2.5 μM 5-Aza-CdR分别处理0、12、48、96 h,比色法检测Caspase-3活力在处理前后的变化:取96孔酶标板,每个样本均设立测定孔和空白孔。步骤如下:向各孔中加入50 μL 2×Reaction buffer,然后加入细胞裂解液上清各50 μL震荡混匀,向各测定孔中加入底物工作液5 μL,各空白孔加入1×Reaction buffer 5 μL震荡混匀;置37 ℃避光水浴1.5 h,水浴结束以后于酶标仪检测光密度值。
Western blot测定不同时间5-Aza-CdR对Caspase-3前体蛋白及PARP蛋白含量影响:将30~60 μg样品于SDS聚丙烯酰胺凝胶上进行电泳,当溴酚蓝(示踪染料)到达距分离胶底部0.5 cm时,关闭电源,4 ℃条件下转印过夜。转印完成后,将硝酸纤维素膜用封闭液封闭,室温轻摇1 h。一抗反应:加入用封闭液稀释的一抗10 mL(抗Caspase-3、抗PARP、actin特异抗体,1:1000稀释),4 ℃轻摇过夜。漂洗滤膜3次,每次10 min。二抗反应:将膜用封闭液稀释的辣根过氧化物酶标记的相应抗体(稀释浓度为1:2000),室温轻摇1 h。漂洗滤膜3次。ECL法显色:将等体积ECL试剂A液、B液,混合均匀加到转印膜上,反应5 min。暗室曝光,曝光1~2 min,显影、定影,自来水充分冲洗。
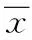
2 结果
2.1 5-Aza-CdR抑制胃癌细胞的生长增殖 本次实验选取了野生型人胃癌细胞株AGS,用不同浓度(0~50 μM)的5-Aza-CdR处理72 h,用MTT检测它对细胞生长活性的影响。图1A显示,未用5-Aza-CdR处理时,AGS细胞存活率为94.6%。当5-Aza-CdR的浓度从0.01 μM增加到0.1 μM时,细胞存活率从90.7%下降到82.1%,与空白对照组的AGS细胞相比差异具有显著性(P<0.05)。随着5-Aza-CdR浓度的不断增加,它对肿瘤细胞的抑制作用亦愈强。在50 μM时,细胞存活率达到了最低值(31.9%)。
本次实验选取2.5 μM 5-Aza-CdR处理AGS细胞12、24、48、72、96 h,如图1B显示,在AGS细胞中,2.5 μM 5-Aza-CdR处理12 h后,细胞存活率为92.8%,此与未加5-Aza-CdR处理的空白对照组细胞相比无显著性差别。在24 h后,细胞存活率从92.8%下降到85.7%,与对照组相比显著降低(P<0.05)。同时,随着药物处理时间的不断延长,愈来愈多的胃癌AGS细胞凋亡,本研究观察到在96 h的2.5 μM 5-Aza-CdR作用下,细胞的生长抑制达到了最高峰(44.4%)。以上实验结果表明,5-Aza-CdR可有效抑制胃癌AGS细胞的生长,并且其抑制作用表现为浓度和时间依赖性。
为了进一步探讨5-Aza-CdR对细胞生长增殖的作用,本实验用较为敏感的克隆形成实验去判定5-Aza-CdR是否对肿瘤细胞长期生长具有影响。基于MTT实验的数据,本研究分别选取0.01、0.1、1、2.5 μM处理的AGS细胞。与未加入5-Aza-CdR的对照组细胞相比,5-Aza-CdR导致胃癌AGS细胞克隆集落显著减少(图1C)。0.01和0.1 μM 5-Aza-CdR分别使细胞的克隆形成抑制率为29.6%以及44.6%,其克隆形成抑制率呈线性增加,在2.5 μM达到了最高峰(76.9%)。
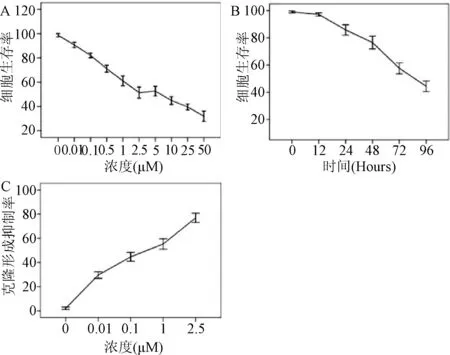
图1 5-Aza-CdR对胃癌AGS细胞的生长活性的影响Fig.1 The effects of 5-Aza-CdR on growth of gastric cancer AGS cells
2.2 5-Aza-CdR对细胞周期的阻滞 为了验证5-Aza-CdR抑制肿瘤细胞生长的作用机制是通过细胞周期的阻滞实现的,本实验用流式细胞仪分析5-Aza-CdR对胃癌细胞各期细胞比例的影响。AGS细胞用2.5 μM 5-Aza-CdR分别处理0、12、48、96 h。流式细胞仪分析的结果显示,在胃癌AGS细胞,随着作用时间的延长,G2期细胞比例从未加5-Aza-CdR处理时的(5.7±0.2)%增加到(28.5±0.2)%。而5-Aza-CdR对G1及S期并没有明显影响(见表1)。
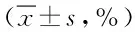
表1 5-Aza-CdR对胃癌AGS细胞各期细胞比例的影响Tab.1 5-Aza-CdR effects on AGS gastric cancer cell ±s,%)
2.3 5-Aza-CdR诱导胃癌细胞发生凋亡 AGS细胞用2.5 μM 5-Aza-CdR分别处理0、12、48、96 h后,Annexin V试剂盒验证不同时间作用前后细胞凋亡的变化。如图2示,在野生型P53的AGS细胞中,未用5-Aza-CdR处理的空白对照组细胞的早期凋亡的阳性率为2.4%,12 h 5-Aza-CdR作用之后其阳性率增加到(11.4±1.9)%。此外,随着5-Aza-CdR作用时间的不停累加,其凋亡率从48 h的(41.0±2.5)%增加到96 h的(63.4±3.1)%。各时间组的细胞凋亡率与空白对照组之间的差异具有统计学意义(P<0.05)。这一结果与MTT结果类似,均表现为明显的时间依赖关系(见图2)。
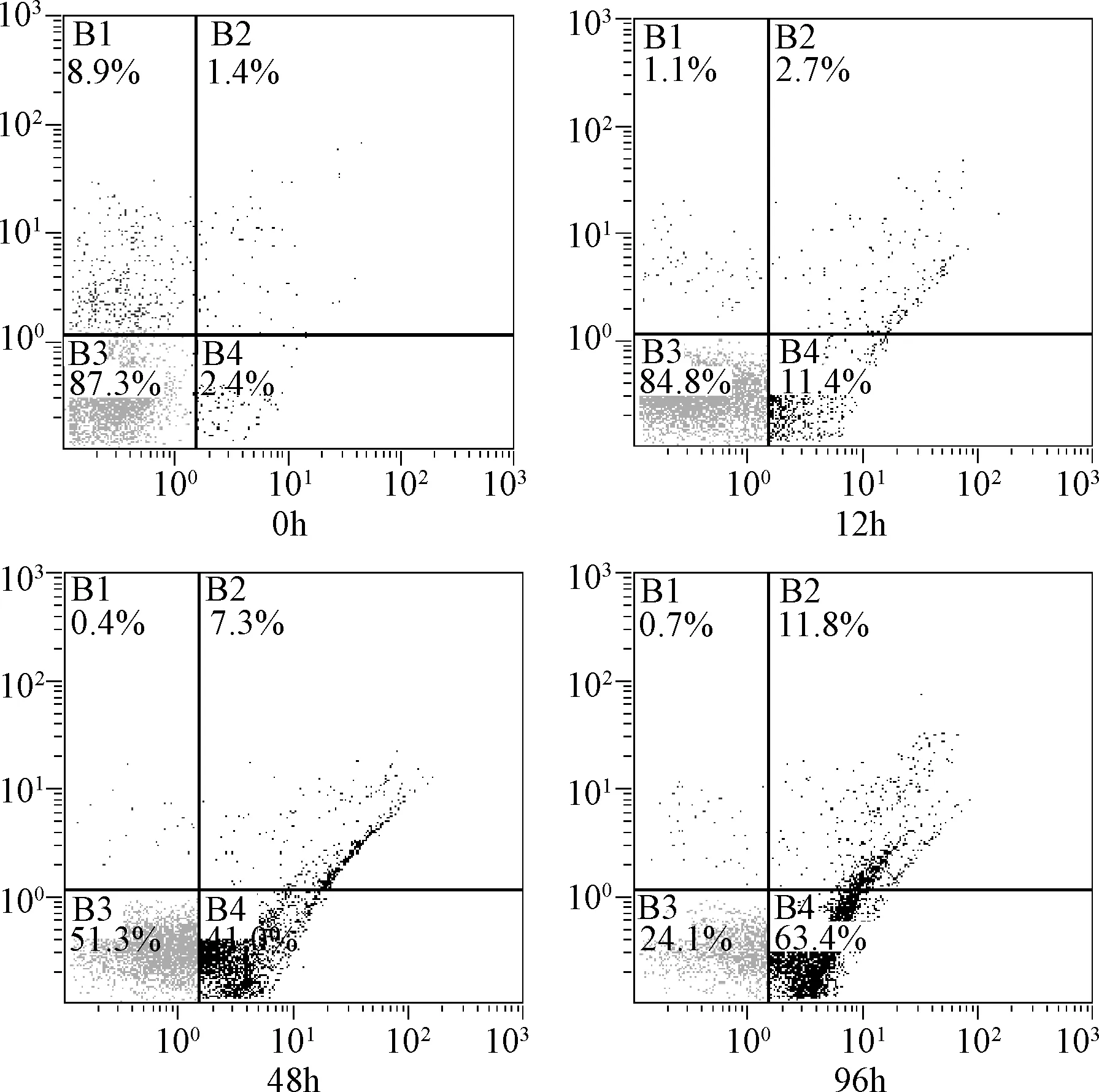
图2 5-Aza-CdR对胃癌AGS细胞凋亡的影响Fig.2 5-Aza-CdR effects on AGS gastric cancer cell apoptosis
2.4 5-Aza-CdR对Caspase-3凋亡通路的影响 AGS细胞用2.5 μM 5-Aza-CdR分别处理0、12、48、96 h,比色法检测Caspase-3活力在处理前后的变化。AGS细胞显示,与空白对照组比较,Caspase-3的活性在48、96h 5-Aza-CdR作用后显著提高(P<0.05),但12hAGS细胞的Caspase-3无变化(见图3A)。
Western blot测定不同时间5-Aza-CdR对Caspase-3蛋白表达的影响:如图3B所示,48 h的5-Aza-CdR作用后,AGS检测到了Caspase-3前体比12 h和未用5-Aza-CdR时明显减少,96 h后最为显著。而PARP(poly ADP-ribose polymerase,PARP),一种caspase激活后裂解的相应胞核内底物多聚酶,在AGS细胞内经过5-Aza-CdR作用48 h后亦被活化,本研究在96 h后几乎检测不到PARP的存在。
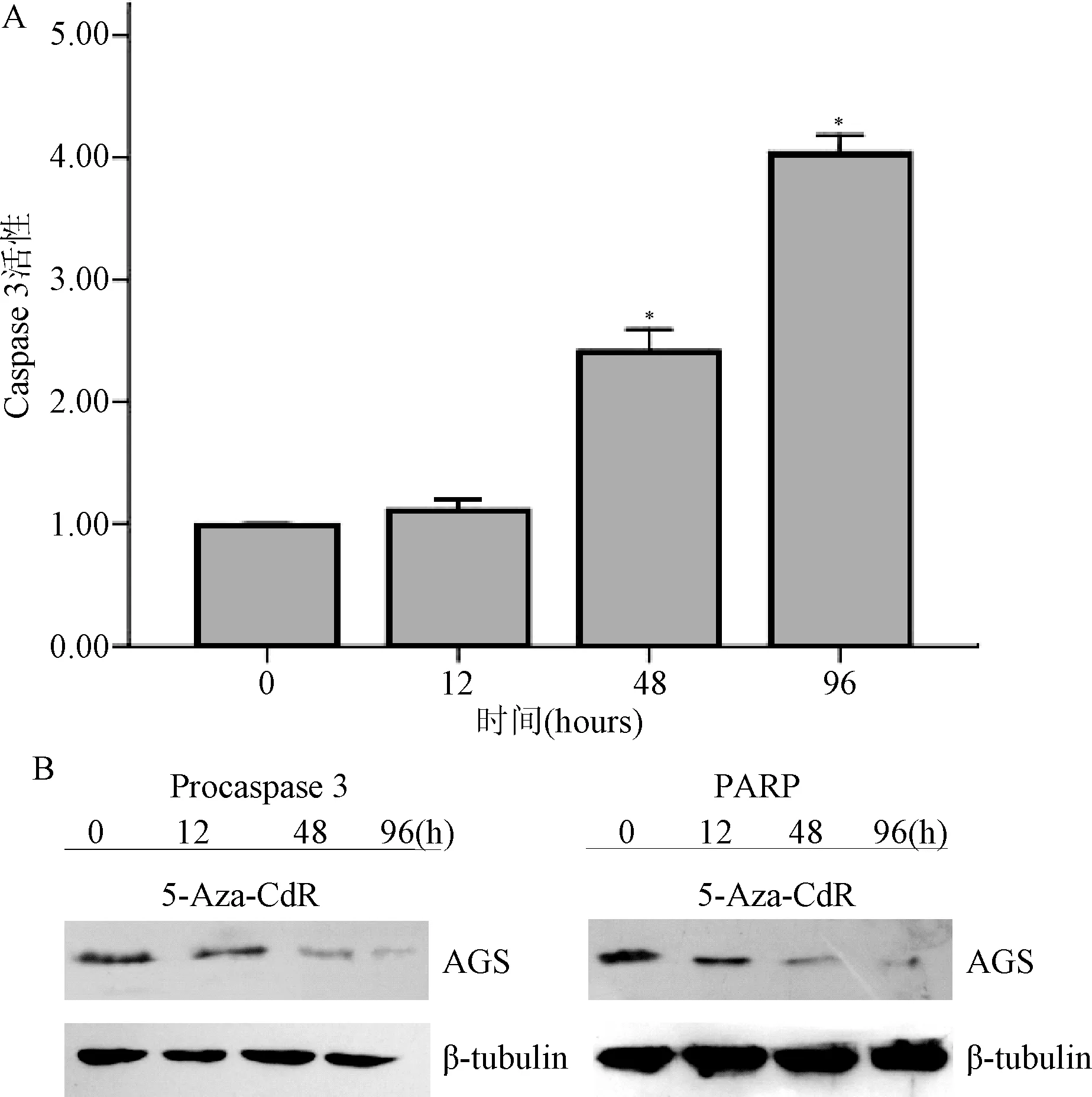
图3 5-Aza-CdR处理前后对AGS细胞Caspase-3及PARP的影响*P<0.05,与对照组相比Fig.3 5-Aza-CdR Caspase-3 on the AGS cells before and after processing and the effects of PARP*P<0.05,compared with control group
3 讨论
如何在不影响内环境稳态的前提下抑制细胞恶性增生进而保证细胞周期的正常进行是肿瘤治疗的手段之一[9-11]。截至目前,研究者们已发现的细胞周期包括G0、G1、S、G2、M期,其中2个决定性转变关卡:一是G1/S期转变,DNA合成开始;二是G2/M期转变,有丝分裂开始;其中最重要的是G1/S期。一个完整的细胞周期,主要是由细胞周期素(cyclins)、细胞周期素依赖蛋白激酶(cyclins dependent kinases,CDKs)和细胞周期素依赖蛋白激酶抑制剂(cyclins dependent kinase inhibitors,CKIs)进行控制[12-14]。在进一步探索5-Aza-CdR对胃癌AGS细胞生长抑制作用机制时,本实验发现5-Aza-CdR导致肿瘤细胞发生细胞生长周期G2期的阻滞。从上述的实验结果可以推断,5-Aza-CdR可能通过干扰一系列细胞周期相关的蛋白酶而使损伤的DNA不能及时修复,从而诱导肿瘤细胞生长增殖的抑制。
研究结果表明,随着5-Aza-CdR作用时间的延长,5-Aza-CdR诱导胃癌AGS细胞的凋亡亦显著地上升,呈现时间依赖效应。关于这一实验现象,可以推断5-Aza-CdR作为一种细胞周期阻滞剂,其作用与剂量和时间密切相关。在长时间或高浓度暴露于5-Aza-CdR时,它与DNA甲基转移酶(DNMT)共价结合,一方面通过调节细胞周期蛋白或相关激酶来使胃癌细胞周期调控点发生紊乱;另一方面,5-Aza-CdR刺激凋亡基因的表达而促发肿瘤细胞发生凋亡。既往研究指出,在低剂量5-Aza-CdR作用的情况下,它的抑制肿瘤作用是通过使基因的启动子发生脱甲基化而恢复沉默的抑癌基因的表达而实现的[15]。通过5-Aza-CdR的96 h的长时间刺激,胃癌AGS细胞表现出生长的显著抑制。相反,在12 h的5-Aza-CdR暴露时,AGS细胞的阳性凋亡率较48、96 h明显减少。可能正是由于短时间的5-Aza-CdR刺激,是以掺入细胞的DNA中与DNA甲基转移酶相结合,从而使发生高甲基化的基因脱甲基化作用为主。而凋亡的发生则需要一系列信号通路的活化,因此,只有当5-Aza-CdR作用足够时间后,它才有效地触发肿瘤细胞发生凋亡。有文献证实[14]5-Aza-CdR的抗癌作用与肿瘤细胞的p53基因状态相关,而此次研究选取的是野生型p53胃癌细胞株AGS,因此5-Aza-CdR显著抑制AGS细胞生长这一现象可以推断p53基因型可能与5-Aza-CdR的抗癌毒性密切相关。
实验数据证实,5-Aza-CdR诱导的胃癌AGS细胞的凋亡是由caspases凋亡通路所介导的,因为本实验检测到效应因子Caspase-3以及PARP的活化。当用广谱caspase抑制剂可有效地取消5-Aza-CdR对胃癌AGS细胞的促凋亡效应,这一实验结论与既往相关研究数据相一致[6-7],同时也证明了caspase凋亡通路与5-Aza-CdR的抗胃癌作用密切相关。
总之,上述实验结论表明5-Aza-CdR可显著地抑制胃癌AGS细胞的生长,使AGS细胞G2生长周期发生阻滞,进而诱导肿瘤细胞发生凋亡。更有意义的是,5-Aza-CdR的抗AGS细胞作用表现出浓度及其时间的依赖性,这一研究结论将为下一步5-Aza-CdR的抗胃癌作用机制的深入探索指明方向。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] Araújo F,Gouvinhas C,Fontes F,et al.Trends in cardiovascular diseases and cancer mortality in 45 countries from five continents(1980~2010) [J].Eur J Prev Cardiol,2013,21(8):1004-1017.
[3] Stone A,Sutherland RL,Musgrove EA.Inhibitors of cell cycle kinases:recent advances and future prospects as cancer therapeutics[J].Crit Rev Oncog,2012,17(2):175-198.
[4] Momparler RL,Bovenzi V.DNA methylation and cancer.J Cell Physiol,2000,183(2):145-154.
[5] Momparler RL.Pharmacology of 5-Aza-2′-deoxycytidine(decitabine)[J].Semin Hematol,2005,42(3):S9-16.
[6] Shin DY,Park YS,Yang K,et al.Decitabine,a DNA methyltransferase inhibitor,induces apoptosis in human leukemia cells through intracellular reactive oxygen species generation[J].Int J Oncol,2012,41(3):910-918.
[7] Patra A,Deb M,Dahiya R,et al.5-Aza-2′-deoxycytidine stress response and apoptosis in prostate cancer[J].Clin Epigenetics,2011,2(2):339-348.
[8] Issa JP,Ottaviano YL,Celano P,et al.Methylation of the oestrogen receptor CpG island links ageing and neoplasia in human colon[J].Nat Genet,1994,7:536-540.
[9] Tsunoda S,Smith E,De Young NJ,et al.Methylation of CLDN6,FBN2,RBP1,RBP4,TFPI2,and TMEFF2 in esophageal squamous cell carcinoma[J].Oncol Rep2009,21(4):1067-1073.
[10] Yoshiura K,Kanai Y,Ochiai A,et al.Silencing of the E-cadherin invasionsuppressor gene by CpG methylation in human carcinomas[J].Proc Natl Acad Sci USA,1995,92(16):7416-7419.
[11] Herman JG,Umar A,Polyak K,et al.Incidence and functional consequences of hMLH1 promoter hypermethylation in colorectal carcinoma[J].Proc Natl Acad Sci USA,1998,95(12):6870-6875.
[12] Gonzalez-Zulueta M,Bender CM,Yang AS,et al.Methylation of the 5′ CpG island of the p16/CDKN2 tumor suppressor gene in normal and transformed human tissues correlates with gene silencing[J].Cancer Res,1995,55(20):4531-4535.
[13] Bender CM,Zingg JM,Jones PA.DNA methylation as a target for drug design[J].Pharm Res,1998,15(2):175-187.
[14] Eads CA,Danenberg KD,Kawakami K,et al.CpG island hypermethylation in human colorectal tumors is not associated with DNA methyltransferase overexpression[J].Cancer Res,1999,59:2302-2306.
[15] Bird AP.The relationship of DNA methylation to cancer[J].Cancer Surv,1996,28:87-101.
(编校:王俨俨,谭玲)
Mechanism of DNA methyl transferase inhibitor, 5-Aza-2′-deoxycytidine against colorectal and gastric cancer
LI Wei1,SHI Ming-liang2,BI Jing-peng1,ZHOU Chun-lin3,LU Nan4
(1.Department of General Surgery, Laiwu City People’s Hospital, Laiwu 271199, China;2.Department of Oncology, Laiwu City People’s Hospital, Laiwu 271199, China; 3. Department of Clinical Medicine, Beijing Union Medical College, Beijing 100000, China; 4.Department of Clinical Medicine, Shandong University, Ji’nan 250100, China)
ObjectiveTo observe the effect of DNA methyl transferase inhibitor, 5-Aza-2′-deoxycytidine (5-Aza-CdR) on colorectal and gastric cancer. MethodsThis experiment selected wild-type P53 human gastric carcinoma cell line AGS with different concentrations and different time of 5-Aza-CdR processing, cell proliferation activity detectd by MTT(0~50 μM,72 h;2.5 μM,0~96 h), cell long-term proliferation activity detected by plate clone formation assay(0~2.5 μM), cell cycle analyzed by flow cytometry(2.5 μM,0、12、48、96 h), tumor cell apoptosis detected by Annexin V/PI(2.5 μM,0、12、48、96 h), activity of Caspase-3 detected by colorimetry(2.5 μM,0、12、48、96 h), proCaspase-3 and poly ADP-ribose polymerase (PARP) content detected by Western blot(2.5 μM,0、12、48、96 h). ResultsThe inhibition increased with increasing of 5-Aza-CdR concentration. It was lowest(31.9%) of cell viability with 50 μM treated for 72 h. The apoptosis of AGS cells increased with time increasing, the growth inhibition reached the highest peak (44.4%), and the inhibition was time and concentration dependent. The cell long-term proliferation activity had the relationship with 5-Aza-CdR treatment, and the inhibition rate of cloning efficiency increased linearly. The flow cytometric analysis showed, the cell ratio of G2 from (5.7±0.2)% of 0h to (28.5±0.2)% 96 h with the action time of 5-Aza-CdR extending. With the accumulation of the drug action time, the apoptosis rate increased at each time, with significant differences compared with blank group (P<0.05). The activity of Caspase-3 increased at 48 h, 96 h compared with control group, with significant differences (P<0.05), but there was no activity change of Caspase-3 at 12 h. The level of proCaspase-3 at 48 h was lower than that at 12 h, 0 h, and it was obviously at 96 h. After treated by 5-Aza-CdR for 48 h, PARP in AGS cells were activatied, and hardly detected the presence of PARP. ConclusionIt could be used as an effective anti colorectal and gastric cancer drug of 5-Aza-CdR, which can enhance the sensitivity of tumor cells to chemotherapy.
5-Aza-CdR; apoptosis; Caspase-3; p53; DNA methyl transferases
山东省医药卫生科技发展计划(2009HW038)
李伟,男,硕士,住院医师,研究方向:胃肠疾病的诊疗,E-mail:lw13506341545@163.com。
R737.33
A
1005-1678(2015)02-0080-05
