热性惊厥敏感鼠与耐受鼠的建立及海马差异表达基因的筛选研究
2015-07-07韦睿张玮于恩彦
韦睿,张玮Δ,于恩彦
(1.昆明医科大学第一附属医院 急诊科,云南 昆明 650031;2.浙江省人民医院 精神科,浙江 杭州 310014)
热性惊厥敏感鼠与耐受鼠的建立及海马差异表达基因的筛选研究
韦睿1,张玮1Δ,于恩彦2
(1.昆明医科大学第一附属医院 急诊科,云南 昆明 650031;2.浙江省人民医院 精神科,浙江 杭州 310014)
目的 建立热性惊厥(febrile seizures,FS)大鼠模型,筛选易感基因并探讨其相关的机制。方法 选取50只SPF级雄性SD 大鼠21日龄,通过发病率分析筛选热性惊厥敏感鼠与耐受鼠;通过FS 敏感组和耐受组差异(gene ontology,GO)功能分析,差异Pathway 分析,差异表达基因间相互作用关系网络分析,差异表达基因共表达网络分析,实时定量PCR 验证基因芯片数据方法研究其机制。结果 筛选获得FS敏感鼠和FS耐受鼠2种不同表型的FS模型鼠;热水浴诱导惊厥和KA诱导癫痫实验结果表明FS敏感鼠比耐受鼠表现出更强的惊厥发作现象;2种不同表型的FS模型鼠的表达谱芯片数据分析获得了1140个差异表达基因,其中包括602个上调基因,538个下调基因,并获得了差异显著的GO功能分类;差异表达基因间相互作用网络分析与白介素-6(interlukin-b,IL-6)IL-6有着紧密的联系;差异表达基因共表达网络分析得到共有174 个共表达能力发生巨大变化的基因。 同时,实时定量PCR验证结果与基因芯片表达一致,表明基因芯片数据的可靠性。结论 2种不同表型FS 模型鼠的建立提示表观遗传机制可能参与FS 疾病的发生发展;大鼠海马全基因组表达谱芯片分析结果提示免疫炎症、离子通道、代谢等多种因素可能在FS 发生发展中起重要作用。
热性惊厥;基因芯片;差异表达基因
热性惊厥(febrile seizures,FS),是一种发生在婴幼儿和儿童时期常见的、伴有体温升高的中枢神经系统功能异常癫痫综合征,通常与发热有关,但没有明显的中枢神经系统感染[1-3]。有关研究显示,FS的发病率在欧美国家为2%~5%,中国为5%~6%,日本为6%~9%,西太平洋马利亚群岛则为11.4%,并且表现出明显的种族和地域的差异性,具有典型特征的促发因素(高热)和发作年龄范围(6月~6岁)[4-5]。流行病学调查显示复杂型FS患者发生癫痫的相对危险性是一般儿童的10倍,严重影响广大儿童患者的身心健康和智力发育[6-7]。尽管多数FS是自限性的,但少部分病人后来演变为非热惊厥。复杂型FS被认为能够导致海马及颞叶硬化,它们是导致癫痫发生的病理基础。目前,关于FS疾病的确切发病机制尚不清楚。本研究旨在通过建立新的FS动物模型,采用高通量基因组学技术,筛选新的FS遗传易感基因,对于阐释FS的发病机制及其内在联系具有重要意义。
1 材料与方法
1.1 材料
1.1.1 实验动物:50只SPF级雄性SD大鼠(21日龄),体质量为50~54 g,由昆明医科大学动物实验中心提供(动物合格证号:2013A032)。动物饲养室温20 ℃,相对湿度60%,每日光照12 h,自由摄食、饮水。定期打扫卫生,保持环境整洁,并注意避免非特异性应激反应的发生。动物使用和处理遵照美国国立卫生署颁布的《实验动物关护和使用指南》。
1.1.2 主要试剂和仪器:水合氯醛、青霉素、KA均购自南京建成,DNA提取试剂盒购自Santa Cruz。
恒温的水浴箱、高恒温水浴箱(Selby Scientific and Medical,美国);紫外凝胶成像仪(Vilber Lourmat 公司,法国);电泳仪(北京东方仪器厂);电子天平(METTER TOLEDO 公司,型号:PL203);不锈钢灭菌锅(上海申安医疗设备,型号DSX-280A)。
1.2 方法
1.2.1 热性惊厥敏感鼠与耐受鼠的建立:FS动物模型的筛选方法:第一代选取50只21日龄雌雄各半野生型SD大鼠,根据经典的热水浴诱导惊厥模型的方法[8],将大鼠放入一个透明的玻璃筒中(直径6 cm,高20 cm),此玻璃筒下部有多个小孔与外部相通。将筒竖立于恒温(45.00±0.25) ℃的水浴箱中,通过向玻璃筒底垫放塑料垫片以调节筒中水的深度,以大鼠沿筒壁站立时仅能露出头部为准,水浴4 min;对热水浴处理的大鼠进行摄像,双盲法记录大鼠发作的潜伏期、持续时间、发作等级。惊厥潜伏期(min):水浴开始至开始发生惊厥之间的时间。惊厥持续时间(min):开始发生惊厥至惊厥停止之间的时间。按照FS的5级行为学评分标准[9]:0级为未发生惊厥;1级为面部抽动;2级为点头、甩尾;3级为一侧前肢抬起阵挛;4级为全身强直,双侧前肢抬起、痉挛;5级为全身强直阵挛,跌倒。筛选出FS最敏感鼠和最耐受鼠并模拟人类遗传方式进行交配繁殖下一代。按照同样的筛选流程获得第二代FS最敏感鼠和最耐受鼠,以此类推。除了记录动物行为学指标外,还通过检测热水浴诱导之后大鼠脑电图指标变化情况进一步确定该模型筛选方法的正确性及可靠性。
FS大鼠脑电图记录方法:选取21日龄FS敏感大鼠和耐受大鼠各6只,以水合氯醛腹腔麻醉(剂量为350 mg/kg),俯卧位固定,使头顶部保持水平,剪开头顶部皮肤,分离皮下组织,剥离刮掉骨膜,暴露颅骨;分别在颅骨相应位置用小型电钻钻一小孔。海马电极坐标,前囟后7.5 mm,中线左右旁开2.5 mm,硬脑膜下深度2.5 mm;将高压消毒后电极短端植入小孔,用调好的玻璃离子体水门汀把电极固定于颅骨。全部操作过程无菌操作,术后每只小鼠肌注青霉素2000 U/d,连续3 d。电极埋置7 d后,大鼠行为状态未见异常。准备进行海马脑电图的记录。首先将电极导线端与信号采集系统连接,线路连通后运行软件,设置脑电图记录参数(纸速3 cm/s,敏感度50 μV/5mm),待稳定后监测脑电图。水浴前5 min,记录FS敏感组鼠大和耐受组大鼠正常情况下的基础脑电,待基础脑电稳定后,将FS敏感组鼠大和耐受组大鼠放入45 ℃水浴中4 min,记录2组模型鼠脑电图的变化,并由另外一名人员记录2组模型鼠的行为学的变化。
KA诱导大鼠癫痫模型:选取第二代21日龄FS敏感组雄性大鼠和耐受组雄性大鼠各5只,腹腔注射KA(3 mg/mL),按照FS的5级行为学评分标准进行等级评分。
1.2.2 热性惊厥敏感鼠与耐受鼠海马全基因组表达谱芯片分析:FS敏感组和耐受组差异(gene ontology,GO)功能分析:对于上述筛选的差异表达基因,通过NCBI、Swissprot/Uniprot、AmiGO等多个数据库的信息对其进行GO功能注释分析,通过计算富集倍数(enrichment fold)和P值(Fisher检验),可以鉴定出该基因群中显著富集的GO功能类别。
FS敏感组和耐受组差异Pathway分析:通过整合KEGG、Biocarta、Reactome等多个数据库信息,利用超几何分布的Fisher精确检验的方法对差异表达基因所参与的Pathway进行显著性分析。
差异表达基因间相互作用关系网络分析:通过整合Pubmed textmining、同源预测、基因neighbor、蛋白-蛋白相互作用、基因融合等数据,建立一个包含所有差异表达基因的单节点的调控网络。
差异表达基因共表达网络分析:通过基因芯片模拟生物信息学软件构建基因共表达网络,基因在芯片上的表达信号强度的变化反映了基因间的内在联系及动力学过程。根据基因芯片实测数据的相关性,预测基因间存在的共表达关系,以此构建基因间的共表达作用网络。然后根据图论原理计算出每个基因在网络中的共表达能力。
实时定量PCR验证基因芯片数据:为了验证大鼠全基因组表达谱芯片数据的可靠性,选取10个差异表达基因,通过实时定量PCR的方法进行验证。首先,提取海马组织样本的总RNA,利用逆转录试剂盒(Fermentas)将RNA逆转录成cDNA作为模板。根据每个基因的cDNA序列设计特异的荧光定量PCR引物初步检物初步检测各个基因的表达情况;按照天根荧光定量试剂盒标准操作方法操作[10]。
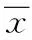
国有企业改革要以完善的财务管理预算体系为基础,通过在经营管理过程总有效的编制财务预算,从而促进建立、健全各种财务规章制度。预算管理要充分发挥国有企业管理层次的引导作用,以管理者为突破口,强化其财务预算管理的意识,来调动管理层进行有效财务预算观的积极性,将预算管理能够切实的落到实处。除此之蛙,要做好国有企业员工的思想教育工作,采取各种措施进行财务预算管理培训,以此来增强全员对财务管理预算的认识。
2 结果
2.1 热性惊厥敏感鼠与耐受鼠的建立
2.1.1 FS动物模型的筛选:对有癫痫发作或者耐受41.0 ℃大鼠进行杂交,寻找F1子代中有癫痫发作的后代,进行纯化,寻找F2代中的纯合子,将F2代的纯合子进行纯化,以此类推寻找F3、F4代。2组不同表型FS模型大鼠家系图谱见图1。
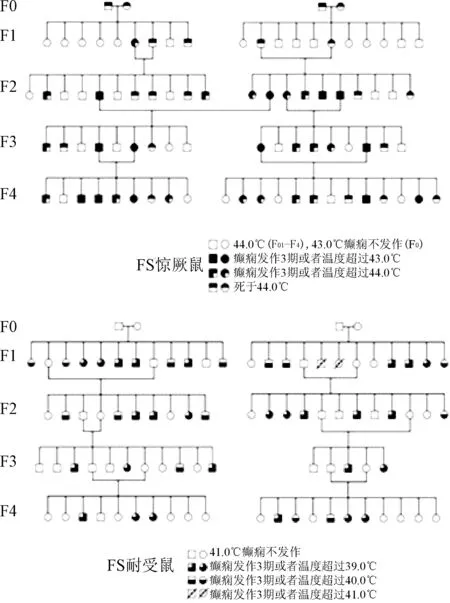
图1 2组不同表型FS家系大鼠图谱Fig.1 Atlas of FS family rats in 2 different phenotypes
FS模型鼠发病率分析:通过分析2组FS发病率,从F0~F4代,经过热水浴诱导,当大鼠核心体温到达41 ℃时,FS敏感鼠的发病率从25%升高至71.4%。而在核心体温为43 ℃时,FS耐受鼠发病率从62.5%逐渐降低至28.6%。结果显示,通过人工定向筛选,FS敏感鼠和耐受鼠的表型逐渐的分离开来,具有不同的温度敏感性。见图2。
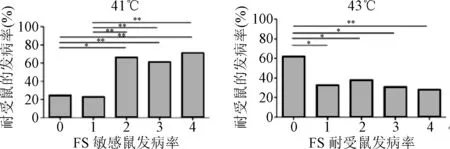
图2 五代(F0~F4)FS敏感鼠与耐受鼠发病率分析Fig.2 Sensitivity analysis of the incidence of FS and tolerance in rats of five generation(F0~F4)
2.1.2 热水浴诱导后FS敏感组与耐受组大鼠脑电图分析:对2组模型鼠脑电图结果分析发现,FS敏感鼠的脑电与耐受鼠脑电相比,表现出高幅度和高频率。FS敏感鼠(图3A上)和耐受鼠(图3A下)水浴后脑电发作经放大后(图3B上,图3B下)发现2组都呈现尖波发作。经过脑电图功率图谱的统计分析,FS敏感组大鼠脑电功率与FS耐受组大鼠脑电功率差异显著(P<0.001)见图3C。同时EEG结果显示FS敏感组比耐受组表现出严重的惊厥行为。因此,图3结果可推断出FS敏感组比耐受组具有更强的高热敏感性。

P<0.05,与耐受鼠相比,compared with tolerant rats图3 45 ℃热水浴诱导后FS敏感鼠与耐受鼠脑电图分析Fig.3 EEG analysis of FS sensitive rats and tolerant rats after induced by 45 ℃ hot water bath
2.1.3 KA诱导后FS敏感组与耐受组大鼠脑电图分析:观察脑电图可以看出,敏感鼠和耐受鼠脑电图在大部分频率波段范围内,KA诱导后发生改变,敏感鼠的脑电图变化幅度较大,见图4A。图4B表明FS敏感组大鼠的平均脑电功率明显高于耐受鼠。FS敏感组大鼠的发作潜伏期显著低于耐受组大鼠的发作潜伏期(P<0.05),见图4C。记录惊厥等级结果发现,FS敏感组大鼠的发作等级最高,100%的大鼠出现了5级惊厥行为,而耐受组大鼠仅有20%出现了3级以上的惊厥行为(图4D),2组模型鼠相比差异有统计学意义(P<0.05)。结果提示,与FS耐受组大鼠相比,FS敏感组大鼠对KA诱导癫痫的发生更加敏感。

图4 KA诱导后FS敏感鼠与耐受鼠脑电图分析*P<0.05,与耐受鼠相比Fig.4 EEG analysis of FS sensitive rats and tolerant rats after induced by KA*P<0.05,compared with tolerant rats
2.2 热性惊厥敏感鼠与耐受鼠海马全基因组表达谱芯片分析
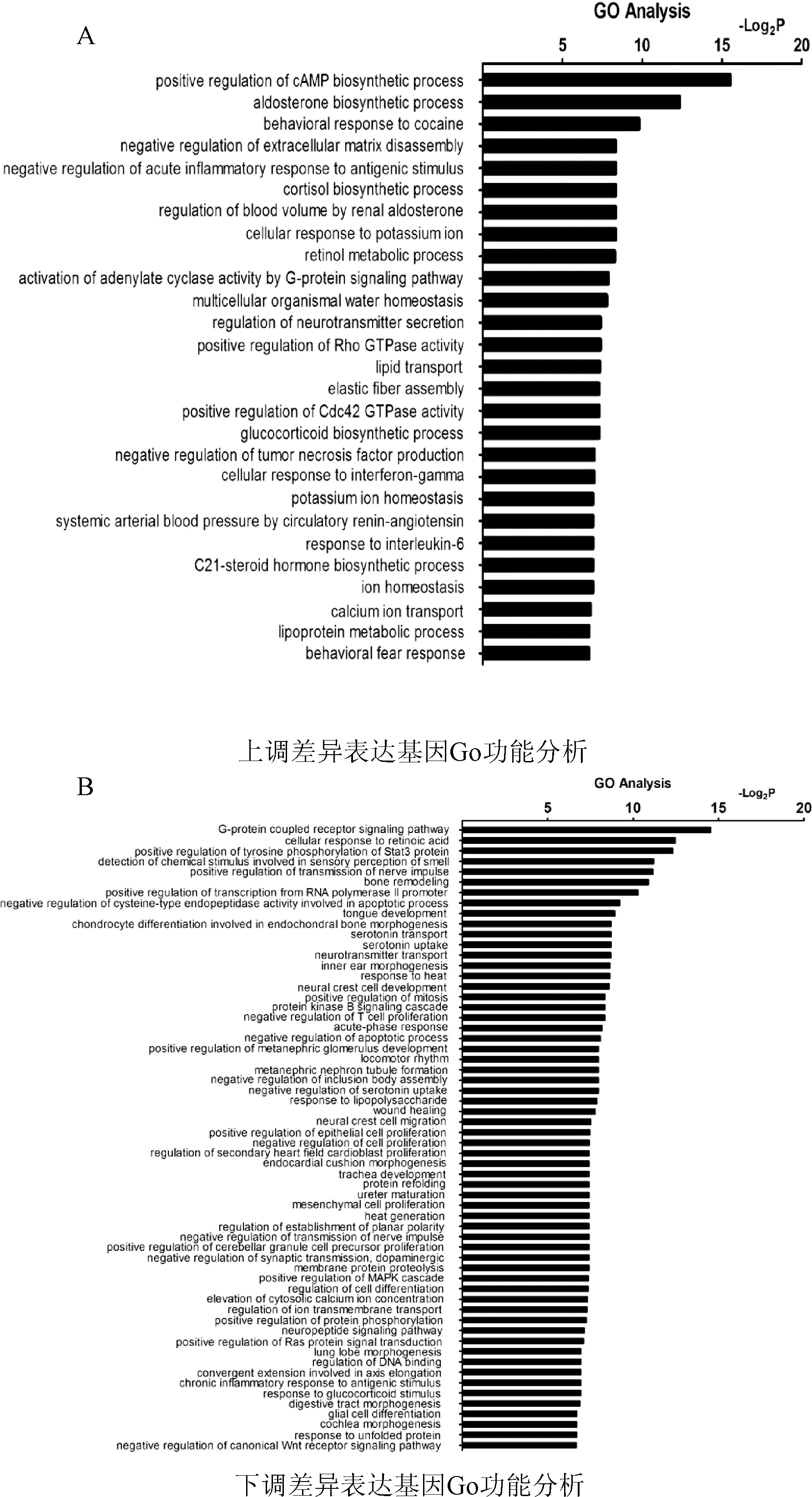
图5 差异GO功能分析Fig.5 Analysis of difference between GO function
2.2.2 差异表达基因间相互作用网络分析:IL-6作为一个重要的FS易感基因位于基因网络关系图的中心,它可能在FS疾病的发生发展过程中起到更加重要的作用。其他的差异表达基因(如APOA5,S100A8,KCNMA1,DPP4)与IL-6有着直接或间接的联系。按照同样的方法,本研究将筛选的免疫相关的差异表达基因构建基因间分子网络,在免疫相关基因的分子网络中,IL-6也位于分子网络的中心,其他的免疫相关基因(如S100A9,DPP4,STAT5A)与IL-6有着紧密的联系。这些分子网络中的差异表达基因可能在FS疾病的发生发展中起到重要的作用。上述实验结果可以推断出FS与免疫炎症因素存在紧密相互关系。见图6。

图6 差异表达基因间相互作用关系网络图Fig.6 The interactions between network map of differentially expressed genes
2.2.3 差异表达基因共表达网络分析:通过比较FS敏感组和FS耐受组网络结构及基因的共表达能力,最终得到共有174个共表达能力发生巨大变化的基因。在共表达网络中,通过K值来表示基因功能的相似性,K值越高代表这个基因可能起到的作用越大。通过分析K值发现共有38个差异表达基因可能在FS疾病的发生发展中起到关键的作用,其中包括溶质转体家族(Slc18A2,SLC6A4),离子通道家族(Scn5a,Kcnma1,Kcnq4),嗅觉受体(Olr1253,Olr1679,Olr536)等。以上结果分析显示,这些共表达基因可能在FS疾病的发生发展中起到非常重要的作用。见表1。

表1 共表达网络分析结果Tab.1 Analysis results of co-expression network
2.2.4 基因芯片可靠性验证:为了进一步证实基因芯片的质量及芯片数据的可靠性,本文在1140个差异表达基因中,选取了10个差异表达基因(5个上调基因,5个下调基因)(图7A)利用实时定量PCR进行验证。结果显示,定量PCR的验证结果(图7B)与基因芯片的结果相符,证明基因芯片这种方便快捷,高通量,大规模的基因表达研究技术是值得信赖的。见图7。

图7 差异表达基因的验证Fig.7 Identity of differentially expressed genes
3 讨论
本文通过经典热水浴诱导惊厥并结合人工定向选择筛选的方式成功获得了2种不同表型的FS模型鼠。这2种模型鼠的建立为后期寻找新的FS易感基因进而阐明FS的发病机制提供了良好的基础。本文对差异表达基因进行了深入的信息挖掘分析,获得了与FS相关的差异性GO。上调差异表达基因所参与的差异GO主要与干扰素、IL-6、IL-3的细胞反应有关,下调差异表达基因所参与的GO主要与T细胞的增殖和免疫系统进程相关。这些免疫相关GO功能信息提示FS与免疫炎症之间存在着密切的关系,对于研究免疫炎症在FS中的作用提供了重要线索。最新研究表明,免疫和炎症进程在FS中作用非常重要[11],特别是由于感染、神经创伤等与癫痫相关的因素引起的先天免疫机制和随后的炎症反应。一些相关的炎症信号通路被证明与FS的发生有关,例如Toll样受体信号通路、NF-κB,MAPK信号通路。在上调差异pathway中存在类固醇激素的生物合成通路,类固醇激素主要包括糖皮质激素、皮质酮、孕激素等,类固醇激素可以作为中枢神经系统内重要的信息传递物质,与神经细胞的兴奋性和突触可塑性有着密切的关系。同时,该通路与表观遗传效应存在密切关系,这些激素可以通过与其各自受体相互作用影响基因的表观遗传修饰,例如组蛋白甲基化、乙酰化,进而可以影响动物的行为表现[12]。这些信息提示表观遗传机制可能会影响FS的发生发展。此外,在差异表达基因及差异pathway中,发现一些代谢相关的基因和信号通路。例如,APOA5、APOC3、PPAR信号通路、细胞色素CYP450代谢通路、花生四烯酸代谢通路等,提示FS可能与代谢相关基因及其信号通路存在紧密的联系。
另外,本文从1140个差异表达基因中选取免疫相关差异表达基因,利用相关的数据库信息构建了差异表达基因间相互作用关系图。在基因相互作用关系图中,发现IL-6位于基因网络关系图中心位置,提示它可能起到关键作用。尽管IL-6在正常的大脑中出于低表达水平,但是惊厥诱导后其基因表达水平迅速升高[13]。IL-6过表达可以通过削弱海马中GABA神经元的抑制作用进而增加惊厥敏感程度[14]。另外1个免疫相关基因-DPP4(又称CD26),在基因网络图中与IL-6有直接的联系,提示2个基因间的相互作用可能会影响FS的发生发展。DPP4是一种T细胞表面抗原,同时它作为一种二肽基肽酶可以水解多种不同的底物,包括胃肠激素(GLP-1)、神经肽类(NPY)、趋化因子类(CCL3,CXCL10)等[15]。先前的研究表明,GLP-1可以通过GLP-1R受体信号通路减弱惊厥发作。将小鼠的GLP-R受体敲除后中发现可以增加惊厥的严重程度和神经元的兴奋性。DPP4的另外一种底物-神经肽Y,可以通过其受体抑制惊厥的发生。DPP4抑制剂也可以减弱由于糖尿病引起的IL-6和IL-1β的表达升高。在FS敏感组中,差异表达基因IL-6和DPP4基因表达上调,结果显示免疫炎症可能在FS中起到重要的作用。
综上所述,通过对大鼠海马表达谱基因芯片的分析,获得了一些候选易感基因和重要的差异GO功能、差异信号通路、差异基因间的相互作用网络关系及共表达网络关系,为阐明FS发病机制提供很好的线索。
[1] Neville BG,Gindner D.Febrile seizures- semiology in humans and animal models: evidence of focality and heterogeneity[J].Brain Dev,2010,32(1):33-36.
[2] Chungath M,Shorvon S.The mortality and morbidity of febrile seizures[J].Nat Clin Pract Neurol,2008(4):610-621.
[3] Nakayama J.Progress in searching for the febrile seizure susceptibility genes[J].Brain Dev,2009,31(5):359-365.
[4] 邵巧燕,戴竟泉,吴斌,等.长托宁对热性惊厥幼鼠海马神经元的保护作用[J].福建医科大学学报,2014,18(4):232-234.
[5] 孙海军,高有桂.小儿热性惊厥复发的相关因素[J].甘肃科技,2014,30(2):122-123.
[6] Ban E,Milon G,Prudhomme N et al.Receptors for interleukin-1 (alpha and beta) in mouse brain: mapping and neuronal localization in hippocampus[J].Neuroscience,1991,43(1):21-30.
[7] Cartmell T,Southgate T,Rees GS,et al.Interleukin-1 mediates a rapid inflammatory response after injection of adenoviral vectors into the brain[J].J Neurosci,1999,19(4):1517-1523.
[8] Haspolat S,Mihci E,Coskun M,et al.Interleukin-1beta,tumor necrosis factor-alpha,and nitrite levels in febrile seizures[J].J Child Neurol,2002,17(10):749-751.
[9] Virta M,Hurme M,Helminen M.Increased plasma levels of pro- and anti-inflammatory cytokines in patients with febrile seizures[J].Epilepsia,2002,43(8):920-923.
[10]Kanemoto K,Kawasaki J,Miyamoto T,et al.Interleukin (IL)1beta,IL-1alpha,and IL-1 receptor antagonist gene polymorphisms in patients with temporal lobe epilepsy[J].Ann Neurol,2000,47(5):571-574.
[11] Virta M,Hurme M,Helminen M.Increased frequency of interleukin-1beta (-511) allele 2 in febrile seizures[J].Pediatr Neurol,2002,26(3):192-195.
[12] Vezzani A,Granata T.Brain inflammation in epilepsy: experimental and clinical evidence[J].Epilepsia,2005,46(11):1724-1743.
[13] Dube C,Vezzani A,Behrens M,et al.Interleukin-1beta contributes to the generation of experimental febrile seizures[J].Ann Neurol,2005,57(1):152-155.
[14] Heida JG,Pittman QJ.Causal links between brain cytokines and experimental febrile convulsions in the rat[J].Epilepsia,2005,46(12):1906-1913.
[15] Dube CM,Ravizza T,Hamamura M,et al.Epileptogenesis provoked by prolonged experimental febrile seizures:mechanisms and biomarkers[J].J Neurosci,2010,30(22):7484-7494.
(编校:王冬梅)
Construction of febrile seizures sensitive,tolerance rats and screening of differential expression genes of febrile seizures hippocampus
WEI Rui1, ZHANG Wei1Δ,YU En-yan2
(1.Department of Emergency, The First Affiliated Hospital of Kunming Medical University, Kunming 650031, China; 2.Department of Psychiatry, People’s Hospital of Zhejiang Province, Hangzhou 310014, China)
ObjectiveTo establish the animal model of febrile seizures(FS), screen susceptibility genes and investigate the related pathogenesis.Methods50 SPF male SD rats (aged 21 days) were selected,screened febrile seizure sensitive and tolerant rats by the incidence of FS.Differences in gene ontology (GO) function,pathway,network interaction of genes differential expression,and differential expression of gene co-expression network were analyzed between FS sensitive group and tolerant group.The validation of gene chip data method was analyzed by Real-time PCR.ResultsAccess to two different phenotypes of FS rat model of screening,including FS sensitive rats and FS tolerance rats.After 43 hot water bath treatment,the incidence of FS sensitive rats rate with increasing passage number and gradually increase.Hot water bath induced seizures and KA induced epilepsy experimental results showed that the FS sensitive rats exhibited stronger seizure phenomenon than tolerance rats.Obtained 1140 differentially expressed genes by expression of two different phenotypes of FS rat models in microarray data analysis,including 602 up-regulated and 538 down regulated genes,and obtained the GO functional classification differences.Differentially expressed genes interaction network analysis showed that were closely with IL-6,The co-expression network analysis,there were 174 gene of co-expression ability changed tremendous. At the same time,real time quantitative PCR validation results consistent with gene chip expression,showed that the reliability of microarray data. ConclusionRat model of FS suggested that epigenetic regulation may play an important role in the pathogenesis of FS.Meanwhile,rat hippocampal gene microarray results suggest that many factors (immunity,ion channels,metabolism et.al) may paly a vital role in the pathogenesis of FS.
febrile seizures; microarray; differential expression genes
2011年省医药卫生计划(2011KYA012)
韦睿,女,本科,主治医师,研究方向:急诊医学,E-mail:qch1821460080@163.com;张玮,通讯作者,男,硕士,副主任医师,研究方向:重症医学,E-mail:qch1821460081@163.com。
R363
A
1005-1678(2015)02-0074-06
