羧甲基茯苓多糖抗乙型肝炎病毒的体内与体外研究
2015-07-07陈继岩
陈继岩
(宁夏师范学院 卫生所,宁夏 固原 756000)
羧甲基茯苓多糖抗乙型肝炎病毒的体内与体外研究
陈继岩
(宁夏师范学院 卫生所,宁夏 固原 756000)
目的 探讨羧甲基茯苓多糖(carboxymethyl-pachymaran,CMP)抗HBV、调节免疫、抗肝纤维化的作用及其机制。方法 体外实验:人肝癌HepG 2.2.15细胞株作为细胞模型,分为阴性对照组、CMP(1.5、3.0、6.0、12.0 mg/mL)组和阳性对照阿昔洛韦(aciclovir,ACV,浓度分别为0.5、1.0、1.5 mg/mL)组,MTT法观察CMP 的细胞毒作用,ELISA 法测定2.2.15细胞上清中HBsAg 和HBeAg 的含量。体内实验:采用四氯化碳复合因素法制作SD大鼠肝纤维化模型,分为正常对照组、模型组、CMP组,香菇多糖组及秋水仙碱组,每组10只,免疫组织化学法观察CMP 对转化生长因子β(TGF-β)、细胞凋亡相关因子caspase-3、Ⅲ型胶原(collagen-III)、层粘蛋白(laminin)的影响,Western blot检测Smad3、Smad7的表达。结果 体外实验:CMP 对HepG2.2.15 细胞株的半数毒性浓度(TC50)为 13.61 mg/mL,对HepG2.2.15 细胞株HBsAg、 HBeAg 分泌的半数有效浓度(IC50)分别为4.38 mg/mL、5.78 mg/mL,治疗指数(TI)值分别为3.15 和2.45,CMP 对HBsAg和HBeAg有抑制作用,并且抑制HBsAg和HBeAg分泌的作用优于ACV。模型组与TGF-β、caspase-3、Ⅲ型胶原、层粘蛋白的表达高于正常对照组(P<0.01);CMP,香菇多糖,秋水仙碱能够降低肝纤维化大鼠肝脏中TGF-β、caspase-3、Ⅲ型胶原、层粘蛋白的表达(P<0.05,P<0.01)。模型组Smad-3的表达高于对照组、Smad-7的表达低于对照组(均P<0.01); CMP,香菇多糖,秋水仙碱能够降低肝纤维化大鼠Smad-3的表达、升高Smad-7的表达(均P<0.01)。CMP 显示了较好的抗纤维化作用,与香菇多糖组比较无统计学差异。结论 通过体内和体外实验,证明CMP 具有抑制HBV,调节TGF-β/Smad信号转导通路等作用,本研究为CMP 在慢性乙型肝炎临床的应用提供了重要的理论和实验依据。
羧甲基茯苓多糖;乙型肝炎病毒;细胞因子;体内;体外
乙型肝炎病毒(hepatitis B virus,HBV)是导致乙型病毒性肝炎的病原体[1]。人类感染HBV后有不同转归,相当部分患者转变成为慢性乙型肝炎(chronic hepatitis B,CHB)[2]。CHB患者树突状细胞(dendritic cells,DC)功能处于抑制状态,部分患者向肝硬化、原发性肝癌发展。HBV感染后及时抗病毒治疗是影响转归的一个重要因素,目前抗HBV的有效药物主要有干扰素-α,但存在疗效不确切、副作用大、停药后易反跳等不足[3-5]。因此积极开展抗HBV的基础与临床研究具有积极的现实意义和紧迫性。中药抗HBV显示出较好的临床效果,其中多糖类中药的临床研究和应用已有多年,证实具有较好的免疫调节作用[6-8]。羧甲基茯苓多糖(carboxymethyl pachymaran,CMP)是茯苓多糖羧甲基化后的产物,临床常用于治疗CHB、抗肝纤维化等,显示出一定的临床效果[9]。开展CMP抗HBV和肝纤维化的实验研究,对于了解CMP抗HBV及抗肝纤维化的作用及其机制,开发和利用CMP资源,寻找治疗CHB的有效替代疗法具有积极的现实意义。本研究从体内实验和体外实验2个方面着手,研究CMP在2.2.15细胞株中对HBV的抑制作用;对实验性肝纤维化模型大鼠TGF-β/Smad信号转导通路的作用,以探讨CMP抗HBV、调节免疫、抗肝纤维化的作用及其机制,为临床应用提供理论和实验依据。
1 材料与方法
1.1 药物与试剂 羧甲基茯苓多糖、香菇多糖(浙江省庆元县金源真菌多糖制品有限责任公司),使用前以培养液配制,浓度为20 mg/mL,0.22 μm 微孔滤膜过滤除菌。噻唑蓝粉剂(MTT)为意大利Duchefa公司生产,L-谷氨酰胺为美国Amresco公司产品分装,TGF-β、caspase-3、Ⅲ型胶原、层粘蛋白抗体、辣根过氧化物酶标记的二抗、ECL试剂盒、BCA试剂盒为美国Santa cruz公司、RIPA裂解液、G418为美国Promega公司进口分装,二甲基亚砜为美国Sigma 公司产品,青霉素、链霉素为华北制药厂产品,阿昔洛韦(ACV,湖北科益药业股份有有限公司,国药准字H42022188),直接用培养液溶解。四氯化碳、橄榄油、秋水仙碱、胎牛血清(南京建成),HBsAg ELISA 检测试剂盒、HBeAg ELISA 检测试剂盒购自上海科华。其余为国产优级纯。
1.2 方法

1.2.2 体内实验大鼠分组及处理:上海大学提供50只健康的SPF级SD大鼠,7~8周龄,体质量270~320 g,雌雄各半,上海市西普尔-必凯实验动物有限公司,许可证号SCXK(沪)2008-0016。均遵循《实验动物保护条例》。在实验前大鼠适应环境。将大鼠分为5个小组:正常对照组、模型组、CMP组,香菇多糖组及秋水仙碱组,每组10只。肝纤维化模型采用四氯化碳复合因素法制作,以四氯化碳/橄榄油(体积比25:75)腹腔皮下注射,5 μL/g,2次/周,连续4周,CMP组,香菇多糖组及秋水仙碱组,建模后分别给予同等剂量的20 mg/mLCMP、20 mg/mL香菇多糖、20 mg/mL秋水仙碱,每天1次,2 mL悬挂灌胃,连续2周。正常对照组皮下多点注射生理盐水,每天1次,2 mL生理盐水悬挂灌胃;模型组建模后每天1次,2 mL生理盐水悬挂灌胃。取造模成功大鼠肝组织,放入8 mL离心管中,加入RIPA裂解液900 μL,冰浴超声匀浆后立即加入PMSF 100 μL,转移至1.5 mL离心管中,然后加入Complete液40 μL,于4 ℃,10000 r/min,离心10 min,收集上清液,-70 ℃保存过夜。
1.2.3 免疫组织化学法:切片脱蜡、水化,放入枸橼酸缓冲液,100 ℃煮沸,冷却,重复1次;滴过氧化酶阻断剂,室温放置,PBS 冲洗;封闭;滴加 1:100 稀释的转化生长因子β(TGF-β)、细胞凋亡相关因子caspase-3、Ⅲ型胶原、层粘蛋白的一抗,室温放置过夜;PBS冲洗,加二抗,PBS 冲洗;滴加 SABC 溶液,PBS 冲洗;将新鲜制备 DAB 溶液滴加在玻片上,室温显色;双蒸水冲洗,苏木素复染;脱水、封片、镜检。细胞浆棕黄色颗粒为CMP 对转化生长因子β(TGF-β)、细胞凋亡相关因子caspase-3、Ⅲ型胶原、层粘蛋白,用 Image-pro plus 6.0图像分析软件随机取 5 个视野于高倍镜下(×400),计数每个视野平均光密度值、平均灰度值、阳性单位值。
1.2.4 蛋白质印迹法(Western blot)检测Smad3、Smad7的表达:采用PIRA裂解液提取总蛋白,应用BCA法测定蛋白浓度,将30~60 μg样品放在SDS聚丙烯酰胺凝胶上进行电泳,4 ℃条件下转印过夜。转印完成后,将硝酸纤维素膜封闭液封闭,室温轻摇1h。一抗反应:加入用封闭液稀释的一抗10 mL(抗TGF-β、caspase-3、Ⅲ型胶原、层粘蛋白特异抗体,1:1000稀释),4 ℃轻摇过夜或者室温2 h。漂洗滤膜3次,每次10 min。二抗反应:将膜用封闭液稀释的辣根过氧化物酶标记的相应抗体(稀释浓度为1:2000),室温轻摇1 h。漂洗滤膜3次。ECL法显色:将等体积ECL试剂A液、B液,混合均匀加到转印膜上,反应5 min。暗室曝光,曝光1~2 min,显影、定影,自来水充分冲洗。蛋白质定量分析:X光片用Microtek ScanWizard 5扫描软件进行电脑扫描、Quantity one 7.0图像分析软件作灰度分析。
2 结果
2.1 羧甲基茯苓多糖抗乙型肝炎病毒的体外实验 CMP 对培养第12天的HepG2.2.15 细胞的细胞毒作用如下表1所示,通过MTT 法测定药物毒性,得到CMP及ACV对2.2.15细胞的半数毒性浓度TC50 分别为13.61 mg/mL、1.71 mg/mL。
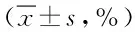
表1 CMP对HepG2.2.15 细胞毒性作用Tab.
*P<0.05,与阴性对照组相比,compared with negative control group
由表看出,CMP和ACV对HepG2.2.15细胞存活率均有抑制作用,其细胞存活率均显著低于对照组(P<0.05),且随药物浓度变大,细胞存活率降低。
由表看出,阴性对照组对HepG2.2.15 细胞株HBsAg、HBeAg 的分泌无抑制作用,CMP和ACV均有抑制作用:4种浓度的羧甲基茯苓多糖及3种浓度的阿昔洛韦对HBsAg、HBeAg 分泌的抑制率,随药物浓度增加抑制率逐渐增大,从第4天到第12天都有抑制作用,第8天达高峰,第12天抑制率小于第4天抑制率(见表2)。
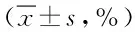
表2 CMP对HepG2.2.15 细胞HBsAg、HBeAg 分泌的抑制率Tab.2 Inhibitory effects of CMP on HBsAg,HBeAg secretion rate of ±s,%)
由表3可以得出,CMP对 HepG2.2.15 细胞株HBsAg、HBeAg的IC50、TI 值高于ACV,说明CMP治疗效果优于ACV。
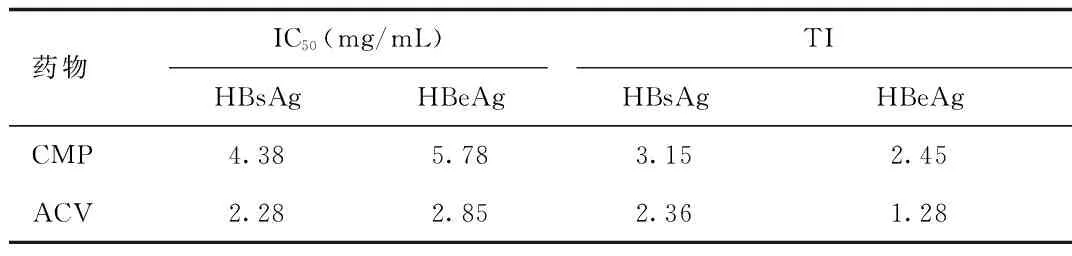
表3 CMP 对HepG2.2.15 细胞HBsAg、HBeAg 的IC50及TI值Tab.3 IC50 and TI value of CMP on HBsAg,HBeAg of HepG2.2.15
2.2 免疫组化检测肝组织中TGF-β、caspase-3、Ⅲ型胶原、层粘蛋白的含量 用计算机扫描,分析各指标的平均光密度值、平均灰度值、阳性单位值,模型组各指标与正常对照组比较均有显著性差异(P<0.01),表明大鼠肝纤维化与TGF-β、caspase-3、Ⅲ型胶原、层粘蛋白的表达有关。CMP组、香菇多糖组、秋水仙碱组与模型组比较,平均光密度值、阳性单位值均下降,平均灰度值均升高,且均具有统计学差异(P<0.05,P<0.01),与正常对照组相比差异,无统计学意义。见表4。
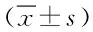
表4 免疫组化法检测肝组织中TGF-β、caspase-3、Ⅲ型胶原、层粘蛋白的结果Tab.4 Immunohistochemical detection results of TGF-β,caspase-3,collagen-III,laminin in hepatic tissue ±s)
*P<0.05,**P<0.01,与模型组比较,compared with the model group;△P<0.05,△△P<0.01,与正常对照组比较,compared with normal control group
2.3 Western blot法检测肝组织中Smad3和Smad7的含量 模型组Smad-3的表达显著高于其他组,差异均有统计学意义(P<0.01)。CMP组和香菇多糖组比较,Smad-3表达的差异无统计学意义,但与秋水仙碱组比较差异具有统计学意义(P<0.01)。Smad-7在模型组中的表达水平显著低于正常对照组、CMP组、香菇多糖组以及秋水仙碱组(P<0.01)。分析数据发现,CMP和香菇多糖组之间Smad-7的表达没有显著差异,但是与秋水仙碱比较差异具有统计学意义(P<0.01)。见表5。
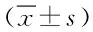
表5 Western blot 检测肝组织中Smad-3、Smad-7含量的结果Tab.5 Western blot results of Smad-3,Smad-7 in hepatic ±s)
**P<0.01,与模型组比较,compared with model group;##P<0.01,与CMP组比较,compared with CMP group
3 讨论
查阅文献后发现[10-11],一些慢性肝疾病的患者的外周血中,CD4+细胞减少,CD4+/CD8+值下降,而CD8+细胞比例增加。CD8+细胞一般被认为主要是由Tc细胞构成。乙型肝炎的发病原因主要是由于机体受到HIV病毒感染,使得免疫功能低下、机体内病毒含量以及感染病毒的细胞不断增加,进而产生免疫耐受[12]。药物的治疗指数(TI)是评价药物疗效的指标[13-14],因此,在体外实验中CMP对HBsAg、HBeAg的TI 值分别为3.15 和2.45,均大于2,这些数据表明CMP 在体外抵抗HBV,CMP的TI 值高于ACV,说明CMP 体外抑制HBV 作用优于ACV。实验结果表明CMP具有体外抑制HBsAg、HBeAg 分泌的作用,从而具有抗HBV作用。
体内实验结果表明,四氯化碳橄榄油容易使大鼠的肝组织发生脂肪样变,甚至坏死、间质炎症细胞浸润,生成更多的胶原纤维和其它病理变化,这些结果表明模型制作成功。通过免疫组化方法对体内的肝组织进行TGF-β表达水平变化的检测和纤维化形成的重要证据蛋白collagen-III、laminin和细胞凋亡的重要信号分子caspase-3表达水平的变化,蛋白印迹法是为了检测TGF-β中的重要的细胞内信号转导分子Smad-3和Smad-7的蛋白表达水平,结果表明,正常肝组织TGF-β的表达水平低,基本上是阴性反应,大鼠肝组织的肝纤维化中TGF-β表达显著增强,肝实质细胞中呈强阳性反应,基质细胞也发生相同的反应,这表明肝纤维化的发展伴随着肝内TGF-β的合成,并结合其他研究者报道,证明具有与促进肝纤维化相关的是TGF-β[15]。CMP组中肝组织TGF-β蛋白、胶原III、层粘连蛋白表达值明显降低,与模型组大鼠中的表达有显著差异(P<0.01),表明CMP可以降低大鼠肝脏中肝纤维化的TGF-β、collagen-III、层粘连蛋白的表达,显著降低大鼠肝组织病理损害,使肝细胞脂肪变性减少,肝索的排列顺序变得整齐,肝小叶也恢复正常,与香菇多糖和秋水仙碱干预组产生类似的效果。这表明羧甲基茯苓多糖抑制TGF-β、Smad-3、collagen-III、laminin、caspase-3蛋白表达,上调Smad-7 蛋白表达,具有较好的抗四氯化碳诱导的大鼠肝纤维化作用,其机制是TGF-β/Smad 信号通路的调节发生了变化。
[1] 王学军,王升启.乙型肝炎病毒进入肝细胞机制研究进展[J].生物化学与生物物理进展,2009,36(5):530-535.
[2] Yu SQ,Lai LY,Ma J,et al.Antisense Smad2 inhibits high glucose-stimulated production of extracellular matrix in cultured rat glomerular mesangial cells[J].J Medical Colleges of PLA,2005,20(4):204-208.
[3] Sporea I,Sirli R,Bota S,et al.Comparative Study Concerning the Value of Acoustic Radiation Force Impulse Elastography (ARFI) in Comparison with Transient Elastography (TE) for the Assessment of Liver Fibrosis in Patients with Chronic Hepatitis B and C[J].Ultrasound in Medicine and Biology,2012,38(8):1310-1316.
[4] Sir D,Tian YJ,Chen WL,et al.The early autophagic pathway is activated by hepatitis B virus and required for viral DNA replication[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(9):4383-4388.
[5] 曾健,张玲,胡坚,等.凝血、纤溶和纤维化与慢性乙型肝炎病毒感染状态的关系[J].广东医学,2012,33(22):3452-3454.
[6] Gressner AM,Weiskirchen R,Breitkopf K,et al.Roles of TGF-beta in hepatic fibrosis[J].Front Biosci,2002,7(13):793-807.
[7] Li JH,Zhu HJ,Huang XR,et al.Smad7 inhibits fibrotic effect of TGF beta on renal tubular epithelial cells by blocking Smad2 activation[J].J Am Soc Nephrol,2002,13(6):1464-1472.
[8] Yen RD,Bonatti H,Mendez J,et al.Case report of lamivudine-resistant hepatitis B virus infection post liver transplantation from a hepatitis B core antibody donor[J].Am J Transplant,2006,6(1):1077-1083.
[9] Xiong W,Wang X,Liu X,et al.Interferon-inducible MyD88 protein inhibits hepatitis B virus replication[J].Virology,2004,319(2):306-314.
[10] Ndiritu M,Cowgill KD,Ismail A,et al.Immunization coverage and risk factors for failure to immunize within the Expanded Programme on Immunization in Kenya after introduction of new Haemophilus influenzae type b and hepatitis b virus antigens[J].BMC Public Health,2006,6(9):132-142.
[11] Chakravarti A,Verma V,Jain M,et al.Characteristics of dual infection of hepatitis B and C viruses among patients with chronic liver disease:a study from tertiary care hospital[J].Trop Gastroenterol,2005,26(4):183-187.
[12] Huang Y,Chen Z,Jia H,et al.Induction of Tc1 response and enhanced cytotoxic T lymphocyte activity in mice by dendritic cells transduced with adenovirus expressing HBsAg[J].Clin Immunol,2006,119(3):280-290.
[13] Wu JF,Chen CH,Hsieh RP,et al.HLA typing associated with hepatitis B E antigen seroconversion in children with chronic hepatitis B virus infection:a long-term prospective sibling cohort study in Taiwan[J].J Pediatr,2006,148(5):647-651.
[14] Hung L,Kumar V.Antisense regulation of expression and transactivation functions of the tumorigenic HBx and c-myc genes[J].Biochem Biophys Res Commun,2006,344(1):293-299.
[15] Sande MA,Waight P,Mendy M,et al.Long-term protection against carriage of hepatitis B virus after infant vaccination[J].J Infect Dis,2006,193(11):1528-1535.
(编校:王俨俨 谭玲)
Study on effect of carboxymethyl-pachymaran on anti-hepatitis virus in vivo and in vitro
CHEN Ji-yan
(Department of Clinic, Ningxia Teachers College, Guyuan 756000, China)
ObjectiveTo study carboxymethyl-pachymaran’s effect of anti-hepatitis virus in vivo and in vitro and its mechanism.MethodsIn vitro, HepG2.2.15 cells was chosen as the cell model, and divided into three groups: negative control group, CMP (1.5,3.0,6.0,12.0 mg/mL)groups and ACV group (acyclovir, 0.5,1.0,1.5 mg/mL).The cytotoxicity of CMP was observed by MTT method.The content of HBsAg and HBeAg in the culture supernatant was determined by ELISA.In vivo, the model of hepatic fibrosis was induced by CCl4composite method in SD rats.The rats were divided into five groups: normal control group, model group, CMP group, lentinan group and colchicines group, 10 rats in each group.The levels of transformation growth factor β(TGF-β), caspase-3, collagen-III and laminin were determined with immunohistochemical method.The expressions of Smad3 and Smad7 were detected by Western blot.ResultsIn vitro, the TC50 value of CMP on HepG2.2.15 cell line was 13.61 mg/mL, the IC50 values of CMP on HBsAg, HBeAg secreted by HepG2.2.15 were 4.38 mg/mL, 5.78 mg/mL, and the therapeutic index (TI) values were 3.15, 2.45.CMP had some inhibitory effect on HBsAg, HBeAg, and the inhibitions of HBsAg, HBeAg secretion were better than ACV.The levels of TGF-β, collagen-III, laminin and caspase-3 of model group were higher than those of normal control group(P<0.01), and the CMP, lentinan and colchicines decreased the above indexes of hepatic fibrosis rats (P<0.05,P<0.01).The expression of Smad-3 was higher, Smad-7 was lower in model group than that in control group, respectively (P<0.01), and the CMP, lentinan and colchicines decreased Smad-3 level and increased Smad-7 level of hepatic fibrosis rats (P<0.01).CMP showed the good antifibrosis effect, and had no significant difference compared with lentinan group. ConclusionIn vivo and in vitro, it is confirmed that CMP could inhibit HBV, regulate TGF-β/Smad signal transduction pathway, etc.The study provides important academic and experimental evidence for the application of CMP in the treatment of chronic hepatitis B.
carboxymethyl-pachymaran; HBV; cytokines; in vivo; in vitro
陈继岩,男,学士,副教授,研究方向:药理学教学与科研,E-mail:262450824@qq.com。
R373.2
A
1005-1678(2015)02-0066-05
