经肝动脉EAP栓塞化疗方案联合放疗治疗胃癌肝转移患者的效果观察
2015-07-07方芳马进安
方芳,马进安
(湘雅大学附属第二医院 肿瘤内科,湖南 长沙 410000)
经肝动脉EAP栓塞化疗方案联合放疗治疗胃癌肝转移患者的效果观察
方芳Δ,马进安
(湘雅大学附属第二医院 肿瘤内科,湖南 长沙 410000)
目的 探讨经肝动脉EAP栓塞化疗方案联合常规分割外放疗治疗胃癌肝转移患者的临床效果。方法 选取湘雅大学附属第二医院收治的确诊胃癌肝转移患者40例, 根据入院单双号顺序分为单纯化疗组和放化疗组各20例, 2组患者均给予EAP方案经肝动脉进行栓塞化疗, 放化疗组结合常规分割外放疗治疗, 对比分析2组患者的近期疗效、远期预后及相关临床指标的差异。结果 放化疗组的缓解率(65%)、总有效率(95%)均高于单纯化疗组患者的(35%、90%),但差异均不具有统计学意义。治疗后2组患者的白细胞介素-2(interleukin -2,IL-2)、肿瘤坏死因子-ɑ(tumor necrosis factor-ɑ,TNF-ɑ)、干扰素-γ(interferon-r ,INF-γ)较治疗前均显著提高(P<0.05), 放化疗组提升效果更显著(P<0.05)。放化疗组患者的胃肠道反应率、骨髓抑制率、白细胞减少率、丙氨酸氨基转移酶(alanine aminotransferase ,ALT)升高率均高于单纯化疗组,但差异均无统计学意义。放化疗组与单纯化疗组各有1例患者失访,单纯化疗组2年有6例患者存活(30%),低于放化疗联合组的9例(45%),但差异无统计学意义(χ2=0.960,P=0.327)。单纯化疗组的2年生存中位时间16.8个月显著低于放化疗组的20.1个月(χ2=3.920,P=0.035)。结论 经肝动脉EAP栓塞化疗方案联合常规分割外放疗治疗胃癌肝转移患者较单纯化疗有利于改善患者的远期预后。
栓塞化疗;常规分割外放疗;胃癌肝转移;临床效果
近年来随着人们饮食习惯的改变,胃癌的发病率在我国各种恶性肿瘤中居第4位, 其致死率在男性恶性肿瘤中占第2位,在女性中占第4位[1]。而胃癌的发病主要与地域、环境、饮食和生活因素、幽门螺杆菌感染、癌前病变以及遗传等有关[2]。胃癌发展到晚期后,癌细胞可能通过血液循环转移到肝、肺、骨骼等处,其中胃癌肝转移的患者5年生存率低于10%[3]。胃癌肝转移患者除极少患者可行手术切除外, 多数采取全身静脉化疗、介入化疗等姑息性治疗手段[4]。本文就经肝动脉栓塞化疗方案联合放疗治疗胃癌肝转移患者的临床效果进行了观察, 现报道如下。
1 资料与方法
1.1 一般资料 选取湘雅大学附属第二医院收治的确诊胃癌肝转移患者40例, 根据入院单双号顺序分为单纯化疗组和放化疗组,各20例患者。单纯化疗组年龄49~74岁, 平均年龄(58.71±6.88)岁, 其中男12例、女8例, 原发肿瘤部位; 贲门部9例、胃窦和胃小弯11例, 低分化7例, 中、高分化13例,肿瘤最大径(3.70±2.81)cm,门静脉癌栓1例。放化疗组年龄45~75岁,平均年龄(59.46±7.01)岁, 其中男13例、女7例, 原发肿瘤部位; 贲门部7例、胃窦和胃小弯13例, 低分化8例, 中、高分化12例,肿瘤最大径(3.67±2.49)cm,门静脉癌栓1例。2组患者的年龄、性别等一般资料比较差异无统计学意义。
纳入标准:①所有患者均经过病理学、影像学检查确诊;②患者主要发生肝转移有可测量的实体病灶; ③患者预计生存时间>3个月;④体力状况ECOG评分≦2分;⑤治疗前获得患者的知情同意,本研究符合医学伦理委员会的要求。排除标准:①合并严重的肝、肾、造血系统功能障碍的患者;②对治疗方案严重不耐受的患者;③未能接受随访观察的患者。
1.2 治疗 2组患者均使用EAP方案经肝动脉进行栓塞化疗,具体治疗措施:行Seldinger法股动脉穿刺插管至肝动脉或视肿瘤分布情况超选进入其供血动脉,注入化疗药物,采用EAP方案(VP16100 mg/m2+adriamycin 60 mg/m2+carboplatin 200 mg/m2),每6、7周重复治疗1次,总共治疗3个周期,整个治疗周期约20周; 放化疗组在此基础上行常规分割外放疗治疗,具体治疗措施; 介入治疗后第2~4周内开始肝肿瘤外放疗定位时依照碘油肿瘤染色结合CT图像。若病灶弥漫分布,予全肝中平面TD 2000cGy,每周1次,放疗5周。
1.3 指标检测方法 所有患者于治疗前后空腹状态下抽取静脉血3 mL,离心制得血清,采用ELISA法测定IL-2、TNF-ɑ和INF-γ水平,试剂盒购自上海拜力生物科技有限公司,具体操作参考说明书进行。
1.4 近期疗效标准 近期疗效评价标准:参照RECIST实体瘤疗效评价标准分为:完全缓解(complete remission,CR)、部分缓解(partial remission ,PR)、疾病稳定(disease stability ,SD)、疾病进展(disease progression ,PD)。CR:可见病灶完全消失,维持一个月以上;PR:肿瘤最大直径及最大垂直直径的乘积缩小达到50%以上,维持一个月以上;SD:肿瘤最大直径及最大垂直直径的乘积缩小<50%,增大<25%, 维持一个月以上;PD:患者出现一个多个病灶的肿瘤最大直径及最大垂直直径的乘积>25%。总有效率=(CR+PR+SD)/本组样本量×100%,缓解率=(CR+PR)/本组样本量×100%。
随访并观察2组患者的2年生存率差异,并绘制生存曲线进行分析。
毒副反应参照参照WHO毒副反应5级分级标准。0度:无毒副作用; Ⅰ度:轻度反应; Ⅱ度:中度毒副反应; Ⅲ度:毒副反应重度; Ⅳ度:有严重的并发症。本研究将(Ⅰ度+Ⅱ度+Ⅲ度+Ⅳ度)定义为发生毒副作用。
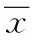
2 结果
2.1 2组患者的近期疗效比较 放化疗组的缓解率为65%,总有效率为95%均高于单纯化疗组的35%和90%,但2组间差异不具有统计学意义。见表1。

表1 2组患者的近期疗效比较[n(%)]Tab.1 Comparison of the short-term efficacy between two groups[n(%)]
2.2 2组患者治疗前与治疗后的血清免疫因子水平变化 放化疗组与单纯化疗组患者的治疗前的血清免疫因子(IL-2、TNF-ɑ、INF-γ)水平差异均无统计学意义。治疗后2组患者的IL-2、TNF-ɑ、INF-γ较治疗前均显著的提高(P<0.05),放化疗组提升效果更佳显著(P<0.05)。见表2。
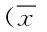

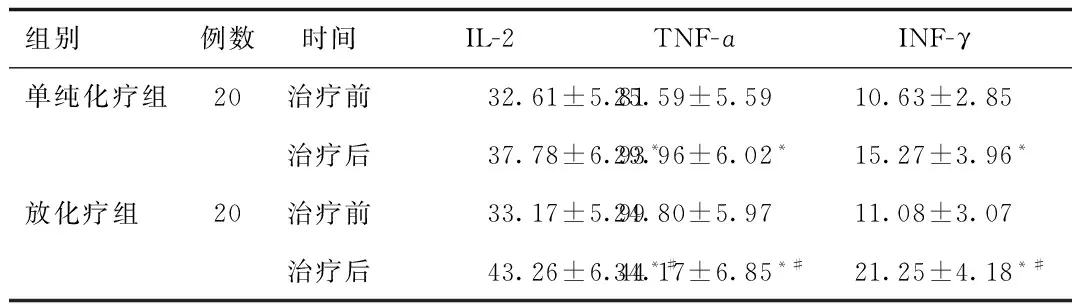
组别例数时间IL-2TNF-ɑINF-γ单纯化疗组20治疗前32.61±5.8125.59±5.5910.63±2.85治疗后37.78±6.93*29.96±6.02*15.27±3.96*放化疗组20治疗前33.17±5.9924.80±5.9711.08±3.07治疗后43.26±6.44*#34.17±6.85*#21.25±4.18*#
*P<0.05,与同组治疗前比较,compared with the same group pre-treatment;#P<0.05,与单纯放化疗组比较,compared with simple radiotherapy and chemotherapy group
2.3 2组患者治疗过程中不良反应比较 放化疗组胃肠道反应发生11例、骨髓抑制发生6例、白细胞减少发生5例、ALT升高发生3例,单纯化疗组胃肠道反应发生8例,骨髓抑制发生3例,白细胞减少发生3例,ALT升高发生2例;但2组的不良反应发生率无统计学意义(χ2=0.1732,P>0.05)。
2.4 2组患者治疗2年随访结果 放化疗组与单纯化疗组各有1例患者失访, 单纯化疗组2年有6例患者存活(30%)低于放化疗联合组的9例(45%),但差异无统计学意义(χ2=0.960,P=0.327>0.05)。单纯化疗组的2年生存中位时间16.8个月显著的低于放化疗组的20.1个月(χ2=3.920,P=0.035<0.05)。见图1。
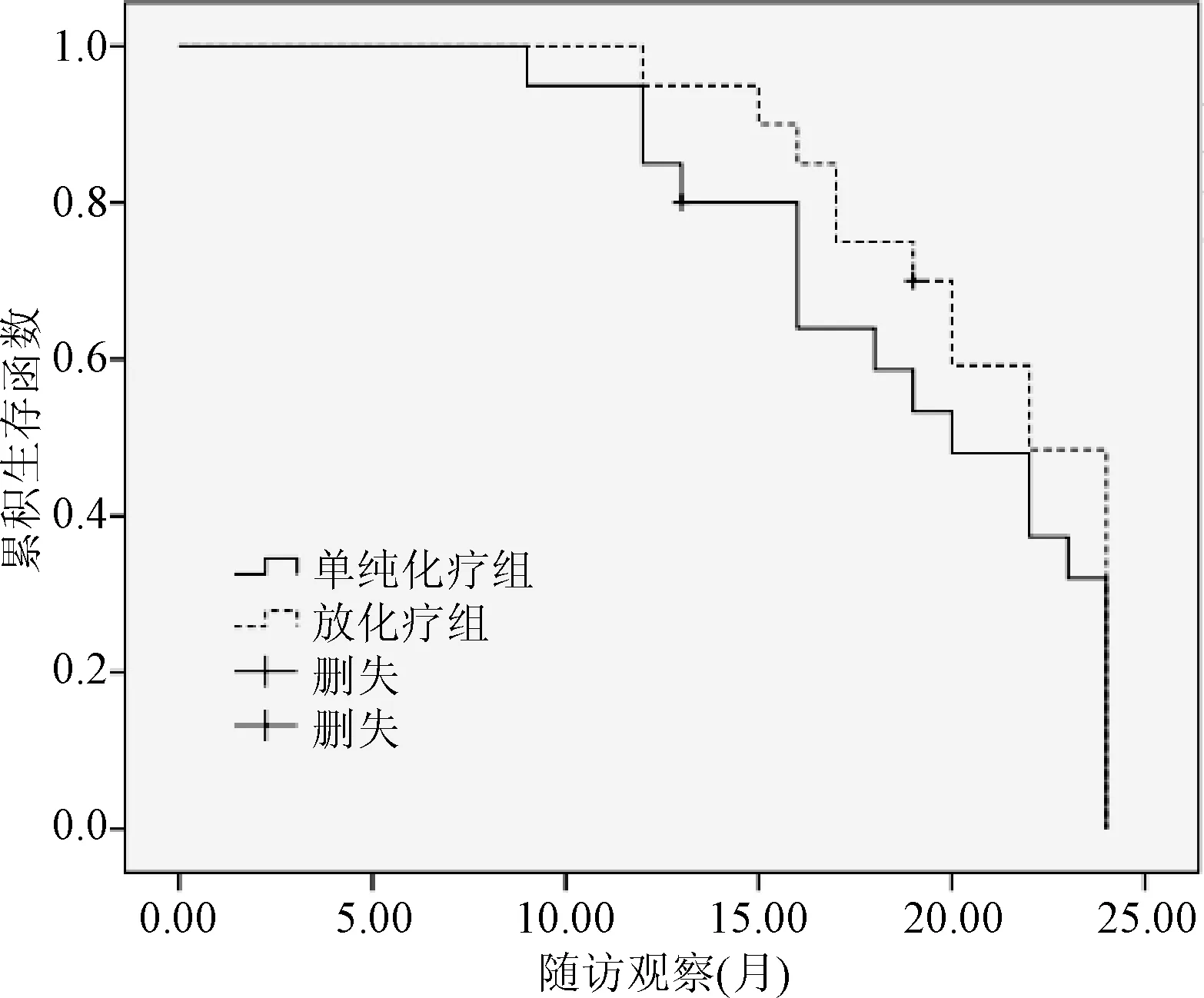
图1 2组患者的生存函数图Fig.1 The survival function of two groups of patients
3 讨论
在我国胃癌的发病率与致死率均较高,而胃癌发生肝转移是造成患者死亡的重要因素[5]。胃癌发生肝转移时大多为晚期,并且患者常伴有其他部位的转移,极易导致根治性手术的切除率低,术后复发率高,降低患者的生存率[6]。胃癌肝转移具有以下特点:①多伴有淋巴结与腹膜转移;②原发病灶常侵袭毗邻脏器。③常为多发或累及双叶[7]。由于胃癌肝转移是一个多因素参与的极为复杂的致病过程,包括癌细胞从原发病灶脱离、脉管浸润、转移脏器和参与血管形成再增殖等过程,因而肝转移是导致胃癌治疗失败的重要原因之一[8]。如何探索出有效的治疗措施以提高胃癌肝转移的治疗效果依旧是目前临床上的重要研究方向。
目前临床上对胃癌肝转移的治疗措施包括以下几种:①外科治疗[9]。由于胃癌肝转移患者多处于晚期,适合手术治疗的患者不多,且术后生存率并不满意。其适应症包括能根治性切除原发癌,或切除后无复发, 肝转移灶仅局限于单叶, 且单发灶直径≤4 cm或多发灶<3 个,无腹膜种植转移及远处淋巴结等肝外其他脏器转移[11-10];②消融治疗。该方式主要是指在影像的的引导下,采用射频、冷冻等物理或是无水酒精等化学方法而灭活肿瘤,是目前替代手术治疗较为流行的治疗方法。该方法安全可靠,主要用于肝脏原发或继发肿瘤的治疗,但是研究表明随着消融技术和设备的不断改进,消融治疗的病灶数目和肿瘤大小也随之增加,因此,在临床上该方法不作为单纯治疗的方式应用[12];③全身治疗。对大多数患者而言,该方法为主要治疗手段,常用的化疗药物为5-氟尿嘧啶、紫杉类(紫杉醇,多西紫杉醇)、拓扑异构酶 I抑制剂( 伊立替康)等[13];④肝动脉灌注化疗。适用于无肝外转移的胃癌肝转移者,尤其对全身化疗疾病进展期是一种常用选择,该方法主要通过利用细胞毒性药物的首过效应而提高局部病灶的药物浓度,从而达到杀伤肿瘤细胞的作用[14],此外,化疗药物还能通过体循环到达全身,达到静脉化疗的功效[15]。此外,放射治疗、分子靶向治疗以及肝移植等也是用于治疗胃癌肝转移的方式[16-17]。
本实验对比分析了单纯经肝动脉EAP栓塞化疗方案和经肝动脉EAP栓塞化疗方案联合放疗治疗胃癌肝转移患者的临床疗效,结果发现放化疗组的缓解率和总有效率均显著高于单纯化疗组,并且经过治疗后放化疗组的IL-2、TNF-ɑ和INF-γ均显著高于单纯化疗组,2组患者胃肠道反应、骨髓抑制、白细胞减少和丙氨酸氨基转移酶升高等不良反应发生率无显著差异。由于免疫调节因子IL-2、 TNF-α、 IFN-γ的水平是胃癌的重要预后因素,这表明经肝动脉EAP栓塞化疗方案联合放疗治疗胃癌肝转移患者有利于机体免疫功能的恢复,此外, 本研究也证实利用卡铂、VP16等药物的放疗增敏特性可能有疗效相加作用,这可能与药物能够降低缺氧细胞的比例、修复放射损伤和使细胞同步化等相关。
综上所述,本实验结果表明,肝动脉EAP栓塞化疗方案联合常规分割外放疗治疗胃癌肝转移患者较单纯化疗具有显著的临床疗效,可以有效减轻毒副反应,缓解血清免疫因子水平,改善患者的远期预后,在临床上值得推广应用。
[1] 陈志伟, 周亮, 姚学权, 等.肝动脉化疗栓塞治疗胃癌肝转移的临床疗效[J].中国肿瘤外科杂志, 2013, 5(4): 230-232.
[2] de MC,Forman D,Plummer M.Gastric cancer: epidemiology and risk factors[J].Gastroenterol Clin North Am, 2013, 42(2):219-240.
[3] Piazuelo MB,Correa P. Gastric cancer: overview[J].Colombia Medica, 2013, 44(3): 192.
[4] Hu X.Risk factors and prognosis of liver metastasis from gastric cancer[J].Zhonghua Weichang Waike Zazhi, 17(2): 108-111.
[5] 张文,张麒,查勇,等.胃癌肝转移行肝切术治疗效果评价[J].中国医学科学院学报,2015,37(1):88-89.
[6] 邓薇,沈琳.胃癌靶向药物治疗进展[J].中国新药杂志,2013,8(1):1531-1538.
[7] 胡祥.胃癌肝转移的高危因素和预后[J].中华胃肠外科杂志,2014,17(2):24-29.
[8] 周亮,姚学权,刘福坤.胃癌肝转移早期诊断的研究进展[J].肿瘤研究与临床,2013,25(1):65-66.
[9] 曹亮,胡祥.胃癌同时性肝转移手术患者的预后分析[J].中华胃肠外科杂志,2014,17(2):124-127.
[10] 陈凛,李佶阳.胃癌肝转移的外科综合治疗[J].外科理论与实践,2015,9(1):9-14.
[11] 蔡磊,李晓武,夏锋.射频消融治疗转移性肝癌的临床疗效[J].中华消化外科杂志,2014,13(3):190-193.
[12] 隋洺骅,张良明.胃癌肝转移的临床特点及治疗[J].国际肿瘤学杂志,2013,40(4):290-293.
[13] 陆若飞,施海辉,黄桃辉.经肝动脉灌注化疗栓塞术与单纯肝动脉灌注术对胃癌肝转移瘤的疗效对比[J].实用癌症杂志,2015,1(1):63-65.
[14] 费新平,鲍鹰.原发性肝细胞癌术后预防性肝动脉灌注化疗的临床研究[J].肝胆胰外科杂志,2015,27(2):104-107.
[15] 樊强,卞邦健,杨广林,等.新辅助化疗在局部晚期胃癌治疗中临床应用[J].现代仪器与医疗,2014,9(6):33-39.
[16] 孟庆雯.肝动脉化疗栓塞后VEGFR-2和PLGF浓度变化及对肝癌预后作用的初步探讨[J].南方医科大学学报,2013,12(4):14-19.
[17] 张鹏,李晓冰,任虎虎,等.经皮肝动脉栓塞化疗联合洛铂热灌注化疗治疗不能手术切除的肝细胞癌的近期疗效观察[J].中国肿瘤临床,2013,40(5):284-286.
(编校:王冬梅)
Effect of EAP transarterial chemoembolization combined with radiotherapy for patients of gastric cancer with liver metastasis
FANG FangΔ, MA Jin-an
(Department of Internal Medicine Oncology, The Second Affiliated Hospital of Xiangya University, Changsha 410000, China)
ObjectiveTo investigate the clinical effect of the treatment of liver metastasis in patients with gastric cancer by the combination of EAP and conventional fractionated radiotherapy.MethodsSelected tumor surgery in our hospital were diagnosed with liver metastasis from gastric cancer patients and 40 cases, for simple chemotherapy group and chemotherapy group, 20 cases in each group according to the odd and even number of admission sequence, two groups of patients were given EAP regimen after hepatic artery embolization chemotherapy, chemoradiotherapy group combined with conventional fractionated external beam radiotherapy treatment, comparative analysis of the differences of two groups of patients with curative effect in the near future, long-term prognosis and related clinical indexes.ResultsThe remission rate (65%) and total effective rate (95%) in the treatment group were significantly higher than those in the simple chemotherapy group (35%, 90%), but the difference was not statistically significant (P<0.05).Two groups of patients of interleukin 1 (IL-2), tumor necrosis factor -alpha (TNF-α), Interferon-r (INF-r) after treatment compared with those before treatment were significantly increased (P<0.05), chemotherapy group ascension better effect was significant (P<0.05).Put chemotherapy patients with gastrointestinal tract reaction rate, bone marrow suppression rate, white blood cell reduction rate, alanine amino transferase (ALT) rise rate were higher than that of simple chemotherapy group, but the difference was not statistically significant.Chemotherapy group and chemotherapy group, 1 cases of patients were lost to follow-up, chemotherapy group 2 years with 6 cases of patient survival (30%) lower than put in 9 cases of combined chemotherapy group (45%), but differences had no statistical significance(χ2=0.960,P=0.327).The median duration of 2 years in the chemotherapy group was significantly lower than that in the 20.1 months in the chemotherapy group (χ2=3.920,P=0.035).ConclusionEAP embolization combined with conventional fractionated radiotherapy for treatment of patients with gastric cancer with liver metastasis is beneficial to improve the long-term prognosis of patients with gastric cancer.
embolization chemotherapy; conventional fractionated radiotherapy; liver metastasis; clinical effect
方芳,通讯作者,女,学历,主治医师,研究方向:E-mail:3272007101@qq.com。
R735.2
A
1005-1678(2015)09-0073-03
