外源亚精胺对盐胁迫下菠菜叶绿素合成前体含量的影响
2015-07-04郭世荣
王 颖,郭世荣,束 胜,刘 芳,刘 涛,孙 锦
(1 南京农业大学 园艺学院,南京210095;2 南京农业大学(宿迁)设施园艺研究院,江苏宿迁223800)
盐胁迫严重影响植物的生长和发育,过量盐离子主要通过引发渗透胁迫、离子毒害和氧化胁迫,致使植物的蛋白质合成、能量和脂类的代谢等生理代谢受抑制,也影响光合作用器官的组分,如酶、光合色素、类囊体膜蛋白及膜脂等[3-4],并使得植物叶绿素(Chlorophyll,Chl)合成代谢受阻、含量降低,从而影响植物的光合作用。植物则通过调节气孔开度、合成渗调物质、区隔过量离子及清除活性氧物质等响应来减轻胁迫损害[5]。
Chl是绿色植物叶绿体内参与光合作用的重要色素,在光合作用的能量捕获及传递中起着重要作用[6]。植物体内Chl的合成与分解代谢一般处于一个动态平衡,失衡就会产生异常。Chl的生物合成途径为:谷氨酸(glutamate,Glu)→δ-氨基酮戊酸(δaminolevulinic acid,ALA)→胆色素原(porphobilinogen,PBG)→尿卟啉原Ⅲ(uroorphyrinogenⅢ,Uro Ⅲ)→原卟啉Ⅸ(protoporphyrin Ⅸ,ProtoⅨ)→镁原卟啉Ⅸ(Mg-protoporphyrin Ⅸ,Mg-protoⅨ)→原叶绿素酸(protochlorophyll,Pchl)→叶绿素a(Chlorophyll a,Chl a)→叶绿素b(Chlorophyll b,Chl b)[7],生物合成的任何一个步骤出现障碍,都会影响Chl的正常合成,从而引起Chl含量降低[8];病害、盐胁迫、温度等生物和非生物胁迫都会破坏Chl合成和降解的动态平衡,从而引起Chl含量的变化[9]。许多研究表明,植物Chl含量在盐胁迫下降低[10-11],但也有Chl含量升高的报道[12-13],并且Chl含量与光合作用效率有正相关关系[11]。
多胺(polyamines,PAs)是一类广泛存在于植物体内的具有强烈生理活性的低分子量脂肪族含氮碱,与逆境胁迫关系密切[14]。植物体内的PAs主要包括腐胺(Put)、亚精胺(Spd)和精胺(Spm)。许多研究表明,PAs可提高盐胁迫下植物的光合色素含量,从而改善光合作用,提高植物的耐盐性[15-16]。然而,PAs提高盐胁迫下植物叶片Chl含量的原因尚不清楚。菠菜(SpinaciaoleraceaL.)Chl含量丰富,是研究植物Chl代谢和光合作用的理想材料。为此,本试验以耐盐性较弱的菠菜品种‘全能菠菜’[17]为材料,通过叶面喷施Spd,研究了外源Spd对盐胁迫下菠菜Chl合成前体含量的影响,探讨外源Spd缓解盐胁迫下菠菜Chl合成受阻的原因,为利用外源Spd提高作物盐胁迫耐性的实践提供理论依据。
1 材料和方法
1.1 试验材料
选用耐盐性较弱的菠菜(SpinaciaoleraceaL.)品种‘全能菠菜’为材料,种子购自于株洲湘蔬种业有限公司;Spd购自Sigma公司。
1.2 材料培养与处理设置
试验于2013年10月至2014年4月在南京农业大学牌楼实验基地自控温室内进行。将菠菜种子在15 ℃去离子水中浸泡12h后放置于20 ℃恒温箱中催芽,待芽长2 mm 时播种于50cm×50cm的石英砂盘内。子叶展开后,每2d浇1次1/4倍的Hogland营养液;幼苗长至5 片真叶时,定植于20L的水培箱中,箱内盛有1/2Hogland营养液,水培箱上覆盖有5×6 个定植孔的泡沫板,每孔植1株,实验期间用气泵24h向水箱内通气。
试验分3部分进行:①NaCl对菠菜生长和Chl含量的影响试验。在菠菜定植后7d,在营养液中分别一次性加入25、50、75、100、150、200、250、300和350mmol·L-1的NaCl,以正常营养液栽培(不进行盐处理)为对照。处理14d后取样测定植株生长和Chl含量等指标;②Spd对NaCl胁迫下菠菜生长与Chl含量的影响试验。菠菜定植后7d,以试验①筛选出的盐浓度处理菠菜植株,同时叶面分别喷施0.01、0.05、0.1、0.5、1.0和1.5mmol·L-1Spd溶液,以不喷施Spd而喷施等量清水为对照。处理14d后测定植株生长和Chl含量等指标;③外源Spd对盐胁迫下菠菜叶绿素前体含量的影响试验。因预备试验中正常营养液栽培用Spd处理,对菠菜Chl含量没有影响,故以试验①和试验②筛选出的盐浓度和Spd浓度为依据,设置如下处理:正常营养液栽培并喷施等量清水(CK);营养液中加入250 mmol·L-1NaCl(NaCl);盐胁迫7d 后叶面喷施Spd溶液(NaCl+Spd)。分别在处理后第0、1、3、5、7天测定叶绿素合成前体ALA、PBG、UroⅢ、ProtoⅨ、Mg-protoⅨ、Pchl、Chl a及Chl b含量。上述试验均重复3次,随机排列,测定结果取平均值。
1.3 测定指标及方法
1.3.1 植株生长指标 各处理材料分别取10株,用去离子水洗净植株,吸干表面水分,先分别测定每株地上部和地下部鲜重(g),再经105℃杀青15min,75℃烘至恒重,测定每株地上部和地下部干重。
1.3.2 Chl含量 Chl含量测定参考沈伟其[18]的乙醇、丙酮、水混合液浸提法(体积比为4.5∶4.5∶1)。
(3)该种原料适合生产粒度不大于2.8 μm、松装密度不大于1.0 g/cm3的韩国喜新钼粉,但是一次过筛率则较低。
1.3.3 叶绿素合成前体含量 Proto Ⅸ、Mg-protoⅨ和Pchl含量测定参考Hodgins[19]的方法;UroⅢ含量测定参考Bogorad[20]的方法;ALA 含量测定参考Richard[21]方法;PBG 含量测定参考Bogorad[20]的方法。
1.4 数据分析
实验数据采用SAS软件Duncan’s多重比较法进行显著性测验分析。
2 结果与分析
2.1 不同浓度NaCl和Spd对菠菜植株生长的影响
由表1可知,随着NaCl处理浓度的升高,菠菜植株地上部分和地下部分的干重、鲜重均呈先升高后降低趋势,并大多在盐浓度为25mmol·L-1时达到最大值,较对照均明显升高,且除地下部干重外均达到显著水平;但随着NaCl浓度继续升高,菠菜植株生长量逐渐降低,植株地上部分干重和鲜重大多在150mmol·L-1时就显著低于对照,地下部分的干重、鲜重也最终显著低于对照;在盐浓度为250 mmol·L-1时,菠菜植株总鲜重、植株总干重、地上部鲜重、地上部干重、地下部鲜重和地下部干重分别较对照分别降低了57.23%、53.08%、63.14%、55.05%、42.22%和42.86%,且均达到显著差异水平(表1)。
同时,250 mmol·L-1NaCl胁迫下,菠菜植株叶面喷施不同浓度Spd后,植株的生长量均有不同程度增加,且随着喷施浓度的增大呈先上升后下降趋势,并在1.0 mmol·L-1Spd时均达到最大值,此时植株鲜重、干重、地上部鲜重、地上部干重、地下部鲜重和地下部干重较单纯盐胁迫处理(CK)分别显著提高了62.83%、71.19%、60.57%、71.74%、70.31%和69.23%(表1)。另 外,图1显 示,250 mmol·L-1NaCl胁迫下,喷施不同浓度的Spd均可促进菠菜植株生长,其中1.0mmol·L-1Spd的作用最为明显。

图1 外源Spd对盐胁迫下菠菜生长的影响Fig.1 Effects of exogenous Spd on the growth of spinach under salt stress

响影的量含素绿叶和长生菜菠对(&’源外"#$%和度浓同不!!表$"0*+.0")97$$),0*%0*,(+7 9:/,8*9"0-)9$,/,7-,04%0,5+67’((%)*+,(-.((%/%0*),0)%0*/"*.,0,(1"2$"0-%3,4!"#$%&!$$素#=&叶""?绿#4总29$!";4 29$#=&$#4!";4 29$"=&$#4!";4重干!4部9*下地>,,*-/:8%.4重地>,,*(/%+9鲜!4部9*下8%.4重地6 9,,*-/:干!4部9上8%.4地69,,*(/%+9重鲜!4部9*上8%.4重单!,*"$-/:干!4总9株8%.4单!,*"$(/%+9重鲜!4总9*株8%.4 2,0)%0*/"*.,0=&$度<浓理#处!";;,$&CIHF@C@H)@CIIF@C@B#&C@KF@C@G)@CB&F@C@B#ICIKF@CBD#&C@DF@C@G)&ECJKF@CHG#)&CI@F@C@I) B&CDEF@CGH#$"2A@ 1"2$&CJ&F@C@H"#@CIJF@C@B"#&CBKF@C@G"#@CBHF@C@E#KCDBF@C&K"&CJGF@C@&"BDC&IFBC@H"&CDBF@C@&"IKC@GF&CIK"BG&CH&F@C@J"@CIDF@C@B"&CIBF@C@G"@CIDF@C@&"IC@EF@CII#&C@JF@C@H)&HCI&F@CJ&)&CKGF@CKG#)B@CIDF@CKH)G@&CJHF@C@G"#@CIGF@C@K"#&CBHF@C@B"#@C&JF@C@&)BCK@F@C&E)-@CDBF@CBB)-&GCEBF&C@K)&C@EF@CIH)-&ECBBF@CEBHG&CGHF@C@G#@CIGF@C@I"#&CBBF@C@I#@CBKF@C@&#ICBBF@CBE#&CBEF@C@D#&DCGGF&CKK#&CGBF@C@K#BBCHHF&C@&#&@@&CIBF@C@B)@CBEF@C@&)&C@KF@C@B)@CB@F@C@H#)BCKKF@C&K)@CHKF@C@&-&&CJDF@CI&-@CDKF@C@B-&KC&IF@CIG%&G@@CD@F@C@K-@C&DF@C@&-@CHBF@C@K-@C&IF@C@&-IC@GF@CB&#@CHIF@C@J-&&C@DF@CDE-@CEJF@C@K%&KC&KF@CHJ%B@@@CHJF@C@K%(@C&GF@C@&%@CJ@F@C@I%@C&BF@C@&-%&CDIF@C@B%@CKDF@C@&%JCEHF@CBK%@CJ&F@C@&(DCK@F@CBI(BG@@CHHF@C@I%@C&GF@C@&%@CGEF@C@B%(@C&&F@C@B-%&CEHF@C@J%@CKKF@C@&(GC&BF@CIG(@CGGF@C@&4 JCDDF@CB&4 I@@@CJDF@C@I(@C&GF@C@&%@CGKF@C@B(@C&@F@C@&%BC@HF@C&D-@CIGF@C@J4 KCKGF@CJ&(@CKGF@C@K9 JCGBF@CKI4 IG@&CB&F@C@K%@CBHF@C@&-@CDIF@C@I(@C&IF@C@&)&CDBF@C&G)@CKJF@C@IJCIKF@CI&%@CGDF@C@BECBJF@CI&-%$"2A@ -67&CIKF@C@H-@CI@F@C@B)-&C@GF@C@J%@C&IF@C@&)&CDEF@C&H)@CGGF@C@B)JCHHF@CHE-%@CJEF@C@H)-ECHGF@CGB-@C@&&CK@F@C@H-@CIBF@C@B#)&C@EF@C@H%@C&DF@C@B"#BCGIF@C&H#@CJ&F@C@H#)HCHEF@CHH)-@CE@F@C@D)&@CI&F@CKH)@C@G&CKJF@C@D)-@CIIF@C@B#)&C&IF@C@H-%@CBBF@C@B"#BCEEF@CIB"#@CH&F@C@E"#DCKHF@CJJ"#@CDIF@C@&#&BCIGF@CGB#@C&&CJ@F@C@I#@CIJF@C@D"#)&CBKF@C@I#)@CBBF@C@K"#IC&EF@CKJ"@CH@F@C&&"#DCJJF&CBI"#)@CDBF@C@D"#&BCEKF@CEE"#@CG&CHEF@C@K"@CK&F@C@&"&CIJF@C@I"@CBBF@C@&"ICBHF@CBI"@CHDF@C@H"&@C&EF@CJJ"&C@&F@C@G"&ICKGF@CKH"&C@&CGDF@C@H#)@CIJF@C@B#IF@C@G)-&CB@C&EF@C@B#BCDKF@CIE"#@CJDF@C@J"#ECKIF&C@&#)-&著显异@CEHF@CBI"#)差上平水@C@G在间&&CIHF@CHH#)理处期同示表母字&CG同不列%同注!!0.(.)"0*-.((%/%0)%"*@C@G$%M%$C 8.*9-.((%/%0*$%**%/+"/%+.4%L"$5%+.0%")9),$5;0 1,*%
可见,盐胁迫浓度为250mmol·L-1时,菠菜植株的干重、鲜重的降低幅度均在50%左右;在此基础上再喷施1.0mmol·L-1Spd又可显著提高菠菜植株的干重、鲜重,并且提高幅度在5 0%以上。卢树昌等[22]认为,植物生长量降低50%左右时是植物的临界盐浓度。因此,将250mmol·L-1作为该菠菜品种的临界盐浓度,并作为后续试验中采用的盐胁迫浓度,同时将1.0mmol·L-1作为后续试验中采用的Spd浓度。
2.2 不同浓度NaCl和Spd对菠菜叶片Chl含量的影响
随着NaCl浓度升高,菠菜叶片Chl含量[Chl a、Chl b和Chl(a+b)]也呈先增高后降低趋势,并均在50mmol·L-1时达到最大值,且显著高于对照;随后,菠菜Chl含量又逐渐降低,当NaCl浓度超过150mmol·L-1时,Chl含量已显著低于对照水平;之后,Chl含量维持在相对稳定的较低水平。当盐浓度为250 mmol·L-1时,Chl a、Chl b 及总Chl含量分别较对照显著降低了42.31%、54.55%和44.53%(表1)。同时,在250 mmol·L-1NaCl胁迫条件下,喷施不同浓度Spd均可不同程度提高菠菜叶片Chl含量,且随Spd浓度升高表现出先升高后降低的趋势,且均在1.0mmol·L-1时达到最大值,此时Chl a、Chl b及Chl(a+b)含量分别较单纯盐胁迫处理(CK)显著提高了46.24%、51.85%和47.11%(表1)。可见,菠菜叶片叶绿素含量在较低浓度(≤100mmol·L-1)盐胁迫下不同程度被促进,但较高浓度(≥150 mmol·L-1)盐胁迫下却得到显著抑制;250 mmol·L-1盐胁迫下,菠菜叶片Chl含量降低50%左右,而喷施1.0 mmol·L-1Spd 后可使Chl含量显著升高50%左右。
2.3 外源Spd对盐胁迫下菠菜叶片叶绿素合成前体含量的影响

图2 外源Spd对盐胁迫下菠菜叶片中ALA 和PBG 含量的影响Fig.2 Effects of exogenous Spd on ALA and PBG contents of spinach leaves under NaCl stress
2.3.1 ALA和PBG含量 图2显示,在250mmol·L-1NaCl胁迫下,菠菜叶片中ALA 和PBG 含量均比对照(CK)显著提高,且随盐胁迫时间延长呈递增趋势,两者含量在盐胁迫处理第7天较对照分别显著提高了86.76%和42.70%;在盐胁迫条件下喷施1.0mmol·L-1Spd,菠菜叶片中ALA 和PBG 含量总体呈降低趋势,并接近对照水平,两者含量在Spd处理第7天时分别显著低于盐胁迫处理52.76%和50.10%。
2.3.2 Uro Ⅲ含量 由图3可看出,菠菜叶片中UroⅢ含量在NaCl胁迫下显著比对照降低,并随盐胁迫时间延长呈递减趋势,其在盐胁迫第7天较对照显著降低38.57%;在盐胁迫条件下,菠菜叶片UroⅢ含量在1.0mmol·L-1Spd处理第1、3天时与盐胁迫处理接近,随后逐渐增加,在Spd处理第7天时已显著高于盐胁迫处理52.16%,并与同期对照接近。
2.3.3 ProtoⅨ、Mg-protoⅨ和Pchl含量 由图4可知,在NaCl胁迫条件下,菠菜叶片中Proto Ⅸ、Mg-protoⅨ和Pchl含量均比对照显著降低,且随盐胁迫时间延长呈缓慢递减趋势,它们在盐胁迫第7天 较 对 照 分 别 显 著 降 低6 3.7 9%、4 4.4 4%和69.23%;在盐胁迫条件下,喷施Spd处理菠菜叶片中ProtoⅨ、Mg-protoⅨ和Pchl含量也始终低于对照,其在Spd处理第7天时均显著高于盐胁迫处理61.90%、60.00%和125.00%。

图3 外源Spd对盐胁迫下菠菜叶片中UroⅢ含量的影响Fig.3 Effects of exogenous Spd on UroⅢcontent of spinach leaves under NaCl stress
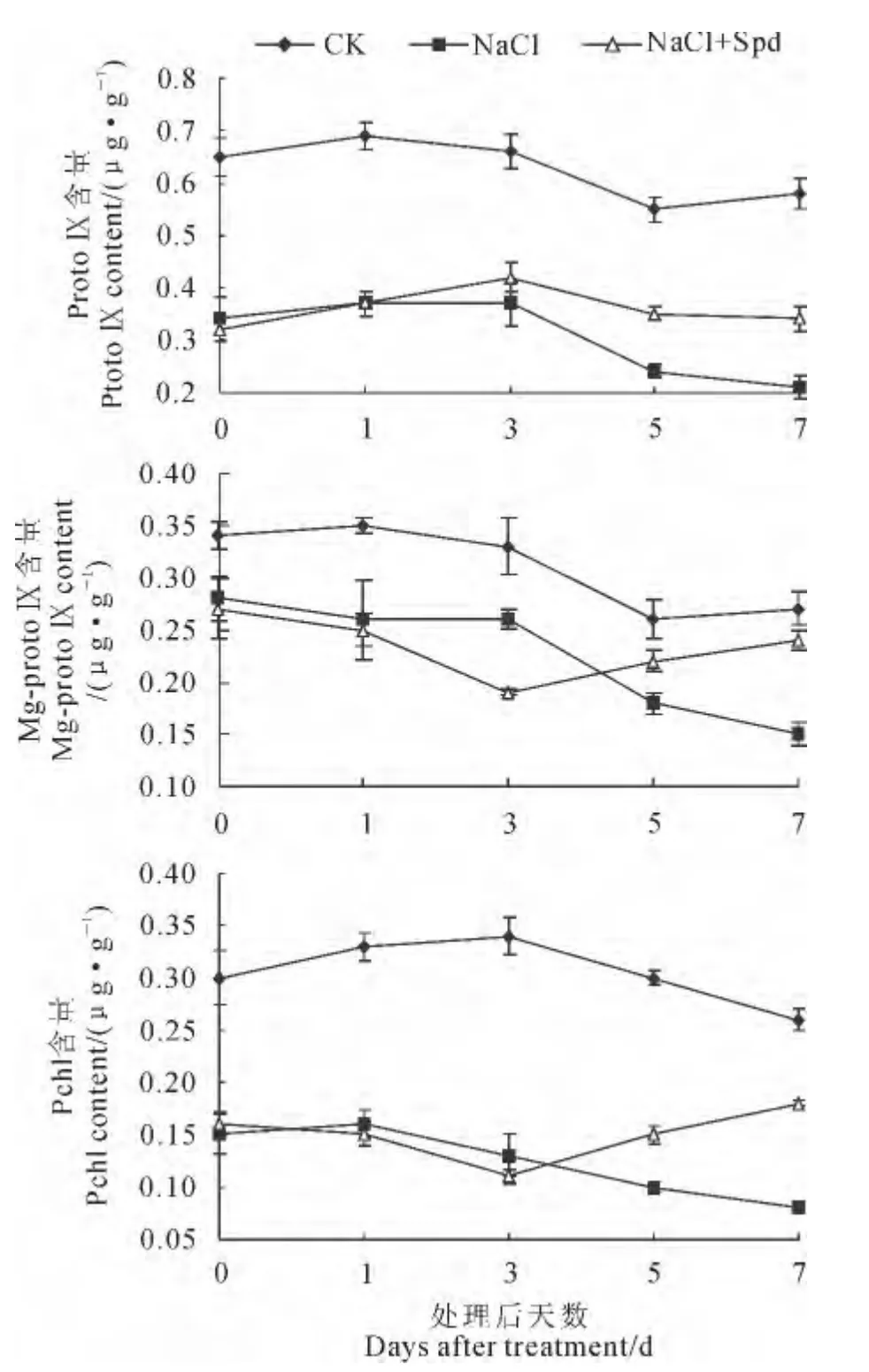
图4 外源Spd对盐胁迫下菠菜叶片中ProtoⅨ、Mg-protoⅨ和Pchl含量的影响Fig.4 Effects of exogenous Spd on ProtoⅨ,Mg-protoⅨand Pchl contents of spinach leaves under NaCl stress
2.3.4 Chl a及Chl b含量 由图5可以看出,菠菜叶片中Chl a及Chl b含量在NaCl胁迫下均始终显著低于对照水平,且随盐胁迫时间延长均呈降低趋势,其在盐胁迫处理第7天时较对照分别显著降低了61.11%和63.16%;同时,盐胁迫菠菜叶片Chl a及Chl b含量在喷施Spd后均有所提高,且处理时间越长增加幅度越大,但始终明显低于同期对照,其在Spd处理第7天时分别较盐胁迫处理显著提高78.57%和71.43%。

图5 外源Spd对盐胁迫下菠菜叶片中Chl a及Chl b含量的影响Fig.5 Effects of exogenous Spd on Chl a and Chl b content of spinach leaves under NaCl stress
以上 结 果 说 明,NaCl胁 迫 下,Chl a、Chl b、Pchl、Mg-protoⅨ、Proto Ⅸ和Uro Ⅲ含量均明显降低,而PBG和ALA含量升高,表明盐胁迫下菠菜Chl含量降低是由于PBG 向Uro Ⅲ的转化受阻所致;盐胁迫下叶面喷施Spd后,菠菜Chl合成前体Chl a、Chl b、Pchl、Mg-protoⅨ、ProtoⅨ和UroⅢ含量均明显升高,而PBG 和ALA 含量有所降低,表明外源Spd可使Chl合成的受阻作用得到有效缓解。
3 讨 论
生物量变化是植物对盐胁迫的综合反应,是评估胁迫程度和植物抗盐能力的可靠指标[23]。盐胁迫下,植物根系最早感受逆境胁迫信号,并产生相应的生理反应,继而影响地上部生长。本研究结果表明,在NaCl浓度为25mmol·L-1时菠菜植株的生长量较对照均有明显提高,这与盐胁迫下桉树幼苗[24]和西瓜幼苗[25]的研究结果一致。低浓度的NaCl处理促进植物生长,可能是由于低浓度NaCl胁迫促进了植物细胞伸展和水分平衡[26],激发了植株根系对K+的摄取[27],改善了光合细胞的水分状况进而促进光合作用[28]。随着NaCl浓度的继续升高,菠菜植株生长量逐渐降低,在盐浓度为250 mmol·L-1时各生长指标均显著低于对照,表明高浓度的盐胁迫显著抑制菠菜植株生长,菠菜植株受到了严重的盐胁迫伤害。
PAs广泛存在于植物细胞中,参与多种生理过程,如叶片衰老、花器官的形成与发育、果实发育与成熟以及植物对逆境的响应等[29-30]。众多研究表明,逆境胁迫下,适宜浓度的PAs处理能够缓解植物所受到的伤害,促进植物生长[31-32]。然而,PAs作为一种新型的植物激素,与其他大多数植物激素一样,在逆境下的作用具有浓度效应。例如,1.0 mmol·L-1外源Spm 可显著提高NO3-胁迫下黄瓜幼苗的净光合速率,增加干物质积累,促进黄瓜生长,但Spm 浓度高达1.5~2.0mmol·L-1时,黄瓜幼苗生长受到抑制[33];低浓度(0.1~15.0mmol·L-1)Put可缓解NaCl胁迫对黄瓜幼苗生长的抑制,株高、生物积累量均显著升高,而高浓度(20.0~30.0mmol·L-1)Put处理则加剧了NaCl对黄瓜幼苗的生长胁迫[34];低浓度(150~200 mg·L-1)Spd可显著提高盐胁迫下黄瓜幼苗生长量,而浓度为250mg·L-1时较低浓度处理的植株生长量明显降低[35];低浓度(100~150mg·L-1)Spd诱导能显著提高盐胁迫下小白菜的株高、单株干重、单株鲜重等生长量,浓度为200mg·L-1时较低浓度处理的植株生长量明显降低[36]。本研究结果表明,1.0 mmol·L-1外源Spd显著提高了盐胁迫下菠菜的生长量,而浓度为1.5mmol·L-1时的菠菜生长量则比1.0mmol·L-1处理显著降低,说明外源Spd缓解盐胁迫对菠菜生长抑制的作用也存在浓度效应。
叶绿素(Chl)含量是反映植物光合能力的一个重要指标,环境因子的改变会引起Chl含量变化,进而引起光合性能的改变[37]。盐胁迫下,植物Chl含量会显著降低[38-39]。本研究结果表明,250mmol·L-1盐胁迫下菠菜叶片Chl含量显著降低,这可能是盐胁迫下菠菜生长显著受到抑制的重要原因之一。一般认为,造成植物Chl含量降低的原因主要是盐胁迫下类囊体膜的完整性受损[40]、Chl合成途径中关键酶活性的降低[41]和降解途径中Chl酶活性的升高[38]等。孙锦等[42]认为,海水胁迫下菠菜Chl含量降低主要是由于其合成途径受阻所致。Chl的生物合成途径(Glu→ALA→PBG→UroⅢ→ProtoⅨ→Mg-protoⅨ→Pchl→Chl a→Chl b)中任何一步骤出现障碍,都会影响Chl的合成,从而引起Chl含量降低[43]。本研究结果表明,NaCl胁迫下,Chl a、Chl b、Pchl、Mg-protoⅨ、ProtoⅨ和UroⅢ含量均明显降低,而PBG 和ALA 含量升高,表明盐胁迫下菠菜Chl含量降低是由于PBG 向Uro Ⅲ的转化受阻,这与陈新斌等[41]的研究结果一致。盐胁迫下叶面喷施Spd后,菠菜Chl合成前体Chl a、Chl b、Pchl、Mg-protoⅨ、ProtoⅨ和UroⅢ的含量均明显升高,而PBG 和ALA 含量有所降低,表明外源Spd可使Chl合成的受阻作用得到有效缓解。可见,盐胁迫下外源Spd通过缓解菠菜Chl合成途径的受阻程度来提高了Chl含量,对维持光合作用的正常进行具有重要作用。
Chl合成过程中PBG 向Uro Ⅲ转化是在胆色素脱氨酶(PBGD)的催化下,4分子PBG 脱氨聚合成线性的1-羟甲基胆色素烷(HMB),HMB 在尿卟啉原Ⅲ合成酶的催化下环合形成所有天然四吡咯化合物的共同前体——尿卟啉原Ⅲ[44]。因此,作为一种具有重要功能的酶,PBGD 广泛存在于生物体内,其活性与叶绿素合成息息相关。目前,已经从豌豆[45]等作物中分离、克隆到PBGD基因。植物在水分胁迫[44]、高低温胁迫[46-48]下PBGD基因表达受抑制,PBGD 活性下降,从而抑制Chl合成,导致Chl含量降低。因此,推测Spd可能通过增强盐胁迫下菠菜叶片中PBGD基因表达水平,使PBGD 活性升高,缓解Chl合成的受阻程度,从而促进Chl合成代谢的顺利进行。然而,Spd对PBGD基因表达的调控作用是否如此,以及具体通过什么途径和方式调节PBGD 基因表达,需要进一步的深入研究。
综上所述,高盐胁迫条件下,菠菜植株的生长受到显著抑制,叶片叶绿素含量降低可能是其中重要原因之一;菠菜叶片含量降低源于其合成受阻,受阻位点在PBG 向Uro Ⅲ的转化路径之间;外源Spd能够缓解盐胁迫下菠菜叶片叶绿素合成路径的受阻程度,促进叶绿素合成,从而提高叶绿素含量,有效缓解盐胁迫对菠菜生长造成的伤害。
[1] PARIDA A K,DAS A B.Salt tolerance and salinity effects on plants:a review[J].EcotoxicologyandEnvironmentalSafety,2005,60(3):324-349.
[2] TONG Y W(童有为),CHEN D F(陈淡飞),etal.Study on the cause and control of secondary saline soils in greenhouse soil[J].Acta HorticulturaeSinica(园艺学报),1991,18(2):159-162(in Chinese).
[3] LAKSHMI A,RAMANJULU S,VEERANJANEYULU K,etal.Effect of NaCl on photosynthesis parameters in two cultivars of mulberry[J].Photosynthetica,1996,32(2):285-289.
[4] MISRA A N,SAHU S M,MISRA M,etal.Sodium chloride induced changes in leaf growth,and pigment and protein contents in two rice cultivars[J].BiologiaPlantarum,1997,39(2):257-262.
[5] ZHU J K.Salt and drought stress signal transduction in plants[J].Annu.Rev.PlantBiol.,2002,53:247-273.
[6] SHI D Y(史典义),LIU ZH X(刘忠香),JIN W W(金危危).Biosynthesis,catabolism and related signal regulations of plant chlorophyll[J].Hereditas(遗传),2009,31(7):698-704(in Chinese).
[7] VON WETTSTEIN D,GOUGH S,KANNANGARA C G.Chlorophyll biosynthesis[J].PlantCell,1995,7(7):1 039-1 057.
[8] TANAKA A,TANAKA R.Chlorophyll metabolism[J].CurrentOpinioninPlantBiology,2006,9(3):248-255.
[9] HAO SH Q(郝树芹),LIU SH Q(刘世琦),ZHANG Z K(张自坤),etal.Characteristics of chlorophyll metabolism and chlorophyll fluorescence in the silvered leaf of summer squash[J].ActaHorticulturaeSinica(园艺学报),2009,36(6):879-884(in Chinese).
[10] SUN J(孙 锦),LI J(李 娟),GUO SH R(郭世荣),etal.Physiological responses of different tolerance spinach to seawater stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2008,28(4):737-744(in Chinese).
[11] SAIRAM R K,SRIVASTAVA G C.Changes in antioxidant activity in sub-cellular fractions of tolerant and susceptible wheat genotypes in response to long term salt stress[J].PlantScience,2002,162(6):897-904.
[12] ROMERO A R,SORIA T,CUARTERO J.Tomato plant-water uptake and plant-water relationships under saline growth conditions[J].PlantScience,2001,160(2):265-272.
[13] WANG Y,NIL N.Changes in chlorophyll,ribulose biphosphate carboxylase-oxygenase,glycine betmne content,photosynthesis and transpiration in amaranthus tricolor leaves during salt stress[J].JournalofHorticulturalScienceBiotechnology,2000,75(6):623-627.
[14] ROY P,NIYOGI K,SEN GUPTA D N,etal.Spermidine treatment to rice seedlings recovers salinity stress-induced damage of plasma membrane and PM-bound H+-ATPase in salt-tolerant and salt-sensitive rice cultivars[J].PlantScience,2005,168(3):583-591.
[15] ZHANG R H,LI J,GUO S R,etal.Effects of exogenous putrescine on gas-exchange characteristics and chlorophyll fluorescence of NaClstressed cucumber seedlings[J].PhotosynthesisResearch,2009,100(3):155-162.
[16] SUN L(孙 璐),ZHOU Y F(周宇飞),LI F X(李丰先),etal.Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings[J].ScientiaAgriculturaSinica(中国农业科学),2012,45(16):3 265-3 272(in Chinese).
[17] LI ZH H(李智海),SUN J(孙 锦),LI J(李 娟),etal.Identification of seawater-tolerant spinach cultivar and selection of its form index[J].ChinaVegetables(中国蔬菜),2009,1(8):11-17(in Chinese).
[18] SHEN W Q(沈伟其).Extraction of mixed solutiou for determination of chlorophyll content in rice leaf blade[J].PlantPhysiologyCommunications(植物生理学通讯),1988,(3):62-64(in Chinese).
[19] HODGINS R,VAN HUYSTEE R B.Rapid simultaneous estimation of protoporphyrin and Mg-protophyrins in higher plants[J].Journal ofPlantPhysiology,1986,125(3-4):311-323.
[20] BOGORAD L.Porphyrin synthesis[M]//DARON H H,GUNSALUNS I C.Methods in Enzymology.New York:Academic Press,1962:885-895.
[21] RICHARD A T.Biochemical Spectroscopy(Vol 1)[M].London:Adam Hilger Ltd,1975:327-330.
[22] LU SH CH(卢树昌),SU W G(苏卫 国).Study on the selection of salt-tolerant plants in high saline and alkaline area[J].Journalof NorthwestSci-TechUniversityofAgricultureandForestry(Nature Science Edition)(西北农林科技大学学报·自然科学版),2004,32(z1):19-24(in Chinese).
[23] HE L(何 磊),LU ZH H(陆兆华),GUAN B(管 博),etal.Seed germination and seeding growth of the two sorghums under saline-alkaline stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(2):362-369(in Chinese).
[24] WENG J ZH(翁锦周),LIN J B(林江波),LIN J G(林加耕).etal.Effect of salt stress on the growth and the content of chlorophyll in seedling leaves of eucalyptus[J].ChineseJournalofTropicalCrops(热带作物学报),2007,28(4):15-20(in Chinese).
[25] HAN ZH P(韩志平),GUO SH R(郭世荣),JIAO Y SH(焦彦生).Effect of NaCl stress on growth and photosynthetic gas exchange of watermelon seedlings[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2008,28(4):745-751(in Chinese).
[26] WANG B Z(王宝增),LIU Y J(刘玉杰),WANG G X(王桂香),etal.A summary about the beneficial effect of low concentration NaCl on plants[J].NorthernHorticulture(北方园艺),2008,(3):63-65(in Chinese).
[27] WANG B Z(王宝增),LIU Y J(刘玉杰).Physiological effects of low concentration of NaCl on nonhalophyteTriticumaestivumL.[J].JournalofNanjingAgriculturalUniversity(南京农业大学学报),2009,32(2):15-19(in Chinese).
[28] ZHANG N(章 宁),TANG L F(唐龙飞),ZHENG D Y(郑德英).Effect of different concentration salt on the growth and physiological of hong ping[J].SubtropicalPlantScience(亚热带植物通讯),1994,23(1):41-45(in Chinese).
[29] GROPPA M D,BENAVIDES M P.Polyamines and abiotic stress:recent advances[J].AminoAcids,2008,34(1):35-45.
[30] KUSANO T,BERBIRICHI T,TATEDA C,etal.Polyamines:essential factors for growth and survival[J].Planta,2008,228(3):367-381.
[31] WANG T(汪 天),LI J(李 娟),GUO SH R(郭世荣),etal.Effect of exogenous polyamine on the growth,activity of H+-ATP enzyme and H+-focal phosphatase of cucumber seedling root under hypoxia stress[J].JournalofPlantPhysiologyandMolecularBiology(植物生理与分子生物学学报),2005,31(6):637-642(in Chinese).
[32] JIANG X M(姜秀梅),QIN Y(秦 勇),GUO G ZH(郭光照).The effects of exogenous spermidine on seed germination and seedling growth of pepper under low temperature stress[J].XinjiangAgriculturalSciences(新疆农业科学),2013,50(12):2 266-2 273(in Chinese).
[33] WANG X H(王秀红),WANG X F(王秀峰),YANG F J(杨凤娟),etal.Effects of exogenous spermine on activities of antioxidant enzymes and photosynthesis in cucumber seedlings under NO3-stress[J].JournalofPlantNutritionandFertilizer(植物营养与肥料学报),2010,16(4):1 020-1 026(in Chinese).
[34] ZHANG R H(张润花),GUO SH R(郭世荣),DUAN Z Q(段增强).Effects of exogenous putrescine concentrations on growth,photosynthesis and lipid peroxidation of cucumber seedlings under salt stress[J].JiangsuJournalofAgricuturalScience(江 苏农业 学 报),2011,27(4):836-841(in Chinese).
[35] LI N(李 娜),CHEN H(陈 红),PEI X B(裴孝伯).Effects of exogenous spermidine on the salt tolerance in cucumber seedlings under salt stress[J].ChineseJournalofTropicalCrops(热带作物学报),2013,34(7):1 359-1 364(in Chinese).
[36] XU F F(徐芬芬).SPD-induced salt resistance and mechanism in Chinese cabbage[J].Guihaia(广西植物),2011,31(5):664-667(in Chinese).
[37] WANG S P(王素平),GUO SH R(郭世荣),HU X H(胡晓辉),etal.Effects of NaCl stress on the content of photosynthetic pigments in the leaves of cucumber seedlings[J].ActaAgriculturaeUniversitatisJiangxiensis(江西农业大学学报),2006,28(1):32-38(in Chinese).
[38] ZHANG Q D(张其德).Effects of salt stress on plant growth and its photosynthesis(middle)[J].Plants(植物杂志),2000,(1):28-29(in Chinese).
[39] SHU SH(束 胜),GUO SH R(郭世荣),SUN J(孙 锦),etal.Research progress on photosynthesis under salt stress[J].ChinaVegetables(中国蔬菜),2012,1(18):53-61(in Chinese).
[40] QIN J(秦 景),DONG W Y(董雯怡),HE K N(贺康宁),etal.Effects of salt stress on growth and photosynthetic physiological features ofHippophaerhamnoidesseedlings[J].EcologyandEnviromentalSciences(生态环境学报),2009,18(3):1 031-1 036(in Chinese).
[41] CHEN X B(陈新斌),SUN J(孙 锦),GUO SH R(郭世荣),etal.Chlorophyll metabolism of spinach leaves under seawater stress[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2012,32(9):1 781-1 787(in Chinese).
[42] SUN J(孙 锦),JIA Y X(贾永霞),GUO SH R(郭世荣),etal.Effects of seawater stress on metabolism of reactive oxygen species and chlorophyll in chloroplasts of spinach(SpinaciaoleranceaL.)[J].ActaEcologicaSinica(生态学报),2009,29(8):4 361-4 371(in Chinese).
[44] DALAL V K,TRIPATHY B C.Modulation of chlorophyll biosynthesis by water stress in rice seedlings during chloroplast biogenesis[J].Plant,CellandEnvironment,2012,35(9):1 685-1 703.
[45] WITTY M,WALLACE-COOK A D,ALBRECHT H,etal.Structure and expression of chloroplast-localized porphobilinogen deaminase from pea(PisumsativumL.)isolated by redundant polymerase chain reaction[J].PlantPhysiology,1993,103(1):139-147.
[46] TEWARI A K,TRIPATHY B C.Temperature-stress-induced impairment of chlorophyll biosynthetic reactions in cucumber and wheat[J].PlantPhysiology,1998,117(3):851-858.
[47] MOHANTY S,GRIMM B,TRIPATHY B C.Light and dark modulation of chlorophyll biosynthetic genes in response to temperature[J].Planta,2006,224:692-699.
[48] MOHANTY S,TRIPATHY B C.Early and late plastid development in response to chill stress and heat stress in wheat seedlings[J].Protoplasma,2011,248:725-736.
