内蒙古高原小叶锦鸡儿与中间锦鸡儿遗传多样性的研究
2015-07-04包姗姗杨九艳赵玲玲张璞进牛云雷应海刚
包姗姗,杨九艳*,赵玲玲,张璞进,牛云雷,应海刚
(1 内蒙古大学 生命科学学院,呼和浩特010021;2 中国科学院内蒙古草业研究中心,呼和浩特010030;3 赤峰市巴林左旗农牧业局,内蒙古赤峰025450)
小叶锦鸡儿(CaraganamicrophyllaLam.)与中间锦鸡儿(CaraganaintermediaKuang et H.C.Fu)是豆科锦鸡儿属(CaraganaFabr.)多年生灌木,主要分布在中国北方温带干旱-半干旱地区,其中小叶锦鸡儿为典型草原及荒漠草原旱生灌木,中间锦鸡儿为典型草原及荒漠草原沙生旱生灌木[1],在植树造林[2]、防风固沙[3]、饲用及药用[4-6]等方面均具有重要价值,对生态环境建设及社会经济发展起到特殊作用。
小叶锦鸡儿与中间锦鸡儿是锦鸡儿属较为常见的2个物种,二者的分类学关系至今仍存在许多争议。许多学者将其归为2个种,认为中间锦鸡儿是小叶锦鸡儿与柠条锦鸡儿的中间类型或杂交种[7];也有些学者将其归为一个种[8-9],认为中间锦鸡儿为小叶锦鸡儿的亲本之一[10]。分子生物学及分析技术的发展为研究物种间的生物学关系提供了更为有效的方法。ISSR 分子标记[11]由于其操作简单、重复性好、多态性高且费用低廉,当前,ISSR 技术应用的领域已从植物扩展到真菌。本试验利用ISSR 分子标记技术,对小叶锦鸡儿、中间锦鸡儿共15个种群进行了遗传多样性分析,旨在从较大跨度范围内,研究内蒙古高原小叶锦鸡儿与中间锦鸡儿的遗传关系,并阐明其呈替代性分布的遗传基础。
1 材料和方法
1.1 样品采集
于2013年8~9月在内蒙古由东向西,按照水分逐渐减少的梯度选取15个样点采集小叶锦鸡儿、中间锦鸡儿的叶片,这15个样点分别位于典型草原以及荒漠草原上,其中小叶锦鸡儿7个种群,中间锦鸡儿8个种群。每种随机选取24株,各株距不低于10m,采集叶片,并用变色硅胶进行快速干燥,保存备用。采样地点见表1、图1。
15个采样地点各随机选取3 个重复对土壤样品进行采集,每个重复包含3 层土壤样品:0~10 cm、10~20cm、20~30cm,所采集土壤样品用于土壤养分的测定。

表1 15个种群采样地点Table1 Sampling positions of 15populations
1.2 ISSR 扩 增
采用试剂盒(Tiangen 公司生产的Plant Genomic DNA Kit植物基因组DNA 提取试剂盒),从硅胶干燥固定的叶片中提取DNA,并用琼脂糖凝胶电泳检测。
本研究所用PCR 引物购自南京博尔迪生物科技有限公司,经过筛选最终确定对全部DNA 样品均有清晰、稳定多态性扩增条带且重复性好的引物12条(表2),所选用Marker分子量范围为100~3 000bp。
ISSR 扩增反应经过比较和优化确定为20μL反应体系:模板1μL,引物1μL,2×TaqMix 10 μL、ddH2O 8μL补至20μL。
PCR 扩增条件为:94 ℃预变性5min;94 ℃变性45s,51~53℃复性45s,72℃延伸1.5min,共35个循环;72 ℃延伸10min,4 ℃保存备用。
PCR 产物于2%琼脂糖凝胶(含核酸染料)中电泳检测,电流220mA、电压100V、电极缓冲液为1×TAE、电泳时间为50 min。电泳结束后在Syn-Gene凝胶成像系统下观察照相。
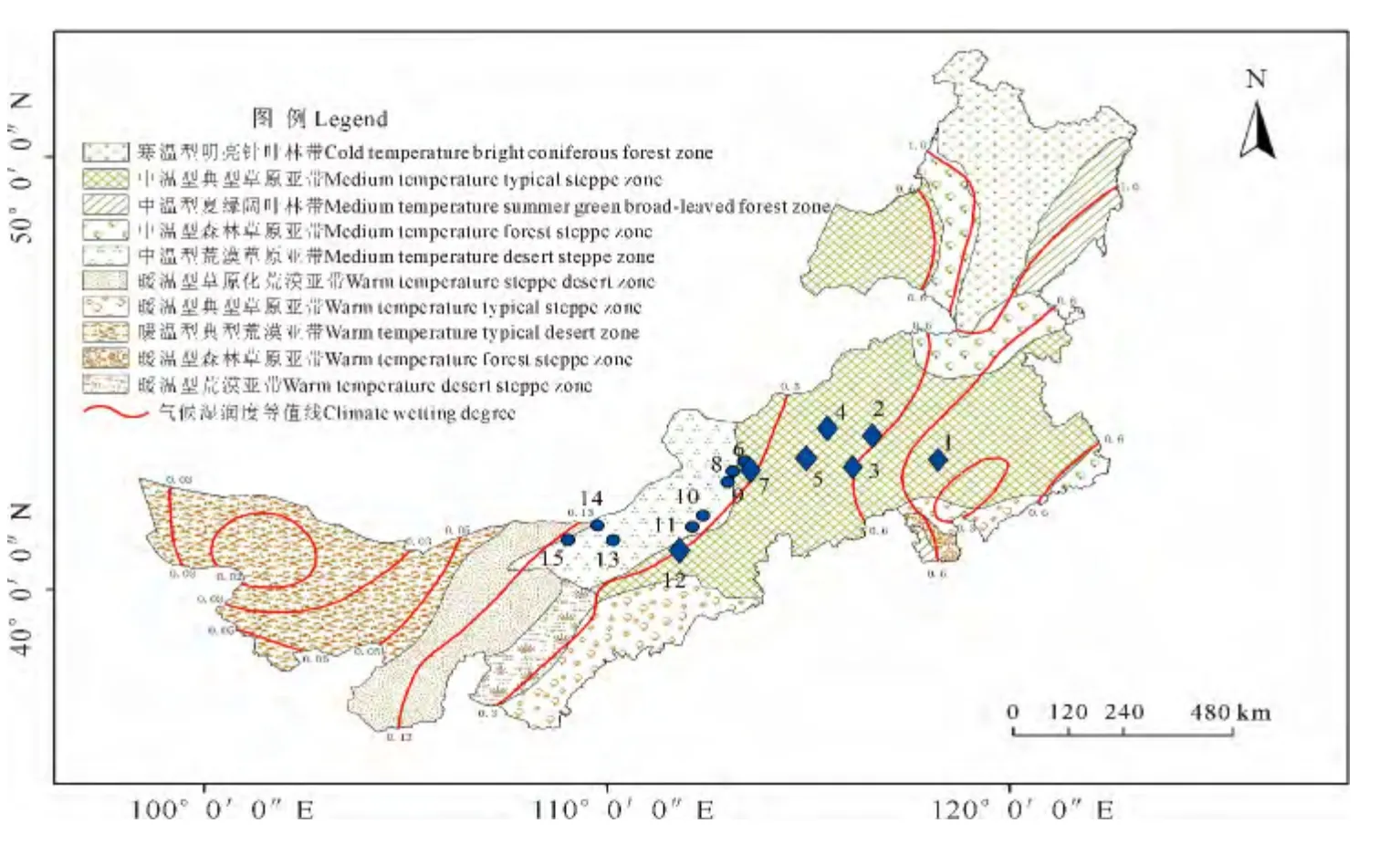
图1 各采集样点分布图Fig.1 Sampling site distribution map
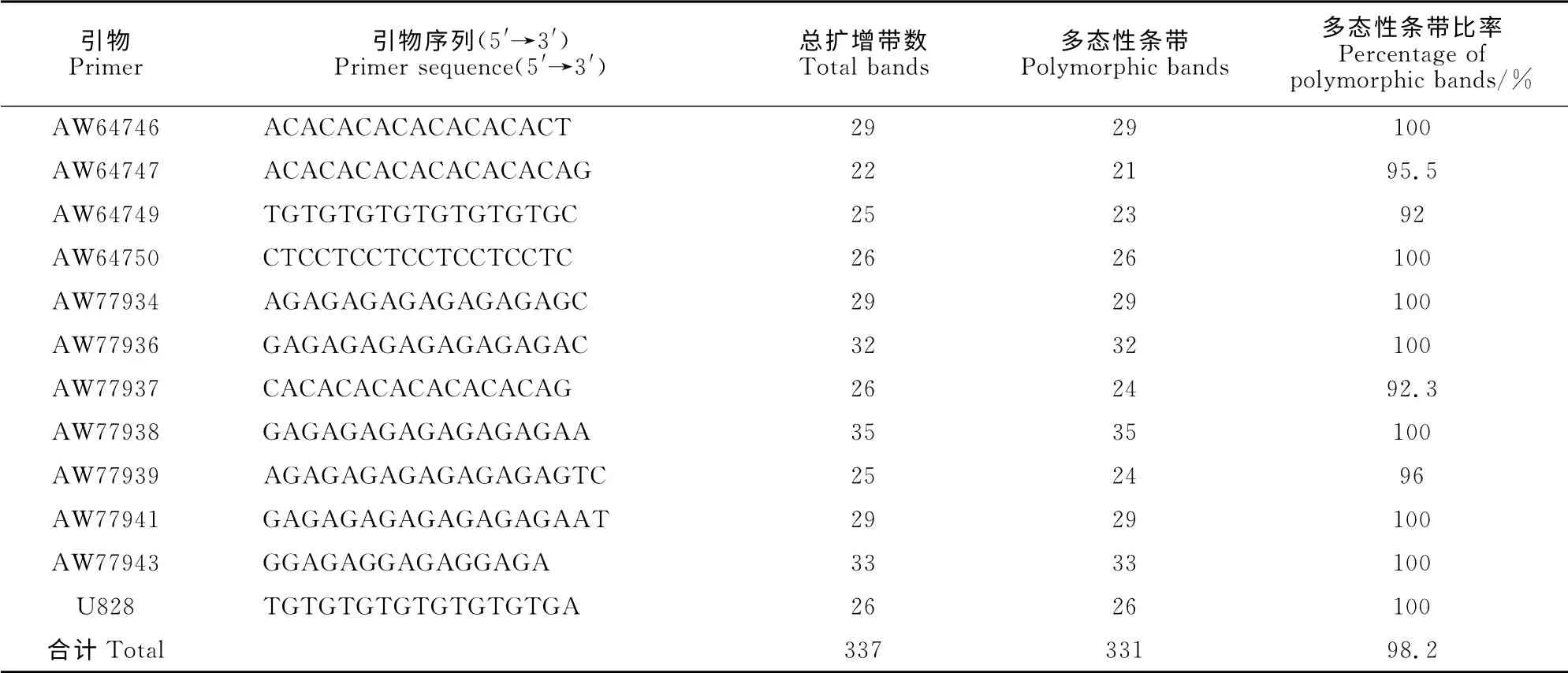
表2 ISSR 引物及其序列和多态性分析Table2 ISSR primers and the sequence polymorphism analysis
1.3 数据统计与分析
以清晰可辨的扩增条带在相对迁移位置的有无记数,每个可辨带代表一个变异,在相同迁移位置,有带记为1,无带记为0,生成分子数据矩阵。利用Popgene 3.2统计ISSR 扩增产物的多态位点百分数、Nei’s遗传多样性指数、Shannon信息指数、居群间遗传分化系数(Gst)、遗传距离(D)和遗传一致度(I)。应用Structure 2.3.2软件对15 个锦鸡儿种群的遗传结构进行邻接聚类分析。
1.4 相关性分析
本研究利用SPSS 17.0对小叶锦鸡儿、中间锦鸡儿遗传多样性各指数与气象因子、土壤因子做逐步回归,进行相关性分析。其中气象因子选取5个:年降水量、年平均气温、年平均相对湿度、年日照时数和有效积温,该气象数据均取自中国气象科学数据共享服务网自1960年至2012年的数据;土壤因子共测定了以下5 项:全氮、全磷、全碳、有机碳和pH 值。并用Mantel检验[12]进行相关性检测。
2 结果与分析
2.1 遗传多样性分析
用12条引物对小叶锦鸡儿、中间锦鸡儿的共360个个体的DNA 样品进行扩增,其中小叶锦鸡儿个体168个,中间锦鸡儿个体192个,部分扩增结果见图2。
2.1.1 小叶锦鸡儿居群 小叶锦鸡儿7个种群共168个个体,经PCR 扩增后共得到331 个条带,其中多态位点数为325个,小叶锦鸡儿物种水平上的多态位点百分数为98.19%(表3),从中可以看出小叶锦鸡儿的遗传多样性很高[13]。从表3可以看出,不同种群多态位点百分数是不同的,多态位点百分数从小到大依次为种群Ca1<Ca5<Ca7<Ca12<Ca4<Ca3<Ca2。
Nei’s基因多样性指数是衡量居群多样性的最常用指标。本研究显示,其变化范围在0.233 4~0.282 7之间,从小到大为种群Ca1<Ca12<Ca7<Ca5<Ca3<Ca4<Ca2。
Shannon信息指数分析结果与Nei’s基因多样性指数所显示结果趋于一致,其变化范围为0.354 5~0.426 5,从小到大依次为种群Ca1<Ca12<Ca7<Ca5<Ca3<Ca4<Ca2。
从总体上看,小叶锦鸡儿种群总的Nei’s基因多样性指数为0.289 7,Shannon 信息指数为0.444 0,由此也可以看出小叶锦鸡儿种内具有丰富的遗传多样性。
2.1.2 中间锦鸡儿居群 经PCR 扩增后,中间锦鸡儿8个种群192个个体共扩增出330个条带,其中多态性位点数为329个,多态位点百分数为99.7%(表4),从多态位点百分数可以粗略地看出中间锦鸡儿的遗传多样性非常高。各种群的多态位点百分数由低到高依次为Ca10<Ca14<Ca13<Ca9<Ca15<Ca8<Ca6(表4)。Nei’s基因多样性指数与Shannon信息指数所表达的结果相同,从小到大都为Ca10<Ca14<Ca9<Ca13<Ca15<Ca8<Ca6(表4)。
图2 引物AW77939 对小叶锦鸡儿种群Ca2和中间锦鸡儿种群Ca14的扩增图谱Fig.2 Primer AW77939amplification patterns of C.microphylla population Ca2and C.intermedia population Ca14

表3 小叶锦鸡儿种群ISSR 检测遗传多样性结果Table3 The results of C.microphyllaISSR genetic diversity

表4 中间锦鸡儿种群ISSR 检测遗传多样性结果Table4 The results of C.intermediaISSR genetic diversity
总体看来,中间锦鸡儿种群总的Nei’s基因多样性指数为0.312 8,Shannon信息指数为0.478 4,由此可知,中间锦鸡儿种内具有丰富的遗传多样性。
2.2 遗传结构与基因流分析
2.2.1 小叶锦鸡儿居群 从表5看出,小叶锦鸡儿居群的总基因多样度为0.289 7,其中居群内基因多样度为0.255 2,居群间遗传分化系数为0.119 0。
居群间遗传分化系数是反映群体遗传分化程度的重要指标[14]。7个小叶锦鸡儿种群的分化系数在0.05~0.15之间,表明小叶锦鸡儿种群具有中等程度的遗传分化。本研究中7个小叶锦鸡儿居群间的基因流为3.701 0,表明居群间基因流频繁,而居群间遗传分化并非由遗传漂变所致。
2.2.2 中间锦鸡儿居群 由表6可以看出,总基因多样度为0.312 8,其中居群内基因多样度为0.253 9,居群间遗传分化系数为0.188 1,表明中间锦鸡儿种群存在较大程度的遗传分化。中间锦鸡儿居群间的基因流为2.157 8,表明中间锦鸡儿居群间的遗传分化也并非由遗传漂变所致。
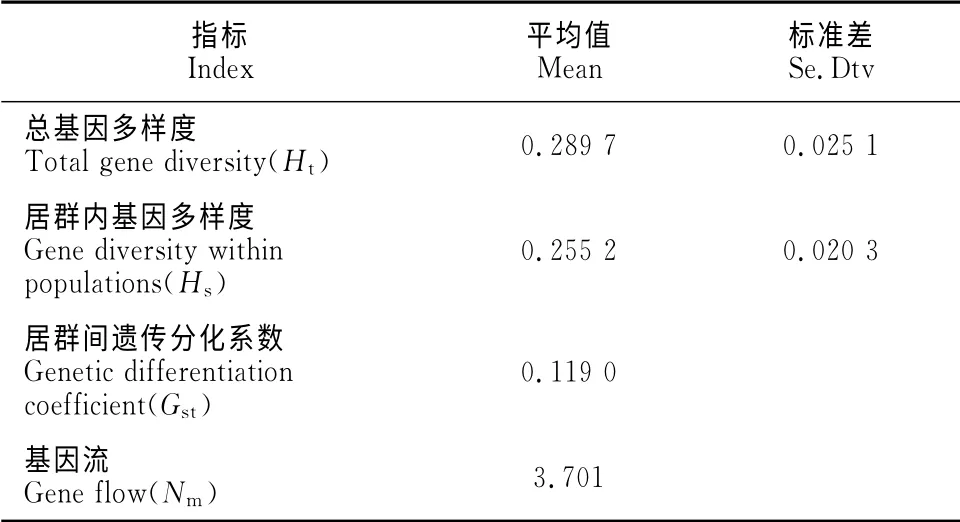
表5 小叶锦鸡儿种群的遗传分化Table5 Genetic differentiation of C.microphylla population
2.3 遗传距离与遗传一致度分析
2.3.1 小叶锦鸡儿居群 基因分化系数虽然能够对居群分化的程度作出评价,但却不能判定居群间相互关系的远近,而居群间的遗传距离用来表明每两个居群间彼此关系的远近,进一步说明居群间遗传分化程度的高低。从表7可以看出,小叶锦鸡儿种群Ca5与Ca7间的遗传距离最近,为0.025 5,而种群Ca1 与Ca7 间的遗传距离最远,为0.067 1。各居群遗传一致度在0.935 1~0.974 8之间。各居群间的平均遗传距离为0.048 1,平均遗传一致度为0.953 1,说明居群间遗传距离较低,而居群间的相似程度较高。
2.3.2 中间锦鸡儿居群 表8显示的是中间锦鸡儿居群间的遗传距离与遗传一致度。从表8可以看出,中间锦鸡儿居群间的遗传距离变化范围在0.029 0~0.286 8之间,遗传一致度的变化范围在0.750 6~0.971 4之间,其中种群Ca9与Ca10的遗传距离最小,为0.029 0,而遗传一致度最大,为0.971 4,表明种群Ca9和Ca10的遗传相似性最大;种群Ca6与Ca14之间的遗传距离最大,为0.286 8,而遗传一致度最小,为0.750 6,表明种群Ca6 与Ca14的遗传相似性最小。各居群间平均遗传距离为0.100 0,平均遗传一致度为0.909 4。
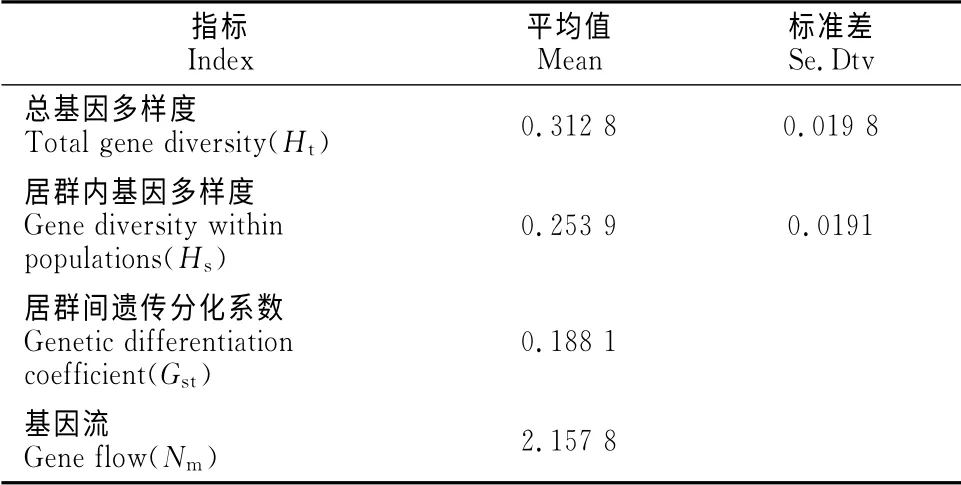
表6 中间锦鸡儿种群的遗传分化Table6 Genetic differentiation of C.intermedia population
2.4 聚类分析
从图3可知,种群Ca4 和Ca5 聚为一个群体(红色),其余种群各自成独立的群体;种群Ca3有2种主要的遗传成分;每个种群都有其他种群的遗传成分渗入,15个种群间都有共同的遗传成分。
邻接聚类分析结果如图4所示,种群Ca1、Ca2、与Ca3聚为一支,再与聚为一支的种群Ca4和Ca5相聚,之后与种群Ca7 以及聚为一支的种群Ca8、Ca9、Ca10聚合,再与种群Ca6以及聚为一支的种群Ca11、Ca12聚合,最后依次与种群Ca13、Ca14和Ca 15依次相聚。由此结果可以看出,同种锦鸡儿各种群的亲缘关系最近;中间锦鸡儿和小叶锦鸡儿的各种群在聚类时发生了交叉,揭示了中间锦鸡儿和小叶锦鸡儿遗传关系密切。从总体上看,15个锦鸡儿种群表现为从东到西逐渐聚类。
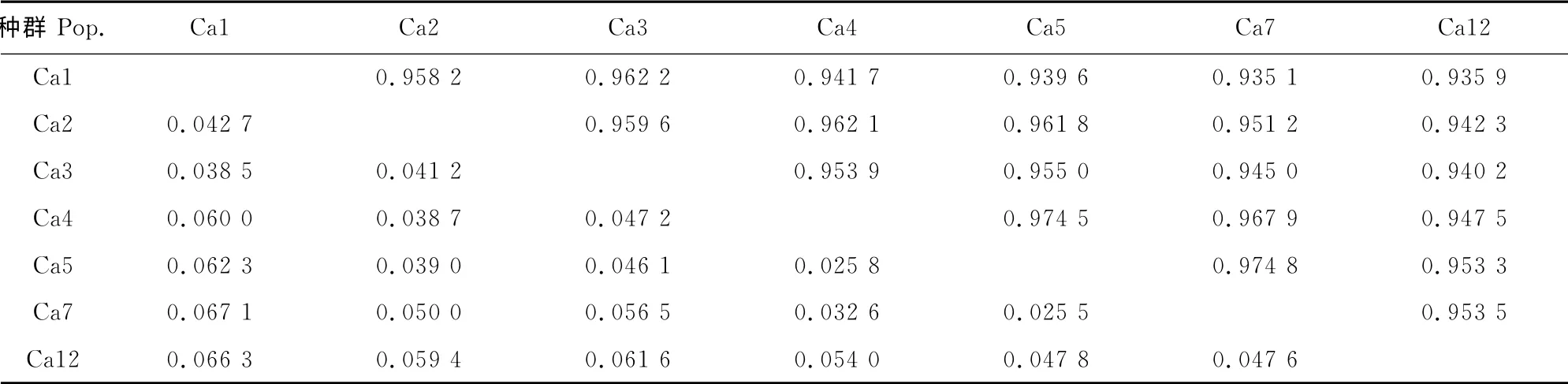
表7 小叶锦鸡儿种群遗传距离与遗传一致度Table7 Nei’s genetic distance and genetic identity of C.microphylla
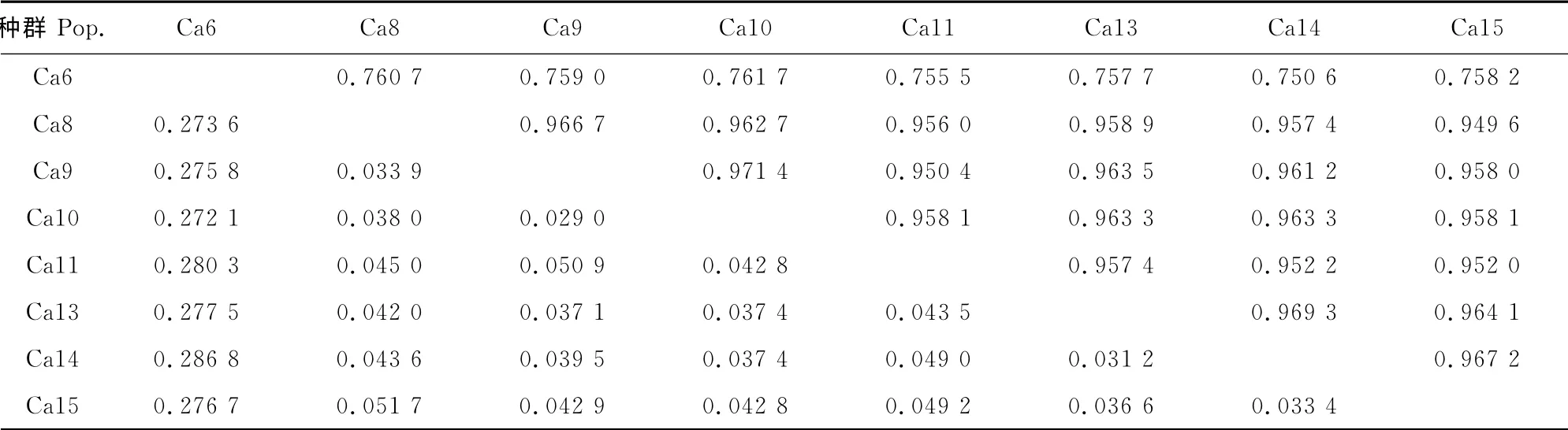
表8 中间锦鸡儿种群遗传距离与遗传一致度Table8 Nei’s genetic distance and genetic identity of C.intermedia
2.5 遗传距离与地理距离的相关性
Mantel检验是由Nathan Mantel所提出[12],是对两个矩阵相关关系的检验,在种群遗传学、群落生态学等领域都已得到广泛应用。本研究对小叶锦鸡儿与中间锦鸡儿两两种群间的遗传距离与地理距离的相关性进行Mantel检验。分析得出,相关系数r=0.695 1(P>0.05),表明锦鸡儿种群的遗传分化与地理距离有一定的相关性,但相关性并不显著,说明锦鸡儿种群的遗传变异并非由地理距离所产生的遗传漂变所致。
2.6 ISSR 遗传多样性各指数与气象因子及土壤因子之间的相关性分析
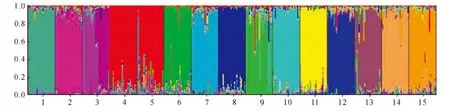
图3 15个锦鸡儿种群的遗传结构结果(运用Structure中的混合模型)Fig.3 Results of Bayesian analysis of 15populations of Caragana using admixture model in Structure
以15个锦鸡儿种群的ISSR 遗传多样性各指数(有效等位基因数、Nei’s基因多样性指数、Shannon信息指数、多态位点数、多态位点百分数)为因变量,以包括经纬度、海拔高度,气象因子、土壤因子在内的共23个因子做自变量,在SPSS 17.0中分别作逐步回归。引入变量P值确定为0.05,剔除变量P值为0.10。如表9所示,各遗传多样性指数仅与平均气温这一气象因子有相关关系,剔除22个其他变量。在以有效等位基因数为因变量的逐步回归中,引入平均气温这一自变量,且该因子对有效等位基因数的解释程度为44.4%,同时引入的截距项也与有效等位基因数存在显著相关关系,方差分析显示模型达显著水平(P=0.018<0.05),说明模型的解释效果较好。平均气温对Nei’s基因多样性指数、Shannon信息指数、多态位点数、多态位点百分数 的解释程度分别为48.5%、50%、47.6%、47.6%,且方差分析所显示的结果均表明模型解释效果较好(P<0.05)。
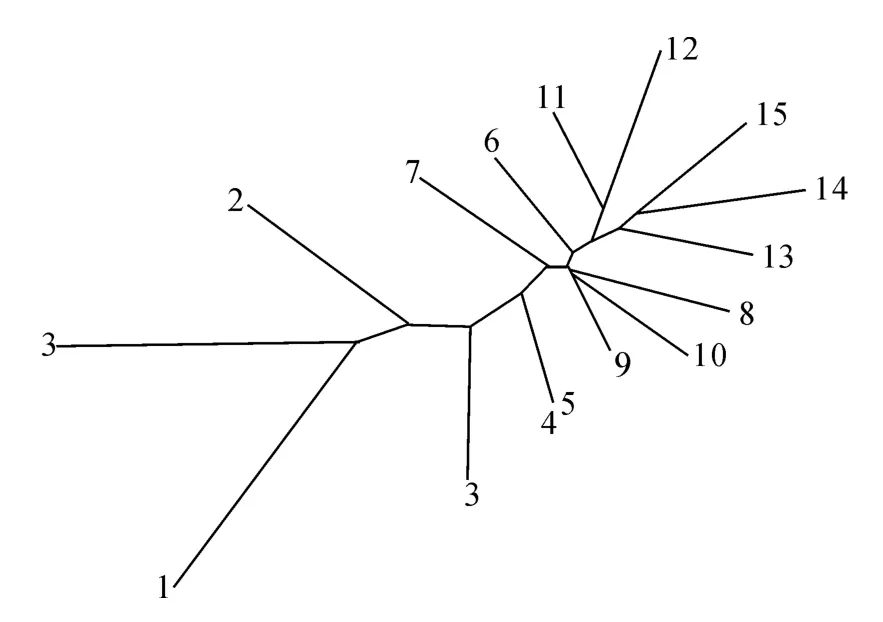
图4 15个锦鸡儿种群邻接聚类树Fig.4 Neighbor joining tree of 15 Caragana populations
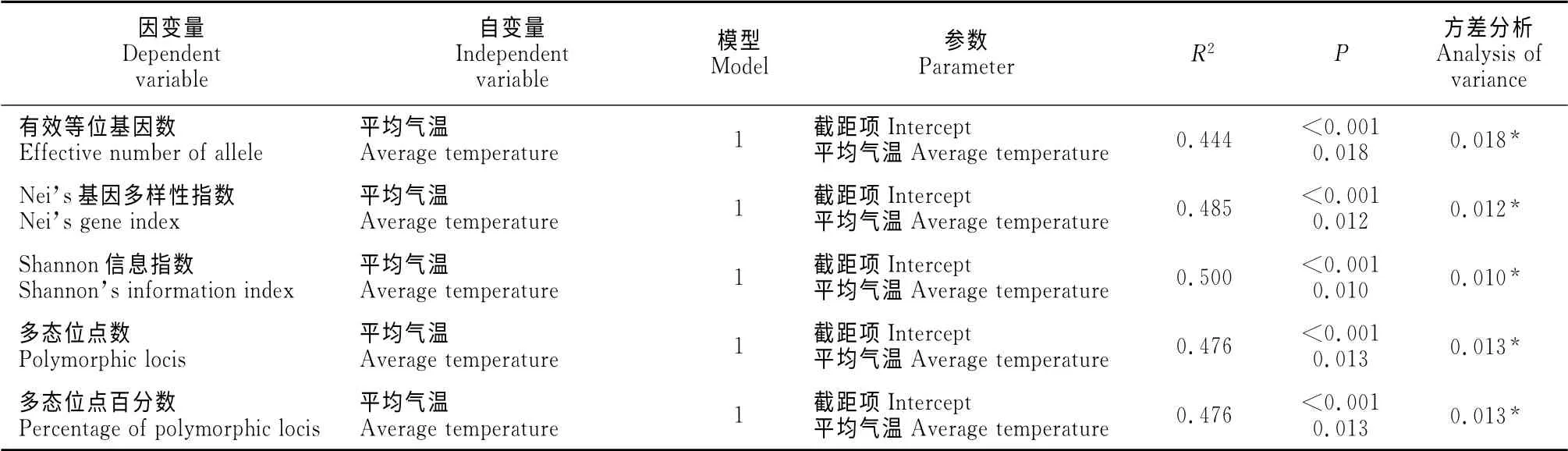
表9 ISSR 遗传多样性各指数与气象因子和土壤因子逐步回归Table9 The regression analysis of ISSR genetic diversity index with meteorological factors and soil factors
3 讨 论
小叶锦鸡儿与中间锦鸡儿在表型性状上具有极大的相似性,单利用传统的形态学分类方法很难从本质差异上对二者进行区分。目前,应用DNA 分子标记手段对于中间锦鸡儿分类学地位的研究,特别是小叶锦鸡儿与中间锦鸡儿遗传关系的研究成为人们关注的焦点。侯鑫等[10]基于ITS序列和trnl-F序列探讨小叶锦鸡儿、中间锦鸡儿和柠条锦鸡儿的种间关系,发现中间锦鸡儿的trnl-F 序列与小叶锦鸡儿完全一致。赵一之等[15]应用RAPD 技术研究发现,小叶锦鸡儿、中间锦鸡儿和柠条锦鸡儿不是孤立的3个钟,而是一个地理渐变群。段永红等应用RAPD 技术发现小叶锦鸡儿与中间锦鸡儿的种间差异不大,有较近的亲缘关系[16]。在本研究中,聚类分析的结果表明虽然两个种之间存在交错,但能够明显的区分开来。
周海燕等[17]将科尔沁沙地的小叶锦鸡儿与毛乌素沙地的中间锦鸡儿引种至腾格里沙漠,发现小叶锦鸡儿对极端干旱环境的适应性不及中间锦鸡儿。李进等[18]利用梯度分析法对3 种锦鸡儿的解剖结构指标进行分析,表明抗旱性顺序为小叶锦鸡儿<中间锦鸡儿<柠条锦鸡儿。马成仓[19]对小叶锦鸡儿与中间锦鸡儿形态特性、光合特性、水分代谢特性、光合机构等方面研究二者的生态适应性,结果表明中间锦鸡儿有比小叶锦鸡儿更强的生态适应性,更能适应干旱环境。
通常来讲一个物种拥有较为丰富的遗传多样性使其更能够适应环境的变化,反之,遗传多样性贫乏的物种通常在进化上的适应性就相对较弱。Nei’s基因多样性指数与Shannon信息指数是衡量居群多样性的最常用指标[20]。本研究中中间锦鸡儿种群总的Nei’s基因多样性指数与Shannon信息指数均高于小叶锦鸡儿种群,这表明中间锦鸡儿种群具有比小叶锦鸡儿种群更高的遗传多样性,这与中间锦鸡儿种群具有更好的生态适应性相一致。中间锦鸡儿种群间的遗传分化系数为0.188 1,而小叶锦鸡儿种群间的遗传分化系数为0.119 0,这表明中间锦鸡儿种群内具有更高的遗传分化,这种高度的遗传分化使得中间锦鸡儿能够适应不良的环境,扩展其分布范围。
气候条件,特别是降水、温度会影响到植物的生长状况和物候,影响植物的开花、结实,以及传粉、种子的传播[21-22],从而影响到基因交流。在内蒙古高原,水-热组合条件是影响植被分布的主导因素。热量分布从东到西逐渐升高,而降水量分布则是从东到西逐渐减少,由温度和降水组成的湿润度逐渐降低[23]。本研究对从东到西分布15个锦鸡儿种群遗传多样性各指数与23个环境因子进行的相关性分析表明,平均气温这一热量条件对锦鸡儿种群的遗传分化起着重要的作用。
锦鸡儿属起源于第三纪中期,小叶锦鸡儿与中间锦鸡儿为锦鸡儿属在草原区形成的水份系列上地理替代类群Ser.microphyllae中的2种。其中小叶锦鸡儿分布于外贝加尔、蒙古高原、东北平原和华北等地,是分布于草甸草原与典型草原区的旱生灌木,中间锦鸡儿分布于蒙古南部和内蒙中部,是典型草原区向荒漠草原区的过渡类型[24]。本研究的邻接聚类分析表明,在内蒙古高原小叶锦鸡儿和中间锦鸡儿的集中分布区,从典型草原到荒漠草原,15 个种群逐渐聚类,体现了这2个种在分布上的地理渐变性及地理替代性;同时小叶锦鸡儿种群与中间锦鸡儿种群也出现了交叉,体现出中间锦鸡儿与小叶锦鸡儿密切的亲缘关系,表现出生态过渡带物种的分子变异特征,说明生态过渡性与植物物种遗传结构过渡性密切相关。作为地理替代种不仅显示了中间锦鸡儿和小叶锦鸡儿2个种的同源性,也显示出其更强的适应性。植物在异质环境中适应分化,形成了不同的局域种群,保持着与环境匹配的特征组合,并逐渐积累起对异质环境和波动环境的遗传改变,这是适应现实环境和潜在变动环境的基础[25]。中间锦鸡儿和小叶锦鸡儿交叉变异是物种适应进化的结果,不仅拓展了自身的生存空间,也维护了当地的物种多样性。
[1] 马毓泉.内蒙古植物志[M].呼和浩特:内蒙古人民出版社,1980.
[2] ZHAO Y ZH(赵一之).The distribution pattern and ecological adaptation ofCaraganamicrophylla,C.davazamciiandC.korshinskii[J].ActaEcologicaSinica(生态学报),2005,25(12):3 411-3 414(in Chinese).
[3] LI Q X,WANG Y ZH,ZHU Y J,etal.Effects of soil improvement ofCaraganaintermediaplantations in alpine sandy land on Tibet Plateau[J].ActaEcologicaSinica,2014,34:123-128.
[4] 江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1985:392-393.
[5] JIN ZH N(金正男),JIN J J(金景姬),JIN G ZH(金光洙).Pharmacological action of the extract ofCaraganamicrophyllaLam.[J].JournalofYanbianMedicalCollege(延边医学院学报),1994,17(4):267-270(in Chinese).
[6] LIU H X(刘红霞),LIN W H(林文翰),YANG J SH(杨峻山).The study progress on chemical composition and pharmacological action of the genusGaragana[J].ChinesePharmaceuticalJournal(中国药学杂志),2004,39(5):327-330(in Chinese).
[7] NIU X W(牛西午).The distribution and description ofCaraganaFabr.in China[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),1999,19(5):107-133(in Chinese).
[8] WANG H X(王洪新),HU ZH A(胡志昂),ZHONG M(钟 敏),etal.Morphological variations ofCaraganapopulations in the Maowusu sandy grassland[J].ActaEcologicaSinica(生态学报),1994,14(4):366-371(in Chinese).
[9] WANG H X(王洪新),HU ZH A(胡志昂),ZHONG M(钟 敏),etal.Seed protein diversity ofCaraganapopulations in Maowusu sandy grassland and its biological implication[J].ActaEcologicaSinica(生态学报),1994,14(4):372-380(in Chinese).
[10] HOU X(侯 鑫),LIU J E(刘俊娥),ZHAO Y ZH(赵一之),etal.Interspecific relationships ofCaraganamicrophylla,C.davazamciiandC.korshinskii(Leguminosae)based on ITS and trnL-F data sets[J].ActaPhytotaxonomicaSinica(植物分类学报),2006,44(2):126-134(in Chinese).
[11] ZIETKIEWICZ E,RAFALSKI A,LABUDA D.Genome fingerprinting by simple sequence repeat(SSR)anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[12] MANTEL N.The detection of disease clustering and a generalized regression approach[J].CancerResearch,1967,27(2):209-220.
[13] SHENG H M(盛红梅),CHEN T(陈 拓),AN L ZH(安黎哲).Genetic diversity and relationship among species ofCaraganaFabr.[J].JournalofDesertResearch(中国沙漠),2005,25(5):697-701(in Chinese).
[14] CAI X H(蔡小辉),SONG ZH K(宋忠魁),PENG Y H(彭银辉),etal.ISSR analysis of twoScyllaparamamosainpopulations with different body colors[J].JournalofOceanographyinTaiwanStrait(台湾海峡),2011,30(3):363-368(in Chinese).
[15] ZHAO Y ZH(赵一之),SONG Z Y(宋宗元),ZHAO L Q(赵利清).Caraganaordosica,a new species ofCaragana(Leguminosae)[J].BulletinofBotanicalResearch(植物研究),2005,25(4):385-388(in Chinese).
[16] DUAN Y H(段永红),NIU X W(牛西午),LI S Q(李素清),etal.Genetic diversity analysis ofPeashrubin China by RAPD[J].ActaAgriculturaeBoreali-Sinica(华北农学报),2009,24(1):143-148(in Chinese).
[17] ZHOU H Y(周海燕),ZHANG J G(张景光),LONG L Q(龙利群),etal.Photosynthesis of several dominant shrubs of genusCaraganaL.in ecotone[J].JournalofDesertResearch(中国沙漠),2001,21(3):227-231(in Chinese).
[18] LI J(李 进),ZHANG X F(张秀伏).Study on the application of gradient analysis technique in plant drought resistance[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),1996,16(3):284-292(in Chinese).
[19] 马成仓.内蒙古高原锦鸡儿属(Caragana)几种优势植物生态适应性与地理分布的关系[D].天津:南开大学,2004.
[20] LI H Y(李鸿雁),LI ZH Y(李志勇),SHI W G(师文贵),etal.The genetic diversity of three ecologicalMedicagoruthenicagermplasms revealed by ISSR and SSR[J].ActaPrataculturaeSinica(草业学报),2012,21(5):107-113(in Chinese).
[21] GUO ZH X(国志兴),ZHANG X N(张晓宁),WANG Z M(王宗明),etal.Responses of vegetation phenology in northeast China to climate change[J].ChineseJournalofEcology(生态学杂志),2010,29(3):578-585(in Chinese).
[22] SONG CH Q(宋春桥),YOU S C(游松财),KE L H(柯灵红),etal.Phenological variation of typical vegetation types in northern Tibet and its response to climate changes[J].ActaEcologicaSinica(生态学报),2012,32(4):1 045-1 055(in Chinese).
[23] 中国科学院内蒙古宁夏综合考察队.内蒙古植被[M].北京:科学出版社,1985.
[24] ZHOU D W(周道玮),WANG A X(王爱霞),LI H(李 宏).Classification and distribution of Sect.Caraganaof genusCaraganaFabr.(Fabaceae)[J].JournalofNortheastNormalUniversity(Nat.Sci.Edi.)(东北师大学报·自然科学版),1994,(2):64-68(in Chinese).
[25] 姜汉侨.植物生态学[M].北京:高等教育出版社,2004.
