冰片对血脑屏障P-糖蛋白功能的影响
2015-07-02周国梁毛斌斌
俞 浩,周国梁,毛斌斌
(安徽科技学院 食品药品学院,安徽 凤阳 233100)
冰片对血脑屏障P-糖蛋白功能的影响
俞 浩,周国梁,毛斌斌
(安徽科技学院 食品药品学院,安徽 凤阳 233100)
观察冰片对血脑屏障(BBB)P-糖蛋白功能的影响。取NIH小鼠,随机分为冰片高、中、低剂量组,维拉帕米组和溶剂对照组。灌胃给药,每日2次,共7次。末次给药后,分别从尾静脉和脑室注射罗丹明123(Rho-123)。注射Rho-123后取血浆和脑组织,荧光分光光度法测定血浆及脑组织中Rho-123含量。结果表明:尾静脉注射Rho-123后,冰片对小鼠血浆Rho-123含量无明显影响;5,10,20和30 min冰片高、中剂量组小鼠脑组织Rho-123浓度均显著高于溶剂对照组(P<0.01)。脑室注射Rho-123后5,10,20和30 min,冰片高剂量组小鼠血浆Rho-123浓度均显著低于溶剂对照组(P<0.05);20,30 min冰片中剂量组小鼠血浆Rho-123浓度亦显著低于溶剂对照组(P<0.05);1,5,10和20 min冰片高剂量组小鼠脑组织Rho-123浓度显著高于溶剂对照组(P<0.01或P<0.05);5,10 min冰片中剂量组小鼠脑组织Rho-123浓度亦显著高于溶剂对照组(P<0.05)。说明冰片能抑制BBB P-gp功能。
冰片;血脑屏障;P-糖蛋白;罗丹明123
P-糖蛋白(P-glycoprotein,P-gp)是能量依赖性药物转运外排泵,其能降低细胞内不同化学结构和不同作用机制底物的浓度,使细胞对多种化合物产生耐药。研究表明,P-gp在肿瘤细胞和许多正常组织中均有高水平表达,其能将进入组织细胞内的底物排出细胞,导致细胞产生耐药[1-3]。冰片是一小分子化合物,结构明确,毒性较低。冰片不仅本身极易透过血脑屏障(Blood brain barrier,BBB),还能促进伊文思蓝、泛影葡胺、庆大霉素等透过BBB[4-5]。对冰片开放BBB的机制研究发现,其能升高脑微血管内皮细胞内Ca2+浓度和一氧化氮合酶(iNOS)活性,减少脑微血管内皮细胞细胞间粘附分子的表达,开放BBB内皮细胞间紧密连接,增加脑毛细血管内皮细胞吞饮囊泡数量[6-7]。本实验拟在前期研究的基础上,采用尾静脉-脑室注射P-gp底物罗丹明123(Rho-123),观察冰片对P-gp的作用,进一步探讨冰片开放BBB的机制。
1 材料与方法
1.1 实验动物
雄性NIH小鼠,体重28±2 g,广东省医学实验动物中心提供,合格证号:SCXK(粤)2003-0002,粤监证字2005A011。
1.2 药品与试剂
冰片,购于广州市药材公司,为机制冰片,批号:20040904;Rho-123,Sigma公司;盐酸维拉帕米片,江苏四环生物股份有限公司,批号:0503071;甲醇(色谱纯),天津市科密欧化学试剂开发中心。
1.3 仪器设备
LXJ-IIB低速大容量离心机,上海安亭科学仪器厂;AEL-160型电子分析天平,日本岛津公司;Forma低温冰箱,Thermo公司;RC5C高速低温离心机,美国杜邦公司;LS-55荧光分光光度计,Perkin-Elmer公司。
1.4 Rho-123供试液的配制
取Rho-123 1mg,用100μL的DMSO充分溶解,配制成浓度为10 mg/mL的Rho-123贮备液。取适量Rho-123贮备液,用生理盐水分别稀释至0.015 mg/mL(尾静脉注射用)和0.2 mg/mL(脑室注射用)。
1.5 动物分组与给药
取NIH小鼠,随机分为冰片高、中、低剂量组(200 mg/kg,100 mg/kg,50 mg/kg,根据大鼠剂量按体表面积换算),维拉帕米组(40 mg/kg,根据人等效剂量按体表面积换算)和溶剂对照组。各组均每日给药2次,共7次,溶剂对照组给等体积的粟米油,容量均为20 mL/kg。末次给药前小鼠禁食不禁水12 h,末次给药后即刻,分别从尾静脉(0.3mg/kg)和脑室(注射点为脑中线前卤左侧2 mm,深3 mm)注射Rho-123(0.3 mg/kg)。
1.6 样品采集与处理
分别于注射Rho-123后1,5,10,20,30 min摘眼球取血,肝素抗凝,离心分离血浆,-70 ℃冰箱保存待测。断头取脑,剥去软脑膜及脑表面血管,生理盐水洗净,滤纸吸尽水分,切取右半侧脑组织,锡箔包裹,-70 ℃冰箱保存待测。
取血浆0.1 mL,加0.1mL生理盐水和0.8 mL甲醇,涡旋10 s,15000 rpm/min离心10 min,取上清500 μL注入微量比色杯测定。
取脑组织,称重,加入0.5 mL生理盐水匀浆,15000 rpm/min离心10 min,取上清0.1 mL,加0.1 mL生理盐水和0.8 mL甲醇,涡旋10 s,再15000 rpm/min离心10 min,取上清500 μL注入微量比色杯测定。
1.7 检测方法
1.7.1 Rho-123标准溶液的配制 精密称取Rho-123 1 mg,用100 μL的DMSO充分溶解,配制成浓度为10 mg/mL的Rho-123贮备液。取贮备液用生理盐水配制成1,5,10,50,100 ng/mL系列浓度的Rho-123标准溶液。
1.7.2 血浆中Rho-123含量测定标准曲线的制备 取1,5,10,50,100 ng/mL系列浓度的Rho-123标准溶液0.1 mL于5支试管中,各加入0.1 mL空白血浆和0.8 mL甲醇,涡旋混匀,15000 rpm/min离心10 min,取上清于激发波长495 nm,发射波长520 nm处(狭缝宽度均为5 nm)测定荧光强度,以荧光强度对浓度进行线性回归,得血浆Rho-123标准曲线方程为:Y = 5.476X-0.077,r = 0.9998,线性范围为1~100 ng/mL。
1.7.3 脑组织中Rho-123含量测定标准曲线的制备 取1,5,10,50,100 ng/mL系列浓度的Rho-123标准溶液0.1 mL于5支试管中,各加入0.1 mL空白脑匀液和0.8 mL甲醇,涡旋混匀,15000 rpm/min离心10 min,取上清于激发波长495 nm,发射波长520 nm处(狭缝宽度均为5 nm)测定荧光强度,以荧光强度对浓度进行线性回归,得脑组织Rho-123标准曲线方程为:Y = 6.544 X+9.918,r = 0.9997,线性范围为1~100 ng/mL。
1.8 数据统计与处理
2 结果
2.1 冰片对小鼠尾静脉注射Rho-123 血浆药物浓度的影响
由表1,尾静脉注射Rho-123后各时间点冰片各剂量组小鼠血浆Rho-123浓度均未见明显改变,与溶剂对照组比较无显著性差异(P>0.05)。


组别Rho-123(ng/mL)1min5min10min20min30min溶剂对照组122.45±32.4761.11±25.8259.04±8.9343.09±10.0735.03±4.31维拉帕米组117.25±34.3866.98±15.4661.27±8.5945.28±7.7935.69±12.46冰片高剂量组105.32±22.7970.94±14.8856.27±7.9739.50±8.6830.99±10.43冰片中剂量组116.61±19.9162.49±6.1458.64±15.5539.77±14.3632.86±16.18冰片低剂量组122.05±25.2768.81±7.2957.08±23.2338.89±2.0633.64±2.59
2.2 冰片对小鼠尾静脉注射Rho-123脑组织药物浓度的影响
由表2可知,尾静脉注射Rho-123后5,10,20和30 min,冰片高、中剂量组小鼠脑组织Rho-123含量均显著升高,与溶剂对照组比较有非常显著性差异(P<0.01),作用与维拉帕米相当。说明冰片能促进Rho-123透过BBB。


组别Rho-123(ng/g)1min5min10min20min30min溶剂对照组27.76±9.5032.89±17.1433.99±14.6727.44±11.5630.37±5.30维拉帕米组42.36±14.3357.34±12.64**63.22±14.13**51.24±10.21**50.33±12.01**冰片高剂量组39.03±13.5152.43±9.71**58.13±12.44**46.99±7.74**48.47±8.00**冰片中剂量组38.25±15.7151.15±8.97**53.66±14.45**42.87±8.42**41.42±9.06**冰片低剂量组28.10±10.4040.87±7.3241.54±11.5639.80±7.0436.70±4.14
注:与溶剂对照组比较*P<0.05,**P<0.01
2.3 冰片对小鼠脑室注射Rho-123 血浆药物浓度的影响
由表3可知,脑室注射Rho-123后5,10,20和30 min,冰片高剂量组小鼠血浆Rho-123浓度显著低于溶剂对照组(P<0.05),其作用与维拉帕米相当;20,30 min,冰片中剂量组小鼠血浆Rho-123浓度亦显著低于溶剂对照组(P<0.05),其作用与维拉帕米相当。说明冰片能抑制Rho-123从脑组织外排。

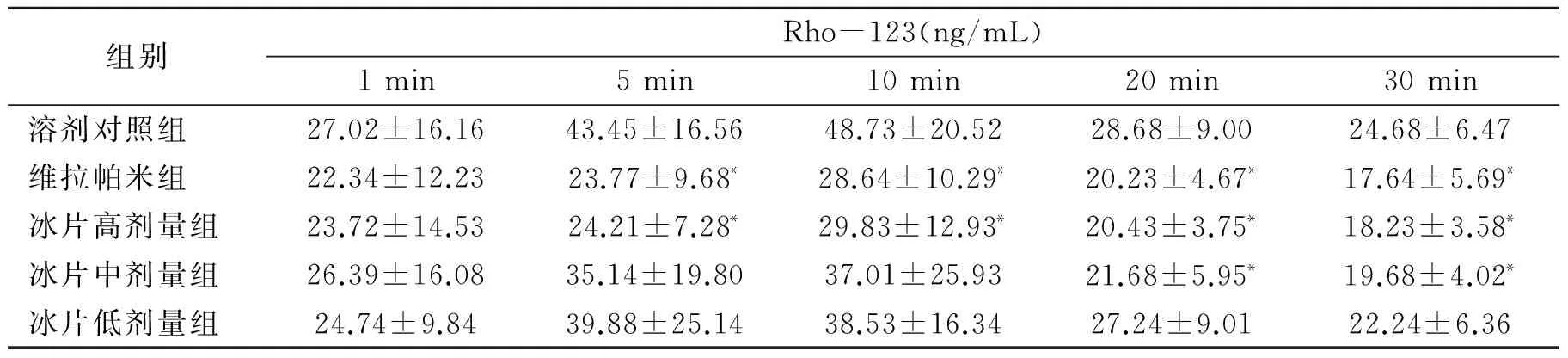
组别Rho-123(ng/mL)1min5min10min20min30min溶剂对照组27.02±16.1643.45±16.5648.73±20.5228.68±9.0024.68±6.47维拉帕米组22.34±12.2323.77±9.68*28.64±10.29*20.23±4.67*17.64±5.69*冰片高剂量组23.72±14.5324.21±7.28*29.83±12.93*20.43±3.75*18.23±3.58*冰片中剂量组26.39±16.0835.14±19.8037.01±25.9321.68±5.95*19.68±4.02*冰片低剂量组24.74±9.8439.88±25.1438.53±16.3427.24±9.0122.24±6.36
注:与溶剂对照组比较*P<0.05,**P<0.01。
2.4 冰片对小鼠脑室注射Rho-123 脑组织药物浓度的影响
由表4可知,脑室注射Rho-123后1,5,10及20 min,冰片高剂量组小鼠脑组织Rho-123浓度显著高于溶剂对照组(P<0.01或P<0.05);5,10 min,冰片中剂量组小鼠脑组织Rho-123浓度亦显著高于溶剂对照组(P<0.05);其中5,10 min,冰片高剂量的作用与维拉帕米相当。说明冰片能抑制Rho-123从脑组织外排。


组别Rho-123(ng/g)1min5min10min20min30min溶剂对照组110.17±37.6470.89±7.5963.15±17.2340.75±13.6930.44±19.72维拉帕米组139.93±9.46*100.04±6.42**95.89±9.46**64.98±10.33**39.45±15.23冰片高剂量组146.55±12.45*97.86±5.50**93.31±5.81**56.82±15.82*38.15±9.44冰片中剂量组131.87±38.3985.55±15.48*81.57±16.97*43.48±5.9437.70±5.81冰片低剂量组125.53±48.0679.09±10.9866.46±17.6054.93±21.9944.53±24.25
注:与溶剂对照组比较*P<0.05,**P<0.01。
3 讨论
冰片是一味传统中药,临床较少单独应用,常作为“佐使药”,以增加其他药物的治疗效果,即中医所谓的“独行则势弱,佐使则有功”[8]。现代药理研究表明,冰片能促进许多药物透过机体的生物屏障,如BBB、血眼屏障、胃肠屏障、皮肤屏障、鼻腔黏膜等[9-12]。研究表明,冰片能促进EB和利福平透过血眼屏障,保护缺血再灌注引起的视网膜损伤,其机制与抑制ICAM-1在视网膜内的聚集有关[10]。对其开放BBB的机制研究发现,冰片能升高BCECs内Ca2+浓度和iNOS活性,减少BCECs ICAM-1的表达,升高大鼠下丘脑组胺和5-羟色胺的含量,开放BBB内皮细胞间紧密连接,增加吞饮囊泡数量,抑制P-gp功能,但对P-gp的表达量无明显影响[7,13]。Rho-123为P-gp底物,是常用的评价P-gp抑制剂活性的探针药物[14-15]。
本实验研究结果表明,尾静脉注射Rho-123后,冰片对小鼠血浆Rho-123浓度无明显影响,但能显著升高小鼠脑组织Rho-123浓度,作用与维拉帕米相当。脑室注射Rho-123后,冰片高、中剂量组小鼠血浆Rho-123浓度显著低于溶剂对照组,脑组织Rho-123浓度显著高于溶剂对照组,其中高剂量组作用与维拉帕米相当,说明冰片能促进Rho-123透过BBB,抑制Rho-123从脑组织的外排,提示冰片能够抑制BBB P-gp功能,也为冰片“佐使有功”的理论提供了实验依据。
[1]Chen X Z, Xu H B, Xu L Zb, et al. Guggulsterone regulates the function and expression of P-glycoprotein in rat brain microvessel endothelial cells[J].European Journal of Pharmacology 2013,718(1-3):24-29.
[2]Liang Y,Zhou Y Y,Zhang J W, et al.In vitro to in vivo?evidence of the inhibitor characteristics of Schisandra lignans toward P-glycoprotein[J].Phytomedicine, 2013,20(11):1030-1038.
[3]Desrayaud S,Guntz P,Scherrmann J M,et al. Effect of the P-glycoprotein inhibitor,SDZPSC 833 on the blood and brain pharmacokinetics of colchicine[J]. Life Sci,1997,61(2):153-163.
[4]梁美蓉,叶少梅,张银卿,等. 冰片对兔、大鼠脑组织伊文氏蓝染色作用的观察[J].广州中医学院学报,1993,10(4):211-213.
[5]刘启德,梁美蓉,陈之喜,等. 冰片对庆大霉素透血脑屏障的影响[J].广州中医学院学报,1994,11(1):38-40.
[6]刘启德,赵保胜. 冰片促血脑屏障的开放与病理性开放的比较[J].中药新药与临床药理,2002,13(5):287-288.
[7]陈艳明,王宁生.冰片对BBB体外模型细胞间紧密连接和细胞吞饮囊泡的影响[J].中国中西医结合杂志,2004,24(7):632-634.
[8]孙启明. 冰片药性问题及其反思[J].中国药学杂志,1993,28(8):497-498.
[9]林咸明,陈华德,严建伟,等.穴位注射“冰片液”对血脑屏障通透性的影响[J].针刺研究,2003,28(2):99-101.
[10]赵威,王宁生,宓穗卿.冰片对大鼠缺血再灌注模型视网膜单链糖蛋白ICAM-1表达的影响[J].中药新药与临床药理,2009,20(5):430-431,441.
[11]胡利民,樊官伟,高秀梅,等.天然冰片、合成冰片对大鼠胃黏膜屏障影响的比较[J].天津中医学院学报,2005,24(3):123-125.
[12]陈新梅,朱家壁,孙卫东,等. 冰片对人参皂苷 Rgl鼻腔吸收的促进作用及鼻腔纤毛毒性研究[J]. 中国药学杂志,2006,41(4):261-264.
[13]李伟荣,姚丽梅,宓穗卿,等.冰片对大鼠下丘脑组胺、5-羟色胺含量的影响[J].中药材,2004,27(12):937-939.
[14]Fontaine M,Elmquist WF,Miller DW.Use of rhodamine 123 to examine the functional activity of P-gp in primary cultured brain microvessel endothelial cell monolayers[J].Life Science,1996,159(18):1521-1531.
[15]Troutman MD,Thakker DR. Rhodamine 123 requires carrier-mediated influx for its activity as a P-glycoprotein substrate in CaCo-2 cells[J]. Pharm Res,2003,20(8):1192-1199.
( 责任编辑:窦鹏)
Effect of Borneol on the Function of P-glycoprotein in Blood Brain Barrier
YU Hao,ZHOU Guo-liang,MAO Bin-bin
(College of Food and Drug, Anhui Science and Technology University, Fengyang 233100,China)
To observe the effect of borneol on the function of P-glycoprotein in blood brain barrier(BBB).NIH mice were randomly divided into three borneol groups(high,middle and low dose groups),verapamil group and millet oil group,and
respectively borneol, verapamil or millet oil by intragastric administration for 7 times,twice each day.Subsequently intravenous injection(IV)or cerebral ventricle injection(ICV) rhodamine 123(Rho-123) respectively,the concentrations of Rho-123 in plasma and brain tissue were measured by fluorometric detection.After IV administration with Rho-123 the plasma rhodamine 123 concentrations of three borneol groups had no significant change compared with millet oil group,at 5,10,20,30 min the cerebral Rho-123 concentrations of borneol high and middle dose groups were increased significantly compared with millet oil group.At 5,10,20,30 min after ICV administration with Rho-123 the plasma administration with Rho-123 concentrations of borneol high dose group were decreased significantly. At 20,30 min the plasma Rho-123 concentrations of borneol middle dose group were also decreased significantly compared with millet oil group.At 1,5,10,20 min the cerebral Rho-123 concentrations of borneol high dose group were increased significantly. At 5,10 min the cerebral Rho-123 concentrations of borneol middle dose group were also increased significantly compared with millet oil group.The results show that borneol could inhibit P-gp function of BBB.
Borneol;Blood brain barrier;P-glycoprotein;Rhodamine 123
2014-11-26
安徽高校省级自然科学研究重点项目(KJ2014A051);安徽科技学院—江苏华生安颐生物科技有限公司合作项目。
俞浩(1975-),男,安徽省定远县人,博士,副教授,主要从事中药药理学和保健食品学研究。
R285.5
A
1673-8772(2015)02-0034-05
