利用抑制消减杂交技术分离酱香风味的相关基因
2015-07-01朱德丽李茂琴
朱德丽,谢 和,李茂琴
(贵州大学 生命科学学院,贵州 贵阳550025)
从酱香型白酒提出至今,酱香酒的主体香成分及其产生机制一直是白酒研究的热点。最初关于酱香酒风味物质的形成与微生物关系的研究一般集中在对工艺改进或用纯种微生物强化发酵,对酱香酒的酿造微生物研究主要集中在某些影响酱香酒酒体质量的微生物分离、筛选及鉴定上[1-3]。随着现代生命科学技术的发展,分子生物技术已逐步应用于酿酒微生物的研究[3-9],通过分析微生物的DNA 序列,从基因水平上对与酱香形成相关的微生物进行定性和定量研究,能更全面、深入地了解和揭示酱香风味物质的形成机理。庄名扬等[10]自酱香型大曲中分离、筛选到地衣芽孢杆菌(B3-1)等多株芽孢杆菌,其中只有B3-1菌株能产生2,3-丁二醇,并形成酱香,将其判定为酱香功能细菌。其能通过单独发酵产生酱香风味,这可能与这类菌株在长期进化过程中形成一些特异性基因有关,如耐高温、独特香味代谢特性等。鉴于酱香形成机理较复杂,目前极少有白酒酱香相关基因的报道[11-12]。获取和鉴定相关基因,是酱香酒研究领域的难点。由于酱香酒香气成分复杂,在短期内也难以弄清酿造过程中复杂的微生物区系以及高温条件下微生物对酱香酒的具体贡献。笔者拟从单一的产酱香功能菌作为切入点,依据差异基因分离策略,应用抑制消减杂交(SSH)技术筛选与产酱香相关的基因序列,进一步运用数据库分析基因代谢产物与酱香形成的相关性,为今后深入研究白酒酱香风味形成机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 产酱香枯草芽孢杆菌(Bacillussubtilis)E20菌株,不产酱香枯草芽孢杆菌10075菌株均由贵州大学微生物学实验室提供。
1.1.2 试剂 DNA marker DL2000、DNA marker DL10000、Ex Taq DNA 聚合酶、pMD 18-T Vector、Clontech PCR-SelectTM Bacterial Genome Subtraction Kit(Cat No.637404,Clontech)等购于大连TaKaRa公司,Bacterial gDNA Miniprep Kit(阳性细菌基因组提取试剂盒)购于Biomiga 公司,4S green核酸染料、SanPrep柱式PCR 产物纯化试剂盒购于上海生工生物工程技术服务有限公司。
1.1.3 仪器 PCR 仪(MyCycler)、凝胶成像系统(Gel Doc XR+)购自美国Bio-Rad公司,稳压电泳仪(DYY-4)购自北京六一仪器厂,压力蒸汽灭菌锅(YXQ-280MD)购自嘉兴市中新医疗仪器有限公司。
1.2 枯草芽孢杆菌基因组DNA的提取
按阳性细菌基因组提取试剂盒说明书提取枯草芽孢杆菌的基因组DNA。用1%琼脂糖凝胶电泳检测DNA 质量。
1.3 抑制消减杂交
以产酱香E20菌株的基因组DNA 作为消减杂交的试验方,以不产酱香10075菌株的基因组DNA作为消减杂交的驱动方,依照Clontech 公司的PCR-Select Bacterial Genome Subtraction Kit说明书,驱动方DNA 和试验方DNA 样品分别用RsaI完全酶切后,用1%的琼脂糖电泳进行酶切效率的检测,确定完成酶切后,加入2.5μL 0.2 mol/L EDTA(pH 8.0)终止反应。用苯酚∶三氯甲烷∶异戊醇(体积比为25∶24∶1)抽提并用乙醇沉淀收集DNA。将酶切后回收的双链DNA(Tester)分成2份分别连接接头1R 及接头2R,以23SRNA 正向引物和PCR Primer1、23SRNA 正向和反向引物分别进行PCR 扩增,检测接头连接效率,若这2 种PCR 产物的条带亮度相差不超过4倍,说明接头连接成功,否则需要重复连接反应。
确保接头连接成功后,将过量的驱动方DNA分别加入连有接头1R 和2R 的试验方DNA 反应管中,98℃反应1.5min,然后63℃退火1.5h,完成第1轮杂交反应。将第1次的2个杂交试验方样品混合,加入过量新鲜的变性驱动方DNA,63℃杂交过夜,完成第2轮消减杂交。以2轮杂交完成后的杂交产物为模版,Primer1为引物进行第1次PCR 扩增,将第1次PCR 扩增产物稀释10倍后取1μL作为第2轮PCR 的模板,以1对巢式引物进行扩增,完成2次PCR。分别以浓度大致相同的已消减、未消减的2 次PCR 产物为模版,选择L516S、L523R引物扩增16~23S 间隔区作为引物进行PCR 扩增,依次在18个、23个、28个和33个循环后取出5 μL产物用2%的琼脂糖凝胶电泳检测,若消减和未消减的条带出现相差5个循环及以上,说明消减效率较高。
1.4 基因组DNA消减文库的构建及重组子的鉴定
采用上海生工PCR 产物纯化试剂盒纯化第2次PCR 产物,并取适量与pMD18-T 载体连接,将连接反应物加到100μL的感受态细胞中转化,转化产物涂于X-gal/IPTG Amp琼脂培养基上37℃过夜培养。随机挑取白色克隆,接种于含氨苄的LB液体培养基中,随机筛选32个在含氨苄的LB 液体培养基中生长的克隆,用primer1R(NP1R),primer 2R(NP2R)引物进行PCR 反应,检测插入的片段,判断阳性重组率。根据克隆插入片断大小,并筛选大于100bp片段。
1.5 差异基因的测序及序列分析
在转化平板中挑选白色克隆共77个,用含氨苄的LB培养16h 后,筛选阳性克隆委托invitrogen公司测序,得到的序列去掉两端的载体序列,从NCBI(the National Center for Biotechnology and Information,NCBI)获取枯草芽孢杆菌的完整基因组的基因注释信息,构建blast数据库,使用文库测序基因片段对菌株数据库进行同源检索,对每个序列分别进行注释。然后进行GO 富集分析(包含生物过程、细胞组成、分子功能3个部分)、相关酶分析及KEGG 代谢途径分析。最后,将文库测序基因中的酶与乙偶姻、乙酰乳酸合成酶(alsS)基因、乙酰乳酸脱羧酶(alsD)基因及其相关代谢进行网络互作分析,并将其与美拉德反应相关的反应物进行网络互作分析。
2 结果与分析
2.1 枯草芽孢杆菌基因组
由图1显示,提取枯草芽孢杆菌10075菌株及E20菌株基因组DNA 较完整,无显著降解,可用于下一步试验。

图1 枯草芽孢杆菌E20、10075基因组Fig.1 E20and 10075genome of B.subtilis
2.2 消减杂交分离差异DNA片段
2.2.1 基因组DNA 的酶切 高质量的试验方DNA 和驱动方DNA 分别用RsaI酶切,电泳后条带呈弥散状,主要为200~2 000bp。确定完成酶切后调整DNA 的浓度约为300ng/mL。

图2 基因组DNA 接头连接效率琼脂糖电泳图谱Fig.2 Agarose electrophoresis of connection efficiency of genome DNA joints
2.2.2 接头连接效率分析 由图2显示,Testeri-1/2接头序列用引物P1/23SRNA均能在有效循环数内扩展出条带,相比较用23SRNA Primer 和PCR Primer1扩展的条带较亮,相差不大,说明接头连接良好。
2.2.3 差减后产物的2轮PCR 扩增 由图3可见,第2次PCR 产物条带呈弥散带,分布比第1次PCR 产物集中,说明2菌株同源DNA 序列已被成功扣除,试验方DNA 的特异性片段得到有效富集。说明,2轮消减杂交成功。

图3 PCR 产物的琼脂糖电泳图谱Fig.3 Agarose electrophoresis of PCR products
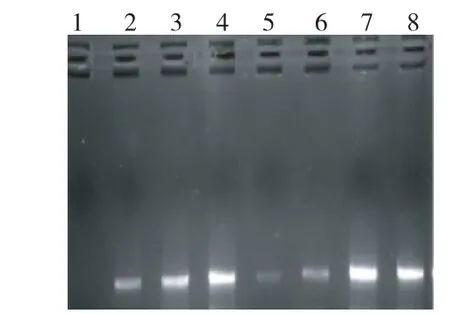
图4 L516S和L523R 引物扩增的消减效率图谱Fig.4 Amplification subtraction efficiency of L516Sand L523Rprimers
2.2.4 消减杂交效率 由图4可见,消减的在23个循环时出现条带,但未消减的在18个循环时已经出现条带,说明消减效率较高。
2.3 消减产物的克隆及序列的同源性
2次PCR 产物纯化后经pMD18-T Vector转化大肠杆菌(E.coli)功能细胞DH5α的阳性克隆,涂布在平板上生长14~16h后,蓝色不明显,将其于4℃放置24h后,蓝色明显加深。PCR 鉴定阳性克隆结果显示(图5),其中随机挑选的32个克隆中,阳性克隆为29个,阳性重组率大于90%,满足随机挑选克隆测序要求,从而成功建立产酱香的特异性基因组DNA 消减文库。

图5 插入片段阳性克隆大小的检测Fig.5 Positive clone size of the insertion fragment
2.4 差异基因文库的生物信息学分析
测序后初步获得的77个差异基因序列,其中有65条获取准确注释,平均相似度98%,E-value <1E-07。文库测序基因包括肽链释放因子2(prfB)、苯丙氨酰tRNA 合成酶的β链(pheT)、谷氨酰胺合成酶(glnA)、DNA 旋转酶A 亚单位(gyrA),组氨酸解氨酶(hutH)、HTH 型转录调控因子yybE(yybE)、表面活性素合成酶亚基1(srfAA)、表面活性素合成酶亚基2(srfAB)等。65 个基因的GO(gene ontology)富集分析显示,这些基因主要是各种核苷结合蛋白,参与细胞氨基酸代谢过程和碳水化合物运输过程。KEGG 代谢通路富集计算显示,氮代谢(Nitrogen metabolism)最显著相关。酶分析显示,在65个代谢物中有26个酶。
从以数据库为依据构建的网络图6A 可知,DNA 旋转酶A 亚单位(gyrA)和HTH 型转录调控因子yybE(yybE)通过调节乙偶姻脱氢酶操纵子转录激活因子(acoR)的活性,从而直接调节乙偶姻相关代谢;同时gyrA还可以通过与pheT相互作用,连同谷氨酰胺合成酶(glnA)一起调节乙酰乳酸合成酶(alsS)的代谢;而乙酰乳酸在乙酰乳酸脱羧酶(alsD)作用下生成乙偶姻,2个分子乙偶姻和2个分子氨反应,生成四甲基吡嗪,乙偶姻还可以通过下游代谢反应生成2,3-丁二醇。
从网络图6B 可知,文库测序的基因中的苯丙氨酰tRNA 合成酶的β链(pheT)、表面活性素合成酶亚基1(srfAA)、肽链释放因子2(gyrA)等与苯丙氨酸、谷氨酸、赖氨酸、酪氨酸等氨基酸也在代谢方面存在一定联系。此外,从网络图6B 还发现,文库测序基因与儿茶酚等酚类和一些其他小分子也存在联系。

图6 文库测序基因与其他代谢物和反应物的相关性Fig.6 Correlations between other metabolins,reactant and library sequencing gene
3 结论与讨论
1)gyrA和yybE等基因与乙偶姻、alsD、alsS及其相关代谢的相关性。2,3-丁二醇是一种白酒中普遍使用的香味添加剂,而吡嗪类化合物为酱香酒中的特征风味物质之一。与香味直接相关的物质乙偶姻,亦称3-羟基-2-丁酮(acetoin),其单体为无色或淡黄色液体,为一种天然的香味化合物,具有愉快的香气,在国际上被广泛应用,多被作为香味增强剂用在奶油、干酪、咖啡、果实的加工中。据报道芽孢杆菌能合成大量 的乙偶姻[13],Nicholson报道[14]其相关的基因信息为bdhA等。郑磊[11]对枯草芽孢杆菌E20的alsS基因进行敲除试验显示,alsS基因失活后的E20 菌株模拟酱香发酵黄豆的香味与在失活前相比变化很大,酱香风味消失,表明alsS基因及其相关代谢过程与酱香风味的形成有直接联系。表明,DNA 旋转酶A 亚单位(gyrA)和HTH型转录调控因子yybE(yybE)等文库测序基因通过调节alsS及乙偶姻的相关代谢,从而间接影响酱香风味的形成。
2)gyrA、pheT、prfB等基因与美拉德反应的相关性。法国化学家梅拉德发现,在酸性条件下,游离的氨基酸或蛋白质与还原糖之间发生反应,最终生成棕褐色的化合物。这类反应不仅影响食品的颜色,而且对食品的香味存在重要影响,并将此反应称为非酶棕化反应或美拉德反应。早在1992年,赵维娜等[15]提出细菌发酵过程中有美拉德反应发生。1997年,庄名扬[16]指出,酱香型酒的酒体成分与美拉德反应关系密切,而且美拉德反应与水分、酸碱度、温度、时间等因素有关。Kam Huey Wong等[17]研究了17种氨基酸与葡萄糖在酸性条件下的美拉德反应的产香情况,其中苯丙氨酸和酪氨酸反应可以产生干玫瑰香气,赖氨酸和缬氨酸反应产生烧焦糖香气。邵元龙[18]通过模拟发酵对枯草产酱香芽孢杆菌E20进行研究,在其发酵液中检测到苯丙氨酸、谷氨酸、酪氨酸等多种氨基酸,而在不产酱香的枯草芽孢杆菌的发酵液中几乎未检测到氨基酸。这些研究充分说明,氨基酸或蛋白质对酱香酒的呈香有重要贡献。
自用美拉德反应解释酱香酒香气的产生机制以来,褐变及产香一直被作为筛选酱香型功能细菌的关键指标。褐变反应包括非酶褐变及酶促褐变2种,非酶褐变在酱香大曲中涉及到美拉德反应,而酶促褐变反应主要涉及到酚氧化酶类,包括单酚氧化酶,如酪氨酸酶。酪氨酸酶主要的作用底物为酪氨酸。酪氨酸酶参与的褐变反应主要包括人头发及皮肤黑色素的形成、果蔬的氧化褐变等。多酚氧化酶如儿茶酚酶、漆酶等参与氧化的底物为二元酚和多元酚类化合物,如儿茶酚(邻苯二酚)、漆酚等。
酶是代谢产物的直接催化剂,文库差异基因gyrA、pheT、prfB等通过一系列复杂生化反应,催化产生大量是氨基酸和小分子,为美拉德反应提供了前提物质及反应环境,最终反应生成大量的吡嗪类、呋喃类等呈香化合物,形成一种复杂的复合香。
本试验分离出与酱香形成可能相关的基因序列,其中某些基因片断间接显示其在产香味物质前体中的潜力,如苯丙氨酰tRNA 合成酶的β链(pheT)、DNA 旋转酶A 亚单位(gyrA)和HTH 型转录调控因子yybE(yybE)等与之相关的基因可能是菌株是否产酱香或产酱香强弱的重要原因,虽然这些信息不能作为产酱香菌株的表型差异的直接证据,但构建的产酱香差异基因文库信息,为进一步研究这些基因片断在产酱香芽孢杆菌中发挥的作用提供线索,为今后深入研究酱香的形成机制奠定基础。
[1]谢 和,赵维娜.几株产酱香细菌的分离和鉴定[J].贵州农学院学报,1992(1):80-84.
[2]李贤柏.郎酒高温大曲产酱香细菌的研究[J].重庆师范学院学报:自然科学版,1997(4):20-23.
[3]张荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,1997(4):31-34.
[4]Liu X,Guo K L,Zhang H X.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCR-denaturing gradient gel electrophoresis[J].World J Microbiol Biotechnol,2012,28:2375-2381.
[5]谭映月,胡萍,谢 和.应用PCR-DGGE 技术分析酱香型白酒酒曲细菌多样性[J].酿酒科技,2012,10:107-111.
[6]颜林春.高温大曲的细菌菌群结构分析和酿酒功能菌的选育及强化大曲的研究[D].福建:福建师范大学,2012.
[7]吴 群,徐 岩.高温大曲中地衣芽胞杆菌(Bacillus licheniformis CGMCC 3963)的耐高温特征[J].微生物学报,2012,07:910-915.
[8]刘晓光.产酱香枯草杆菌质粒对菌体生理特性影响及与酱香产生关系初探[D].贵阳:贵州大学,2007.
[9]龚丽琼.基于宏基因组筛选高温大曲纤维素酶的基因及细菌菌群结构多样性分析[D].福建师范大学,2012.
[10]庄名扬,王仲文.酱香型高温大曲中功能菌B_(3-1)菌株的分离、选育及其分类学鉴定[J].酿酒,2003(05):26-27.
[11]郑 磊.CotA、alsS基因与酱香相关性研究[D].贵阳:贵州大学,2014.
[12]罗建超,谢 和.大曲中产酱香芽孢杆菌的筛选及其代谢产香探析[J].酿酒科技,2012,05:35-40.
[13]Leejeerajumnean A,Duckham S C,Owens J D,et al.Volatile compounds in Bacillus-fermented soybeans[J].J Sci Food Agric,2001(5):525-529.
[14]Nicholson W L.The Bacillus subtilis ydjL (bdhA)gene encodes acetoin reductase/2,3-butanediol dehydrogenase[J].Appl Environ Microbiol,2008(22):6832-6838.
[15]赵维娜,谢 和,秦 京,等.嗜热芽孢杆菌制曲的美拉德反应与褐变产酱香研究[J].贵州农学院学报,1992(2):83-89.
[16]庄名扬.美拉德反应与酱香酒[J].酿酒,1997(1):73-77.
[17]Kam Huey Wong,Suraini Abdl Aziz,Suhaila Mohamed.Sensory aroma from Maillard reaction of individual and combinations of amino acids with glucose in acidic conditions[J].International Journal of Food Science and Technology,2008,43:1512-1519.
[18]邵元龙,谢 和.两株枯草芽孢杆菌产酱香的研究[J].武汉大学学报,2004(S2):27-30.
