eNOS解偶联对减压病大鼠肺动脉内皮功能损伤的影响
2015-06-28林海珊欧敏方以群
林海珊,欧敏,方以群
eNOS解偶联对减压病大鼠肺动脉内皮功能损伤的影响
林海珊,欧敏,方以群
目的 探讨不安全减压对大鼠肺动脉内皮功能的影响及其相关机制。方法 60只雄性SD大鼠随机分为对照组(n=30)和减压病(DCS)组(n=30)。将DCS组大鼠置于加压舱内,暴露于600kPa压缩空气环境下60min,再以100kPa/ min减至常压,制作DCS模型。DCS组存活大鼠及对照组大鼠麻醉后剥离肺动脉,检测离体肺动脉内皮依赖的血管舒张能力,采用Western blotting检测肺动脉组织中内皮型一氧化氮合酶(eNOS)表达情况及其解离情况,以及肺动脉组织中各蛋白硝基化水平,行离体肺动脉超氧化物阴离子探针(DHE)染色检测活性氧(ROS)形成情况。结果 DCS组30只大鼠经历不安全减压后死亡10只,存活大鼠肺动脉内皮依赖的血管舒张能力明显下降(P<0.05)。DCS组及对照组eNOS表达量差异无统计学意义(P>0.05),但DCS组eNOS单体/二聚体比例明显高于对照组(P<0.05);DCS组肺动脉组织各蛋白酪氨酸硝基化水平明显高于对照组(P<0.05)。DHE染色结果显示,DCS组肺动脉中ROS生成量明显高于对照组(P<0.05)。结论 模拟潜艇逃生过程中不安全减压可导致肺动脉内皮中eNOS二聚体解偶联,解离的eNOS单体不能合成NO,从而影响血管内皮依赖舒张能力;eNOS单体可促进ONOO–合成,导致肺动脉组织中蛋白酪氨酸硝基化水平提高,引起细胞信息调控紊乱,eNOS单体还可引起活性氧离子ROS形成增加,从而介导过氧化损伤。
减压病;一氧化氮合酶Ⅲ型;超氧阴离子;3-硝基酪氨酸
目前国内外学者普遍认为,不安全减压可导致血管及组织内气泡形成,而减压性血管内气泡形成后是否导致循环障碍与血管功能状态有直接关系[1]。相关研究表明,不管气泡的直径是否大于血管管径(实际上每一个可见气泡的直径都大于微血管管径,至少必定大于毛细血管的管径),气泡的流速、流向、流态完全取决于血管的功能状态,在血流、血压的作用下都易变形通过各种管径的血管随血液进入循环。只有当血液停滞和血管痉挛闭锁、气泡无出路、血压的作用力小于血管闭合时,其内的气泡才呈静止状态[2],从而引起减压病(decompression,DCS)症状。因此,我们推测不安全减压过程中,血管舒张能力障碍可导致DCS的产生。
血管舒张分为内皮依赖性血管舒张及非内皮依赖性血管舒张。非内皮依赖性血管舒张可由乙酰胆碱、缓激肽等刺激引起,主要为生理刺激引起的血管舒张。NO是内皮依赖性血管舒张的重要因子[3],由一氧化氮合酶(NOS)合成。NOS包括eNOS、iNOS、nNOS三型。nNOS为神经型,多位于神经元细胞;iNOS为诱导型,在炎症的病理状态下可诱导生成;eNOS在血管内皮细胞中稳定表达,可合成生理需要量的NO,eNOS在二聚体形态下将左旋精氨酸转化为NO,当eNOS解离为单体时则不能正常合成NO,而生成大量超氧阴离子O2,O2与NO反应生成大量ONOO–[4],对重要蛋白进行氮化修饰,改变信号途径,直接和(或)间接介导了NO的细胞毒性效应。DCS中血管损伤是否与eNOS解偶联相关目前尚未见报道,本文对此进行了初步研究。
1 材料与方法
1.1 实验动物、材料及设备 雄性二级SD大鼠60只,体重210±25g,购自海军医学研究所动物中心,实验动物合格证:SCXK(沪)2008-0016。抗硝基酪氨酸抗体(anti-3-nitrotyrosine antibody,ab110282)购自英国Abcam公司。eNOS抗体购自德国BD Bioscience公司。超氧阴离子探针DHE(Dihydroethidium)及不含2-巯基乙醇的上样缓冲液购自美国Sigma公司。Krebs-Henseleit(K-H)溶液(mmol/L):NaCl 119,NaHCO325,MgCl21.19, KCl 4.7,KH2PO41.2,CaCl22.5,D-Glucose 11.1。高钾K-H溶液(含60mmol/L KCl):NaCl 63.7,NaHCO325,MgCl2·6H2O 1,KCl 60,KH2PO41.2,CaCl22.5,D-Glucose 11.1。高钾无钙液:用EGTA(0.05)代替高钾溶液中的CaCl2,其余成分与高钾溶液相同。RIPA裂解缓冲液:100ml RIPA Buffer,50mmol/L Tris-HCl(pH 7.4),150mmol/L NaCl,1%NP-40,0.1%SDS。储存:4℃,2µg/ml Aprotinin(蛋白酶抑制剂,于使用前加入)。实验设备:0.3m3加压舱(山东宏远公司),610M型多通道血管张力检测仪(DMT公司,丹麦),Power Lab 8/30生物信号采集处理系统(AD公司,澳大利亚);DK-8D型电热恒温水槽(上海医用恒温设备厂)。Stemi DV4型体视显微镜(ZEISS公司,德国)。
1.2 方法
1.2.1 实验分组及模型制作 60只雄性SD大鼠随机均分为2组。对照组:将30只大鼠置于0.3m3的加压舱(用于小型动物复现DCS模型),不予加压处理,停留65min,持续通入空气,维持二氧化碳(CO2)水平低于300mg/L,舱内湿度维持在40%~60%,温度维持在27~30℃,大鼠在舱内可自由活动,研究者可通过闭路电视观察大鼠舱内行为。DCS组:将30只大鼠置于与对照组相同的加压舱内,并设置相同的温度、湿度。以100kPa/min的速度将舱内空气加压至600kPa(相当于60米海深所处的压力)维持60min,并持续通入空气,维持CO2水平低于300mg/L,并以相同速度减压至常压。
1.2.2 标本收集 两组动物出舱后观察动物行为变化及死亡发生率。1h后存活大鼠用1%戊巴比妥钠50mg/kg腹腔注射麻醉,大鼠仰卧位固定于操作台,开胸取心肺组织,冰浴条件下剥离肺动脉组织,每组各留8段肺动脉组织置于K-H液中,立即行离体血管张力检测及DHE染色,其余组织冻存于–80℃中以备Western blotting检测。
1.2.3 动脉血管内皮依赖性舒张功能的检测 血管标本取出后,迅速置于通入含混合气体(95%O2+5%CO2)的K-H营养液(pH 7.4,4℃)中,制备血管环(3~4mm),悬挂于内置10ml营养液并含消炎痛(10–5mol/L,抑制内源性前列环素系统)的生理浴槽中,恒速通入混合气体,恒温37.0±0.5℃,静息负荷为4g,通过张力换能器将采集信号传入计算机系统中,记录血管环的张力变化。首先用含60mmol/L KCl的高钾溶液刺激血管,检测血管张力的反应性。把浴槽内的K-H液换成含高钾的K-H液。高钾使冠状动脉环产生收缩反应,维持5min待张力稳定后,以5min末的激活张力(单位为mN/mm)作为100%,充分冲洗至基线。先用去甲肾上腺素预收缩血管环,待张力稳定后加入乙酰胆碱(Ach),记录血管张力的变化,测定其对Ach (10–9~10–4mol/L)的内皮依赖性舒张反应。为检测本实验中Ach所诱导的舒张反应是否为内皮源性NO所介导,部分血管环拭去内皮或预先以NOS抑制剂L-NAME(3×10–4mol/L)预处理15min后再行检测。
1.2.4 肺动脉3-硝基酪氨酸、eNOS单体及二聚体的检测 采用Western blotting法检测肺动脉组织中3-硝基酪氨酸(3-nitrotyrosine)水平。每只大鼠取等量肺动脉组织,每10mg加0.1ml RIPA,匀浆机电动匀浆。注意保持低温(埋在冰中),快速匀浆。将样品转移到1.5ml离心管中,4℃下12 000g离心2~3min。取上清液加上样缓冲液后,加热至98℃,5min。进行SDS-聚丙烯酰胺凝胶电泳,转移至PVDF膜上(Bio-Rad公司产品),加入含一抗(兔抗鼠1:1000稀释)的反应液,然后加入羊抗兔IgG二抗(1:4000稀释)。eNOS单体及二聚体检测,组织样本处理过程中加入不含巯基乙醇的上样缓冲液,且两者混合后无需加热,于4℃下行SDS-聚丙烯胺凝胶电泳,转膜后加入含一抗(兔抗鼠,稀释比例为1:500)的反应液孵育过夜,后续步骤同前。结果采用国产HP IAS21000型图像分析仪测定平均光密度值。
1.2.5 肺动脉ROS测定 每组各取6只存活大鼠,分别于处死前30min尾静脉注射DHE(100µmol/L,0.1ml/10g)荧光染料,30min后麻醉取肺动脉组织,冰冻切片包埋剂(OCT)包埋,–20℃冷冻,用冰冻切片机10µm切片,PBS洗3次,抗荧光淬灭剂封固,荧光显微镜观察大鼠肺动脉组织的ROS含量(红色荧光)。采用Image-Pro Plus 6.0图像分析软件对荧光强度进行定量分析,结果以相对荧光强度单位表示。
1.3 统计学处理 采用SPSS 13.0软件进行统计分析。计量资料±s表示,两组间样本均数比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 内皮依赖的血管舒张功能 在10–5mol/L去甲肾上腺素预收缩的血管环上,DCS组ACh诱导的血管最大舒张反应百分比(12.5%±3.2%)明显低于对照组(48.6%±4.3%,P<0.05),提示DCS模型大鼠血管内皮依赖舒张功能明显受损。经去内皮或3×10–4mol/L L-NAME预处理后,血管环对ACh不再产生明显的舒张效应,提示这种舒张效应为内皮源性NO所介导(图1)。
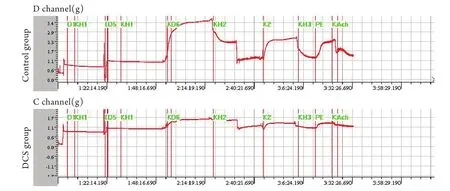
图1 大鼠肺动脉内皮依赖血管舒张能力变化Fig.1 Changes of the endothelium dependent vasodilatation function in rats
2.2 3-硝基酪氨酸在肺动脉组织中的表达 DCS组肺动脉组织3-硝基酪氨酸相对表达水平(256±7)明显高于对照组(178±7),差异有统计学意义(P<0.05,图2)。
2.3 eNOS单体及二聚体的检测 对照组与DCS组中eNOS总量比较未见明显差异(P>0.05),表明eNOS在血管内皮细胞中恒定表达。eNOS单体/二聚体比值在DCS组中明显升高,与对照组相比差异有统计学意义(P<0.05,图3)。
2.4 肺动脉ROS检测结果 DHE染色结果显示,对照组肺动脉组织中ROS生成量较少,荧光强度较弱。而经历不安全减压后,DCS组大鼠肺动脉组织中ROS生成量明显增加,肺动脉红色荧光强度明显增强。图像分析结果显示,与对照组比较,DCS组大鼠肺动脉组织中ROS生成量明显增加(P<0.05,图4)。
图2 大鼠肺动脉组织3-硝基酪氨酸表达(±s,n=8)Fig.2 Expression level of 3-nitrotyrosine in pulmonary artery tissue of rats (±s, n=8)
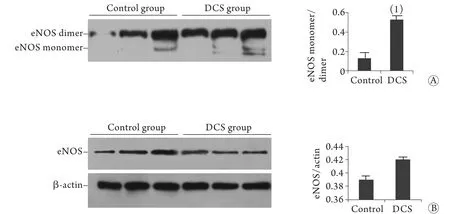
图3 大鼠肺动脉组织eNOS表达量以及其单体和二聚体表达量(±s, n=8)Fig.3 Expression of eNOS and its monomer/dimer in pulmonary artery tissue of rats (±s, n=8)
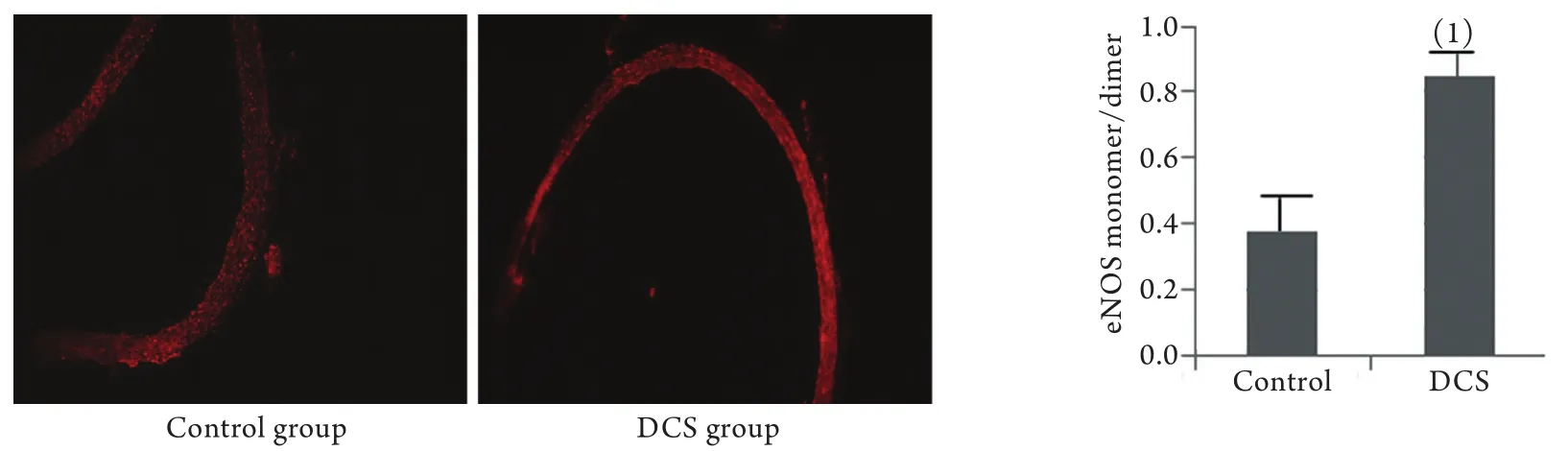
图4 大鼠肺动脉组织中ROS的生成量(DHE染色)Fig.4 Comparison of the generated amount of ROS in pulmonary artery tissue of rats (DHE staining)
3 讨 论
DCS 是由于环境压力骤降,导致血管内外气泡形成引起的,可发生于潜水员、宇航员等[5]。气泡随血液进入肺循环时,一部分气体通过肺毛细血管床时可逸出,未被排除的气泡则随血液到达左心,并随动脉血液分散到包括心、肺等脏器在内的全身各部位血管中。循环系统内气体的致病性,一方面是由于气体(气泡)栓塞血管[6],另一方面是由于进入循环系统的大量气体极大地改变了心腔、肺血管床成分,使心脏由血泵变为气泵,导致心肌缺血、缺氧,心肌收缩无力或发生心力衰竭,从而使呼吸、循环中枢继发缺血、缺氧[2]。不充分减压亦可导致机体血管功能障碍,继而使血液和其内气泡流速、流向、流态紊乱,甚至阻断血液、气泡流通,血液停滞,其内气泡呈静止状态。而改善血管功能可促进气泡排除,一定程度减轻DCS 的发病率及死亡发生率。
国内外对潜艇逃生、潜水等减压过程中产生的气泡损伤进行了大量的研究。Nossum等[7]经家兔颈静脉内注入空气0.01ml/(min·kg),1h后发现实验组家兔内皮依赖的血管舒张能力下降,非内皮细胞依赖的血管舒张能力不变,且光镜下血管内皮层并未出现异常,从而证实气泡可导致内皮层生化水平的紊乱,使内皮依赖的血管舒张能力下降。该研究从侧面验证了本实验结果的正确性。另外,王岩等[8]的研究中提到在潜水前5d或潜水前30min用硝酸酯类作为外源NO供体可明显减少大鼠和猪体内的气泡,降低DCS的发生率和患者死亡率,而给予非选择性NOS抑制剂(L-NAME)则可增加DCS的发生率和死亡率。NO可介导血管内皮依赖性血管舒张功能,因此我们推测DCS中的血管功能损伤与NO合成障碍有关。介导内皮依赖性血管舒张功能的NO主要由血管内皮中的eNOS合成[9-10]。eNOS为两个单体组成的二聚体蛋白,其在二聚体状态下可发生下列化学反应:L-精氨酸+O2eNOS二聚体→L-胱氨酸+NO。若eNOS解离为单体,则介导的反应变为:L-精氨酸+O2eNOS单体→ONOO–+H2O2+O2[11]。ONOO–可使酪氨酸硝基化,改变信号通路,引起一系列细胞毒性反应。
综上,本研究结果显示,DCS模型中肺动脉内皮依赖的血管舒张功能较对照组明显降低,DCS模型大鼠肺动脉组织中存在eNOS解偶联情况,且组织中蛋白酪氨酸硝基化水平及ROS生成明显高于对照组,说明DCS中存在肺动脉内皮eNOS解偶联情况,导致NO合成减少,内皮依赖的血管舒张功能降低,从而使血管闭塞加重,气泡通过受阻,肺内滤出气泡减少,最后使DCS损伤加重。eNOS解偶联后产生的ONOO–使蛋白酪氨酸硝基化并合成超氧离子,介导一系列过氧化损伤。eNOS解偶联可能为DCS气泡损伤中的一个靶点,但不是DCS中损伤的唯一靶点,干预该过程能否改善DCS整体发病率及死亡率还需进一步研究。
[1]Pontier JM, Vallée N, Ignatescu M, et al. Pharmacological intervention against bubble-induced platelet aggregation in a rat model of decompression sickness[J]. Appl Physiol, 2011, 110(3): 724-729.
[2]Yuan JF, Pan LS, Wang Q, et al. Relationship between the state of intravascular bubbles and microcirculation system[J]. Space Med Med Eng, 1996, 4(9): 276-280. [袁锦富, 潘令松, 王铨,等. 减压性血管内气泡状态与微循环状态的关系[J]. 航天医学与医学工程, 1996, 4(9): 276-280.]
[3]Djurhuus R, Nossum V, Lundsett N, et al. Simulated diving after heat stress potentiates the induction of heat shock protein 70 and elevates glutathione in human endothelial cells[J]. Cell Stress Chaperones, 2010, 15(4): 405-414.
[4]Yang YM, Huang A, Kaley G, et al. eNOS uncoupling and endothelial dysfunction in aged vessels[J]. Am J Physiol Heart Circ Physiol, 2009, 297(5): H1829-H1836.
[5]Vann RD, Butler FK, Mitchell SJ, et al. Decompression illness[J]. Lancet, 2010, 377(9760): 153-164.
[6]Zhou S, Pan SY, Zhang Y, et al. The diving chamber pressurized with hyperbaric oxygen therapy in the treatment of cerebral embolism in 6 cases[J]. Med J Chin PLA, 2011, 36(12): 1362-1363. [周山, 潘树义, 张禹, 等. 潜水加压舱加压结合高压氧治疗脑气栓症6例[J]. 解放军医学杂志, 2011, 36(12): 1362-1363.]
[7]Nossum V, Hjeled A, Brubakk AO. Small amounts of venous gas embolism cause delayed impairment of endothelial function and increase polymorphonuclear neutrophil infiltration[J]. Eur J Appl Physiol, 2002, 86(3): 209-214.
[8]Wang Y, Chen DG, Li XW, et al. Progress in research on the role of nitric oxide donor to prevent decompression sickness[J]. J Navy Med, 2012, 33(5): 359-360. [王岩, 陈大贵, 李学文, 等.一氧化氮供体对减压病预防作用研究的进展[J]. 海军医学杂志, 2012, 33(5): 359-360.]
[9]Niu Q, Wang AL, Wang W, et al. The protective effect of glutamine pretreatment on intestinal ischemia-reperfusion injury and eNOS/NO levels in rats[J]. 2015, 43(3): 252-255. [牛琼,王爱丽, 王伟, 等. 谷氨酰胺预处理对大鼠肠缺血再灌注损伤的保护作用及其对eNOS-NO通路的影响[J]. 天津医药, 2015, 43(3): 252-255.]
[10]Wu Q, Ma KH, Zhang XG, et al. Protective effects of Rho kinase inhibitor on rats' vascular endothelium and its effects on the expression of eNOS[J]. Med J Chin PLA, 2012, 37(11): 1044-1049. [吴巧, 马康华, 张晓刚, 等. Rho激酶抑制剂对大鼠血管内皮的保护作用及eNOS表达的影响[J]. 解放军医学杂志, 2012, 37(11): 1044-1049.]
[11]Alderton WK, Cooper CE, Knowles RG. Nitric oxide synthases: structure, function and inhibition[J]. Biochem J, 2001, 357(Pt 3): 593-615.
Effects of eNOS uncoupling on the endothelial dysfunction of pulmonary artery in rats with decompression sickness
LIN Hai-shan1, OU Min2*, FANG Yi-qun31Third Clinical Medical School of Southern Medical University, Guangzhou 510515, China
2Department of VIP Respiratory, Navy General Hospital of PLA, Beijing 100048, China
3Navy Medical Research Unit, Shanghai 200433, China
*
, E-mail: oumin1999@aliyun.com
This work was supported by the Army Research Subject of Traditional Chinese Medicine (10ZYZ219)
ObjectiveTo explore the effects of unsafe decompression on the endothelial function of pulmonary artery in rat and its possible related mechanism.MethodsSixty male SD rats (260±35g) were randomly divided into two groups (30 each): control group and decompression (DCS) group. Decompression sickness (DCS) model was reproduced by placing the rats in a compression chamber with air pressure of 600kPa for 60min, followed by decompression at a rate of 100kPa/min to normal pressure. The surviving rats in both control and DCS groups were sacrificed and their pulmonary artery was harvested. The endothelium dependent vasodilatation capacity of isolated pulmonary artery was assessed. The expression and uncoupling of endothelial nitric oxide synthetase (eNOS), as well as the nitration level of each kind of protein in the pulmonary artery tissue, were analyzed by Western blotting. The concentration of reactive oxygen species (ROS) in the pulmonary artery was determined with superoxide anion probe dihematoporphyrin ether (DHE) staining.ResultsTen of 30 rats in DC group died of unsafe decompression, and the endothelium dependent vasodilatation capacity of excised pulmonary artery in survived rats was found to decline obviously (P<0.05). No significant difference was found in the expression level of eNOS between the two groups (P>0.05), but the ratio of eNOS monomer/dimer increased significantly in DC group than in control group (P<0.05). The tyrosine nitration level of each kind of protein in the pulmonary artery tissues was higher significantly in DC group than that in control group (P<0.05). DHE showed that the generated amount of DCS in pulmonary artery tissues was obviously higher in DC group than in control group (P<0.05).ConclusionsUnsafe decompression may lead to uncoupling of eNOS dimersin the endothelium of pulmonary artery. Uncoupled eNOS monomers may inhibit the synthesis of NO, thereby affect the endothelium dependent vasodilatation function. On the other hand, the eNOS monomers may facilitate the anabolism of ONOO-, leading to an increase in tyrosine nitration level of each kind of protein in the pulmonary artery tissues, thereby cause the regulation disorder of cell information system. The eNOS monomers may also increase the production of ROC, there by mediate the peroxide injuries.
decompression disease; nitric oxide synthase type Ⅲ; superoxide anion free radical O2; 3-nitrotyrosine
R845.21
A
0577-7402(2015)06-0502-05
10.11855/j.issn.0577-7402.2015.06.17
2014-11-24;
2015-04-10)
(责任编辑:张小利)
军队中医药科研专项课题(10ZYZ219)
林海珊,硕士研究生。主要从事减压病防治方面的研究
510515 广州 南方医科大学第三临床医学院(林海珊);100048 北京 海军总医院干部呼吸内科(欧敏);200433 上海 海军医学研究所(方以群)
欧敏,E-mail:oumin1999@aliyun.com
