混合胺液用于脱除天然气中CO2的性能研究
2015-06-28唐建峰花亦怀徐明海王传磊韩雅萍史泽林
陈 杰,唐建峰,花亦怀,徐明海,王传磊,韩雅萍,冯 颉,史泽林
(1.中海石油气电集团 技术研发中心,北京 100027; 2.中国石油大学 储运与建筑工程学院,山东 青岛 266580;3.海洋石油工程股份有限公司, 天津 300461)
混合胺液用于脱除天然气中CO2的性能研究
陈 杰1,唐建峰2,花亦怀1,徐明海2,王传磊3,韩雅萍2,冯 颉1,史泽林2
(1.中海石油气电集团 技术研发中心,北京 100027; 2.中国石油大学 储运与建筑工程学院,山东 青岛 266580;3.海洋石油工程股份有限公司, 天津 300461)
为了选择脱碳性能优越的三乙醇胺(TEA)混合胺液吸收剂,采用吸收速率、酸气负荷、解吸率等作为评价指标,首先在纯CO2条件下,分别对一定浓度的TEA和一乙醇胺(MEA)、TEA和二乙醇胺(DEA)、TEA和二乙烯三胺(DETA)、TEA和三乙烯四胺(TETA)、TEA和哌嗪(PZ) 混合得到的5种混合胺液进行实验对比分析,综合考察其吸收和解吸性能指标的变化规律,初步筛选出TEA+MEA、TEA+DETA、TEA+PZ 3种性能较优的混合胺液。然后在混合气条件下,对这3种混合胺液的吸收和解吸性能进行进一步实验对比。结果发现,当原料气中CO2浓度较低时,可优先选择TEA+PZ混合胺液;解吸条件相同时,TEA+MEA混合胺液的解吸性能较好。可为实际天然气脱碳工业应用提供依据和参考。
混合胺液;吸收剂;吸收;解吸;天然气脱碳
天然气作为一种清洁优质能源,在我国改善能源结构、大力推动低碳经济发展的过程中,获得了前所未有的飞速发展[1]。随着全球天然气勘探开发的逐渐深入,天然气脱碳技术逐渐成熟。醇胺法脱碳具有吸收负荷高、吸收效果好、吸收剂可循环利用、使用成本低等特点,被广泛应用于天然气脱碳领域[2]。而混合胺液吸收能力强、反应速率快、适用范围广、再生能耗低、气体损失小、净化程度高、溶液腐蚀小[3-5],可以弥补单一胺液的不足,提高胺液的综合性能,达到改善脱碳效果的目的。
目前,国内外研究较多的是以甲基二乙醇胺(MDEA)为主的混合胺液。三乙醇胺(TEA)与MDEA同为叔胺,性能相似,但采用TEA作为天然气脱碳胺液的研究较少[6]。TEA具有吸收容量大、价格低廉等特点,但其对CO2的吸收速率较慢,如果在TEA中加入适当的其他种类胺液,则能够有效地提高其吸收速率。笔者以TEA作为天然气脱碳胺液的主组分,分别加入一乙醇胺(MEA)、二乙醇胺(DEA)、二乙烯三胺(DETA)、三乙烯四胺(TETA)、哌嗪(PZ), 组成不同混合胺液,实验研究它们对CO2的吸收与解吸性能,并从多方面、多角度分析实验结果,得出其综合脱碳性能,旨在为胺液脱碳性能的研究探索适宜的实验方法,为选择天然气脱碳性能优越的混合胺液提供理论依据。
1 胺液脱碳的基本原理
醇胺类化合物的分子结构中至少包含有1个羟基和1个胺基,羟基的作用是降低化合物的蒸气压并增加其水溶性,胺基则为水溶液提供必要的碱度,促进对酸性气体组分的吸收[7]。根据连接在胺基的氮原子上的“活泼”氢原子数,醇胺可分为伯胺、仲胺和叔胺3类。伯胺与仲胺可直接与CO2反应生成稳定的氨基甲酸盐,如式(1)、(2)所示。
(1)
(2)
叔胺的氮原子上没有活泼氢,因而不能像伯胺、仲胺一样直接与CO2反应生成氨基甲酸盐,而是靠游离胺与水之间的氢键增强反应的活性,生成碳酸氢盐,如式(3)所示。
(3)
TEA与目前工业中应用较多的MDEA同为叔胺,用作单一胺液吸收CO2时,具有吸收负荷高等优点,但由于其不能与CO2直接生成碳酸氢盐导致吸收速率较慢,这种缺陷在CO2处理量较大的情况时表现尤为明显。弥补此缺陷的主要途径是在TEA中加入一定量的单一伯胺或仲胺,使CO2先与伯胺或仲胺快速反应生成氨基甲酸盐,生成的氨基甲酸盐则催化TEA生成两性离子中间化合物,从而加快了对CO2的吸收。混合胺液之间发生的这种过程称为交互作用,如式(4)所示。
(4)
2 实验部分
2.1 试剂
MEA,分析纯,天津天泰精细化学品有限公司产品;DEA,分析纯,天津市科密欧化学试剂开发公司产品;TEA,分析纯,西陇化工有限公司产品;DETA、TETA、PZ,分析纯,成都格雷西亚化学技术有限公司产品;CaCl2,分析纯,国药集团化学试剂有限公司产品;CuSO4,分析纯,上海振欣试剂厂产品;H2SO4,分析纯,广东省精细化学品工程技术研究开发中心产品;CH4、CO2,纯度99.999%,以及分别含4.07%和6.44%(体积分数)CO2的CH4+CO2混合气,均由青岛天源特种气体厂提供。
2.2 实验装置及方法
2.2.1 CO2吸收实验
胺液吸收CO2的实验装置及流程如图1所示。带有磁耦合搅拌的反应釜是关键设备,容积300 mL,设计压力10 MPa,磁力搅拌速率范围150~1200 r/min;反应釜筒体设液体循环夹套,最外层使用保温材料包裹,确保控温效果。恒温水浴的温度控制范围为室温以上5~100℃,控制精度为±0.1℃。
首先,预热恒温水浴至设定温度,配制实验所需的胺液样本,并利用真空泵将胺液充入釜内;然后,持续将釜内抽真空,使得釜内CO2的含量尽可能减少,再将高压气瓶中原料气经减压阀调压后通入高压反应釜;最后,开启数据采集系统及磁力搅拌系统,以一定速率搅拌,进行CO2吸收实验。实验过程中定时观察反应釜内温度、压力变化数据,待釜内压力趋于稳定后,关闭数据采集系统及恒温水浴,吸收实验结束。
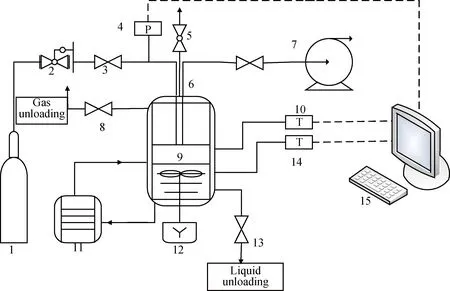
图1 CO2吸收实验装置流程图
2.2.2 CO2解吸实验
采用解吸实验装置,将已吸收CO2的胺液置于三口烧瓶内进行CO2解吸。解吸出的酸气通过皂膜流量计记录瞬时流量,通过湿式气体流量计记录累计流量[8]。每隔1 min记录1次胺液气相和液相温度、皂膜流量计读数、湿式气体流量计读数及压差,待湿式气体流量计读数连续5次不变时,停止实验。
2.2.3 胺液中CO2含量的测定
采用酸解法测定CO2吸收与解吸实验所得胺液样品中CO2含量。用H2SO4将CO2从胺液中置换出来,通过测定放出的CO2气体体积计算胺液对CO2的吸收量。CO2吸收实验后的胺液样品中CO2含量较高,称为富液,用图2所示的仪器进行测定; CO2解吸实验后的胺液样品中CO2含量很低,称为贫液,采用图3所示的仪器进行测定。
量取一定量的胺液样品注入三口烧瓶中,并将适量稀硫酸注入滴液漏斗中,封闭整个系统并检查系统气密性;将量筒放至液面与广口瓶或锥形瓶相平的位置,记录初始液位刻度和环境温度;注入一定量稀硫酸后关闭,待量筒内液面稳定后再注入一定量稀硫酸,直至量筒1min内液位不再变化;调节量筒中的液位至稍低于广口瓶中油层上表面,记录此时液位刻度,并计算实验前后刻度差。
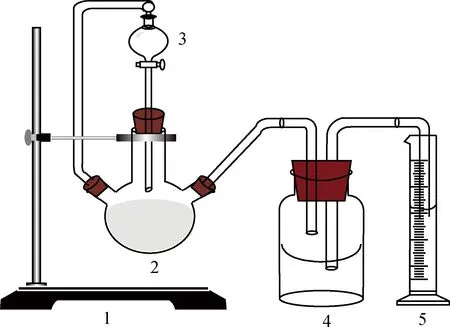
图2 富液CO2含量测定装置
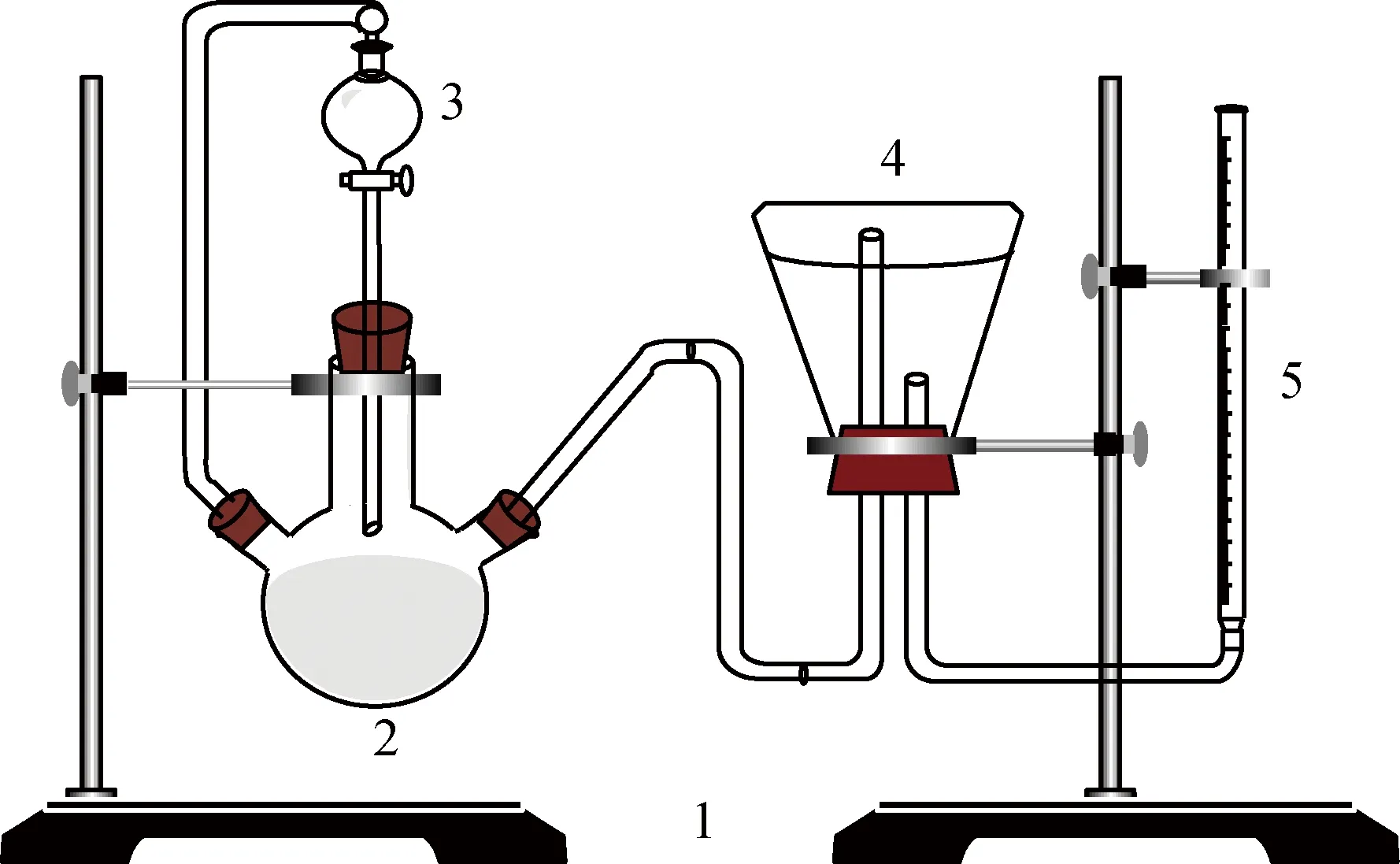
图3 贫液CO2含量测定装置
2.3 评价指标
对胺液吸收CO2性能的评价指标包括吸收速率、吸收负荷、酸气负荷,对胺液解吸CO2性能的评价指标包括解吸率、残余酸气负荷。
(1) 吸收速率vab
吸收速率指单位时间内单位体积胺液吸收CO2的量,如式(5)所示。吸收速率越高,吸收性能越好。
(5)
式(5)中,vab为胺液对CO2的吸收速率,mol/(L·min);V为胺液体积,L;Δτ为吸收时间,min;Δn为Δτ时间内CO2物质的量的变化量,mol。
(2) 吸收负荷L
吸收负荷指单位体积胺液吸收CO2的量,代表胺液对CO2的吸收能力,如式(6)所示。
(6)
式(6)中,L为胺液吸收负荷,mol/L。
(3) 酸气负荷α
酸气负荷指胺液中单位物质的量的醇胺所含CO2物质的量,如式(7)所示。
(7)
式(7)中,α为胺液酸气负荷,mol/mol;a为胺液中醇胺浓度,mol/L。
(4) 解吸率rde
解吸率指一定时间内胺液解吸出的CO2量与胺液解吸前所含CO2总量的比值。解吸率能够表示出胺液的再生能力。
(5) 残余酸气负荷αre
残余酸气负荷指胺液进行解吸实验后单位物质的量的醇胺中残余的CO2物质的量,其单位为mol/mol,可以表示胺液的再生效果。
3 结果与讨论
3.1 纯酸气条件下5种TEA混合胺液CO2吸收解吸性能对比
3.1.1 CO2吸收性能
在50℃、纯酸气初始压力0.22 MPa的条件下,采用TEA+MEA、TEA+DETA、TEA+TETA、TEA+PZ、TEA+DEA 5种混合胺液进行CO2吸收实验,测定其吸收速率(vab)、吸收负荷(L)和酸气负荷(α),结果示于图4、图5。各混合胺液中,TEA的浓度均为2 mol/L,另一胺的浓度均为1 mol/L.
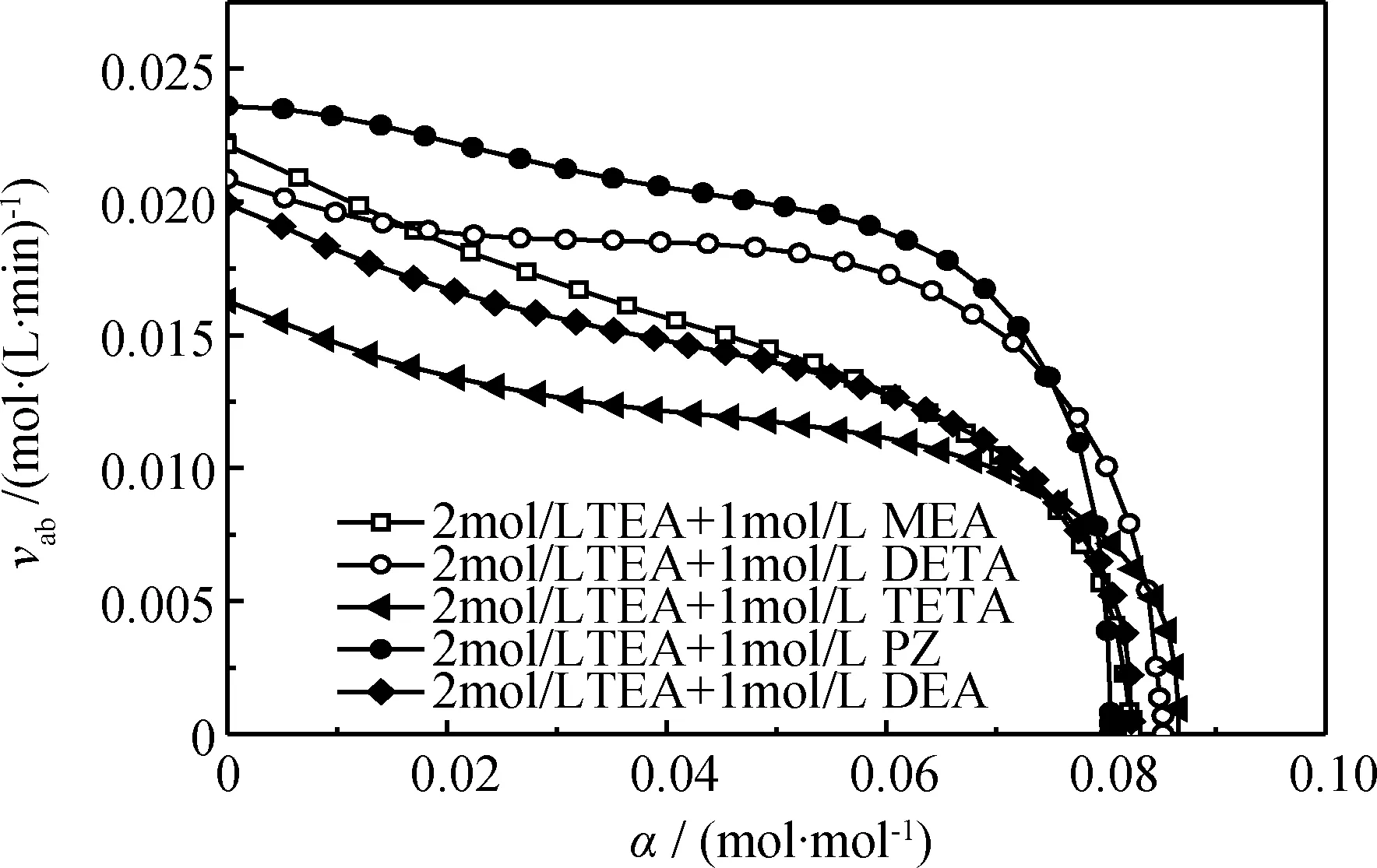
图5 纯酸气中5种混合胺液CO2吸收速率(vab)随酸气负荷(α)的变化
由图4可以看出,5种混合胺液的吸收负荷随时间的变化趋势大致相同,均在0~10 min内随时间变化呈线性关系增加,10 min后各曲线变化趋势逐渐变缓并于15~25 min内先后达到平衡。其中,TEA+PZ的吸收负荷最先达到平衡,TEA+TETA的吸收负荷达到平衡所需时间最长,TEA+MEA与TEA+DEA具有相近的吸收负荷达到平衡时间;TEA+TETA具有最高的最终吸收负荷,TEA+DETA次之,TEA+PZ、TEA+MEA、TEA+DEA三者具有相近的最终吸收负荷;在吸收达到平衡前,同一时刻各混合胺液按吸收负荷从大到小排列的顺序为TEA+PZ、TEA+DETA、 TEA+MEA、TEA+DEA、 TEA+TETA。
由图5可以看出,各混合胺液的吸收速率均随酸气负荷的增加而下降,且当酸气负荷在0~0.07 mol/mol范围内缓慢下降,当酸气负荷超过0.07 mol/mol时迅速下降,并均于酸气负荷0.085 mol/mol左右处降为0。在混合胺液吸收速率迅速下降前,TEA+PZ的吸收速率明显高于其它混合胺液,TEA+TETA、TEA+DEA的吸收速率较低;TEA+DETA的吸收速率在初始阶段低于TEA+MEA,当酸气负荷超过0.02 mol/mol时迅速升高并接近于TEA+PZ的吸收速率,TEA+DETA的吸收速率下降最慢。
综合图4、图5可以看出,TEA+PZ具有最短的吸收负荷达到平衡时间,且吸收速率较高;TEA+TETA具有最高的最终吸收负荷,但其吸收负荷达到平衡所需时间最长,且吸收速率最低;TEA+MEA和TEA+DEA具有相近的吸收负荷变化规律及吸收速率变化规律,两者的吸收完成时间及最终吸收负荷也基本相同,TEA+MEA具有稍高的初始吸收速率;TEA+DETA具有与TEA+PZ相近的吸收负荷达到平衡时间、与TEA+TETA相近的最终吸收负荷,其吸收速率稍高于TEA+TETA,且变化最为缓慢,吸收性能最稳定。因此,TEA+PZ、TEA+MEA、TEA+DETA具有相对较好的CO2吸收性能。
3.1.2 CO2解吸性能
TEA+MEA、TEA+DETA、TEA+TETA、TEA+PZ、TEA+DEA 5种不同混合胺液富液与贫液的酸气负荷及CO2解吸率列于表1,5种混合胺液CO2解吸率随时间和温度的变化示于图6、图7。
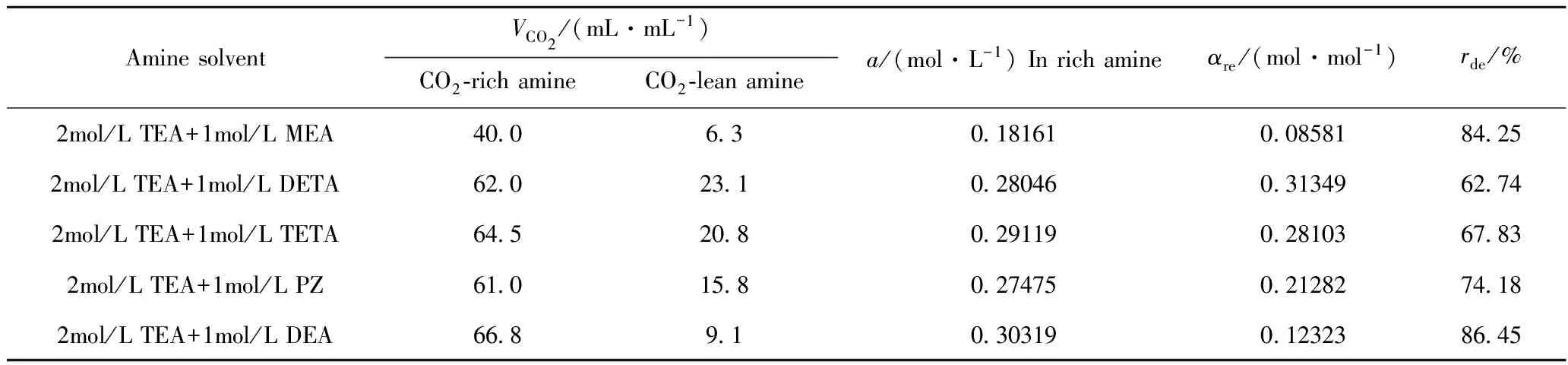
表1 5种混合胺液CO2解吸数据

图6 5种混合胺液CO2解吸率(rde)随时间的变化
由表1可以看出,TEA+DETA、TEA+TETA、TEA+DEA三者具有相近的富液酸气负荷,但TEA+DEA具有最少的贫液残余负荷;TEA+MEA的富液酸气负荷明显低于其它4种混合胺液,其贫液残余负荷也最少; 按CO2解吸率由大到小排列的混合胺液顺序为TEA+DEA、TEA+MEA、 TEA+PZ、TEA+TETA、TEA+DETA。
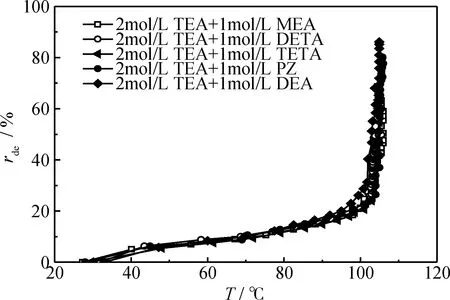
图7 5种混合胺液CO2解吸率(rde)随温度的变化
由图6可以看出,各混合胺液的解吸率均随时间的增加而增加,且在0~10 min内各胺液的解吸率变化曲线近乎重合。10 min后,TEA+DEA和TEA+PZ的解吸率变化曲线较为接近,且略高于其它3种混合胺液的曲线;TEA+MEA与TEA+TETA的解吸率变化曲线非常接近,且均高于TEA+DETA;TEA+DETA的解吸时间最短。由图7可以看出,各混合胺液的解吸率随温度的变化曲线基本一致,均在初始温度~100℃内缓慢上升,当温度高于100℃时急剧上升并很快达到峰值。其中TEA+DEA的解吸率峰值略高于其它几种混合胺液。
综合表1、图6、图7可以得出,TEA+DEA具有最高的富液吸收负荷与最高的最终解吸率;TEA+MEA的最终解吸率仅次于TEA+DEA,但其富液吸收负荷最少;TEA+DETA的最终解吸率最低,但其解吸完成时间最短;同一解吸时刻,TEA+DEA与TEA+PZ均具有较高的解吸率,但TEA+PZ的最终解吸率不高。因此,TEA+DEA、TEA+MEA具有较好的CO2解吸性能。
3.1.3 5种TEA混合胺液的综合脱碳性能
TEA+PZ、TEA+DETA、TEA+MEA具有较好的CO2吸收性能,且TEA+MEA具有较好的CO2解吸性能;TEA+PZ的CO2解吸性能不是很理想,但其吸收性能最好;TEA+DETA的解吸率最低,但其解吸时间最短,且吸收性能最稳定;TEA+DEA具有最好的CO2解吸性能,但其吸收性能较差。因此,综合分析认为,对CO2吸收和解吸性能较好的TEA混合溶液为TEA+DETA、TEA+MEA和TEA+PZ。
3.2 混合气条件下优选TEA混合胺液的脱碳性能
由3.1节内容得出,在纯CO2条件下,混合胺液TEA+DETA、TEA+MEA、TEA+PZ的综合脱碳性能较好。考虑到实际天然气工业中原料气通常为混合气,因此,在混合气条件下对这3种混合溶液进行CO2吸收和解吸实验,进一步比较它们的脱碳性能。
3.2.1 TEA+DETA、TEA+MEA、TEA+PZ的CO2吸收性能
在50℃、5MPa条件下,采用CO2体积分数分别为4.07%、6.44%的混合气,将TEA+DETA、TEA+MEA、TEA+PZ分别进行CO2吸收实验,结果示于图8。

图8 混合气条件下TEA+DETA、TEA+MEA、TEA+PZ的CO2吸收负荷(L)随时间的变化
由图8可以看出,两种混合气条件下,TEA+DETA、TEA+MEA、TEA+PZ的CO2吸收负荷随时间的变化趋势大致相同,均在初始阶段随时间变化呈线性增加,然后增加趋势逐渐变缓,最终达到平衡;且均出现TEA+PZ的吸收负荷最先达到平衡,TEA+MEA的吸收负荷达到平衡所需时间最长、最终吸收负荷最大的现象。在CO2体积分数为6.44%的混合气中,3种混合胺液吸收负荷达到平衡所需的时间均比在CO2体积分数为4.07%混合气中要长,其最终吸收负荷也更大。
由图9可知,两种混合气条件下,TEA+DETA、TEA+MEA、TEA+PZ的CO2吸收速率均随酸气负荷的增加而降低,并最终趋于0,且在初始状态TEA+DETA均有最高的吸收速率;在CO2体积分数为4.07%的混合气中,TEA+DETA的吸收速率在酸气负荷为0.025 mol/mol附近逐渐低于TEA+PZ的吸收速率,在酸气负荷为0.035 mol/mol附近逐渐低于TEA+MEA的吸收速率;在CO2体积分数为6.44%的混合气中,TEA+DETA的吸收速率下降较快,在酸气负荷为0.06 mol/mol左右先后低于TEA+MEA和TEA+PZ的吸收速率。在两种混合气中,3种混合胺液的吸收速率分别于酸气负荷0.045 mol/mol及0.08 mol/mol左右趋于0。
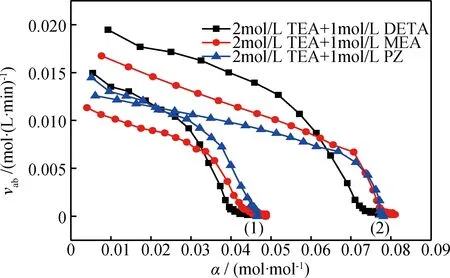
图9 混合气条件下TEA+DETA、TEA+MEA、TEA+PZ的CO2吸收速率(vab)随酸气负荷(α)的变化
综合分析图8、9可知,在两种混合气条件下,TEA+DETA、TEA+MEA、TEA+PZ的CO2吸收负荷及吸收速率具有相近的变化趋势,但在CO2体积分数为6.44%的混合气中,三者吸收CO2达到平衡所需的时间较长,其最终吸收负荷也更高;TEA+PZ具有最短的吸收完成时间,TEA+MEA具有最高的最终吸收负荷;TEA+DETA具有最高的初始吸收速率,但其吸收性能不稳定;TEA+MEA吸收速率变化较平稳,CO2吸收性能稳定。
3.2.2 TEA+DETA、TEA+MEA、TEA+PZ的CO2解吸性能
TEA+DETA、TEA+MEA、TEA+PZ 3种混合胺液富液与贫液的酸气负荷及CO2解吸率列于表2, 3种混合胺液的CO2解吸率随时间和温度的变化示于图10。

表2 TEA+DETA、TEA+MEA、TEA+PZ的CO2解吸数据
由表2可以看出,TEA+DETA和TEA+PZ具有相近的富液吸收负荷与贫液残余负荷;TEA+MEA具有最高的富液吸收负荷与最少的贫液残余负荷;TEA+MEA、TEA+PZ、TEA+DETA的CO2解吸率依次降低。
由图10可以看出,TEA+DETA、TEA+MEA、TEA+PZ的CO2解吸率均随时间延长呈增长趋势,且在0~15 min内增长速率较快,当时间超过15 min时增长速率逐渐变慢;在整个CO2解吸过程中,同一时刻TEA+MEA、TEA+PZ、TEA+DETA 的CO2解吸率依次降低。三者的CO2解吸率均随温度的增加而增加,且在解吸初始温度~85℃范围内增长趋势缓慢,当温度高于85℃时急剧增加,并均于100℃左右完成解吸;同一解吸温度下,TEA+MEA、TEA+PZ、TEA+DETA的CO2解吸率依次降低。
综合分析表2、图6、图7可得,TEA+MEA具有最高的富液吸收负荷与最少的贫液残余负荷,且在同一解吸时刻、同一解吸温度下均有最高的解吸率,因此其CO2解吸性能最好;TEA+DETA和TEA+PZ具有相近的解吸率,但在解吸过程中前者的解吸率低于后者,其CO2解吸性能较差。
3.2.3 综合脱碳性能
两种混合气质条件下,TEA+MEA均有最高的最终CO2吸收负荷,且具有最高的CO2解吸率;TEA+PZ具有最短的吸收完成时间,但最终吸收负荷不高,解吸性能较差;TEA+DETA具有最高的初始吸收速率,但其吸收性能不稳定,且解吸性能最差。
4 结 论
(1) 纯CO2条件下,在TEA+DETA、TEA+MEA、TEA+TETA、TEA+PZ、TEA+DEA 5种混合胺液中,TEA+DETA、TEA+MEA和TEA+PZ表现出较好的综合脱碳性能,具有较高的CO2吸收负荷(均在0.225 mol/L以上)与较短的反应时间(15~25 min),且均具有较好的CO2解吸效果,能够保证胺液的循环利用,降低成本,因此可作为良好的脱碳胺液应用于天然气工业中。
(2) 混合气条件下,TEA+DETA、TEA+MEA和TEA+PZ均表现出了较稳定的CO2吸收负荷,且随CO2浓度的升高,吸收完成时间及最终吸收负荷也随之增加。因此纯酸气条件下优选出的混合胺液的CO2吸收规律同样适用于不同气质的原料气,且胺液的CO2吸收能力会随CO2浓度的升高而提升。
(3) 混合气条件下,TEA+DETA、TEA+MEA和TEA+PZ的CO2吸收速率随CO2浓度的升高变化较为明显,说明酸气浓度对混合胺液的CO2吸收速率影响较大。其中,TEA+PZ在CO2浓度较低时吸收速率较高,TEA+MEA的CO2吸收性能相对稳定,TEA+DETA的CO2吸收性能最不稳定。
(4) TEA+DETA、TEA+MEA和TEA+PZ的CO2解吸效果均较好,且均在100℃左右即可完成解吸过程,可降低胺液再生过程中的能耗,节约脱碳成本。在同一解吸时刻、同一解吸温度下,TEA+MEA具有最高的CO2解吸率。因此,在实际脱碳工业中,当各混合胺液吸收性能相差不大时,可优先选择TEA+MEA混合胺液。
[1] 谢飞龙,李洋洋, 张浩.天然气中酸性气体脱除方法探讨与研究[J].科技风, 2013 (10): 53-54.(XIE Feilong, LI Yangyang, ZHANG Hao. Discussion and Research on removal method of acid gas in natural gas[J].Technology Wind, 2013 (10): 53-54.)
[2] 宿辉,崔琳. 二氧化碳的吸收方法及机理研究[J].环境科学与管理,2006,31(8):79-81.(SU Hui, CUI Lin, Research on absorption method and mechanism of carbon dioxide[J].Environmental Science and Management, 2006, 31(8):79-81.)
[3] 王开岳,汪忖理, 李志良,等.天然气净化工艺——脱硫脱碳、脱水、硫磺回收及尾气处理[M].北京:石油工业出版社,2005.
[4] 黎四芳,任铮伟, 李盘生,等.MDEA-MEA混合有机胺水溶液吸收CO2[J].化工学报,1994,(6):698-703.(LI Sifang, REN Zhengwei, LI Pansheng, et al. Absorption of CO2by aqueous MDEA-MEA solution[J].Journal of Chemical Industry and Engineering,1994,(6):698-703.)
[5] 杜元龙,苏俊华. 二氧化碳综合利用的可行性[J].吉林工学院学报,1998,19(3):24-26.(DU Yuanlong, SU Junhua. The feasibility of the utilization of carbon dioxide[J].Journal of Jilin Institute of Technology,1998,19(3):24-26.)
[6] GERALD O. Carbon dioxide gets grounded[J]. Chemical Engineering,2000,107 (3):41-45.
[7] 陆诗建,李清方, 张健.醇胺溶液吸收二氧化碳方法及反应原理概述[J].科技创新导报, 2009, 13:4-5.(LU Shijian, LI Qingfang, ZHANG Jian. Overview of CO2absorption with organic amines solution and reaction theory[J].Science and Technology Innovation Herald, 2009,13:4-5.)
[8] 花亦怀,郭清, 冯颉,等.天然气脱碳单一胺液及混合胺液解吸性能研究[J].天然气化工(C1化学与化工),2014,(1):47-51.(HUA Yihuai, GUO Qing, FENG Jie,et al. Desorption properties research on single and mixed amine solvents in the natural gas decarbonization[J].Natural Gas Chemical Industry(C1 Chemistry and Chemical),2014,(1):47-51.)
Study on Performance of Mixed Amine Solutions for Nature Gas Decarbonization
CHEN Jie1,TANG Jianfeng2,HUA Yihuai1,XU Minghai2,WANG Chuanlei3,HAN Yaping2,FENG Jie1,SHI Zelin2
(1.CNOOCGas&PowerGroupResearch&DevelopmentCenter,Beijing100027,China;2.CollegeofPipelineandCivilEngineering,ChinaUniversityofPetroleum,Qingdao266580,China;3.OffshoreOilEngineeringCo.Ltd,Tianjin300461,China)
In order to select triethanolamine (TEA) mixed amine absorbents of superior decarbonization performance, the absorption rate, acid gas load, desorption rate were used as the evaluation indicators. Firstly, five mixed amine absorbents with a certain concentration of TEA and monoethanolamine(MEA), TEA and diethanolamine (DEA), TEA and diethylenetriamine (DETA), TEA and triethylenetetramine (TETA), TEA and piperazine (PZ) were prepared, and the comparative analysis of which were carried out under conditions of pure CO2. After the variation of absorption and desorption performance indicators were surveyed comprehensively, TEA+MEA, TEA+DETA, TEA+PZ the three mixed amine absorbents were initially selected to be used for further comparatively analysis under conditions of gas mixture. The results showed that among the three mixed amine absorbents, TEA+PZ mixed amine absorbent was prior one for the raw gas with low CO2concentration, while TEA+MEA mixed amine absorbent possessed better desorption properties under the same regeneration conditions, which provided the basis and reference for the industrial applications in natural gas decarbonization.
mixed amine solution; absorbent; absorption; desorption; natural gas decarbonization
2014-05-05
国家重点基础研究“863”项目(2013AA09A216)资助
陈杰,男,高级工程师,博士,主要从事LNG关键技术开发与设备国产化研究;Tel:010-84521290;E-mail:chenjiepaper@126.com通讯联系人: 唐建峰,男,教授,博士,主要从事天然气预处理、LNG关键技术等研究工作;Tel:0532-86983173;E-mail:tangpaper@126.com
1001-8719(2015)04-0904-08
TE644
A
10.3969/j.issn.1001-8719.2015.04.011
