外源壳聚糖对NaCl胁迫下菜用大豆光合作用及荧光特性的影响
2015-06-28杨恒山董永义贾俊英包金花吕德贵沈祥军
王 聪,杨恒山,董永义,贾俊英,包金花,吕德贵,沈祥军
(1内蒙古民族大学农学院,内蒙古通辽028042;2沈阳农业大学园艺学院,沈阳110000)
外源壳聚糖对NaCl胁迫下菜用大豆光合作用及荧光特性的影响
王 聪1,杨恒山1,董永义1,贾俊英1,包金花1,吕德贵1,沈祥军2
(1内蒙古民族大学农学院,内蒙古通辽028042;2沈阳农业大学园艺学院,沈阳110000)
采用蛭石栽培,以耐盐性不同的2个菜用大豆[Glycine max(L.)Merr.]品种为试材,研究外源壳聚糖对NaCl胁迫下幼苗叶片光合及叶绿素荧光参数的影响,探讨外源壳聚糖调控菜用大豆光合作用的生理机制。结果显示:(1)外源壳聚糖通过诱导非气孔因素显著缓解了盐敏感品种‘理想高产95-1’(LX)在胁迫第6、9、12天时净光合速率(Pn)的下降,但胁迫第15天该作用消失;通过同时诱导气孔因素和非气孔因素缓解了耐盐品种‘绿领特早’(LL)在胁迫第3、6天时Pn的下降,其后Pn下降的缓解则主要通过诱导非气孔因素实现,且LL的Pn较盐处理的增幅均高于同期的LX。(2)外源壳聚糖阻止了LX在盐胁迫第12天、LL在胁迫第15天时非光化学猝灭系数(NPQ)的下降;外源壳聚糖显著缓解了LL在盐胁迫第15天时光化学猝灭系数(qP)、实际光化学效率(ФPSⅡ)的下降。(3)无盐条件下,外源壳聚糖在处理早期通过诱导气孔导度(Gs)、qP及ФPSⅡ等气孔和非气孔因素显著提高了两品种菜用大豆的Pn,但中、后期该作用消失。研究表明,菜用大豆具有潜在的抗逆性,外源壳聚糖在NaCl胁迫下对菜用大豆的作用与无盐条件下不同;壳聚糖只有在菜用大豆受到盐胁迫伤害时才可诱导其潜在的抗盐性,但其诱导途径、诱导时效、诱导效果因品种耐盐性不同而异;耐盐品种LL具有较强、持久且多元的潜在抗逆能力,这可能是其经壳聚糖诱导后能维持相对较高Pn的重要原因之一。
外源壳聚糖;NaCl胁迫;菜用大豆;不同品种;光合作用
盐胁迫已成为引起植物产量和品质下降的一种主要的非生物胁迫类型。提高作物的抗盐胁迫能力,已经成为现代植物研究工作中亟待解决的关键问题之一。现实生产中,迫切需要一种简单可行且廉价、清洁的方法来提高植物的耐盐性。壳聚糖(Chitosan,CTS)是甲壳素脱乙酰化后得到的一种聚氨基葡萄糖,甲壳素广泛存在于节肢类动物的翅膀、甲壳以及许多真菌的细胞壁中。甲壳素在自然界的合成量仅次于纤维素,是地球上第二大可再生资源,是一种非常廉价、清洁的化学物质。壳聚糖既具有普通多糖类分子的特性,又具有许多独特的功能,被认为是很有潜力的非生物胁迫抗性诱导剂。壳聚糖可提高低温胁迫下玉米的发芽指数,缩短发芽时间;提高可溶性糖及过氧化物酶(POD)、过氧化氢酶(CAT)活性,降低丙二醛(MDA)含量,进而提高玉米的干物质量[1]。水分胁迫下喷施不同浓度的壳聚糖可明显降低辣椒幼苗活性氧清除系统中超氧化物歧化酶(SOD)和POD的活性,提高可溶性蛋白质、谷胱甘肽(GSH)及抗坏血酸(AsA)的含量,降低细胞质膜相对透性和MDA的含量。外源壳聚糖可以通过提高其抗氧化物质的含量(非酶机制),有效地阻止辣椒体内MDA积累,缓解水分胁迫对辣椒幼苗造成的膜脂过氧化,增强辣椒幼苗的抗旱性[2]。干旱胁迫下,壳聚糖通过降低AsA-GSH循环活性以提高H2O2含量,进而刺激水稻生长,这也说明H2O2是壳聚糖诱导抗旱反应过程中的信号分子[3]。上述研究也表明,外源壳聚糖对相同胁迫下不同种类植物的抗性诱导机制不尽相同。
关于外源壳聚糖缓解逆境胁迫方面的报道较多,但壳聚糖对盐胁迫下菜用大豆的光合作用有何影响?是否可缓解盐胁迫对其造成的负面影响?尚未见报道。本试验以抗性不同的2个菜用大豆品种为研究对象,用壳聚糖溶液喷施菜用大豆幼苗叶片,研究盐胁迫下壳聚糖对菜用大豆叶片气孔调节、气体交换及光合电子传递等的影响,旨在探明外源壳聚糖调控菜用大豆光合作用的生理机制,以期为壳聚糖作为抗盐剂的开发应用提供理论参考。
1 材料和方法
1.1 试材培育
菜用大豆[Glycine max(L.)Merr.]品种选用盐敏感品种‘理想高产95-1’(LX)和耐盐品种‘绿领特早’(LL)[4],试验于2013年5月20日至7月9日在沈阳农业大学试验基地日光温室内进行。干种子直播于上直径25cm、下直径15cm、高20cm的塑料盆中,蛭石作基质,浇灌日本园试营养液,每盆定苗4株。真叶展开后每3d浇1/4浓度日本园试营养液1次,每盆浇液0.5L。
1.2 CTS诱导及NaCl处理
试验设如下处理:(1)对照(CK):叶面喷洒清水,根部浇灌营养液;(2)处理1(T1):叶面喷洒CTS溶液,根部浇灌营养液;(3)处理2(T2):叶面喷洒清水,根部浇灌溶有NaCl的营养液;(4)处理3(T3):叶面喷洒CTS溶液,根部浇灌溶有NaCl的营养液。每处理10盆,3次重复。NaCl处理的适宜浓度为100mmol·L-1,该浓度下,盐敏感品种LX表现为重度胁迫,盐害指数达40.00;耐盐品种LL表现为轻度胁迫,盐害指数为6.67[4];CTS处理的适宜浓度为200mg·L-1(2013年预备试验筛选)。
2片真叶完全展开后,用手持小型喷雾器将CTS溶液均匀喷洒在幼苗叶片的正面和背面,以量足但不下滴为宜,对照和T3喷洒清水。诱导处理5 d后进行NaCl处理,NaCl溶于1/4浓度日本园试营养液,均匀浇入T2和T3基质中,每3d浇液1次,浇液量同上。对照和T1仅浇营养液。
1.3 测定项目及方法
NaCl处理0d开始测定,以后每3d测定1次,共测定6次。以第一片完全展开的三出复叶顶叶为测试对象。处理15d(T2处理植株叶片出现明显褪绿、黄化症状)后测幼苗全株干重。
光合参数用GFS-3000光合仪(德国WALZ公司生产)于上午9:00~11:30测定。气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、叶片周围空气CO2浓度(Ca)及净光合速率(Pn)由光合测定系统直接读出;气孔限制值(Ls)=1-Ci/Ca。测定过程中光强约为800μmol·m-2·s-1,大气温度范围为(25±2)℃,大气CO2浓度范围为(487±10)μmol ·L-1。每次测定重复10次。
在测定叶片光合参数的同时,用Dual-PAM-100荧光仪测定叶绿素荧光参数。叶片经暗适应30 min后,测定光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)、实际光化学效率(ФPSⅡ)。每次测定重复6次。
1.4 数据处理
采用SPSS软件对试验数据进行统计分析。

图1 壳聚糖对NaCl胁迫下菜用大豆干重的影响LX.理想高产95-1;LL.绿领特早;CK.对照;T1.CTS;T2.NaCl;T3.NaCl+CTS;不同小写字母表示处理间在0.05水平存在显著性差异;下同Fig.1 Effect of chitosan on dry weight of vegetable soybean under NaCl stress LX.Lixianggaochan 95-1;LL.Lülingtezao;CK.Contrast;T1.CTS;T2.NaCl;T3.NaCl+CTS;Different letters indicatesignificant difference among treatments at 0.05level;the same as below
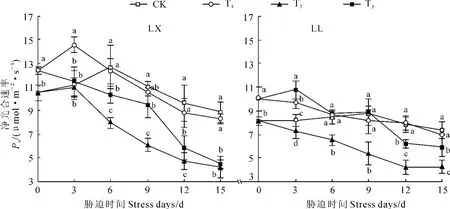
图2 壳聚糖对NaCl胁迫下菜用大豆Pn的影响Fig.2 Effect of chitosan on Pnof vegetable soybean under NaCl stress
2 结果与分析
2.1 壳聚糖对NaCl胁迫下菜用大豆干重的影响
由图1可知,NaCl胁迫15d后,菜用大豆品种LX及LL经T1处理后的干重均与对照无显著差异;T2条件下,两品种的干重均显著低于对照,降幅分别为28%、19%;T3处理显著提高了LX及LL的干重,较T2的增幅分别为15%、25%,且LL的干重达对照水平。表明NaCl胁迫显著抑制了菜用大豆干质量的增加,外源壳聚糖可阻止或缓解盐胁迫对其生长的抑制作用,但对耐盐品种诱导效果更佳;无盐条件下,外源壳聚糖对菜用大豆干质量的诱导作用不显著。
2.2 壳聚糖对NaCl胁迫下菜用大豆光合参数的影响
2.2.1 净光合速率(Pn) 由图2可知,T1处理后,LX和LL的Pn在盐胁迫第0、3天(喷施壳聚糖第5、8天,下同)时均显著高于对照,之后均未受到显著影响。其中,LX的Pn经T2处理第6~15天时均显著低于对照,第15天时降幅达52%;T3处理使第6、9、12天时的Pn较T2显著升高,但第15天时回落到T2水平。LL的Pn经T2处理后在整个胁迫期间均较对照显著降低,但降幅均低于同期的LX;其Pn经T3处理后均大幅升高,其中第3天时显著高于对照,第6、9天时达对照水平,且增幅均高于同期的LX。以上结果表明NaCl胁迫下,外源壳聚糖对菜用大豆的Pn有促进诱导作用,但诱导时期、诱导效果均因品种而异;无盐条件下,壳聚糖对两品种菜用大豆前期的Pn均有促进诱导作用;壳聚糖的诱导作用具有时效性。
2.2.2 气孔导度(Gs)和蒸腾速率(Tr) 图3显示,T1条件下,两品种Gs在第0、3天时均较对照显著增高,其余时期均未受显著影响。LX的Gs经T2处理第6、9、12天时均较对照显著降低,T3处理并未对其Gs产生显著影响;LL的Gs在T2处理整个胁迫期间均显著低于对照,T3处理第3、6天时较T2显著升高,但显著低于对照,其后均维持在T2水平。两品种菜用大豆的Tr在各处理下均与Gs的变化趋势一致。这表明壳聚糖在NaCl胁迫下对菜用大豆Gs的影响因品种耐盐性强弱而异,且无盐或盐胁迫下壳聚糖对Gs的调节作用均具有时效性;Gs的大小直接体现了气孔的开张程度,而外源壳聚糖可通过影响气孔运动,进而影响气孔开度。

图3 壳聚糖对NaCl迫下菜用大豆Gs和Tr的影响Fig.3 Effect of chitosan on Gsand Trof vegetable soybean under NaCl stress
2.2.3 胞间CO2浓度(Ci) 两品种菜用大豆Ci在T1处理第0、3天时显著高于对照,其后均未见显著影响。LX的Ci经T2处理后第6、15天时显著高于对照,其余时期均维持在对照水平;与T2相比,LX的Ci在T3处理后第3、15天时无显著变化,其余时期均显著降低。LL的Ci在T2处理第3~12天时均较对照显著降低,第15天显著升高;T3处理使其整个胁迫期间Ci均比T2显著降低(图4)。
2.2.4 气孔限制值(Ls) 由图5可知,两品种菜用大豆经T1处理后,第0、3天时的Ls较对照显著降低,其后均未产生显著影响。LX的Ls在T2处理第3、9、12天时维持在对照水平,其余时期均显著低于对照;与T2相比,其Ls在T3处理第3天时未受显著影响,第6、9、12天时显著升高,第15天时回落至T2水平。LL的Ls在T2处理第3~12天时均较对照显著升高,第15天时显著降低,而T3处理使整个胁迫期间的Ls均比T2显著升高。

图4 壳聚糖对NaCl胁迫下菜用大豆Ci的影响Fig.4 Effect of chitosan on Ciof vegetable soybean under NaCl stress

图5 壳聚糖对NaCl胁迫下菜用大豆Ls的影响Fig.5 Effect of chitosan on Lsof vegetable soybean under NaCl stress

图6 壳聚糖对NaCl胁迫下菜用大豆NPQ的影响Fig.6 Effect of chitosan on NPQof vegetable soybean under NaCl stress
2.3 壳聚糖对NaCl胁迫下菜用大豆叶绿素荧光参数的影响
2.3.1 光化学猝灭系数(qP)和实际光化学效率(ФPSⅡ) 图7显示,LX经T1处理后,其第3、6天时的qP及ФPSⅡ均显著高于对照,其余时期均未受到显著影响;经T2处理第3天时的qP及ФPSⅡ较对照显著升高,之后维持在对照水平,至第15天时均显著下降;T3处理在整个期间均未对qP及ФPSⅡ产生显著影响。LL的qP及ФPSⅡ在T1处理第0天时显著高于对照,其后均未受到显著影响;其qP及ФPSⅡ在T2处理第15天时较对照显著降低,而T3处理显著提高了此期的qP及ФPSⅡ,但两处理均显著低于对照。表明外源壳聚糖显著诱导了无盐条件下两品种菜用大豆处理早期的qP及ФPSⅡ,而对盐胁迫条件下的qP及ФPSⅡ未产生显著影响(LX)或仅在胁迫末期产生显著诱导作用(LL);壳聚糖的诱导作用具有时效性。
2.3.2 非光化学猝灭系数(NPQ) 由图6可知,T1处理在整个试验期间均未对两品种菜用大豆的NPQ产生显著影响。LX的NPQ在T2处理第3、6、9天时均显著高于对照,至第12、15天时则较对照显著降低;T3处理显著提高了其胁迫第12天时的NPQ,且达对照水平,其余时期均与T2无显著差异。LL经T2处理第3天时的NPQ显著高于对照,第6、9、12天时维持在对照水平,至第15天时则显著降低;T3处理使胁迫15天时的NPQ比T2处理显著升高,且达对照水平,其余时期均未产生显著影响。说明盐胁迫前期对两品种菜用大豆的NPQ产生了显著的促进作用,随着胁迫时间的延长,该促进作用消失,NPQ显著下降,外源壳聚糖能够阻止NPQ的下降,但其作用具有时效性,且对不同品种的作用不同;无盐条件下,壳聚糖对菜用大豆的热耗散能力无显著诱导作用。
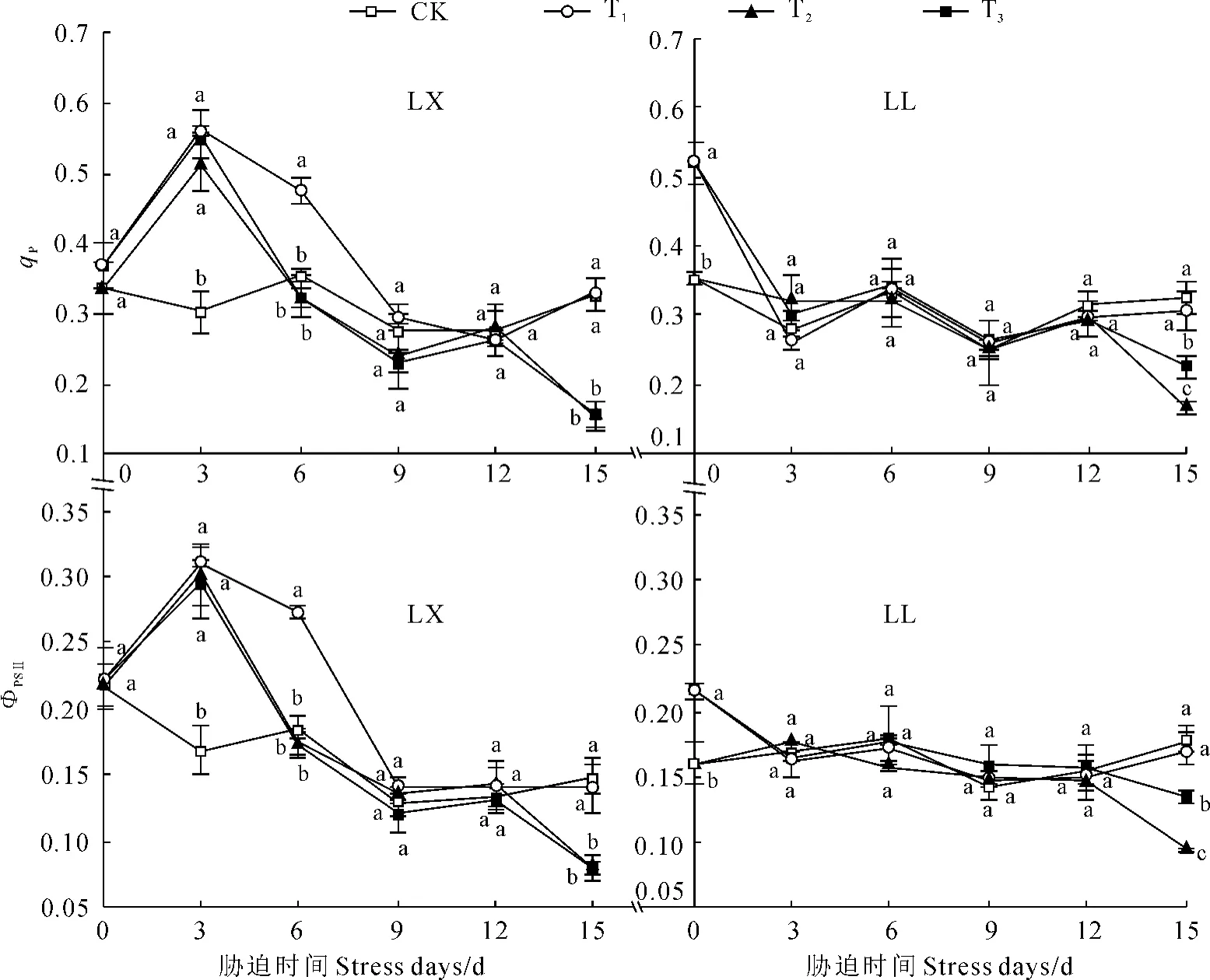
图7 壳聚糖对NaCl胁迫下菜用大豆qP和ФPSⅡ的影响Fig.7 Effect of chitosan on qPandФPSⅡof vegetable soybean under NaCl stress
3 讨 论
3.1 NaCl胁迫下外源壳聚糖对菜用大豆光合参数的诱导效应
植物Pn变化的原因可分为气孔因素(主要是受气孔导度的影响)和非气孔因素(受叶肉细胞光合活性的影响,如光合作用相关酶的活性,光系统Ⅱ反应中心电子流的状态等)。一般地,Pn、Gs和Ci下降,Ls上升,则Pn的下降主要由气孔限制引起;Pn、Gs和Ls下降,Ci上升,或Pn、Gs下降,Ci、Ls无显著变化,则Pn的下降主要由非气孔限制引起[5-9]。而通过调控诱导气孔或非气孔因素则可能提高Pn,或阻止、缓解Pn的下降。
在盐胁迫条件下黑麦草[10]、玉米[11]等光合作用下降的主要原因是非气孔限制;而水稻盐敏感品种光合作用下降的主要因素是气孔限制,耐盐品种在盐胁迫下的光合作用上升,其中气孔因素、非气孔因素对光合能力的提高均发挥了重要作用[12]。说明盐胁迫对不同种类、不同品种植物光合作用产生的影响不同。本研究结果显示,NaCl胁迫下,盐敏感菜用大豆品种LX在胁迫第6、15天时Pn、Gs(Tr)、Ls下降,Ci升高;胁迫第9、12天时Pn、Gs(Tr)下降,Ci、Ls无显著变化,说明非气孔限制是导致其Pn下降的主要原因,这与刘建新等[10]、车永梅等[11]的研究结果相近;喷施壳聚糖后,Pn、Ls在胁迫第6、9、12天时均较盐处理显著升高,Gs(Tr)无显著变化,Ci显著下降,表明壳聚糖可通过诱导非气孔因素显著缓解盐胁迫下Pn的下降。第15天时的Pn、Gs(Tr)、Ci、Ls均与盐处理无显著差异,表明壳聚糖的作用具有时效性。
耐盐品种LL在胁迫第3~12天时均表现为Pn、Gs(Tr)、Ci下降,Ls升高;胁迫第15天时表现为Pn、Gs(Tr)、Ls下降,Ci升高,说明LL在胁迫第3~12天时Pn的下降主要是由气孔限制引起,第15天时主要是非气孔限制所致。这与李海波等[12]的研究结果不同,可能与不同种类植物抗盐能力差异较大有关。壳聚糖处理后,胁迫第3天时的Pn、Gs(Tr)、Ls较盐处理显著升高,Ci显著下降;胁迫第6天时的Pn、Gs(Tr)升高,Ci、Ls与盐处理无显著差异,且两时期Pn的增幅(51%、34%)均明显高于Gs的增幅(21%、20%),表明外源壳聚糖不仅通过诱导气孔因素,同时还可能通过诱导非气孔因素来阻止或减轻Pn的下降。这与李艳等[13]针对油菜的研究结果相近。胁迫第9~15天时的Pn、Ls较盐处理显著升高,Gs(Tr)无显著变化,Ci显著下降,又说明胁迫中后期壳聚糖主要通过诱导非气孔因素来缓解其Pn的下降。
3.2 NaCl胁迫下外源壳聚糖对菜用大豆叶绿素荧光参数的诱导效应
qP反映PSⅡ天线色素吸收的光能用于光化学电子传递的份额[14]。ΦPSⅡ是PSⅡ反应中心在部分关闭情况下的实际原初光能捕获效率[15],NPQ则是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散的部分[16]。本研究表明,NaCl胁迫下,两品种菜用大豆的qP、ФPSⅡ及NPQ表现为胁迫前、中期显著高于对照或与对照无显著差异,后期(第12、15天)显著低于对照,这与刘建新等[10]关于黑麦草的研究结果相近,但与车永梅等[11]关于玉米、孙璐等[17]关于高粱的研究结果不同,反映了植物叶绿素荧光参数受盐胁迫影响的多样性。壳聚糖处理显著提高了LX在胁迫第12天时的NPQ及LL在胁迫第15天时的NPQ及qP、ФPSⅡ,而对LX胁迫第15天时的NPQ及qP、ФPSⅡ无显著影响。这与上述“壳聚糖通过诱导非气孔因素显著缓解了LX在胁迫第12天时、LL在胁迫第15天时Pn的下降,而对LX在胁迫第15天时的Pn无显著影响”的结果相吻合。这也说明PSⅡ的光合电子传递活性、捕获效率及热耗散能力可能是盐胁迫后期影响菜用大豆Pn变化的重要的非气孔因素。
3.3 无盐条件下外源壳聚糖对菜用大豆光合作用的诱导效应
本研究显示,无盐条件下,外源壳聚糖通过诱导Gs、qP及ФPSⅡ等气孔、非气孔因素显著提高了两品种菜用大豆前期的Pn。有研究表明,外源壳聚糖可诱导植物表皮释放H2O2、增加保卫细胞的Ca2+浓度,进而诱导气孔孔径减小或气孔关闭,这是植物防止病菌入侵的早期防御反应之一[18-20]。至于本研究中外源壳聚糖导致两品种菜用大豆早期Gs升高,一时还难以解释,有待于进一步研究。不过可以肯定的是,无盐条件下,外源壳聚糖对菜用大豆光合作用的影响是一个复杂的过程,其作用具有时效性,且对不同品种的作用不同。
综合上述研究结果,本研究表明了以下几点:(1)在NaCl胁迫和无盐条件下,外源壳聚糖对菜用大豆光合作用的影响不同,这可能是其启动了不同的应答机制所致[21-24]。(2)NaCl胁迫下,外源壳聚糖可显著促进菜用大豆的光合作用,但其诱导作用只有在Pn、Gs、E、qP、ФPSⅡ及NPQ等受到显著抑制的情况下才显现。说明菜用大豆具有潜在的抗逆性,当其在逆境下受到胁迫伤害时,外源壳聚糖可诱导其潜在抗逆能力,调动抗逆协调机制,以阻止伤害或降低其伤害程度。(3)NaCl胁迫下,外源壳聚糖对耐盐特性不同的两品种菜用大豆的诱导途径、诱导时效、诱导效果均不同,耐盐品种LL表现出较强、持久且多元的潜在抗逆能力,这可能是其在外源壳聚糖作用下能维持相对较高的同化力,进而维持相对较高干质量的重要原因之一。
植物光合作用是一个非常复杂的生理过程,除光合及叶绿素荧光参数外,还要受到多种因素的影响,因此,NaCl胁迫下外源物质促进光合作用的机制也十分复杂,仅从某一侧面或某个环节去研究外源物质在NaCl胁迫下对光合作用的影响还远远不够。NaCl胁迫下,外源壳聚糖如何影响叶绿素代谢、活性氧代谢、光合相关蛋白质代谢以及叶黄素循环等热耗散途径,进而影响光合作用,均还需进一步深入研究。
参考文献:
[1] GUAN Y J,HU J,WANG X J,et al.Seed priming with chitosan improves maize germination and seedling growth in relation to physiological changes under low temperature stress[J].Journal of Zhejiang University SCIENCE B,2009,10(6):427-433.
[2] MA Y X(马彦霞),YU J H(郁继华),ZHANG G B(张国斌),et al.Protective effects of exogenous chitosan on oxidative damage in pepper seedling leaves under water stress[J].Scientia Agricultura Sinica(中国农业科学),2012,45(10):1 964-1 971(in Chinese).
[3] PONGPRAYOON W,ROYTRAKUL S,PICHAYANGKURA R,et al.The role of hydrogen peroxide in chitosan-induced resistance to osmotic stress in rice(Oryza sativa L.)[J].Plant Growth Regulation,2013,70:159-173.
[4] WANG C(王 聪),ZHU Y L(朱月林),YANG L F(杨立飞),et al.Screening of vegetable soybean cultivars for salt tolerance and their physiological characteristics[J].Jiangsu Journal of Agricultura Science(江苏农业学报),2009,25(3):621-627(in Chinese).
[5] FARQUHAR G D,SHARKEY T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.[6] KHAN W M,PRITHIVIRAJ B,SMITH D L.Effect of foliar application of chitin and chitosan oligosaccharides on photosynthesis of maize and soybean[J].Photosynthetica,2002,40(4):621-624.
[7] KOU W F(寇伟锋),LIU ZH P(刘兆普),et al.Effects of sea water at different concentrations on the photosynthesis and chlorophyll-fluorescence properties of oil sunflower seedlings[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2006,26(1):73-77(in Chinese).
[8] YIN Z P(尹赜鹏),LIU X M(刘雪梅),SHANG ZH W(商志伟),et al.Response of photosynthesis and chlorophy II fluorescence parameters to different drought stress in Cerasus humilis Bunge[J].Plant Physiology Journal(植物生理学报),2011,47(5):452-458(in Chinese).
[9] WONG S C,COWAN I R,FARQUHAR G D.Leaf conductance in relation to rate of CO2assimilation.Ⅱ.Influences of water stress and photoinhibition[J].Plant Physiology,1985,78:830-834.
[10] LIU J X(刘建新),HU H B(胡浩斌),WANG X(王 鑫).Effects of exogenous silicon on active oxygen metabolism and photosynthetic parameters of lolium perenneL seedlings under salt stress[J].Chinese Journal of Grassland(中国草地学报),2008,30(5):25-30(in Chinese).
[11] CHE Y M(车永梅),TANG J(唐 静),CHEN K(陈 康),et al.Effects of nitric oxide on chlorophyll fluorescence parameters and photosynthetic characteristics of maize seedling under salt stress[J].Journal of Maize Sciences(玉米科学),2009,17(3):91-94(in Chinese).
[12] LI H B(李海波),CHEN W F(陈温福),LI Q Y(李全英).Responses of rice leaf photosynthetic param eters to light intensity under NaCl stress[J].Chinese Journal of Applied Ecology(应用生态学报),2006,17(9):1 588-1 592(in Chinese).
[13] LI Y(李 艳),ZHAO X M(赵小明),XIA X Y(夏秀英),et al.Effects of oligochitosan on photosynthetic parameters of Brassica napus seedlings under drought stress[J].Acta Agronomica Sinica(作物学报),2008,34(2):326-329(in Chinese).
[14] WANG K B(王可玢),XU CH H(许春辉),ZHAO F H(赵福洪),et al.The effects of water stress on some in vivo chlorophyll a fluorescence parameters of wheat flag leaves[J].Acta Biophysica Sinica(生物物理学报),1997,13(2):273-278(in Chinese).
[15] MARTINEZ-CARRASCO R,SÁNCHEZ-RODRIGUEZ J,PÉREZ P.Changes in chlorophyll fluorescence during the course of photoperiod and in response to drought in Casuarina equisetifolia Forst.and Forst[J].Photosynthetica,2002,40(3):363-368.
[16] DEMMIG-ADAMS B,ADAMS W W,HEBER U,et al.Inhibition of zeaxanthin formation and of rapid changes in radiationless energy dissipation by dithiothreitol in spinach leaves and chloroplast[J].Plant Physiology,1990,92:293-301.
[17] SUN L(孙 璐),ZHOU Y F(周宇飞),LI F X(李丰先),et al.Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings[J].Scientia Agricultura Sinica(中国农业科学),2012,45(16):3 265-3 272(in Chinese).
[18] LEE S,CHOI H,SUH S,et al.Oligogalacturonic acid and chitosan ceduce stomatal aperture by inducing the evolution of reactive oxygen species from guard cells of tomato and Commelina communis[J].Plant Physiology,1999,121:147-152.
[19] ROBERTS M R.14-3-3proteins find new partners in plant cell signaling[J].Trends in Plant Science,2003,8:218-223.
[20] CHINNUSAMY V,JAGENDORF A,ZHU J K.Understanding and improving salt tolerance in plants[J].Crop Science,2005,45:437-448.[21] LINK V L,HOFMANN M G,SINHA A K,et al.Biochemical evidence for the activation of distinct subsets of mitogen-activated protein kinases by voltage and defence-related stimuli[J].Plant Physiology,2002,128(1):271-281.
[22] REN D,YANG H,ZHANG S.Cell death mediated by MAPK is associated with hydrogen peroxide production in Arabidopis[J].Journal of Biological Chemistry,2002,277(1):559-565.
[23] POVERO T,LORETI E,PUCCIARIELLO C,et al.Transcript profiling of chitosan-treated Arabidopsis seedlings[J].Journal of Plant Research,2011,124:619-629.
[24] LIU T T,LIU Z X,SONG C J,et al.Chitin-induced dimerization activates a plant immune receptor[J].Science,2012,336(6 085):1 160-1 164.
(编辑:裴阿卫)
Effects of Exogenous Ehitosan on Photosynthesis and Fluorescence Characteristics of Vegetable Soybean under NaCl Stress
WANG Cong1,YANG Hengshan1,DONG Yongyi1,JIA Junying1,BAO Jinhua1,LÜDegui1,SHEN Xiangjun2
(1College of Agriculture,Inner Mongolia University for Nationalities,Tongliao,Inner Mongolia 028042,China;2College of Horticulture,Shenyang Agricultural University,Shenyang 110000,China)
In order to investigate the physiological regulation mechanism of exogenous chitosan on vegetable soybean photosynthesis,we studied the effects of exogenous chitosan on photosynthetic and chlorophyll fluorescence parameters in seedling leaves of two vegetable soybean[Glycine max(L.)Merr.]cultivars with different salt tolerance under NaCl stress by adopting vermiculite culture.The results showed:(1)exogenous chitosan alleviated the decline of net photosynthetic rate(Pn)of salt-sensitive cultivar LX markedly at the 6th,9th and 12th days of salinity by inducing non stomatal factors,but this effect disappeared after 15days of salt stress.For salt-tolerant cultivar LL,chitosan reduced the decline of Pnsignificantly at the 3rd and 6th days of salinity by inducing stomatal factors and non stomatal factors simultaneously,and reduced that of the 9th,12th and 15th days of salt treatment mainly by inducing non stomatal factors,and itsgrowth of Pncompare with NaCl treatment were higher than that of LX.(2)Exogenous chitosan prevented the decline of non photochemical quenching coefficient(NPQ)of LX after 12days of salinity,and prevented the decline of NPQand markedly alleviated the decline of photochemical quenching coefficient(qP)and actual photochemical efficiency(ФPSⅡ)of LL after 15days of salinity.(3)Under no NaCl condition,chitosan increased the Pnof two vegetable soybean cultivars significantly by inducing stomatal factors and non stomatal factors such as stomatal conductance(Gs),qPandФPSⅡat the early stage of spraying chitosan,but these effects disappeared at middle and later stage.All the results suggest that:vegetable soybean has potential resistance.The effects of exogenous chitosan on vegetable soybean under NaCl stress differ from those of no NaCl condition.Chitosan can only induce potential salt resistance of vegetable soybean when it is injured by salt stress.However,the induction route,induction timeline and induction effect of chitosan on vegetable soybean were different because of different salt tolerance of vegetable soybean.The salt tolerant cultivar LL has strong,durable and multiple potential resistance ability,which may play an important role in maintaining relatively higher Pninduced by chitosan.
exogenous chitosan;NaCl stress;vegetable soybean;different varieties;photosynthesis
Q945.78
A
10.7606/j.issn.1000-4025.2015.06.1198
1000-4025(2015)06-1198-08
2014-12-08;修改稿收到日期:2015-06-03
国家自然科学基金(31260472,31260483);内蒙古民族大学科研创新团队计划(NMD1003)
王 聪(1968-),男,博士,教授,硕士生导师,主要从事蔬菜生理生态和生物技术研究。E-mail:tongliaowangcong@163.com
