外源H2S对NO3-胁迫下番茄幼苗生理生化特性的影响
2015-06-28景举伟白学贵陈宣钦李昆志徐慧妮
景举伟,李 顺,赵 艳,白学贵,陈宣钦,李昆志,徐慧妮*
(1昆明理工大学生命科学与技术学院,昆明650500;2云南农业大学基础与信息工程学院,昆明650201)
外源H2S对NO3-胁迫下番茄幼苗生理生化特性的影响
景举伟1,李 顺1,赵 艳2,白学贵1,陈宣钦1,李昆志1,徐慧妮1*
(1昆明理工大学生命科学与技术学院,昆明650500;2云南农业大学基础与信息工程学院,昆明650201)
采用营养液水培方法,通过外源施加H2S供体NaHS(100μmol/L),研究了信号分子H2S对100mmol/L NO3-胁迫下番茄幼苗生理生化特性的影响。结果表明:(1)NO3-胁迫下,随着处理时间的延长,番茄幼苗的株高、根长、鲜重和干重显著降低,叶绿素(a、b)含量、净光合速率、气孔导度、蒸腾速率均显著降低,而胞间CO2浓度以及丙二醛(MDA)、H2O2含量增加,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性显著降低,抗坏血酸(AsA)和还原性谷胱甘肽(GSH)含量显著降低。(2)与NO3-胁迫处理相比,外源NaHS处理1、3、5d后,番茄幼苗的株高、根长、鲜重和干重显著增加,叶绿素(a、b)含量、净光合速率、气孔导度、蒸腾速率均显著升高,而胞间CO2浓度显著降低;MDA和H2O2含量降低,SOD、POD、CAT和APX活性显著增强,AsA和GSH含量显著增加,而且幼苗的硝酸还原酶、谷氨酰胺合成酶、谷氨酸合酶的活性显著增强;L-半胱氨酸脱巯基酶活性和内源H2S含量增加。研究认为,外源H2S可能通过提高抗氧化物酶的活性和增加抗氧化物质含量来缓解NO3-对番茄幼苗造成的伤害,从而增强其对NO3-胁迫耐性。
土壤次生盐渍化;硫化氢;光合特性;氮代谢;抗氧化物酶
设施作物生长周期短,复种指数高,种植结构单一,生产中普遍存在超量不平衡施用化肥现象,加之土壤得不到雨水淋洗,并长期处于高温高湿的环境中,蒸腾量大,使得大量盐分集聚在土层表层,一般在5~8年后,会发生不同程度的土壤次生盐渍化[1]。土壤次生盐渍化是温室蔬菜生长的主要障碍之一,研究表明其土壤的盐分组成特点和滨海、内陆盐土不同,其阴离子主要是NO3-,阳离子主要是Ca2+和K+[2]。NO3-离子浓度过高会将土壤固相中的Ca2+等置换出来形成各种硝酸盐,提高土壤溶液的浓度和渗透压,降低土壤-植物根系-植物叶片的水势梯度,引起叶片气孔关闭,同时,过量NO3-还会妨碍作物对铁的吸收利用,引起叶片黄化[3]。
H2S是继NO、CO之后发现的第3种气体信号分子,在植物生长发育和胁迫环境中发挥着重要作用。研究表明,一定浓度的外源H2S能够缓解盐胁迫、渗透胁迫、氧化胁迫等对植物的伤害。盐胁迫下H2S参与调节植物活性氧(ROS)代谢,提高抗氧化物酶的活性[4]。渗透胁迫引起的番薯(Ipomoea batatas)叶绿素含量下降,喷施NaHS显著提高其超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)活性,降低脂氧合酶(LOX)、H2O2和MDA的含量,从而缓解渗透胁迫[5]。
番茄是中国设施栽培的主要蔬菜之一,其幼苗若受高浓度盐危害,会引起幼苗老化并产生畸形果,严重影响其品质和产量[6-7]。番茄在3年以上的保护地内栽培,每年产量会降低10%~20%,且病害逐年加重[8]。目前外源施加NaHS对NO3-胁迫下番茄幼苗生理和生化特性的影响鲜见报道。本试验研究了外源添加H2S的供体NaHS对NO3-胁迫下番茄生长、碳氮代谢和氧化胁迫的影响,旨为丰富气体信号分子H2S在盐胁迫下对植物调控作用的资料并为解决设施土壤次生盐渍化伤害奠定理论基础。
1 材料和方法
1.1 材 料
番茄(Solamum lycopersicumL.)品种为‘中蔬4号’NaHS为Sigma公司产品,其他试剂均为国产分析纯。
1.2 幼苗培养及处理
选取籽粒饱满、大小均匀、无病虫害的番茄种子,3%次氯酸钠溶液消毒10min,蒸馏水冲洗3~5次,播种在垫有2层滤纸的直径为9cm的培养皿内催芽。种子80%露白后,将其均匀地播种到珍珠岩上,并覆盖1层珍珠岩,喷透水。番茄幼苗长至1片真叶时移栽于4L方盆,每盆12株幼苗,添加华南农业大学水培番茄营养液配方进行培养[9]。当番茄幼苗长至三叶一心时开始处理,试验共设3个处理:(1)正常培养(CK):番茄营养液栽培;(2)NO3-胁迫(NO3-):在前期实验基础上,营养液中添加100 mmol/L NO3-溶液进行高浓度NO3-处理,NO3-溶液采用1mol/L KNO3和0.5mol/L Ca(NO3)2等体积配制;(3)NO3-胁迫+NaHS(NO3-+H2S):在番茄营养液中同时添加100mmol/L NO3-溶液和100μmol/L NaHS溶液。分别在处理1、3、5d后进行相关指标的分析测定。培养温室条件为:每天光照16h,光强为300μmol·m-2· s-1,白天温度为25~32℃,夜间温度为15~20℃,空气相对湿度为65%左右。
1.3 测定项目及方法
1.3.1 株高、根长、鲜重和干重 用直尺测量番茄幼苗株高(茎基部到生长点的长度)和根长(根茎结合处到主根根尖的长度);番茄幼苗用去离子水冲洗干净并吸干水分,从根茎结合处剪断,分为地上部和地下部,分别称得鲜重;再在烘箱中105℃下杀青15min后,75℃烘干至恒重,称得干重。
1.3.2 叶绿素含量 收集各处理相同部位番茄叶片,在液氮中充分研磨成粉末状,以95%乙醇对叶绿素进行抽提。叶绿素含量采用紫外分光光度法进行测定[10]。
1.3.3 光合参数 采用Yaxin-1102便携式光合蒸腾仪,于晴天上午9:00~11:00测定植株光合参数。取第3片完全展开的功能叶,测定其净光合速率、气孔导度、胞间CO2浓度、蒸腾速率。测定时的光量子通量密度为800μmol·m-2·s-1,环境CO2浓度为(380±10)μmol·mol-1,叶室温度为25℃。
1.3.4 MDA和H2O2含量 番茄叶片中MDA含量根据Han等[11]的方法测定,H2O2含量根据李忠光等[12]方法测定。
1.3.5 抗氧化酶活性 粗酶液提取按照Gossett等[13]的方法,取0.2g番茄叶片样品,加1mL酶提取液(50mmol/L、pH 7.8的磷酸缓冲液,含1 mmol/L EDTA、1mmol/L AsA与1%PVP),冰浴研磨,研磨后加1mL磷酸缓冲液,倒入离心管中,4℃、12 000r/min离心20min,上清即为酶粗提液,离心后-20℃保存,可直接用于SOD、POD、CAT、APX活性的测定。SOD活性测定按照Beauchamp等[14]的方法,以抑制氮蓝四唑(NBT)光化学反应50%为一个酶活性单位。POD活性测定参照Tatiana等[15]的方法,取粗酶液20μL加入比色皿中,加3mL反应液,内含50mmol/L pH 7.0的磷酸缓冲液、2.7mmol/L愈创木酚和2mmol/L H2O2,马上记录吸光度值(A470)的连续变化值。CAT活性测定参照Aebi的方法[16],取粗酶液100μL加入比色皿中,加入3mL反应液,内含有50mmol/L pH 7.0磷酸缓冲液和10μL 30%H2O2,记录A240的连续变化值。APX活性测定参照Nakano等[17]的方法进行,取粗酶液100μL,加入3mL反应液,内含50mmol/L pH 7.0磷酸缓冲液,1mmol/L AsA和2.5mmol/L H2O2,记录A290的连续变化值。
1.3.6 还原型抗坏血酸(AsA)含量和还原型谷胱甘肽(GSH)含量 AsA和GSH含量按照Jiang等[18]的方法测定。(1)AsA含量测定:取0.1g番茄叶片在液氮中研磨成粉末,立即转移至冰浴的6%TCA中。4℃、12 000r/min离心20min,取上清。上清液中加入0.2mL 150mmol/L NaH2PO4和0.2mL H2O。然后经过以下反应体系反应:0.4 mL 10%TCA,0.4mL 44%正磷酸,溶于70%乙醇的0.4mL 4%a,a′-2联吡啶,以及0.2mL 0.3%(W/V)FeCl3。混匀后,混合物在37℃下温育60 min,然后在525nm处测其吸光度值。(2)GSH含量测定:取0.2g样品在液氮中研磨成粉状,再加入1mL 5%5-磺基水杨酸进行充分研磨,匀浆转移至2mL离心管,在4℃下12 000r/min离心15min,上清转移至新的离心管中。取上清液0.25mL,加入150mmol/L NaH2PO4(pH 7.7)2.6mL、DNTB试剂0.18mL,以加磷酸缓冲液代替DNTB试剂作空白。摇匀后,于30℃保温反应5min,测定412 nm波长下的光吸收值。
1.3.7 氮代谢关键酶活性 硝酸还原酶(NR)、谷氨酰胺合成酶(GS)及谷氨酸合成酶(GOGAT)活性的测定采用王月福等[19]的方法。
1.3.8 L-半胱氨酸脱巯基酶(LCD)活性和内源H2S含量的测定 LCD活性和内源H2S含量的测定参照Chen等[20]的方法。(1)LCD活性测定:取番茄叶片0.3g,加入研钵中,然后加入1mL Tris-HCl缓冲液(20mmol/L、pH 8.0)研磨,离心后取上清液。取该上清液500μL于试管中,加入2mL匀浆液,然后加入一定量醋酸锌。之后在试管中加入100μL 30mmol/L FeCl3溶液(用1.2mol/L HCl配制)、100μL 20mmol/L N,N-二甲基-对苯二胺(用7.2mol/L HCl配制)。将试管用塞子塞好,37℃反应30min,然后测定670nm下吸光度值。(2)内源H2S含量测定:取0.3g番茄叶片在液氮中磨碎,迅速转移到1mL 20mmol/L Tris-HCl(pH 8.0)中,于4℃转速12 000r/min离心15 min,取出上清。反应液体系:0.8mmol/L L-半胱氨酸,2.5mmol/L DTT,100mmol/L Tris-HCl(pH 9.0)和100μg(或10μg)0.1g/L蛋白样品。再加入L-半胱氨酸后启动反应,37℃孵育30min;反应完成后加入溶于1.2mol/L HCl的100μL 30 mmol/L FeCl3和溶于7.2mmol/L HCl的100μL 20mmol/L N,N-二甲基-对苯二铵终止反应并显色15min。形成的亚甲基蓝在用分光光度计在670 nm处测定吸光度值,标准曲线采用相应浓度的Na2S。
1.4 数据处理与分析
试验数据均由3次重复平均值和标准误差组成,采用Excel和DPS 7.05(Duncan法)对数据进行统计分析。
2 结果与分析
2.1 外源施加NaHS对NO3-胁迫下番茄幼苗生长的影响
表1显示,与对照(CK)相比,100mmol/L NO3-胁迫处理1d后就严重抑制了番茄幼苗的生长,如NO3-处理1、3、5d后,番茄幼苗地上部鲜重分别显著降低了14.5%、44.4%、71.8%,地下部的鲜重分别显著降低了23.4%、49.1%、82.3%。外源施加100 μmol/L NaHS后,番茄幼苗生长抑制得到显著缓解,其鲜重、干重、株高、根长均增加;处理5d后,与NO3-处理相比,地上部鲜重、地下部鲜重、地上部干重、地下部干重、根长和株高分别显著增加了162.8%、188.2%、214.2%、280.0%、98.3%和41.3%,但仍显著低于对照(表1)。以上结果表明,100mmol/L NO3-胁迫显著抑制了番茄幼苗生长,外源施加100μmol/L NaHS能够有效缓解NO3-胁迫对番茄幼苗生长造成的抑制作用。
2.2 外源施加NaHS对NO3-胁迫下番茄幼苗叶片光合特性的影响
由图1可看出,与对照相比,NO3-胁迫下处理1、3、5d后,番茄幼苗叶片叶绿素a、b和总叶绿素含量均不同程度下降。其中,叶绿素a含量分别降低23.3%、38.7%、69.2%,叶绿素b含量分别降低了31.2%、58.1%、79.0%,总叶绿素含量分别降低了17.0%、37.3%、62.6%,并大多达到显著水平(P<0.05)。外源施加NaHS后,与NO3-胁迫相比,番茄幼苗中叶绿素a、叶绿素b和总叶绿素含量均增加,但未达到显著水平(P<0.05)。其中,叶绿素a含量在处理1、3、5d时分别增加19.4%、26.3%、37.0%,叶绿素b含量分别增加了10.0%、26.0%、27.0%,总叶绿素含量分别增加了13.0%、17.3%、30.2%。

表1 外源施加NaHS对NO3-胁迫下番茄幼苗生长的影响Table 1 Effect of exogenous NaHS on the growth of tomato seedlings under NO3-stress

图1 外源施加NaHS对NO3-胁迫下番茄幼苗叶绿素a、叶绿素b和总叶绿素含量的影响Fig.1 Effect of exogenous NaHS on chlorophyll a,chlorophyll b and total chlorophyll content of tomato seedling under NO3-stress
同时,NO3-胁迫处理1、3、5d后,番茄叶片的净光合速率,气孔导度,蒸腾速率均显著下降(P<0.05),而胞间二氧化碳浓度显著增加(图2);施加外源NaHS后,与NO3-胁迫相比,幼苗净光合速率、气孔导度显著增加(P<0.05),蒸腾速率有所增加,但未达显著水平(P<0.05),胞间二氧化碳浓度却显著降低,并接近对照水平。其中,净光合速率分别增加了16.0%、30.4%、64.2%,气孔导度分别增加了45.0%、57.9%、75.0%,蒸腾速率分别增加了21.6%、35.9%、59.5%,胞间二氧化碳浓度(Ci)分别降低了33.1%、31.6%、34.2%。以上结果说明,外源施加NaHS可以缓解NO3-胁迫对番茄叶片光合作用造成的伤害。
2.3 外源施加NaHS对NO3-胁迫下番茄幼苗膜脂过氧化水平和H2O2含量的影响
如图3所示,与对照相比,NO3-胁迫1、3、5d后,番茄幼苗叶中的MDA含量和H2O2含量均显著增加(P<0.05)。施加外源NaHS后,与NO3-胁迫相比,叶中MDA含量和H2O2含量均一定程度降低,但未达显著水平(P<0.05);其中MDA含量在处理1、3、5d后分别降低了25.2%、16.8%、29.8%,H2O2分别降低了10.9%、15.9%、11.5%。以上结果说明,外源施加NaHS可以一定程度上缓解NO3-胁迫对番茄幼苗膜脂过氧化和氧化胁迫的伤害。
2.4 外源施加NaHS对NO3-胁迫下番茄幼苗抗氧化物酶活性和抗氧化物质含量的影响

图2 外源施加NaHS对NO3-胁迫下番茄幼苗净光合速率(A)、气孔导度(B)、蒸腾速率(C)和胞间二氧化碳浓度(D)的影响Fig.2 Effect of exogenous NaHS on net photosynthesis rate(A),gas conductance(B),transpiration rate(C)and cellular CO2concentration(D)of tomato seedling under NO3-stress

图3 外源施加NaHS对NO3-胁迫下番茄幼苗MDA和H2O2含量的影响Fig.3 Effect of exogenous NaHS on the MDA and H2O2contents of tomato seedling under NO3-stress
NO3-胁迫处理1、3、5d后,番茄幼苗叶片SOD、POD和CAT活性随胁迫时间的增加而显著降低(P<0.05),而APX活性却随胁迫时间的增加而显著增加(P<0.05)。外源施加NaHS均增加了SOD、POD、CAT和APX的活性,但仅APX活性增加达到显著水平;与NO3-胁迫相比,在处理5d后,幼苗叶片SOD、POD、CAT和APX的活性分别增加30.1%、54.5%、41.6%、20.2%(图4,A~D)。同时,幼苗叶片重要的抗氧化物质AsA和GSH含量在NO3-胁迫后显著增加;在处理5d后,其含量分别比对照增加30.5%和19.6%。外源施加NaHS后,叶片AsA和GSH含量均不同程度增加,但仅GSH含量达到显著水平;与NO3-胁迫相比,AsA和GSH含量在胁迫5d后分别增加13.1%和13.8%(图4,E、F)。以上结果说明,外源施加100μmol/L NaHS能够增加抗氧物酶活性及抗氧化物质的含量,从而增强番茄幼苗抵御NO3-胁迫的能力。
2.5 外源施加NaHS对NO3-胁迫下番茄幼苗氮代谢关键酶活性的影响
由图5可知,NO3-胁迫处理1、3、5d后,氮代谢关键酶硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合酶(GOGAT)活性随胁迫时间的增加而显著降低(P<0.05),其在胁迫5d后分别比CK降低83.5%、57.4%、66.7%;外源施加NaHS处理显著增加了NR、GS、GOGAT活性,其在处理5d后分别是NO3-胁迫下活性的3.0、2.4和2.3倍。以上结果说明,NO3-胁迫抑制了氮代谢过程中关键酶的活性,外源NaHS能有效缓解这种抑制作用。
2.6 外源施加NaHS对NO3-胁迫下番茄幼苗L-半胱氨酸脱巯基酶活性及内源H2S含量的影响

图4 外源施加NaHS对NO3-胁迫下番茄幼苗的SOD、POD、CAT、APX活性及AsA、GSH含量的影响Fig.4 Effect of exogenous NaHS on SOD,POD,CAT,APX activities and ASA,GSH content of tomato seedling under NO3-stress
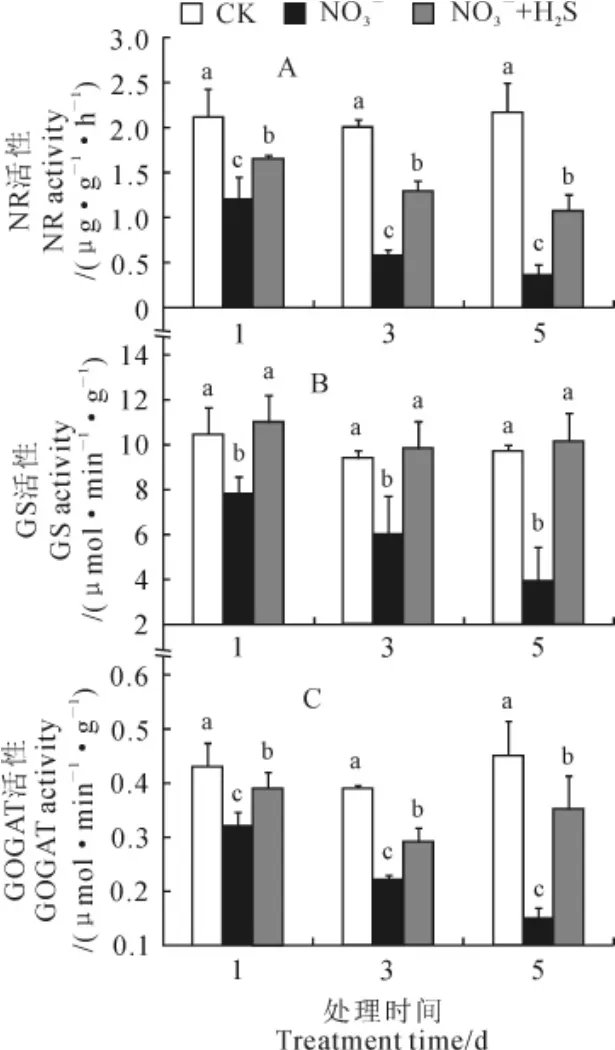
图5 外源施加NaHS对NO3-胁迫下番茄幼苗的根系NR、GS和GOGAT活性的影响Fig.5 Effect of exogenous NaHS on NR,GS,GOGAT activities of tomato seedling under NO3-stress
L-半胱氨酸脱巯基酶是产生H2S的关键酶之一。由图6可知,NO3-胁迫处理1、3、5d后,番茄幼苗叶片L-半胱氨酸脱巯基酶(LCD)活性均比对照显著降低(P<0.05);外源施加NaHS后,与NO3-胁迫相比,处理1、3、5d后LCD活性分别显著增加55.2%、30.3%、15.0%,但并未达到对照水平。同时,番茄幼苗叶片内源H2S含量在NO3-胁迫后比对照有所降低,并有随胁迫时间延长而增加的趋势;外源施加NaHS后内源H2S含量显著增加,在处理1、3、5d后分别是NO3-胁迫处理下的2.4、1.7和1.3倍,但与对照无显著性差异。以上结果说明,外源NaHS能够显著促进NO3-胁迫番茄幼苗叶片中LCD酶活性,进一步激发内源H2S含量的增加。
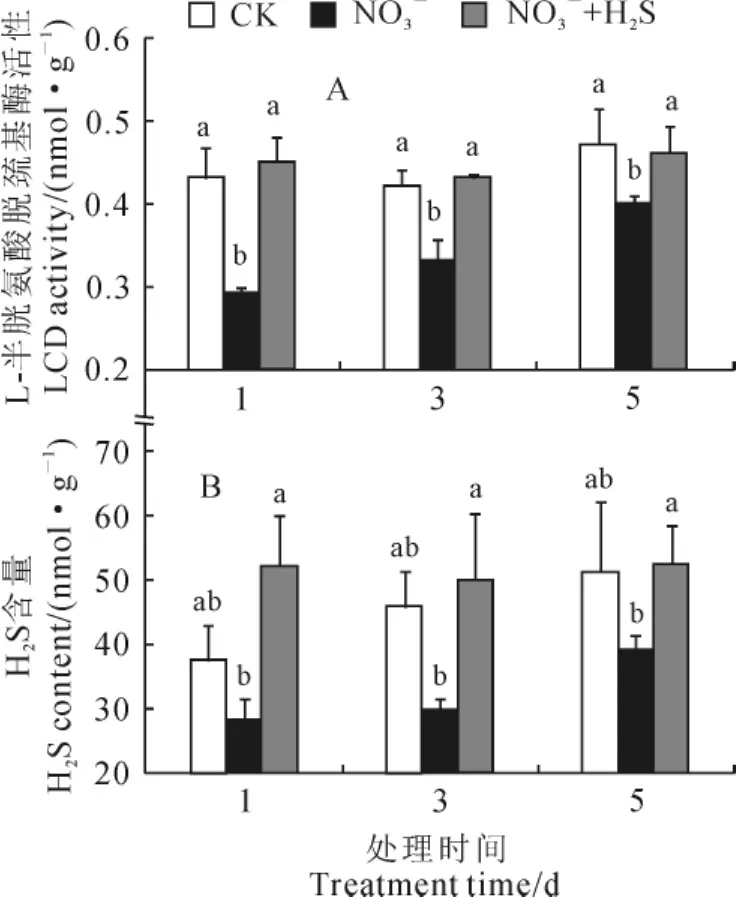
图6 外源施加NaHS对NO3-胁迫下番茄幼苗L-半胱氨酸脱巯基酶活性和内源H2S含量的影响Fig.6 Effect of exogenous NaHS on LCD activity and H2S content of tomato seedling under NO3-stress
3 讨 论
硫化氢(H2S)是继NO和CO之后的第3种气体信号分子,参与各种生理调节作用,如调节动物心脏和神经系统功能、舒张血管和消化道平滑肌以及抑制平滑肌细胞增殖等过程;H2S参与了植物生长发育及对外界逆境的抵御反应,如促进植物生长、调控气孔运动、促进根的发育、增强光合作用、缓解逆境伤害(盐胁迫、干旱胁迫、离子毒害、热激伤害)提高幼苗的耐寒性及延缓果实等组织的成熟衰老等[21]。一定浓度的外源H2S能够缓解NaCl胁迫对小麦种子萌发和幼苗生长的抑制[22]。长期干旱胁迫降低了大豆品种Xu-1和Xu-6的叶和根的生物量,叶面喷施NaHS,增加了其生物量[23]。干旱胁迫下,甘薯幼苗子叶中的叶绿素含量显著减少,喷施NaHS后,显著减轻了幼苗叶片叶绿素含量的降低[24]。本研究发现,NO3-胁迫处理后降低了番茄幼苗的株高、根长、干重、鲜重和叶绿素含量,外源施加NaHS使受胁迫番茄幼苗的株高、根长、干重、鲜重等增加,叶绿素a、叶绿素b、总叶绿素含量上升。
盐胁迫下膜质过氧化作用加强,导致质膜透性加大,离子平衡失调,代谢紊乱,生长发育受到抑制。在盐胁迫下,植物叶片中MDA含量和H2O2含量会随着盐浓度的升高而增加。外源施加H2S的供体NaHS可以缓解干旱胁迫所已引起的甘薯幼苗H2O2和MDA含量的升高,从而提高甘薯幼苗抵抗干旱诱导的氧化胁迫的能力[25]。Wang等[26]研究发现,100μmol/L NaHS处理激活了SOD、CAT、POD和APX的同工酶活性或相应转录物,从而导致NaCl胁迫引起的氧化损伤减轻。同样,Zhang等[27]研究表明,H2S供体NaHS可以提高Cr、Al和Cu胁迫下种子某些抗氧化酶的活性,进而对种子的正常萌发起到一定的保护作用。铜胁迫增加了小麦种子中APX活性,外源NaHS预处理,则增加了AsA和GSH含量,进而通过调节AsA-GSH代谢减轻Cu胁迫对种子的氧化伤害作用[28]。本研究发现,施加外源NaHS后,番茄幼苗MDA含量和H2O2含量显著降低,SOD、CAT、POD、APX活性增强,AsA和GSH含量增加,从而缓解盐害对番茄幼苗造成的氧化损伤作用,进而对番茄幼苗生长起到保护作用。
硝酸还原酶(NR)是植物体内控制氮代谢的关键酶和限速酶,也是一种诱导酶,对作物光合、呼吸及碳代谢等有着重要影响,其活性受到NO3-含量的诱导[29]。NR是催化NO3-转化为NH4+过程中的限速酶,进入植物体内的NO3-必须还原为NH4+后才可以参与氨基酸与蛋白质的合成过程,进而被植物吸收利用。本实验发现,NO3-胁迫下,番茄幼苗NR活性随着处理时间的增加而降低,影响NO3-还原为NH4+,导致了NO3-含量的大量积累,植物积累过多的离子,会导致离子毒害,影响植物的正常生长,这与孙菲菲等[30]、赵永福等[31]、李飞等[32]的研究结果一致。施加外源NaHS后,增加了番茄幼苗NR活性,进而缓解了NO3-对植物的胁迫。叶绿体中GS/GOGAT循环是植物体内NH4+同化的主要途径,GS对NH4+有较高的亲和力可避免NH4+积累造成对植株的伤害,在植物氮代谢中起着非常重要的作用[33],本研究发现,NO3-胁迫下,番茄中GS与GOGAT的活性显著下降,说明了GS/GOGAT与NO3-含量有关,而施加外源的NaHS后,可能是GS/GOGAT活性得到了提高,加快了NH4+同化速度,减弱了NO3-在植物体内的积累,进而缓解了NO3-对植物造成的伤害。
近年来发现植物体如黄瓜、玉米、大豆、拟南芥、油菜、水稻等植物叶中发现有内源H2S的存在,它主要通过通过半胱氨酸脱巯基酶(cysteine desulphydrase)催化半胱氨酸降解生成H2S、丙酮酸盐和NH3,也可以通过叶片吸收大气中的H2S,或者在亚硫酸盐还原酶的作用下,将SO32-直接还原成H2S。研究发现H2S能与乙烯、脱落酸、赤霉素、茉莉酸等植物激素及NO、CO等信号分子发挥相互作用,抵御生物和非生物胁迫[34]。Zhang等[35]研究发现,外源施加NaHS可缓解铅胁迫引起的棉花根、茎、叶内源H2S含量增加。本研究也发现,与对照相比,NO3-胁迫使L-半胱氨酸脱巯基酶的活性和H2S的产生量降低,施加外源NaHS使胁迫幼苗H2S的产生量和L-半胱氨酸脱巯基酶的活性增加。
综上所述,本研究主要分析了外源施加NaHS对NO3-胁迫下番茄幼苗生理生化特性的影响,并且发现H2S可能主要通过增加幼苗体内抗氧化物酶的活性和增加抗氧化物质含量,以及调节氮代谢过程来缓解NO3-胁迫的伤害,维持植株光合特性和正常生长发育,最终增强番茄幼苗抵抗NO3-胁迫的能力。
[1] LI J Y(李金耀),ZHANG F CH(张富春),MA J(马 纪),et al.The mechanisms of salt resistance in plants in molecular levels[J].Plant Physiology Communications(植物生理学通讯),2003,39(6):715-719(in Chinese).
[2] LIU Q F(刘庆芳),LÜJ L(吕家珑),LI S L(李松玲),et al.The spatiotemporal variation of nitric nitrogen in protected vegetable soils in different years of cultivation[J].Agricultural Research in the Arid Areas(干旱地区农业研究),2011,29(2):159-163(in Chinese).
[3] YU H Y(余海英),LI T X(李廷轩),ZHOU J M(周健民),et al.Salt accumulation,translocation and ion composition in greenhouse soil profiles[J].Plant Nutrition and Fertilizer Science(植物营养与肥料学报),2007,13(4):642-650(in Chinese).
[4] ASHARF M.Biotechnological approach of improving plant salt tolerance using antioxidants as markers[J].Biotechnol.Advance,2009,27(1):84-93.
[5] WANG Y Q,LI L,CUI W T,et al.Hydrogen sulfide enhances alfalfa tolerance against salinity during seed germination by nitric oxide pathway[J].Plant and Soil,2012,351:107-119.
[6] LIU ZH Y(刘志媛),ZHU ZH J(朱祝军),QIAN Y R(钱亚荣),et al.Effect of iso-osmotic Ca(NO3)2and NaCl on growth of tomato seeding[J].Acta Horticulturae Sinica(园艺学报),2001,28(1):31-35(in Chinese).
[7] YAO J(姚 静),SHI W M(施卫明).Effect of salt stress on structure and growth of tomato seeding roots[J].Soils(土壤),2008,40(2):279-282(in Chinese).
[8] WANG X J(王学军).The study on soil salinization of protected farmland[J].Northern Horticulture(北方园艺),1998,(3/4):12-13(in Chinese).
[9] LÜJ ZH(吕炯璋),SANG P T(桑鹏图),LI L ZH(李灵芝),et al.Effect of nutrient solution with different formulas and concentrations on the growth of tomato seedling[J].Journal of Shanxi Agricultural University(山西农业大学学报·自然科学版),2010,30(2):112-116(in Chinese).
[10] 张志良,瞿 伟.植物生理学实验指导[M].北京:高等教育出版社,2002.
[11] HAN Y,ZHANG J,CHEN X Y,et al.Carbon monoxide alleviates cadmium-induced oxidative damage by modulating glutathione metabolism in the roots of Medicago sativa[J].New Phytol.,2008,177(1):155-166.
[12] LI ZH G(李忠光),SONG Y Q(宋玉泉),GONG M(龚 明),et al.Xylenol orange method used for the measurement of hydrogen peroxide in plant tissue[J].Journal of Yunnan Normal University(云南师范大学学报),2007,27(3):50-54(in Chinese).
[13] GOSSETT D R,MILLHOLLON E P,LUCAS M C,et al.Antioxidant response to NaCl stress in salt tolerant an salt sensitive cultivars of cotton[J].Crop Sci.,1994,34:706-714.
[14] BEAUCHAMP C,FRIDOVICH I.Superoxide dismutase:improved assays and an assay applicable to acrylamide gels[J].Anal Biochem.,1971,44:276-287.
[15] TATIANA Z,YAMASHITA K,MATSUMOTO H,et al.Iron deficiency induced changer in ascorbate content and enzyme activities related to ascorbate metabolism in cucumber roots[J].Plant and Cell Physiology,1999,40:273-280.
[16] AEBI H.Catalase in vitro[J].Methods Enzymol,1984,105:121-126.
[17] NAKANO Y,ASADA K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology,1981,22(5):867-880.
[18] JIANG M Y,ZHANG J H.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlngs[J].Plant Cell Pyhsiol.,2001,42:1 265-1 273.
[19] WANG Y F(王月福),YU ZH W(于振文),LI SH X(李尚霞),et al.Effect of nitrogen nutrition on the change of key enzyme activity during the nitrogen metabolism and kernel protein content in winter wheat[J].Acta Agronomica Sinica(作物学报),2002,28(6):743-748(in Chinese).
[20] CHEN J,WU F H,WANG W H,et al.Hydrogen sulfide enhances photosynthesis through promoting chloroplast biogenesis,photosynthetic enzyme expression,and thiol redox modification in Spinaciaoleraceaseedlings[J].J.Exp.Bot.,2011,62:4 481-4 493.
[21] WANG R.Physiological implications of hydrogen sulfide:a whiff exploration that blossomed[J].Physiol.Rev.,2012,92:791-896.
[22] ZHANG H,ZHU Q T,LAN Y H,et al.Hydrogen sulfide alleviates aluminum toxicity in germinating wheat seedlings[J].Journal of Integrative Plant Biology,2010,52(6):556-567.
[23] ZHANG H,JIAN H,JING CX,et al.Hydrogen sulfide protects soybean seedlings against drought-induced oxidative stress[J].Acta Physiol.Plant,2010,32(5):849-857.
[24] ZHANG H,YE H K,WANG S H,et al.Hydrogen sulfide counteracts chlorophyll loss in sweetpotato seedling leaves and alleviates oxidative damage against osmotic stress[J].Plant Growth Regulation,2009,58(3):243-250.
[25] ZHANG H,TANG J,et al.Hydrogen sulfide promotes root organogenesis in Ipompea batatas,Salix matsudanaand Glycine max[J].J.Integr Plant Biol.,2009,51(12):1 086-1 094.
[26] WANG Y Q,LI L,CUI W T.Hydrogen sulfide enhances alfalfa(Medicago sativa)tolerance against salinity during seed germination by nitric oxide pathway[J].Plant and Soil,2012,351(1-2):107-119.
[27] ZHANG H,ZHU Q T,LAN Y H,et al.Hydrogen sulfide alleviates aluminum toxicity in germinating wheat seedlings[J].Journal of Integrative Plant Biology,2010,52(6):556-567.
[28] SHAN C J,DAI H P,SUN Y F,et al.Hydrogen sulfide protects wheat seedlings against copper stress by regulating the ascorbate and glutathione metabolism in leaves[J].Australian Journal of Crop Science,2012,6(2):248-254.
[29] BHNRWANA S A,ALI S,FAROOQ M A,et al.Hydrogen sulfide ameliorates lead-induced morphological,photosynthetic,oxidative damages and biochemical changes in cotton[J].Environ Sci.Pollut Res.,2014,21(1):717-731.
[30] SUN F F(孙菲菲),WANG D SH(王东升),CHEN H(陈 欢),et al.Effect of nitrogen metabolism in the leaves of pakchoi under NaCl stress[J].Journal of Jiangsu Agricultural Sciences(江苏农业科学),2012,40(4):160-162(in Chinese).
[31] ZHAO F G(赵福庚),LIU Y L(刘友良).Advances in study on metabolism and regulation of proline in higher plants under stress[J].Chinese Bulletin of Botany(植物学通报),1999,16(5):540-546(in Chinese).
[32] LI F(李 飞),YANG T ZH(杨铁钊),ZHANG X Q(张小全),et al.Flue-cured tobacco nitrogen metabolism differences and its influence on aroma precursors in different amount of nitrogen[J].Acta Agricultural Boreali-Sinica(华北农学报),2014,39(1):170-177(in Chinese).
[33] 李合生.现代植物生理学[M].北京:高等教育出版社,2002:221-222.
[34] JIN ZH P,PEI Y X.Research progress on hydrogen sulfide signaling in plants[J].Chinese Journal of Cell Biology,2013,35(6):20-29.
[35] ZHANG H,DOU W,JIANG C X,et al.Hydrogen sulfide stimulatesβ-amylase activity during early stages of wheat grain germination[J].Plant Signal Behav.,2010,5(8):1 031-1 033.
(编辑:裴阿卫)
Effect of Exogenous NaHS on the Physiological and Biochemical Characteristics of Tomato Seedlings under NO3-Stress
JING Juwei1,LI Shun1,ZHAO Yan2,BAI Xuegui1,CHEN Xuanqin1,LI Kunzhi1,XU Huini1*
(1College of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China;2College of Basic Science and Information Engineering,Yunnan Agricultural University,Kunming 650201,China)
The study investigated the effect of gas transmitter H2S(by adding H2S donor NaHS)on the physiological and biochemical characteristics of hydroponic growth tomato seedlings under nitrate stress.The result showed that:(1)with the increasing nitrate stress treatment time,the shoot height,root length,fresh weight and dry weight,chlorophyll a and b contents,net photosynthetic rate,gas conductance and transpiration rate decreased significantly,while the intracellular CO2concentration,the MDA and H2O2contents increased.The activities of superoxide dismutase,catalase,peroxidase,and ascorbate peroxidase and the antioxidant substances of ascorbate and GSH contents decreased after nitrate stress treatment.(2)When NaHS was added,the shoot height,root length,fresh weight and dry weight,chlorophyll a and b contents,net photosynthetic rate,gas conductance and transpiration rate increased significantly after NaHS added for 1,3,5days,while the intracellular CO2concentration decreased,compared with the nitrate stresstreatment alone.The MDA and H2O2contents decreased,while the antioxidant enzyme activities of superoxide dismutase,catalase,peroxidase,and ascorbate peroxidase increased,besides,the antioxidant substances of ascorbate and GSH contents increased after NaHS was added.The activities of nitrate reductase,glutathione synthetase,and glutamate synthase increased after NaHS was added.NaHS treatment stimulated the increase of L-desulfhydrase activity,which in turn induced accumulation of H2S content.These results indicate that the alleviation of the nitrate stress damage on tomato by H2S might be fulfilled through increasing the antioxidant enzyme activities and the antioxidant substances contents.
soil secondary salinization;hydrogen sulfide;photosynthetic characteristics;nitrogen metabolism;antioxidant enzyme
Q945.78
A
10.7606/j.issn.1000-4025.2015.06.1173
1000-4025(2015)06-1173-09
2015-01-25;修改稿收到日期:2015-06-02
国家自然科学基金(31101557,31460526)
景举伟(1983-),男,在读硕士研究生,主要从事植物营养与基因工程研究。E-mail:jingjuwei@126.com
*通信作者:徐慧妮,副教授,硕士生导师,主要从事蔬菜逆境生理及分子生物学研究。E-mail:hnxusun@126.com
