华南象草PpCAD基因的亚细胞定位及其在转基因烟草中的异源表达
2015-06-28张博雅彭小群张向前解新明
唐 然,张博雅,彭小群,张向前,江 院,解新明
(华南农业大学林学与风景园林学院草业科学系,广东省草业工程技术研究中心,广州510642)
华南象草PpCAD基因的亚细胞定位及其在转基因烟草中的异源表达
唐 然,张博雅,彭小群,张向前,江 院,解新明*
(华南农业大学林学与风景园林学院草业科学系,广东省草业工程技术研究中心,广州510642)
该研究根据已克隆的华南象草(Pennisetum purpureumcv.Huanan)肉桂醇脱氢酶(CAD)基因PpCAD的cDNA序列,构建亚细胞定位载体pAN580-PpCAD,用PEG介导法转化象草原生质体,以探究PpCAD蛋白在细胞内的定位;同时构建植物过表达载体pBA002-PpCAD,通过农杆菌介导法在烟草中异源表达,以研究PpCAD基因与植物木质素合成的关系。结果显示:(1)PpCAD定位在象草原生质体的细胞质内;(2)过表达载体pBA002-PpCAD转化烟草后获得27株转基因烟草,其中25株PCR鉴定为阳性;(3)半定量RT-PCR检测6株转基因烟草后发现,PpCAD基因在不同植株的表达量存在差异,通过Southern杂交检测后发现该差异与目的基因插入的拷贝数有关;(4)6株转基因烟草和野生型烟草表型上没有明显差异,除目的基因多拷贝插入的植株OEC6外,木质素含量有不同程度的提高,最高比野生型提高了56.50%。研究表明,PpCAD是一个细胞质蛋白,在烟草中过表达PpCAD能够提高植株木质素含量,表明PpCAD基因参与了植物的木质素合成,可用于象草的木质素调控研究。
华南象草;木质素;PpCAD;亚细胞定位;遗传转化;烟草
木质素是一种复杂的三维高分子化合物,由松柏醇、芥子醇和香豆醇3种单体聚合而成,与植物的生长发育密切相关[1-2],在维持植株机械强度,保证水分和营养运输,提高生物与非生物胁迫方面起到重要的作用[3-4]。但是,由于木质素主要沉积于导管细胞和维管束间的纤维细胞中,且结构复杂,难于降解,在造纸工业中会造成大量的能源浪费和环境污染[5]。同时,木质素的存在还制约着木质纤维生物质乙醇的转化,并且降低牧草的干物质消化率[6-7]。所以,植物木质素的调控研究成为热点。
肉桂醇脱氢酶(CAD,EC 1.1.1.195)是木质素合成代谢途径中的关键酶,催化木质素单体形成的最后一步,并将醛类化合物转化为相应的醇类[8-9]。CAD基因在植物体内以多基因家族的形式存在,通常将控制木质素合成的CAD基因称为Bona-fide CAD,而将其同系物称为CAD-like基因[9-10]。如水稻(Oryza sativa)的CAD基因家族中有12个成员,而Bona-fide CAD基因只有1个,即OsCAD2。OsCAD7与水稻植株的茎秆强度有关,是唯一验证了功能的水稻CAD-like基因,而大多数CAD-like基因的功能未知[11-12]。所以,在对CAD基因进行调控的研究前,必须对其进行功能验证,这也是培育木质化改良新品系的必经之路。如今,在一些物种中已经进行了Bona-fide CAD的调控研究,如下调杨树(Populus tremula×Populus alba)的CAD基因提高了木质素高聚物中醛基单元的组分,简化了预处理条件,降低了造纸成本[13];沉默柳枝稷(Panicum virgatum)CAD基因降低了植株木质素含量,改变了木质素组分,并提高了糖化效率[14];而作为牧草的紫花苜蓿(Medicago sativa)在CAD基因下调后干物质消化率明显提高[15]。降低植物木质素含量的转基因研究一直在进行中,但是关于CAD基因调控的研究却很少,特别是在单子叶植物中[16-17]。
象草(Pennisetum purpureum)是一种优良的C4禾本科牧草,广泛种植于热带与亚热带地区[18]。由于其具有较好的适口性和营养品质,已成为中国华南地区的重要牧草之一[19]。除此之外,因其产量高、生物量大、抗逆性强、热值高等特点,也常被用作造纸原料和能源作物[20-21]。所以,木质素的含量及组分成为制约象草开发与利用的重要因素。如今,控制华南象草(P.purpureumcv.Huanan)木质素合成的PpCAD基因[9]、Pp4CL(4-香豆酰辅酶A连接酶)基因[22]和PpCCR(肉桂酰辅酶A还原酶)基因[23]已成功克隆并经过了生物信息学分析,但都缺乏体内及体外的表达分析研究。
本研究构建PpCAD基因亚细胞定位载体和植物表达载体,分别以华南象草原生质体和烟草(Nicotiana tabacum)作为转化媒介,研究PpCAD蛋白在细胞内的分布,以及PpCAD基因在烟草中异源表达后植株木质素含量的变化,以验证Pp-CAD与木质素合成的关系,为象草的木质化改良研究奠定基础。
1 材料和方法
1.1 材 料
供试材料为华南象草(P.purpureumcv.Huanan),种植于华南农业大学牧草引种园。烟草(Nicotiana tabacum)组培苗K326、根癌农杆菌(Agrobacterium tumefaciens)EHA105、大肠杆菌(Escherichia coli)Top10、植物表达载体pBA002-3 ×HA、亚细胞定位载体pAN580和pUTL2-mCherry由本实验室保存。其中,pBA002-3×HA的植物筛选标记为Bar基因。pAN580和pUTL2-mCherry分别带有增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)报告基因和红色荧光蛋白(mCherry)报告基因。
1.2 总RNA提取与cDNA合成
采用TransZolUpTM试剂盒(北京全式金生物科技有限公司)提取华南象草幼叶总RNA,通过1%(W/V)琼脂糖凝胶电泳检测RNA完整性,并用微量紫外分光光度计检测RNA纯度与浓度。参照TransScript First-strand cDNA Synthesis Super MIX(北京全式金生物科技有限公司)使用说明书,将提取的总RNA反转录为cDNA第一链。
1.3 载体构建
根据已克隆的华南象草PpCAD基因cDNA序列(GeneBank登录号为HQ840705)[9],设计2对特异性引物Pp-Spe-F与Pp-Sma-R、Pp-Xba-F与Pp-Bam-R,分别带有SpeⅠ/SmaⅠ和XbaⅠ/BamHⅠ两组限制性酶切位点(引物序列见表1,下同)。以T/A克隆载体pMD19-T-PpCAD为模版,进行PCR扩增。Pp-Spe-F与Pp-Sma-R引物组的扩增产物纯化后,与亚细胞定位载体pAN580经SpeⅠ和SmaⅠ双酶切后连接;Pp-Xba-F与Pp-Bam-R引物组的扩增产物纯化后,与植物表达载体pBA002-3×HA经XbaⅠ和BamHⅠ双酶切后连接。2组连接产物经热激法转化大肠杆菌Top10,挑选单菌落进行PCR和双酶切鉴定,挑选阳性菌落扩繁后提取质粒并送测序。2个载体的表达均由烟草花叶病毒启动子(CaMV 35S)启动。构建的表达载体分别命名为pAN580-PpCAD和pBA002-Pp-CAD。
1.4 华南象草PpCAD基因的亚细胞定位
1.4.1 原生质体的分离与纯化 华南象草原生质体的分离与纯化参照水稻原生质体分离与纯化方法[24]并有改良。取生长12d的华南象草幼苗,在4℃条件下避光处理16h,以幼苗第1片叶鞘上、下5 cm的幼嫩部位作为原生质体分离材料。称取0.5g叶鞘,用手术刀片切成0.5mm细段并转入0.6 mol/L甘露醇中浸泡30min;将材料移入10mL酶解液中,在28℃、遮光条件下50r/min震荡酶解4 h。酶解液组分为:1.5%(W/V)纤维素酶R-10(Yakult,Japan)、0.75%离析酶(W/V)R-10(Yakult, Japan)、0.5mol/L甘露醇、10mmol/L MES[2-(N-吗啉)乙磺酸(pH 5.8)]、10mmol/L CaCl2和0.1%牛血清蛋白(bovine serum albumin,BSA)。酶解结束后用200目不锈钢滤网过滤酶解产物混合液,残渣用10mL预冷的W5溶液(154mmol/L NaCl,125mmol/L CaCl2,5mmol/L KCl,2mmol/L MES,pH 5.7)冲洗后进行第2次过滤;滤液于300 r/min离心5min后吸出上清,加入2mL预冷的W5溶液,轻悬沉淀,150r/min离心2min,移去上清后再用2mL预冷的W5溶液重复洗涤2~3次;洗好的沉淀用500μL W5溶液悬浮,得到纯化的原生质体。

表1 PCR所用引物Table 1 PCR primers
1.4.2 原生质体的转化 原生质体转化采用PEG介导法。150r/min离心2min收集纯化好的原生质体后用MMg溶液(0.5mol/L甘露醇,15 mmol/L MgCl2,2mmol/L MES,pH 5.7)重悬,使原生质体终浓度达2×106个/mL。取20μL构建好的pAN580-PpCAD重组质粒(10ng)加入100 μL原生质体细胞中,混匀后加入10μL新鲜制备的PEG(polyethylene glycol,PEG)溶液[40%(W/V)PEG 4000,0.2mol/L甘露醇,100mmol/L CaCl2],轻弹混匀,28℃黑暗孵育15min。同时,为了增加实验结果准确性,以空载体pUTL2-mCherry为对照,将其与重组质粒pAN580-PpCAD共转化象草原生质体。在共转化实验中,将2个质粒等质量混合(总浓度10~15ng),并加入到100μL原生质体细胞中。孵育完成后,加入1mL W5溶液,小心颠倒混匀以终止反应。150r/min离心5min后移去上清,用1mL WI溶液(0.5mol/L甘露醇,20 mmol/L KCl,4mmol/L MES,pH 5.7)重悬,28℃黑暗中静置培养过夜(12~16h)。孵育完成后,300 r/min离心5min收集细胞,用约50μL WI溶液重悬后进行显微观察。
1.4.3 显微拍照 EGFP和mCherry的激发波长(最大吸收峰)分别为488和587nm,发射波长(最大发射峰)分别为511和610nm。转化后的原生质体使用蔡司激光扫描共聚焦显微镜7DUO(Zeiss LSCM 780&7Live)进行观察和拍照,并用Zen 2012软件进行进行图片处理。
1.5 华南象草PpCAD基因在烟草中的异源表达
1.5.1 农杆菌转化 利用冻融法,将含有PpCAD基因的植物表达载体pBA002-PpCAD转化农杆菌EHA105感受态,铺板后挑单菌落进行PCR鉴定。选择阳性单菌落扩繁作为农杆菌侵染的种质液。
1.5.2 烟草遗传转化 根据改良的叶盘法进行烟草的遗传转化。选择健康的烟草组培苗,无菌条件下剪取叶片,剔除叶脉后切成0.5cm×0.5cm小块,并接种于预培养培养基MS-P(MS+0.5mg/L 6-BA+0.1mg/L NAA)中预培养3d。将含有pBA002-PpCAD载体的EHA105种质液,以1∶100比例扩繁至OD600为0.4~0.5,5 000r/min离心5min,收集菌体后用不含蔗糖的1/2MS培养基重悬,使OD600为0.1~0.2。烟草叶片结束预培养后将其浸没于重悬液中,每5min晃动1次,15 min后取出叶片,吸干多余菌液,于MS-P培养基中黑暗下共培养48h。将共培养后的叶盘转入无菌水中清洗5min,再转入含500mg/L Cef的无菌水中清洗10min,再用无菌水清洗叶盘3~4次,尽可能去除叶盘表面农杆菌。用无菌滤纸吸干叶盘表面水分,转入MS-S培养基(MS+0.5mg/L 6-BA+0.1mg/L NAA+5mg/L Basta+200mg/L Cef+200mg/L Car)中进行筛选及分化培养。每2周用MS-S培养基继代1次,待分化后的烟草无菌苗生长至3cm时,转入MS-R(MS+0.2mg/L NAA+100mg/L Timetin)培养基进行生根培养。待根系长成后移栽至温室,种植土壤为植物营养土,购自广州市荣丰园艺公司,种植前将营养土、蛭石、河沙以8∶1∶1比例混合,并以500g/盆进行分配。分化、生根及移栽后的植物培养条件均为25℃、16h光/8h暗培养。
1.5.3 PCR扩增和Southern杂交 采用新型植物基因组DNA试剂盒(康为世纪)提取烟草成熟叶片DNA,并用位于载体插入位点两端序列的引物PBA-F和PBA-R进行PCR扩增,野生型植株为阴性对照,含有目的片段的质粒作为阳性对照,反应体系为:2×Taq MasterMix(康为世纪)10μL,10 μmol/L引物PBA-F/PBA-R各0.5μL,DNA模板1μL,ddH2O 8μL。反应程序为:95℃预变性5 min;95℃变性30s,55℃退火30s,72℃延伸2 min,30个循环;72℃孵育10min。转基因烟草成熟叶片总RNA提取和反转录方法同1.2,RT-PCR以cDNA为模板,采用载体上的Bar基因进行引物BAR-F/BAR-R检测,并以看家基因Actin引物Actin-F/Actin-R扩增作为内参。PCR反应体系中各组分用量以及PCR反应程序与上述相同。Southern杂交通过地高辛标记检测试剂盒Ⅱ(Roche)进行,大量提取转基因烟草基因组DNA,用限制性内切酶HindⅢ酶切24h,DNA模板量为15μg,并以40ng质粒pBA002-PpCAD经XbaⅠ酶切后作为对照。用Bar基因标记探针,Southern杂交中,探针的标记、电泳、转膜、预杂交、杂交与显影等步骤均按照说明书的步骤进行。
1.5.4 木质素含量测定 待转基因烟草移栽3个月后,利用溴乙酰法[25]测定茎杆木质素总含量。称取1g新鲜样品,用5mL 95%乙醇研磨粉碎,5 000 r/min离心30min。去除上清,用95%乙醇清洗沉淀3次,再用乙醇∶正己烷(1∶2)清洗沉淀3次。将清洗后的沉淀置于烘箱中烘干至恒重。取3mg烘干样品放入小锥形瓶中,加入5mL 25%(V/V)AcBr(溶于冰醋酸中)提取液于恒温水浴锅中,用玻璃片盖住瓶口,70℃振动孵育30min。将液体(约4mL)转入10mL容量瓶,依次加入0.9mL 2mol/L NaOH、5mL冰醋酸、0.1mL 7.5mol/L盐酸羟胺,定容至10mL。2 000r/min离心7min,吸取上清测定OD280值。根据样品的OD280,利用木质素标准曲线回归方程求得样品木质素的浓度(mg/L),并计算样品木质素重量。木质素总含量=木质素重量/干燥样品重量(%),实验结果重复3次。数据利用Excel 2013软件进行统计整理,并用SPSS 17.0进行邓肯式新复极差法(DMRT)多重比较。
2 结果与分析
2.1 载体构建与鉴定
以pMD19-T-PpCAD为模板,经引物组Pp-Spe-F与Pp-Sma-R扩增,得到含有起始密码子和终止密码子的PpCAD片段,大小约1.1kb(图1)。该目的片段经过SpeⅠ和SmaⅠ双酶切后,与亚细胞定位载体pAN580连接,得到重组质粒pAN580-PpCAD,经酶切验证,PpCAD片段成功连接到载体(图1)。同样,以pMD19-T-PpCAD为模板,经引物组Pp-Xba-F与Pp-Bam-R扩增后得到约1.1 kb产物,与植物表达载体pBA002-3×HA相连(图1),用XbaⅠ和BamHⅠ对重组质粒pBA002-Pp-CAD进行双酶切,能够切出约1.1kb目的片段(图1)。最终经测序验证,得到含有目的片段PpCAD的2个载体。

图1 目的片段PpCAD的克隆与载体构建后的双酶切鉴定M.DL2000;1.含有酶切位点SpeⅠ和SmaⅠ的PpCAD基因目的片段;2.含有酶切位点XbaⅠ和BamHⅠ的PpCAD基因目的片段;3.pAN580-PpCAD双酶切鉴定;4.pBA002-PpCAD双酶切鉴定Fig.1 Cloning of target fragment PpCADand enzyme digestion identification after vector construction M.DL2000;1.Target fragment of PpCADharboring SpeⅠand SmaⅠrestriction sites;2.Target fragment of PpCADharboring XbaⅠand BamHⅠrestriction sites;3.Restriction digestion of pAN580-PpCAD;4.Restriction digestion of pBA002-PpCAD

图2 PpCAD蛋白的亚细胞定位A.pAN580-PpCAD在象草原生质体的瞬时表达;B.pAN580-PpCAD和pUTL2-mCherry在象草原生质体的共转化;GFP.绿色荧光蛋白信号;Chlorophyll.叶绿体自发荧光;mCherry.红色荧光蛋白信号;Bright.明场;Merged.左边所有图片的叠加Fig.2 Subcellular localization of PpCAD protein A.Transient expression of pAN580-PpCADin P.purpureumprotoplasts;B.Co-expression of pAN580-PpCAD and pUTL2-mCherry in P.purpureumprotoplasts;GFP.Signal of green fluorescent protein;Chlorophyll.Chlorophyll autofluorescence;mCherry.Signal of red fluorescent protein;Bright.Bright field;Merged.Overlapping of all left photos
2.2 PpCAD基因亚细胞定位
以PEG介导法将含有EGFP绿色荧光蛋白报告基因的pAN580-PpCAD转化到华南象草原生质体中,通过激光共聚焦显微镜观察,叶绿体自发荧光为参照,发现原生质体细胞质中有绿色荧光信号(图2,A),表明PpCAD蛋白可能定位在细胞质中。为进一步验证结果,将带有红色荧光蛋白mCherry的pUTL 2-mCherry空载体和pAN580-PpCAD同时转化到华南象草原生质体中,在共转化后的细胞中检测到大面积红色荧光信号,但是绿色荧光信号只在除了细胞膜和叶绿体的部分检测到(图2,B),说明PpCAD是细胞质蛋白。
2.3 PpCAD基因在烟草中的过表达
2.3.1 转基因烟草的PCR检测 本研究共得到27株转基因烟草植株,移栽4周后,提取成熟叶片DNA,并用位于载体插入位点两端引物PBA-F和PBA-R进行PCR扩增。结果表明(图3),27株转基因烟草中除了OEC8和OEC21外,其余25株都能扩增出与对照大小相同的片段,但是OEC1、OEC2、OEC3、OEC14、OEC17、OEC24和OEC27的扩增条带丰度较低,可能是由于含有目的基因的农杆菌以内生菌的形式存在于烟草植株内造成的假阳性现象,也可能是因为DNA模板浓度较低造成。除此之外的18个转基因烟草DNA都能扩增出期望大小的目的条带,而野生型WT不能扩增出条带,证明PpCAD基因整合到了烟草基因组中。
2.3.2 转基因烟草RT-PCR和Southern杂交检测挑选6个PCR阳性植株OEC4、OEC6、OEC12、OEC15、OEC16和OEC25进行RT-PCR检测,在转录水平上检测转基因烟草中目的基因的表达量,并以看家基因Actin作为内参,分析目的基因在不同转基因植株之间表达水平的差异。RT-PCR鉴定结果(图4,A)显示,OEC6反转录不能扩增出目的条带,而OEC12条带丰度最高,说明该植株的目的基因表达水平最高。同理,OEC25表达水平最低,而OEC4、OEC15、OEC16都有目的基因的表达,但表达水平略低于OEC12。用Bar基因探针对该6个植株进行Southern杂交后发现(图4,B),所有烟草植株都能杂交出目的条带,进一步证明目的基因存在于转基因烟草中。其中,OEC4、OEC12、OEC15和OEC16只有1条杂交带,说明目的基因以单拷贝的形式整合进烟草基因组中;而OEC6有4个杂交带,OEC25有2个杂交带,说明目的基因在这2个烟草植株中以多拷贝的形式存在。结合RT-PCR结果,OEC6没有目的基因表达和OEC25表达量低的原因可能是由于目的基因的多拷贝插入。

图3 转基因烟草植株的PCR检测M.DL2000;OEC1~OEC27.转基因烟草植株1~27;WT.野生型植株(阴性对照);CK+.pBA002-PpCAD质粒(阳性对照);下同Fig.3 PCR assays of N.tabacumtransgenic plantsM.DL2000;OEC1-OEC27.N.tabacumtransgenic plants No.1-27;WT.Wild type(Negative control);CK+.Plasmid of pBA002-PpCAD(Positive control);The same as below
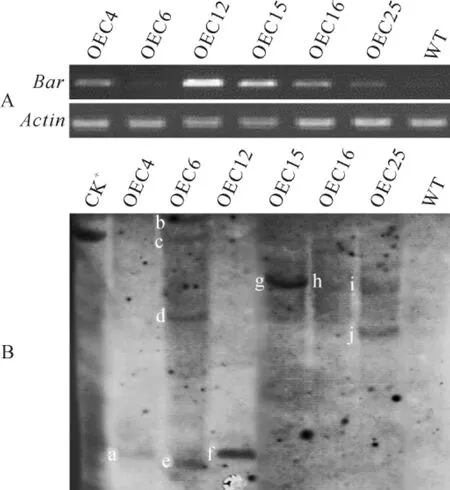
图4 转基因烟草植株RT-PCR(A)和Southern杂交检测(B)A.转基因植株RT-PCR检测;B.转基因植株Southern杂交:a~j.Southern杂交条带Fig.4 RT-PCR assays(A)and Southern blot(B)of N.tabacumtransgenic plants A.RT-PCR assays of transgenic plants;B.Southern blot of transgenic plants:a~j.Hybridization fragments of Southern blotting
2.3.3 转基因烟草木质素含量测定 6个转基因烟草植株的形态与对照相比没有明显差异(图5,A),说明在烟草中过表达PpCAD不影响植株表型。测定该6个植株茎秆木质素含量(图5,B),OEC15木质素含量最高,占样品干重31.17%,比野生型植株木质素含量(19.19%)提高了57.50%,且差异显著(P<0.05);OEC4、OEC12、OEC16和OEC25木质素含量与对照相比也有不同程度的提高,分别提高了45.32%、28.34%、35.79%和45.07%。但是,OEC6木质素含量只占样品干重18.97%,与对照相比差异不显著。结合RT-PCR和Southern杂交结果,推断可能是OEC6中Pp-CAD基因的多拷贝抑制表达而造成的。以上结果表明,PpCAD基因在烟草中的过量表达会在一定程度上提高植株木质素含量,也表明了PpCAD基因参与了植物木质素的合成。

图5 转基因烟草表型(A)与木质素含量测定(B)A.转基因烟草表型;B.溴乙酰法木质素含量测定,数据为木质素含量平均值±标准误;数值后不同小写字母表示材料间差异达显著水平(P<0.05)Fig.5 Phenotypes of N.tabacumtransgenic plants(A)and determination of lignin content(B)A.Photos of N.tabacumtransgenic plants;B.Lignin content determined by acetyl bromide method;All data were the mean values of lignin content±standard error;Different letters after the numbers denote that the difference is significance among materials(P<0.05)
3 讨 论
3.1 PpCAD蛋白定位于细胞质
通过原生质体为受体的瞬时表达系统,能够快速高效分析基因在植物细胞水平的表达特性,对蛋白质定位、蛋白质互作以及蛋白质动态变化分析有十分重要的意义[24]。蛋白质的亚细胞定位是理解植物的形态建成和生长发育的主要手段之一,同时也是功能基因组学的重要内容[26]。在本研究中,PpCAD蛋白与GFP组成的融合蛋白定位在原生质体细胞质中,说明PpCAD是一个细胞质蛋白。通常情况下,植物基因的定位信息存在于自身编码的某段氨基酸序列中,蛋白合成后再由精确的导向机制定位到细胞的特定位置[27]。PpCAD蛋白通过分子生物学预测后推断是一个没有定向序列的非分泌蛋白,而且预测定位于细胞质中[9],与本研究实际定位结果一致。但在孝顺竹(Bambusa multiplex)的亚细胞定位研究中却发现CAD蛋白只定位于洋葱表皮细胞的细胞核中[28],这可能是因物种差异造成的。同时,孝顺竹的CAD蛋白在洋葱表皮细胞表达,属于异源表达,而PpCAD蛋白的转化受体就是象草的原生质体,这可能也是造成定位差异的原因。
3.2 PpCAD基因在烟草中过表达提高了植株木质素含量
在烟草的遗传转化研究中,共得到了27株转基因烟草,其中25株为PCR鉴定的含有目的片段PpCAD的阳性植株,并选6株生长一致的烟草进行后续实验。半定量RT-PCR检测发现该6个植株PpCAD基因在叶片中的表达量有明显差异,Southern杂交检测发现目的基因为多拷贝插入时基因几乎不表达(如OEC6)。而当插入片段为单拷贝时,目的基因表达量较高(如OEC12),这也进一步证实了在转基因研究中基因多拷贝插入造成的沉默现象[29]。一般认为,转基因植株中目的基因的插入拷贝数和基因表达量呈负相关[30],本研究结论与之相同。
在本研究中,PpCAD基因在烟草中的过表达没有造成植株的表型变化,这与前人研究结果一致[31]。通过溴乙酰法测定转基因植株木质素含量后发现,RT-PCR检测PpCAD基因表达的植株中,木质素含量有不同程度提高。其中,OEC15植株茎杆木质素含量最高,比野生型提高了57.50%,最低的OEC12植株也提高了28.34%。孝顺竹CAD基因在水稻中过表达后发现,所有转基因植株木质素含量平均增幅达50%[28],与本研究结果类似。但是,腊梅(Chimonanthus praecox)CAD基因在烟草中过表达后,木质素含量最高只比对照提高了18.80%[31]。同样,银合欢(Leucaena leucocephala)CAD基因转化烟草后,木质素含量最高只提高了7.43%[32]。造成这种差异的原因有很多,首先,这与木质素的测定方法和测定时期有关[33];其次,木质素合成是一个复杂的过程,植物不同组织、器官和细胞内存在一个复杂而完善的代谢网络,且代谢的补偿机制不同[34];最后,可能是由于单子叶和双子叶植物CAD基因对木质素合成的贡献差异造成的[10],象草和孝顺竹同属于单子叶植物,而腊梅和迎合欢属于双子叶植物。当然,具体原因需要进一步实验证实。
Bona-fide CAD基因被认为直接参与了木质素的合成,先前的生物信息学分析推断PpCAD基因是一个Bona-fide CAD基因[9],本研究进一步证明了PpCAD确实与植物的木质素合成有关,说明PpCAD基因可以用于培育象草木质化改良新品种的研究。但是,CAD基因家族成员众多,而大部分CAD-like基因的功能未知[8,10]。有研究表明部分CAD-like基因在Bona-fide CAD基因缺失后表达量上调,补偿了木质素合成的功能,说明某些CAD-like基因可能也参与了木质素的合成[35]。所以,在进行木质素下调研究时,最好能够分析CAD基因家族中各成员的功能与关系,这样才能达到有效调控木质素合成的目的。
[1] WENG J K,CHAPPLE C.The origin and evolution of lignin biosynthesis[J].New Phytologist,2010,187(2),273-285.
[2] EUDES A,GEORGE A,MUKERJEE P,et al.Biosynthesis and incorporation of side-chain-truncated lignin monomers to reduce lignin polymerization and enhance saccharification[J].Plant Biotechnology Journal,2012,10(5):609-620.
[3] KAMDEE C,LMSABAI W,KIRK R,et al.Regulation of lignin biosynthesis in fruit pericarp hardening of mangosteen(Garcinia mangostana L.)after impact[J].Postharvest Biology and Technology,2014,97(11):68-76.
[4] LI Y CH(李尧臣),QI C K(戚存扣).Lignin content and key gene expression in lignin synthesis of Brassica napus L.with lodging resistance[J].Jiangsu Journal of Agricultural Sciences(江苏农业学报),2011,27(3):481-487(in Chinese).
[5] RAGAUSKAS A J,WILLIAMS C K,DAVISON B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311(5 760):484-489.
[6] HISANO H,NANDAKUMAR R,WANG Z Y.Genetic modification of lignin biosynthesis for improved biofuel production[J].In Vitro Cellular &Developmental Biology-Plant,2009,45(3):306-313.
[7] FU C,MIELENZ J R,XIAO X,et al.Genetic manipulation of lignin reduces recalcitrance and improves ethanol production from switchgrass[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(9):3 803-3 808.
[8] MA Q.Functional analysis of a cinnamyl alcohol dehydrogenase involved in lignin biosynthesis in wheat[J].Journal of Experimental Botany,2012,61(10):2 735-2 744.
[9] TANG R,ZHANG X Q,LI Y H,et al.Cloning and in silico analysis of a cinnamyl alcohol dehydrogenase gene in Pennisetum purpureum[J].Journal of Genetics,2014,93(1):145-158.
[10] GUO D,RAN J.WANG X.Evolution of the cinnamyl/sinapyl alcohol dehydrogenase(CAD/SAD)gene family:The emergence of real lignin is associated with the origin of bona fide CAD[J].Journal of Molecular Evolution,2010,71(3):202-218.
[11] TOBIAS C M,CHOW E K.Structure of the cinnamyl-alcohol dehydrogenase gene family in rice and promoter activity of a member associated with lignification[J].Planta,2005,220(5):678-688.
[12] HIRANO K,AYA K,KONDO M,et al.OsCAD2is the major CADgene responsible for monolignol biosynthesis in rice culm[J].Plant Cell Reports,2012,31(1):91-101.
[13] BAUCHER M,CHABBERT B,PILATE G,et al.Red xylem and higher lignin extractability by down-regulating acinnamyl alcohol dehydrogenase in poplar[J].Plant Physiology,1996,112(4):1 479-1 490.
[14] FU C,XIAO X,XI Y,et al.Downregulation of cinnamyl alcohol dhydrogenase(CAD)leads to improved saccharification efficiency in switchgrass[J].Bioenergy Research,2009,4(3):153-164.
[15] BAUCHER M,BERNARD-VAILHÉM A,CHABBERT B,et al.Down-regulation of cinnamyl alcohol dehydrogenase in transgenic alfalfa(Medicago sativa L.)and the effect on lignin composition and digestibility[J].Plant Molecular Biology,1999,39(3):437-447.
[16] HU K(胡 可),YAN X F(严雪锋),LI D(栗 丹),et al.Genetic improvement of perennial ryegrass with low lignin content by silencing genes of CCRand CAD[J].Acta Prataculturae Sinica(草业学报),2013,22(5):72-83(in Chinese).
[17] FORNALÉS,CAPELLADES M,ENCINA A,et al.Altered lignin biosynthesis improves cellulosic bioethanol production in transgenic maize plants down-regulated for cinnamyl alcohol dehydrogenase[J].Molecular Plant,2012,5(4):817-830.
[18] XIE X M(解新明),ZHAO Y H(赵燕慧),HUO S(霍 松),et al.Dynamic changes of enzyme activities related to lignin biosynthesis for elephant grass cultivars[J].Acta Agrestia Sinica(草地学报),2010,18(4):523-527(in Chinese).
[19] LI Y H(李有涵),TANG R(唐 然),XIE X M(解新明).Correlation of modular growth and biomass allocation of Pennisetumpurpureumcv.Huanan ramets[J].Chinese Journal of Ecology(生态学杂志),2011,30(9):1 875-1 880(in Chinese).
[20] MADAKADZE I C,MASAMVU T M,RADIOTIS T,et al.Evaluation of pulp and paper making characteristics of elephant grass(Pennisetum purpureumSchum.)and switchgrass(Panicum virgatumL.)[J].African Journal of Environmental Science and Technology,2010,4(7):465-470.
[21] ZHANG X F,ZHANG X H,GAO B,et al.Effect of cadmium on growth,photosynthesis,mineral nutrition and metal accumulation of an energy crop,king grass(Pennisetum americanum×P.purpureum)[J].Biomass &Bioenergy,2014,67:179-187.
[22] HUO S(霍 松),CHEN H(陈 慧),ZHU Q H(朱琼华),et al.Cloning of a 4CLgene fragment and construction of an RNAi expression vector of Pennisetum purpurerm[J].Acta Prataculturae Sinica(草业学报),2012,21(1):296-301(in Chinese).
[23] ZHU Q H,ZHANG X Q,HUO S,et al.Cloning and bioinformatic analysis of cinnamoyl-CoAreductase gene(CCR)from Pennisetum purpureum[J].Agricultural Science &Technology,2012,13(2):284-291,306.
[24] YANG J W,FU J X,LI J,et al.A novel co-immunoprecipitation protocol based on protoplast transient gene expression for studying protein-protein interactions in rice[J].Plant Molecular Biology Reporter,2014,32(1):153-161.
[25] XIE X M,ZHANG X Q,DONG Z X,et al.Dynamic changes of lignin contents of MT-1elephant grass and its closely related cultivars[J].Biomass &Bioenergy,2011,35(5):1 732-1 738.
[26] TU X T(屠煦童),ZHANG SH J(张仕杰),CHEN X Y(陈小云),et al.Cloning,subcellular localization and expression analysis of gibberellin2-oxidase gene in Diospyros kaki Linn.cv.Nantongxiaofangshi[J].Scientia Agricultura Sinica(中国农业科学),2015,48(1):197-206(in Chinese).
[27] EMANUELSSON O,VON HEIJNE G.Prediction of organellar targeting signals[J].Biochimica et Biophysica Acta(BBA)-Molecular Cell Research,2001,1 541(1-2):114-119.
[28] 章翠琴.孝顺竹木质素肉桂醇脱氢酶的功能研究[D].合肥:安徽农业大学,2013.
[29] GAO C,LONG D,LENK I,et al.Comparative analysis of transgenic tall fescue(Festuca arundinacea Schreb.)plants obtained by Agrobacterium-mediated transformation and particle bombardment[J].Plant Cell Report,2008,27(10):1 601-1 609.
[30] SHOU H,FRAME B R,WHITHAM S A,et al.Assessment of transgenic maize events produced by particle bombardment or Agrobacterium-mediated transformation[J].Molecular Breed,2004,13(2):201-208.
[31] 李志菜.腊梅肉桂醇脱氢酶基因CpCAD的克隆、表达特性分析及功能验证[D].重庆:西南大学,2013.
[32] L.SIRISHA V,PRASHANT S,RANADHERR KUMAR D,et al.Cloning,characterization and impact of up-and down-regulating subabul cinnamyl alcohol dehydrogenase(CAD)gene on plant growth and lignin profiles in transgenic tobacco[J].Plant Growth Regulation,2012,66(3):239-253.
[33] FUKUSHIMA R S,HATFIELD R D.Comparison of the acetyl bromide spectrophotometric method with other analytical lignin methods for determining lignin concentration in forage samples[J].Journal of Agricultural and Food Chemistry,2004,52(12):3 713-3 720.
[34] KIM S J,KIM K W,CHO M H,et al.Expression of cinnamyl alcohol dehydrogenase and their putative homologues during Arabidopsis thaliana growth and development:lessons for database annotations[J].Phytochemistry,2007,14(14):1 957-1 974.
[35] KIM S J,KIM M R,BEDGAR D L,et al.Functional reclassification of the putative cinnamyl alcohol dehydrogenase multigene family in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(6):1 455-1 460.
(编辑:宋亚珍)
Subcellular Localization of PpCADfrom Elephant Grass(Pennisetum purpureumcv.Huanan)and Its Heterologous Expression in Transgenic Tobacco
TANG Ran,ZHANG Boya,PENG Xiaoqun,ZHANG Xiangqian,JIANG Yuan,XIE Xinming*
(College of Forestry and Landscape Architecture,South China Agricultural University,Guangdong Engineering Research Center of Grassland Science,Guangzhou 510642,China)
In the present study,a vector of pAN580-PpCADwas constructed based on the cDNA sequence of PpCADgene from elephant grass(Pennisetum purpureumcv.Huanan),and transformed to elephant grass protoplasts by PEG-mediated method,attempting to figure out the subcellular localization of PpCAD protein.At the same time,the sense vector pBA002-PpCADwas constucted and overexpressed in tobacco by Agrobacterium-mediated method,aiming to study the relationship between PpCADand plant lignin biosynthesis.The results showed that:(1)PpCAD was located in the cytoplasm of elephant grass protoplasts.(2)27transgenic tobacco plants were obtained after transformed with overexpression vector pBA002-Pp-CAD,of which,25plants were identified positive by PCR.(3)The expression levels of 6transgenic plants were different after analyzed by semiquantitative RT-PCR.The Southern blot indicated the expression level was related to the insert copy number of target gene.(4)There was no obvious phenotype difference be-tween PpCADoverexpressed plants and wild type,but the lignin contents were increased in varying degrees among 6transgenic plants except OEC6.Compared with wild type,the maxium amplification rate of lignin content was 56.50%.This study demonstated that PpCAD was a cytoplasmic protein.Overexpression of PpCADin tobacco would lead to a increase of lignin content,which indicated that PpCADwas involve in plant lignin biosynthesis and it could be available for regulation of elephant grass lignin biosynthesis.
Pennisetum purpureum;lignin;PpCAD;subcellular localization;genitic transformation;tobacco
Q785;Q789
A
10.7606/j.issn.1000-4025.2015.06.1069
1000-4025(2015)06-1069-09
2015-03-06;修改稿收到日期:2015-05-12
国家自然科学基金(31272491,30972138);教育部高等学校博士学科点专项科研基金(20124404110011)
唐 然(1988-),男,在读博士研究生,主要从事牧草生物技术研究。E-mail:tangran@stu.scau.edu.cn
*通信作者:解新明,博士,教授,博士生导师,主要从事牧草生物技术及遗传资源研究。E-mail:xiexmbs@scau.edu.cn
