Ni/CeO2-Al2O3复合氧化物催化甲烷部分氧化制合成气的性能
2015-06-27余长林胡久彪樊启哲李家德
余长林,胡久彪,樊启哲,李家德,方 稳
(江西理工大学 冶金与化学工程学院,江西 赣州 341000)
Ni/CeO2-Al2O3复合氧化物催化甲烷部分氧化制合成气的性能
余长林,胡久彪,樊启哲,李家德,方 稳
(江西理工大学 冶金与化学工程学院,江西 赣州 341000)
采用柠檬酸络合法一步制备了Ni/CeO2-Al2O3复合氧化物催化剂。利用N2物理吸附、XRD、H2-TPR和SEM手段对催化剂进行了表征。考察了还原条件对该复合氧化物在甲烷催化部分氧化(POM)制合成气的催化性能的影响,进一步考察了原料气配比(V(CH4)/V(O2))、反应空速和反应温度对Ni/CeO2-Al2O3催化POM反应性能的影响。结果表明,Ni/CeO2-Al2O3复合氧化物的热稳定性好,比表面积较大(108 m2/g),其中的NiO容易被还原。在700℃、纯H2气氛下还原后的Ni/CeO2-Al2O3在POM反应中表现出最好的催化性能。最佳反应条件为V(CH4)/V(O2)=2、GHSV=12000 mL/(h·g)、反应温度750℃。在该反应条件下,POM反应的CH4转化率大于85%,CO选择性达到85%,H2选择性大于94%。
柠檬酸络合;CeO2-Al2O3复合氧化物;甲烷;部分氧化;还原
柠檬酸络合法在合成细小粉体颗粒、功能纳米材料、薄膜和电池电极材料方面的应用十分广泛[1-3]。柠檬酸易与金属离子络合,使金属离子以高分散状态均匀分散在溶胶-凝胶中;在凝胶焙烧过程中,柠檬酸被燃烧为气体而释放,从而形成大比表面积、孔道结构丰富的纳米材料。另外,柠檬酸络合法也可以用来制备纳米复合氧化物,所制备的复合氧化物具有分散均匀、产物粒径小的特点[4-6]。王磊等[5]利用柠檬酸络合法制备了La0.75Sr0.25Mn1-xNixO3+δ系列催化剂,并考察了该催化剂对甲烷部分氧化(POM)制合成气的催化性能。结果表明,柠檬酸络合法不仅能够在催化剂样品中产生钙钛矿结构,促进活性Ni扩散至钙钛矿晶格中,增强Ni的分散性能,而且还能释放出大量的晶格氧,促进CH4的催化氧化反应。余长林等[6]研究发现,采用柠檬酸络合法可制备CexTi1-xO2固溶体,该固溶体负载Co后在POM制合成气反应中表现出很高的活性和稳定性。该固溶体催化剂活性高的原因是载体之间形成了Ce-Ti固溶体,能够在一定程度上抑制非催化活性相CoTiO3的生成。
笔者采用柠檬酸络合法一步制备了Ni/CeO2-Al2O3复合氧化物催化剂,用于POM制合成气反应,探讨了还原条件、原料气体积比(V(CH4)/V(O2))、反应温度和反应空速对该反应的影响。
1 实验部分
1.1 催化剂制备
采用柠檬酸络合法一步制备Ni/CeO2-Al2O3复合氧化物催化剂。准确称取计量的硝酸镍(Ni(NO3)2·6H2O)、硝酸铈铵((NH4)2Ce(NO3)2)和硝酸铝(Al(NO3)3·9H2O),溶解于去离子水中形成均匀透明的溶液。另外称取计量的柠檬酸(C6H8O7)溶解于去离子水中,配制成溶液。搅拌下,将两溶液迅速混合,继续搅拌3 h,放入水浴锅内保持70℃老化12 h。置于烘箱内110℃干燥后充分研磨,转入马福炉中于700℃下焙烧4 h,即得到Ni/CeO2-Al2O3复合氧化物催化剂。催化剂中Ni的理论负载量为10%(质量分数),载体中n(Ce)/n(Al)=1。
制备催化剂所用试剂均为分析纯试剂,购自国药集团化学试剂有限公司。
1.2 催化性能评价
采用天津先权公司WSFM-3060型催化剂装置评价催化剂活性。反应器为内径6 mm的石英管,催化剂用量0.15 g。反应前,在不同温度下,以20 mL/min通入纯H2或N2-H2混合气体,还原1 h。还原结束,采用高纯N2吹扫反应装置20 min,以除去催化剂样品表面吸附和装置内残余的H2。调整至反应温度,并通入CH4-O2混合气,常压下进行POM制合成气反应。反应10 min取样,然后每隔30 min取样,总反应时间为190 min。气样经硅胶除水后,采用GC-2060型气相色谱仪测定其组成,TDX-01填充色谱柱,热导检测器,高纯N2作载气。由气样组成计算CH4转化率、CO和H2选择性[7]。
1.3 催化剂表征
采用北京金埃谱科技有限公司V-Sorb 2800P型比表面积分析仪进行N2物理吸附实验,并结合BET方程计算催化剂的比表面积。采用Bruker D8型X射线衍射仪获取样品的XRD谱,CuKα,λ=0.15406 nm,2θ扫描范围10°~80°,管电压30 kV,管电流15 mA。采用天津先权公司TP-5080化学吸附仪进行样品的H2-程序升温还原测定(TPR),热导池检测,样品装载量50 mg,测试前用N2在300℃下吹扫0.5 h,然后降至室温,切换成流量30 mL/min的N2-H2混合气(其中H2体积分数为10%),待基线平稳,开始程序升温还原,升温速率10 ℃/min。采用美国FEI公司Nova Nano SEM230型扫描电镜仪获取样品的SEM照片。
2 结果与讨论
2.1 Ni/CeO2-Al2O3复合氧化物的物相和比表面积
图1为Ni/CeO2-Al2O3复合氧化物的XRD谱。从图1可见,在2θ为28.5°、33.2°、47.8°和56.7°处呈现较强的衍射峰,依次对应于立方萤石CeO2的(111)、(200)、(220)和(311)晶面的特征衍射峰[8],没有发现Al2O3的特征衍射峰,这是由于Al2O3的衍射峰通常比较弱或者Al2O3处于无定型态。另外,由于Al3+半径(0.054 nm)小于Ce4+半径(0.087 nm),Al3+容易扩散至CeO2的晶格内可能形成复合氧化物。在Ni/CeO2-Al2O3复合氧化物样品中,尽管Ni的质量分数达到10%,但并未检测到NiO的特征衍射峰,说明NiO在Ni/CeO2-Al2O3复合氧化物中处于高分散状态。样品的N2物理吸附测试表明,Ni/CeO2-Al2O3虽然经过700℃焙烧4 h,但仍然具有比较大的比表面积(108 m2/g)。表明该柠檬酸络合法制得的Ni/CeO2-Al2O3复合氧化物具有较好的热稳定性,在高温焙烧后能保持较好的组织结构。

图1 Ni/CeO2-Al2O3复合氧化物的XRD谱
2.2 Ni/CeO2-Al2O3复合氧化物的形貌
图2为Ni/CeO2-Al2O3复合氧化物的SEM照片。由图2可见,制备的Ni/CeO2-Al2O3复合氧化物表面粗糙,没有规则形貌,但具有丰富的孔洞结构。这些孔洞是由焙烧过程中复合氧化物前驱体中的柠檬酸燃烧释放CO2时所生成。

图2 Ni/CeO2-Al2O3复合氧化物的SEM照片
2.3 Ni/CeO2-Al2O3复合氧化物的还原性质
图3为Ni/CeO2-Al2O3复合氧化物的H2-TPR谱。由图3可见,Ni/CeO2-Al2O3复合氧化物具有2个还原峰。230~450℃低温还原峰可归为NiO的还原和CeO2的表面晶格氧的耗氢,与Yao等[9]、Yu等[10]得到的Al2O3负载CeO2的低温还原峰出现在470℃附近的结果较为一致;670℃以上的高温还原峰的归属还不很清楚,可能为复合氧化物在焙烧过程中生成的少量CeAlO3[10]或NiAl2O4[11]被还原所引起。WANG等[12]发现,纯NiO和Ni/CeO2的还原峰温分别在410℃和400℃附近;邱业君等[13]发现,以Al2O3载体负载Ni的还原峰温为600℃左右;而本实验中采用柠檬酸络合法制备的Ni/CeO2-Al2O3复合氧化物中的NiO的还原峰温低于450℃,说明该复合氧化物中的NiO比较容易被还原。

图3 Ni/CeO2-Al2O3复合氧化物的H2-TPR曲线
2.4 Ni/CeO2-Al2O3催化POM制合成气反应的影响因素
2.4.1 还原气氛的影响
在Ni/CeO2-Al2O3催化剂中,POM的活性中心主要为裸露的金属态Ni0粒子,而Ni0粒子的数量取决于NiO被还原的程度。考察了纯H2和V(H2)/V(N2)=1的N2-H2混合气2种还原气氛对Ni/CeO2-Al2O3催化POM反应性能的影响,结果列于表1。由表1可知,在不同气氛中还原的Ni/CeO2-Al2O3对POM反应的催化活性表现出较大的差异,但CO和H2选择性相差不大。与纯H2相比,N2-H2混合气中H2的含量相对较低,可能会降低复合氧化物中氧化镍物种(Niδ+)被还原成活性Ni0的程度,从而减少了催化活性中心Ni0粒子的数目,降低了CH4转化率。采取纯H2气氛对Ni/CeO2-Al2O3催化剂进行还原能提高其POM催化活性。

表1 还原气氛对Ni/CeO2-Al2O3催化POM性能的影响
T=750℃;V(CH4)/V(O2)=2; GHSV=12000 mL/(h·g);t=3 h
2.4.2 还原方式的影响
常见的催化剂还原方式主要有程序升温还原(TPR,也称全程还原)和恒温还原(CTR,亦称半程还原)。表2为Ni/CeO2-Al2O3的还原方式对其催化POM反应性能的影响。从表2可见,采用TPR还原的Ni/CeO2-Al2O3催化POM反应的CH4转化率及CO和H2选择性均比采用CTR还原的要高。在TPR过程中,升温的同时通入H2,可以使Ni/CeO2-Al2O3中的NiO逐步被H2还原,生成分散更均匀的Ni0颗粒,可以防止高温下由于NiO迅速被还原成Ni0颗粒而发生聚集和长大,而大的Ni0颗粒往往不利于POM反应的进行。

表2 Ni/CeO2-Al2O3还原方式对其催化POM反应性能的影响
T=750℃;V(CH4)/V(O2)=2; GHSV=12000 mL/(h·g);t=3 h
2.4.3 还原温度的影响
还原温度将影响Ni/CeO2-Al2O3的还原程度和还原后生成的Ni0颗粒的分散状态。表3为还原温度对Ni/CeO2-Al2O3催化POM反应性能的影响,同时给出未经还原样品的催化性能。由表3可知,未经还原的Ni/CeO2-Al2O3催化POM反应的CH4转化率比550℃还原的Ni/CeO2-Al2O3所得CH4转化率还高,这可能是由于Ni/CeO2-Al2O3中部分Niδ+物种被CH4裂解出的表面吸附氢还原,并转化为活性中心Ni0的缘故;随着还原温度的升高,还原Ni/CeO2-Al2O3催化POM反应的CH4转化率及CO和H2选择性逐渐升高,在还原温度达到700℃时,得到最高的CH4转化率和产物选择性;继续升高还原温度至750℃,还原Ni/CeO2-Al2O3的催化活性略有下降。较低温度(550℃)可能只还原部分的NiO,生成数量较少的活性中心Ni0;而当还原温度升高到750℃,尽管NiO可以被充分还原,但高温可使还原生成Ni0颗粒聚集长大,从而不利于催化性能的提高。

表3 还原温度对Ni/CeO2-Al2O3催化POM反应性能的影响
T=750℃;V(CH4)/V(O2)=2; GHSV=12000 mL/(h·g);t=3 h
2.4.4 原料V(CH4)/V(O2)的影响
图4为原料V(CH4)/V(O2)对Ni/CeO2-Al2O3催化POM反应性能的影响。当V(CH4)/V(O2)=1.0时,CH4转化率为91.6%,随V(CH4)/V(O2)增大,CH4转化率降低。相反,CO和H2选择性均随V(CH4)/V(O2)增大而缓慢升高。增大V(CH4)/V(O2)使反应气体中O2的含量下降,造成催化剂表面吸附态氧分子的含量降低,CH4分子产生有效碰撞和发生反应的频率随之降低;另外,O2含量的减少间接地阻碍体系中CH4完全燃烧的进程,并抑制CO和H2被氧化成CO2和H2O,使CO和H2的选择性升高。Ann等[14]发现,过高的V(CH4)/V(O2)容易导致积炭的发生。

图4 V(CH4)/V(O2)对Ni/CeO2-Al2O3催化POM反应性能的影响
2.4.5 反应温度的影响
图5为反应温度对Ni/CeO2-Al2O3催化POM反应性能的影响。由图5可见,CH4转化率及CO和H2选择性均随反应温度的升高而增加。可将POM反应分为3个区间,(1)非引发区,温度在400℃以下,CH4未发生反应,催化剂的活性基本为零;(2)完全燃烧区,温度介于400~550℃之间,主要发生CH4的燃烧反应,CH4转化率大约为26%,CO和H2选择性近乎为零,反应的主产物为CO2和H2O;(3)部分氧化区,温度达到550℃以上,CH4发生部分氧化反应生成CO和H2,催化剂的活性随温度的升高而逐渐增加。本实验中诱发甲烷发生POM反应的温度为550℃左右。Lanza等[15]研究Pt-Ru双贵金属催化剂上的POM反应,发现其诱发温度在580℃左右。可见,本实验中POM的诱发温度相对较低。

图5 反应温度(T)对Ni/CeO2-Al2O3催化POM反应性能的影响
2.4.6 反应空速的影响
图6为反应空速对Ni/CeO2-Al2O3催化POM反应性能的影响。由图6可知,CH4转化率﹑CO和H2选择性随反应空速的升高而降低,但CO2选择性的变化刚好相反。这是由于反应空速的增大缩短了CH4分子在催化剂表面的滞留时间,抑制了反应物分子间有效碰撞的延续性,致使CH4在裂解前就与O2进行燃烧反应,产生CO2和H2O,随后迅速脱离催化剂床层而成为终产物,使CH4转化率及CO和H2选择性逐渐降低。POM反应机理为通常分为直接氧化和燃烧-重整机理,它们本质的差异为反应的一级产物是否为CO。前者的一级产物是CO,后者的一级产物则是CO2。因此,可以根据CO的选择性随空速增大的变化规律而粗略地推断该反应中的POM反应机理。CO2的选择性随空速的增大而增大,说明反应的一级产物是CO2,而非CO。这可能造成未反应的CH4不能及时与CO2和H2O进行重整反应,就已脱离催化剂床层而成为终产物,阻碍了CO的产生,使CO2的选择性增大。因此,该POM反应可能遵循燃烧-重整机理。

图6 反应空速(GHSV)对Ni/CeO2-Al2O3催化POM反应性能的影响
2.5 Ni/CeO2-Al2O3催化POM反应的稳定性
在纯H2气氛中,对Ni/CeO2-Al2O3进行程序升温至700℃还原,在V(CH4)/V(O2)=2、GHSV=12000 mL/(h·g)、T=750℃的反应条件下,考察Ni/CeO2-Al2O3催化剂的稳定性。POM反应的CH4转化率及CO和H2选择性随时间的变化如图7所示。由图7可知,在整个反应过程中,CH4转化率及CO和H2选择性始终分别维持在85.2%、86.8%和94.8%,表明Ni/CeO2-Al2O3具有较高的催化稳定性。
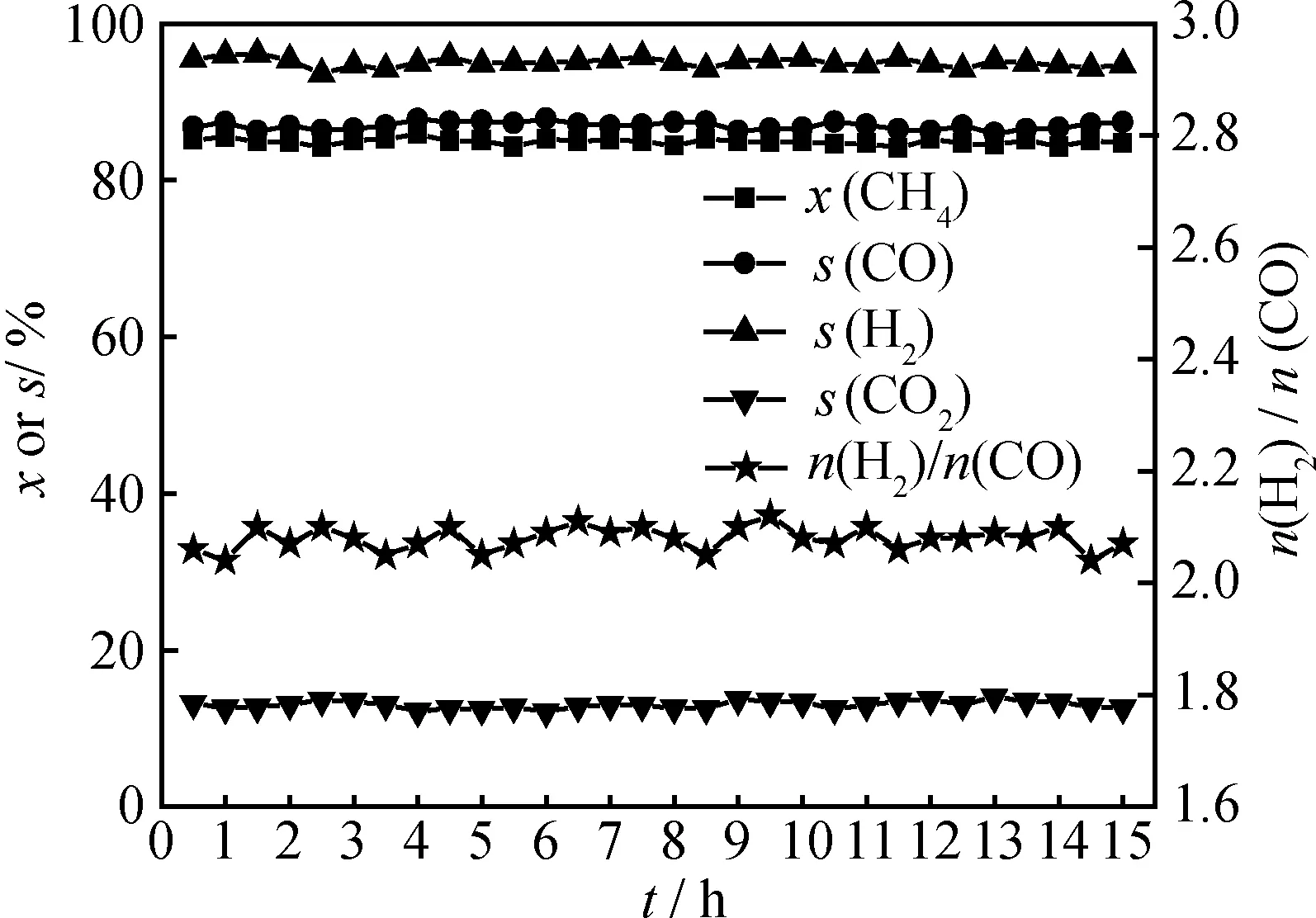
图7 Ni/CeO2-Al2O3催化POM反应的稳定性
3 结 论
(1)以柠檬酸络合法一步制备了Ni/CeO2-Al2O3复合氧化物催化剂。该复合氧化物具有较大的比表面积(108 m2/g)和较低的NiO还原温度。
(2)Ni/CeO2-Al2O3复合氧化物的还原条件对其在POM反应中的催化性能有较大的影响。在纯H2气氛中程序升温至700℃还原后的Ni/CeO2-Al2O3的催化性能最好。
(3)Ni/CeO2-Al2O3催化POM反应的最优工艺参数为V(CH4)/V(O2)=2、GHSV=12000 mL/(h·g)、T=750℃。在此反应条件下,POM反应的CH4转化率和产物选择性较高,Ni/CeO2-Al2O3也表现出较好的催化活性稳定性。
[1] 李意峰, 黄剑锋, 曹丽云, 等. 柠檬酸络合法制备La2CuO4纳米晶[J]. 无机化学学报, 2011, 27(11): 2157-2161. (LI Yifeng, HUANG Jianfeng, CAO Liyun, et al. Preparation of La2CuO4nanocrystallites by citric acid chelating process [J]. Chinese Journal of Inorganic Chemistry, 2011, 27(11): 2157-2161.)
[2] 张媛, 李增喜, 闻学兵, 等. 柠檬酸络合法制备NiO-CeO2-TiO2复合氧化物及其在甲烷部分氧化反应中的应用[J]. 催化学报, 2005, 26(12): 1059-1066. (ZHANG Yuan, LI Zengxi, WEN Xuebing, et al. Partial oxidation of methane over NiO-CeO2-TiO2catalysts prepared by citric acid method [J]. Chinese Journal of Catalysis, 2005, 26(12):1059-1066.)
[3] 严涵, 朱秀芳, 钟秦, 等. EDTA-柠檬酸络合法制备阳极催化剂La0.7Sr0.3Cr0.87Y0.13O3-δ及热力学分析[J]. 中国有色金属学报, 2013, 23(1):141-146. (YAN Han, ZHU Xiufang, ZHONG Qin, et al. Synthesis and thermodynamic analysis of La0.7Sr0.3Cr0.87Y0.13O3-δprepared by EDTA-citrate complexing method [J]. The Chinese Journal of Nonferrous Metals, 2013, 23(1): 141-146.)
[4] 陈全亮, 陈茂龙, 毛少瑜, 等. 柠檬酸法制备复合氧化物材料的配位结构化学[J]. 中国科学:化学,2011, 41(4): 645-653. (CHEN Quanliang, CHEN Maolong, MAO Shaoyu, et al. Progress in coordinated structural chemistry to citrate process [J]. Scientia Sinica Chimica. 2011, 41(4): 645-653.)
[5] 王磊, 曾少华, 张丽娟, 等. La0.75Sr0.25Mn1-xNixO3+δ材料的制备及其催化甲烷部分氧化性能[J]. 催化学报, 2009, 30(3): 247-253. (WANG Lei, ZENG Shaohua, ZHANG Lijuan, et al. Preparation of La0.75Sr0.25Mn1-xNixO3+δmaterials and their catalytic performance for methane partial oxidation [J]. Chinese Journal of Catalysis, 2009, 30(3): 247-253.)
[6] 余长林, 周晓春, 胡久彪, 等. Co/CexTi1-xO2催化剂的制备及其对甲烷部分氧化反应催化性能[J]. 石油学报(石油加工), 2013, 29(6): 966-974. (YU Changlin, ZHOU Xiaochun,HU Jiubiao, et al. Preparation of Co/CexTi1-xO2catalysts and their catalytic performance in catalytic partial oxidation of methane [J]. Acta Petrolei Sinica (Petroleum processing Section), 2013, 29(6): 966-974.)
[7] 余长林, 胡久彪, 翁维正, 等. Co/Ce0.5Zr0.5O2催化剂的制备及甲烷部分氧化制合成气[J]. 燃料化学学报, 2012, 40(4): 418-423. (YU Changlin, HU Jiubiao, WENG Weizheng, et al. Preparation of Co/Ce0.5Zr0.5O2catalysts and their catalytic performance in methane partial oxidation to produce synthesis gas [J]. Journal of Fuel Chemistry and Technology, 2012, 40(4): 418-423.)
[8] MAK A C, YU C L, YU J C, et al. A lamellar ceria structure with encapsulated platinum nanoparticles [J]. Nano Res, 2008, 1(6): 474-482.
[9] YAO H C, YAOYU Y F. Ceria in automotive exhaust catalysts: I Oxygen storage [J]. J Catal, 1984, 86(2): 254-265.
[10] YU C L, GE Q J, XU H Y, et al. Effects of Ce addition on the Pt-Sn/γ-Al2O3catalyst for propane dehydrogenation to propylene [J]. Appl Catal A, 2006, 315: 58-67.
[11] 吴延华, 李少斌, 严前古. Ni与Al2O3相互作用对甲烷部分氧化制合成气Ni/Al2O3催化剂上积炭性能的影响[J]. 催化学报, 2001, 22(5): 501-504. (WU Yanhua, LI Shaobin, YAN Qiangu. Effect of interaction between nickel and alumina on coke deposition on Ni/Al2O3catalyst for partial oxidation of methane to syngas [J]. Chinese Journal of Catalysis, 2001, 22(5): 501-504.)
[12] WANG Luhui, ZHANG Shaoxing, LIU Yuan. Reverse water gas shift reaction over Co-precipitated Ni-CeO2catalysts [J]. Journal of Rare Earths, 2008, 26(1): 66-70.
[13] 邱业君, 陈吉祥, 张继炎. MgO助剂对甲烷部分氧化Ni/Al2O3催化剂结构和性能的影[J]. 燃料化学学报, 2006, 34(4): 450-455. (QIU Yejun, CHEN Jixiang, ZHANG Jiyan. Effects of MgO promoter on properties of Ni/Al2O3catalysts for partial oxidation of methane to syngas [J]. Journal of Fuel Chemistry and Technology, 2006, 34(4): 450-455.)
[14] ANN M DE G, GILBERT F F. The role of coke formation in catalytic partial oxidation for synthesis gas production [J]. Catal Today, 1997, 37(3): 309-329.
[15] LANZA R, CANU P, JARAS S G. Methane partial oxidation over Pt-Ru catalyst: An investigation on the mechanism [J]. Appl Catal A, 2010, 375(1): 92-100.
Catalytic Performance of Ni/CeO2-Al2O3Composite Oxide in Partial Oxidation of Methane to Produce Synthesis Gas
YU Changlin, HU Jiubiao, FAN Qizhe, LI Jiade, FANG Wen
(SchollofMetallurgyandChemicalEngineering,JiangxiUniversityofScienceandTechnology,Ganzhou341000,China)
A Ni/CeO2-Al2O3composite oxide catalyst was prepared by a single-step citric acid complexation method. The produced composite oxide was characterized by means of N2physical adsorption, XRD, H2-TPR and SEM. The effects of reduction conditions on the catalytic performance of the composite oxide catalyst in catalytic partial oxidation of methane (POM) to synthesis gas were investigated. The investigation in the influences ofV(CH4)/V(O2), gas hourly space velocity and reaction temperature on the catalytic performance of Ni/CeO2-Al2O3was carried out. The results showed that the prepared Ni/CeO2-Al2O3composite oxide exhibited high thermal stability and large specific surface area (108 m2/g). Moreover, NiO in the composite oxide was easy to be reduced. The Ni/CeO2-Al2O3reduced by temperature-program method at 700℃ in pure H2exhibited the best catalytic performance in POM reaction. The optimum POM reaction conditions were as following,V(CH4)/V(O2)=2, GHSV=12000 mL/(h·g),T=750℃, under which Ni/CeO2-Al2O3exhibited high catalytic activity and high selectivity to products with the methane conversion of larger than 85% and the selectivities of 85% for CO and 94% for H2.
citric acid complexation; CeO2-Al2O3composite oxide; methane; partial oxidation; reduction
2013-12-09
国家自然科学基金项目(21067004, 21263005)、江西省自然科学基金青年科学计划(20133BAB21003)、江西省青年科学家培养对象计划(20122BCB23015)、江西省教育厅高等学校科技落地计划项目(KJLD14046)、2014江西省研究生创新资金项目(3104000089,3104100013)和2013江西理工大学研究生创新资金项目(3104100039)资助
余长林, 男,教授,博士,主要从事纳米催化新材料研究; Tel:0797-8312334;E-mail: yuchanglinjx@163.com
1001-8719(2015)01-0056-06
TQ032;O643
A
10.3969/j.issn.1001-8719.2015.01.009
