5,7,4'-三羟基取代黄酮化合物与牛血清白蛋白的相互作用
2015-06-27王琳琳朱靖博寇自农杨荣荣
王琳琳, 朱靖博,2, 寇自农, 丁 燕,2, 杨荣荣
5,7,4'-三羟基取代黄酮化合物与牛血清白蛋白的相互作用
王琳琳1, 朱靖博1,2, 寇自农3, 丁 燕1,2, 杨荣荣1
(1.大连工业大学食品学院,辽宁大连 116034; 2.大连工业大学植物资源化学与应用研究所,辽宁大连 116034; 3.大连工业大学实验仪器中心,辽宁大连 116034)
利用荧光光谱法与紫外光谱法研究5,7,4'-三羟基取代类黄酮化合物芹菜素、柚皮素和染料木素与牛血清白蛋白(BSA)的结合,探讨了C环氢化及取代位置对其与BSA相互作用的影响。结果表明,3种化合物对BSA内源性荧光均有猝灭作用,且猝灭类型为静态猝灭;3种化合物与BSA的结合位点约为1,在295 K条件下,与BSA结合由强到弱顺序为芹菜素、染料木素、柚皮素,结合常数分别为1.269× 107、3.011×105和1.342×105L/mol;芹菜素主要通过氢键与范德华力与BSA结合,柚皮素和染料木素主要通过静电作用与BSA结合;说明具有相同A环与B环结构的黄酮化合物,C环氢化后削弱其与BSA的作用,B环连接在C-2位置上与BSA的结合作用更强。3种化合物的加入均改变了BSA酪氨酸残基与色氨酸残基的微环境;同时也改变了蛋白质的二级结构与氨基酸残基,与BSA均形成了复合物。
5,7,4'-三羟基取代黄酮化合物;芹菜素;柚皮素;染料木素;牛血清白蛋白;荧光光谱法;紫外光谱法
0 引 言
黄酮化合物是一类植物中分布很广而且重要的多酚类天然产物,具有重要的药理活性[1],化学结构中具有C6—C3—C6的基本骨架。黄酮类广泛的生物活性与其化学结构的多样性有紧密的联系,其中5,7,4'-三羟基取代类黄酮化合物是黄酮类化合物中重要的代表,根据C环的结构与取代基位置的不同,作者选取3种化合物为研究对象,分别为5,7,4'-三羟基黄酮(芹菜素)、5,7,4'-三羟基二氢黄酮(柚皮素)与5,7,4'-三羟基异黄酮(染料木素)(见图1),化学结构的异同影响其与牛血清白蛋白的相互作用[2]。
黄酮类化合物可以与蛋白或者其他大分子物质发生特异性结合。人血白蛋白是人血液中非常重要的载体蛋白,可与多种内源性与外源性药物结合并运送到身体的各部位发挥药效[3-4]。白蛋白本身是一种具有内源性荧光的大分子物质,一些药物小分子与其结合后会引起蛋白本身的吸收与发射光谱的特异性变化[5-7],荧光光谱法与紫外光谱法可以快捷有效地反映小分子与白蛋白的作用情况,目前已用光谱法研究了槲皮素[8]、芦丁[9]、金丝桃苷[10]、橙黄决明素[11]和丹参素[12]等与牛血清白蛋白的相互作用。本文以荧光光谱法与紫外光谱法为主要研究方法,通过探究5,7,4'-三羟基取代类黄酮化合物对牛血清白蛋白的荧光猝灭机理、结合位点数、结合常数、热力学参数及作用力的类型、对肽链及氨基酸残基微环境的影响及与白蛋白是否结合成复合物等方面,研究了这3种化合物与牛血清白蛋白相互作用的联系与区别。

图1 芹菜素、柚皮素与染料木素的结构Fig.1 Structures of apigenin,naringenin and genistein
1 实 验
1.1仪器与试剂
LS-55型荧光光度计,美国PE公司; UV2101PC紫外-可见分光光度计,上海Unico公司;芹菜素标准品,上海源叶生物有限公司;柚皮素标准品,北京百灵威科技有限公司;染料木素标准品,大连博迈科技发展有限公司;以上标准品均用无水甲醇配制成2.90×10-4mol/L;牛血清白蛋白(Sigma公司)用p H 7.4的Tris-HCL缓冲液配制成5.0×10-5mol/L的储备液;其他试剂均为分析纯,实验室用水为超纯水。
1.2实验方法
1.2.1 荧光光谱
分别移取0.5 m L BSA储备液于10 m L刻度试管中,依次加入不同体积的标准品溶液,用Tris-HCL缓冲液定容至5 m L,混合均匀并静置5 min。以280 nm为激发波长,激发和发射狭缝分别为5.0、2.5 nm,扫描速度为600 nm/min,在荧光光谱仪上记录285~500 nm波长范围内的发射波长;固定Δλ=15 nm或Δλ=60 nm,记录标准溶液与BSA作用的同步荧光光谱。
1.2.2 紫外光谱
分别移取0.5 m L BSA储备液于10 m L刻度试管中,依次加入不同体积的标准品溶液,用Tris-HCL缓冲液定容至5 m L,混合均匀并静置5 min,在紫外分光光度计上,以Tris-HCL缓冲液为对照品进行紫外光谱扫描。
2 结果与讨论
2.13种黄酮类化合物对BSA荧光的猝灭
BSA分子中因含有色氨酸、酪氨酸等氨基酸残基,在280 nm激发下能产生较强的内源荧光[13]。如图2所示,室温下,在保持BSA浓度固定不变的情况下,随着3种化合物浓度的逐渐增加,BSA的内源性荧光强度均逐渐降低,最大发射波长及峰形保持不变。这表明,这3种化合物与BSA发生了相互作用,可以猝灭BSA的荧光。在相同浓度下,柚皮素与染料木素对BSA荧光强度的猝灭程度相近,当浓度达到20.30μmol/L时,这2种化合物与BSA作用后的荧光强度达到219.46和193.89,而芹菜素对BSA的荧光强度猝灭较明显,在浓度为20.30μmol/L时,其与BSA作用后的荧光强度达到96.6。这表明,在羟基取代位置及A环与B环结构相同的情况下,相同浓度的黄酮类化合物对BSA的猝灭作用最强,异黄酮类其次,二氢黄酮最弱。

图2 3种黄酮类化合物对BSA荧光的猝灭作用Fig.2 Effects of three flavonoids on fluorescence spectra of BSA
外源性物质对BSA内源性荧光猝灭有静态与动态两种方式。通常认为,分子间的有效碰撞和电子转移过程是引起动态猝灭的主要原因,温度的升高加速了分子间的有效碰撞,使动态猝灭常数增大。若是静态猝灭,温度升高降低配合物的稳定性,使猝灭常数减小。动态猝灭过程遵循Stern-Volmer方程[14]:
F0/F=1+Kqτ0[Q]=1+KSV[Q](1)其中,F0与F分别是未加入与加入猝灭剂时BSA的荧光强度;[Q]为药物总浓度;Kq为猝灭速率常数,各类猝灭剂对生物大分子的最大猝灭速率常数为2.0×1010L/(mol·s);τ0为猝灭剂不存在时荧光分子的平均寿命,一般约为10-8s; KSV为动态猝灭常数。
根据方程(1),绘制了在295、305及315 K下的Stern-Volmer方程曲线图,如图3所示。从各图中可以看出,随着温度的增高,斜率均逐渐降低。由方程(1)计算得到的不同温度下的3种物质的KSV与Kq如表1所示,可看出KSV随着温度的升高而减小,且Kq均大于最大碰撞猝灭速率常数2.0×1010L/(mol·s)。由此可以推断,引起猝灭的原因是这3种黄酮类化合物分别与BSA发生了相互作用,对BSA内源性荧光猝灭过程应为静态猝灭。

表1 不同温度下芹菜素、柚皮素、染料木素与BSA体系的KSV与KqTab.1 Stern-Volmer KSVand Kqof the BSA-apigenin, naringenin and genistein interaction at different temperatures

图3 不同温度下3种黄酮类猝灭BSA的Stern-Volmer图Fig.3 Stern-Volmer plots for quenching of BSA fluorescence by three flavonoids at different temperatures
2.23种黄酮类化合物与BSA结合常数与结合位点数的确定
静态猝灭作用是指荧光分子与荧光猝灭剂之间借助分子间作用力,彼此结合成具有一定结构的复合物,而导致荧光体系荧光强度的减弱[15],用静态猝灭公式计算结合常数与结合位点数:
lg[(F0-F)/F]=lg KA+n lg[Q](2)其中,KA是结合常数,n是结合位点数。根据公式(2)处理数据,以lg[(F0-F)/F]对lg[Q]作图可得一直线,如图4所示。根据斜率与截距可计算得到结合常数KA与结合位点数n,如表2所示。3种化合物的结合为点数n均约为1,表明每个BSA分子可结合1个黄酮化合物分子。3种化合物的KA随温度的变化不大,可推断出化合物与BSA之间已形成稳定的复合物,且3种黄酮类化合物与BSA结合的强弱顺序为芹菜素、染料木素、柚皮素。可见,A环与B环结构相同的黄酮化合物,C环氢化后削弱其与BSA的作用,B环连接在C-2位置比连接在C-3位置时与BSA的结合高出2个数量级。

图4 3种黄酮类化合物在不同温度下猝灭BSA的lg[(F0-F)/F]对lg[Q]图Fig.4 Plots of lg[(F0-F)/F]versus lg[Q]for three flavonoids quenching effect on BSA fluorescence different temperatures

表2 不同温度下的结合常数KA与结合位点数nTab.2 Binding constant KAand the number of binding sites n at different temperatures
2.3 3种黄酮类化合物与BSA结合的热力学分析和结合力类型的确定
在配体-蛋白质结合的过程中,主要有4种非共价相互作用力:氢键作用力、范德华力、疏水作用力和静电作用力。不同药物与蛋白质结合力的类型是不同的,可根据化合物与蛋白质反应前后的焓变ΔH和熵变ΔS来判断二者间的主要作用力,在温度变化范围不大的情况下,ΔH可看作一个常数。可根据公式(3)和(4)来计算,计算结果见表3。

其中,K是相应温度下的结合常数,R是气体常数,T是绝对温度。

表3 芹菜素、柚皮素和染料木素与BSA相互作用的热力学参数Tab.3 Thermodynamic parameters of interaction of the three flavonoids and BSA
当ΔS>0,ΔH>0为典型疏水作用力;ΔH<0,ΔS<0时为氢键和范德华力;ΔH<0,ΔS>0时,主要存在静电相互作用。由表3可知,3种化合物与BSA反应的ΔG均小于0,这说明芹菜素、柚皮素和染料木素与BSA的结合是一个放热反应,是一个自发进行的过程。其中,芹菜素与BSA的反应过程中,ΔH<0,ΔS<0,表明二者之间的作用力主要是氢键与范德华力;柚皮素与BSA的反应过程中,ΔH<0,ΔS>0,表明二者之间的作用力主要是静电作用;染料木素与BSA的反应过程中,ΔH<0,ΔS>0,表明二者之间的作用力主要是静电作用。
2.4 3种黄酮类化合物的同步荧光光谱
同步荧光法研究化合物对蛋白质构象的影响。BSA中含有的色氨酸、酪氨酸与苯丙氨酸可以发射内源性荧光,通常情况下,Δλ=15 nm时得到的荧光光谱反应的是蛋白质酪氨酸残基的光谱特征,Δλ=60 nm时得到的是色氨酸残基的光谱特征。这3种黄酮类化合物与BSA结合的同步荧光光谱如图5所示。由图5可知,这3种化合物与BSA体系的同步荧光光谱呈现相同的规律。随着化合物浓度的增加,酪氨酸的最大发射波长发生了微弱的蓝移,蓝移1 nm,而色氨酸的最大发射波长发生明显红移,红移2 nm。这表明3种黄酮类化合物的加入改变了BSA酪氨酸残基的微环境,使其极性增大,同时也改变了色氨酸残基的微环境,使其极性减小,引起了蛋白质构象的变化。
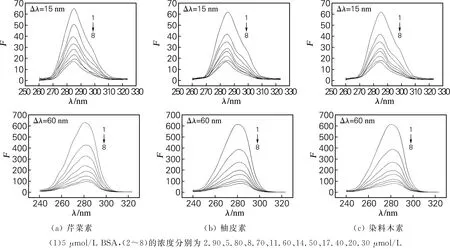
图5 芹菜素、柚皮素及染料木素-BSA体系的同步荧光光谱Fig.5 Synchronous fluorescence spectra of apigenin,naringenin,genistein-BSA systems
2.53种黄酮类化合物的紫外光谱
紫外-分光光谱法是检测化合物与BSA是否形成复合物的有效方法,可研究小分子对蛋白质二级结构的影响。吸收波长在190~230 nm的紫外吸收光谱可反映蛋白质主链的信息,在280 nm的紫外吸收光谱可反映芳香族氨基酸残基的信息。图6为3种化合物与BSA相互作用的紫外光谱。由图6可知,这3种化合物与BSA体系的紫外光谱在波长为220与280 nm处有明显的吸收峰,随着化合物浓度的增大,220 nm处的吸收强度逐渐增大,这表明3种化合物与BSA之间均存在相互作用;280 nm处的吸收强度均逐渐增大,但芹菜素与染料木素的吸收峰伴随明显红移,说明这2种化合物与BSA结合后改变了芳香族残基的微环境,使其极性减小,而柚皮素的吸收峰有轻微蓝移,说明柚皮素与BSA的结合使芳香族残基的微环境极性增大。以上结果均表明这3种黄酮类化合物与BSA均形成了复合物。
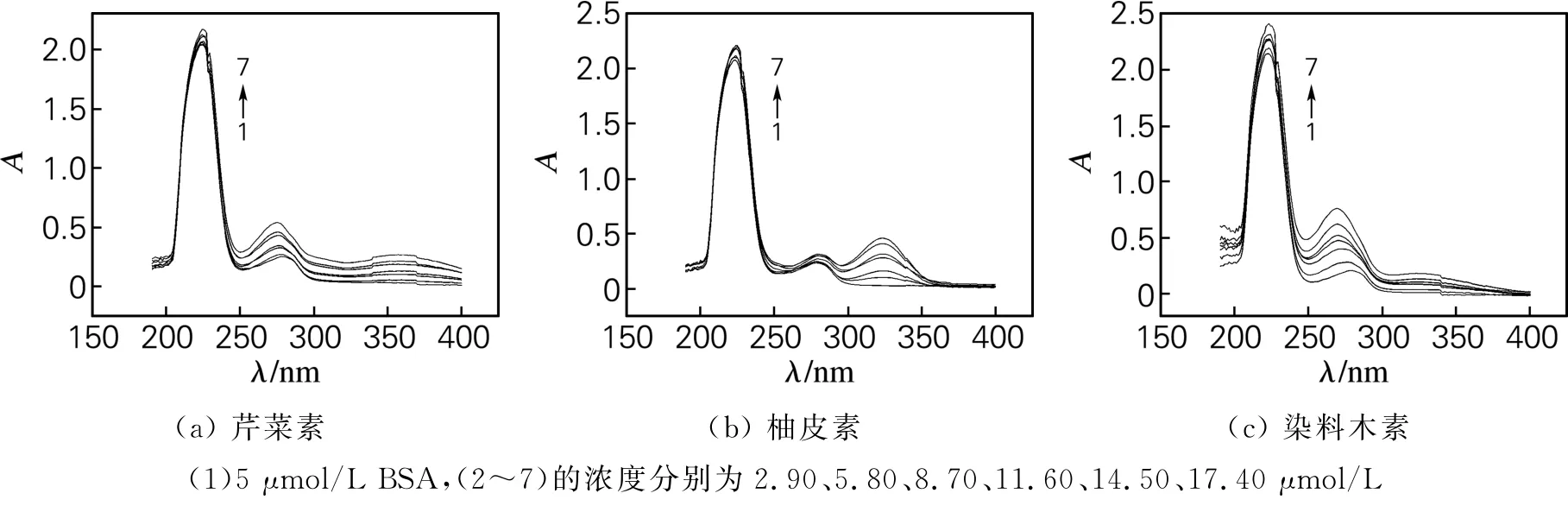
图6 3种黄酮类化合物与BSA相互作用的紫外光谱Fig.6 Ultraviolet spectra of three flavonoids-BSA systems
3 结 论
利用荧光光谱法与紫外光谱法研究芹菜素、柚皮素和染料木素与BSA的结合规律,探讨了3种5,7,4'-三羟基取代类黄酮化合物中C环氢化及取代位置对其与BSA相互作用的影响。结果显示,3种化合物对BSA内源性荧光均有猝灭作用且猝灭类型为静态猝灭;3种化合物与BSA的结合位点约为1,在295 K条件下与BSA结合的强弱顺序为芹菜素、染料木素、柚皮素;芹菜素主要通过氢键与范德华力与BSA结合,柚皮素和染料木素与主要通过静电作用与BSA结合;这表明,具有相同A环与B环结构的黄酮化合物,C环氢化后削弱其与BSA的作用,且B环连接在C-2位置比连接在C-3位置时与BSA的结合常数高了2个数量级。3种化合物的加入均改变了BSA酪氨酸残基与色氨酸残基的微环境,同时也改变了蛋白质的二级结构与氨基酸残基,3种化合物与BSA均形成了复合物。
[1]汪双双,倪永年.光谱法研究11-羟基喜树碱与牛血清白蛋白的相互作用[J].分析试验室,2010,29 (1):10-12.
[2]张国文,陈秀霞.荧光法研究3种黄酮化合物与牛血清白蛋白的结合作用[J].南昌大学学报,2010,32 (2):140-144.
[3]张建刚,卫艳丽,张丽,等.氨基黑10B与牛血清白蛋白作用的光谱法研究[J].分子科学学报,2011,27 (3):170-173.
[4]郭燕青,李建晴,卫艳丽,等.荧光光谱法研究荧光桃红与牛血清白蛋白的相互作用[J].分析科学学报, 2007,23(3):277-278.
[5]张建刚,卫艳丽,董川,等.番红花红T与牛血清白蛋白作用的光谱特性[J].光谱实验室,2011,28(3): 1355-1359.
[6]GE Feng,JIANG Lixiang,LIU Diqiu,et al.Interaction between alizarin and human serum albumin by fluorescence spectroscopy[J].Analytical Sciences, 2011,27:79-84.
[7]陈国珍,黄贤智,许金钩,等.荧光分析法[M].2版.北京:科学出版社,1990-1992.
[8]王春,吴秋华,王志,等.槲皮素与牛血清白蛋白相互作用的研究[J].光谱学与光谱分析,2006,26(9): 1672-1674.
[9]栾妮娜,吴锦绣,宋玉民,等.槐米中芦丁的提取及其与人血清白蛋白荧光光谱研究[J].光谱学与光谱分析,2008,28(4):856-859.
[10]李满秀,窦艳枝.金丝桃苷与牛血清白蛋白相互作用的研究[J].分析实验室,2011,30(5):46-48.
[11]寇自农,徐龙权.橙黄决明素的制备及其与牛血清白蛋白的相互作用[J].大连工业大学学报,2013, 32(1):18-19.
(KOU Zinong,XU Longquan.Preparation of aurantio-obtusin and its interaction with bovine serum albumin[J].Journal of Dalian Polytechnic University,2013,32(1):18-19.)
[12]张曦,寇自农,石羽佳,等.同步荧光光谱法研究丹参素-牛血清白蛋白体系的荧光增强效应[J].分析测试学报,2011,30(4):444-445.
[13]杨曼曼,杨颖,席小莉,等.荧光染料探针与蛋白质结合的研究[J].科学通报,1997,42(12):1276-1278.
[14]邓世星,杨季东.荧光法研究牛血清白蛋白与中性红的相互作用[J].分析科学学报,2007,23(2): 177-179.
[15]查丹明,李舒婷,杨勇飞,等.稀土金属离子与色氨酸相互作用的荧光光谱研究[J].光谱学与光谱分析,1999,19(6):788-790.
Interaction of bovine serum albumin with 5,7,4'-trihydroxy substituent flavonoids
WANG Linlin1, ZHU Jingbo1,2, KOU Zinong3, DING Yan1,2, YANG Rongrong1
(1.School of Food Science and Technology,Dalian Polytechnic University,Dalian 116034,China; 2.Institute of Chemistry and Applications of Plant Resources,Dalian Polytechnic University,Dalian 116034,China; 3.Instrumental Analysis Center,Dalian Polytechnic University,Dalian 116034,China)
The interactions among 5,7,4'-trihydroxy substituent flavonoids apigenin,naringenin, genistein and bovine serum albumin(BSA)were investigated by fluorescence spectroscopy and ultraviolet spectroscopy.The effect of hydrogenation on C ring and the position of substituent on C ring on the affinity for BSA was discussed.Experimental results showed that the three flavonoids could quench BSA fluorescence and the quenching mechanism was static quenching.The binding numbers were all about 1.The descending order of binding force was apigenin(flavone),genistein (flavanone)and naringenin(isoflavone),the binding constant of which were 1.269×107,3.011×105and 1.342×105L/mol at 295 K.The binding force between apigenin and BSA was mainly hydrogen bonding and van der Waals force,naringenin and genistein’s were both electrostatic interaction.The results indicated that hydrogenation on ring C could lower the affinity to BSA,while the B ring connected to the C-2 position could enhance the affinity to BSA.The three flavonoids changed the microenvironment of tyrosine and tryptophan.The three flavonoids were formed compound with BSA,and also changed the protein secondary structure and amino acid residues microenvironment.
5,7,4'-trihydroxy substituent flavonoids;apigenin;naringenin;genistein;bovine serum albumin;fluorescence spectroscopy;ultraviolet spectroscopy
O657.3
:A
1674-1404(2015)05-0320-06
2014-03-12.
辽宁省高等学校重大科技平台项目(2011191).
王琳琳(1988-),女,硕士研究生;通信作者:朱靖博(1963-),男,教授,博士生导师,E-mail:zhujingb@sina.com.
