水体铜胁迫下狗牙根生理响应的FTIR分析
2015-06-27周群英傅杨武黄文君陈明君
周群英 傅杨武 林 润 黄文君 陈明君
(重庆三峡学院环境与化学工程学院,重庆万州 404100)
水体铜胁迫下狗牙根生理响应的FTIR分析
周群英 傅杨武 林 润 黄文君 陈明君*
(重庆三峡学院环境与化学工程学院,重庆万州 404100)
文章以三峡库区消落带适生植物——狗牙根为实验材料,用水体中不同浓度的Cu2+处理18天,用FTIR分析重金属胁迫下狗牙根根、茎、叶中Ax/A2924和A2924的变化情况.结果表明:(1)从狗牙根根、茎、叶的FTIR谱图看,其根、茎、叶的组成相似,不同浓度的水体铜离子胁迫不会改变狗牙根的主要化学成分,但对各组分的含量有所影响.(2)可溶性糖类和氨基酸等有机组分在水中铜离子浓度小于40 mg/L时,含量升高,对铜的耐性增强,当水体铜离子浓度≥ 40 mg/L时,可溶性糖和氨基酸含量逐渐下降.(3)参与重金属迁移、吸附的官能团的吸收峰(3 410 cm-1、1 721 cm-1、1 620 cm-1、1 512 cm-1、1 250 cm-1附近) 产生了一定的位移,表明这些基团参与了离子交换、络合或是作为运输重金属离子的载体.(4)利用红外光谱吸收峰的A1721/A2924值可简单、快捷地判断环境重金属在植物中的迁移运输情况,水体Cu2+在狗牙根中的迁移情况为根>茎≥叶,与文献值基本一致.
当重金属进入水体后可以在土壤、水、大气、生物系统中循环,从而减弱水生生态系统的生命力,进一步通过食物链传播[1].铜是我国水体和土壤中常见重金属种类,在土壤中的富集将阻碍作物生长,降低产品的质量,给农业生产带来安全隐患[2].在长期深淹胁迫条件下狗牙根仍能成活,因而其可作为三峡库区消落带植被恢复与重建的物种[3].20世纪80年代初期发展起来的植物修复技术对环境污染的治理具有十分重要的意义,寻找既能进行植被重建和恢复又能修复水体和土壤中重金属离子的物种是一项十分有益的工作.傅里叶变换红外光谱法具有操作快速、简单和灵敏度高的特点,常用于宏观整体鉴定复杂体系[4].为研究狗牙根对Cu2+的耐性机制及其不同组织器官的生理活性,利用水培实验,通过对模拟水环境中不同浓度梯度的Cu2+胁迫狗牙根时其根、茎和叶的FTIR图谱的研究,获知狗牙根不同组织器官的化学组成成分的变化,将有利于揭示狗牙根对重金属铜的耐受性、铜对狗牙根的毒害机制,为研究狗牙根应用于环境重金属污染修复提供科学依据.
1 材料和方法
1.1 实验材料
实验用狗牙根采自重庆万州非消落带,培植时选用生物量基本相当的幼苗.外源重金属为氯化铜(CuCl2·2H2O)(分析纯).
1.2 水体重金属模拟胁迫实验设计
将备用的狗牙根进行一周的适生性培植,再以添加了外源重金属离子(Cu2+)的Hoagland营养液为模拟水体进行水培实验,按设计浓度分别添加不同质量的Cu2+,浓度梯度和胁迫时间按文献[5]进行设计,水体中外源Cu2+浓度为:0 mg/L、10 mg/L、20 mg/L、30 mg/L、40 mg/L、80 mg/L.
1.3 水培过程及样品处理方法
选择生物量大体相当植株栽种于装有0.55 kg经处理过河沙的烧杯中,培植18天后取样,再观察新生根、芽数量,用去离子水反复淘洗至淘洗液无Cu2+检出.
将取出的每份样品在105℃的烘箱中进行杀青半小时,继续将根、茎、叶烘干,时间24小时,用研钵分别将根、茎和叶分开研磨成极细的粉末,保存于干燥器中,备测.
1.4 测定方法及数据处理
准确称取研细的KBr 0.200 0 g,样品0.004 0 g,在玛瑙研钵中研细混匀,压片控制压力为80 KN,制出均匀透明薄片,用岛津IRPrestige-21测定红外光谱数据,分辨率为4 cm-1,扫描范围400~4000 cm-1,扫描累加次数为32次.数据用Excel-2003进行处理,红外光谱图用Origin8.0绘制.
2 结果与讨论
2.1 水体重金属(Cu2+)对狗牙根生长表现的影响
从表1可以看出,在浓度较低(≤ 30 mg/L)时生长状况优于空白实验,说明低浓度的水体Cu2+能促进狗牙根的生长,当浓度在40 mg/L左右时与空白组相当,当水体中Cu2+浓度达到浓度80 mg/L时,狗牙根叶尖变黄,根部发黑,几无新根新芽长出,生长明显处于停滞状态,显现出明显的毒性.所以狗牙根对Cu2+毒性的耐性存在一个临界值,当超过此临界值时,植物同样会受到毒害,狗牙根受水体Cu2+胁迫的临界值为40 mg/L,在水体中CCu2+≤临界值时狗牙根即能承受Cu2+的胁迫还能很好地生长.

表1 铜胁迫对狗牙根生长的影响
2.2 狗牙根根部的FTIR分析
通过对植物红外光谱的测定,可以反映样品在植化组成上的差异程度[6],作者按张晓斌等[7]研究铬诱导植物根细胞壁化学成分变化的方法,用来半定量分析狗牙根根、茎、叶的特征峰变化.狗牙根根部样品的FTIR光谱见图1见表2.结果显示狗牙根根部在重金属胁迫前后的吸收峰的基本形态保持不变,而一些参与重金属吸附的官能团吸收峰位置有不同程度的位移,没有参与重金属离子迁移、吸附及螯合的官能团的吸收峰几乎没有位移,如1 026 cm-1、1 381 cm-1和2 924 cm-1附近的吸收峰.2 924 cm-1附近的吸收峰是主要来自于蛋白质、核酸、碳水化合物、果胶、维生素和各种膜及细胞壁的组织等成分饱和C-H键的伸缩振动吸收[8].顾艳红等人研究发现,丙二醛含量变化趋势与2 924 cm-1处吸收峰的吸光度升降一致,可能与植物细胞膜的膜脂过氧化程度相关[9],狗牙根根部在Cu2+胁迫下表现为先降后升再降的趋势,可能由于狗牙根根部因耐性机制分泌出有机酸螯合Cu2+,在较低浓度下,Cu2+是植物所需微量元素,有机酸对Cu2+有较强螯合能力,从而使狗牙根根部有机酸消耗速率大于分泌速率[8],因而将下降,在较高浓度下,由于较强的应激效应和有机酸对Cu2+螯合能力减弱,使狗牙根根部有机酸消耗速率小于产生的速率,从而使上升.而在高浓度条件下,Cu2+毒害加重,应激效应减弱,有机酸产生的量减少,则下降;1 721 cm-1附近吸收峰为膜脂和细胞壁果胶中的酯类化合物中的游离羧基和脂肪酸酯、皂苷及黄酮类化合物中酯的官能团酯基中羰基(C = O)部分的伸缩振动吸收[6,10],与细胞膜的膜脂过氧化程度有关,反映膜的透性.Cu2+胁迫浓度的增加的变化趋势为先升高后降低,这可能是在较低浓度下由于狗牙根根部膜脂过氧化,从而使脂类物质减少,但含脂肪族酮类化合物中羰基的产物和细胞壁果胶中酯类化合物的孤立羧基数量逐渐增多[8],使增大,在高浓度下,由于根部螯合和吸附Cu2+的量增大,可能破坏了此机制,使脂肪族酮类化合物过氧化产物减少,引起下降;在3 410 cm-1附近宽而强的峰是缔合羟基(-OH)及氨基酸、蛋白质、核酸、维生素等物质中的N-H键伸缩振动吸收的叠加[4],主要反映狗牙根根中蛋白质、核酸及维生素等组分中的-OH和N-H在光谱中的贡献,值表现为先升后降,其值在1.705 4~1.804 0之间,变化较小,说明根部的生理生化过程受重金属的胁迫影响程度较小,表现出狗牙根作为Cu耐性植物的特性.1 636 cm-1附近的吸收峰为缔合态伯酰胺吸收I带[8],1 512 cm-1附近吸收峰为蛋白质上N-H特征吸收峰(酰胺Ⅱ带)[10],1 250 cm-1附近的吸收峰为酰胺Ⅲ带,是由C-N键的伸缩振动和N-H键的弯曲振动引起的,或许还有羧基中C-O单键伸缩振动的贡献[7]和的比值表示蛋白二级结构中肽键间氢键的结合力的强弱,其值的大小,显示出蛋白质含量的高低[10],其趋势均表现为先增后降,当胁迫浓度在40 mg/L左右时其值最大,可能是由于植物体内可溶性蛋白含量的升高,有利于维持植物细胞的正常代谢,减弱重金属铜对植物的毒害作用,提高植物对重金属的抗逆性,因而在重金属离子浓度较低时其比值增大,而当水体中重金属浓度较高时将对核酸的合成产生抑制作用,使相关蛋白酶活性增加而加速蛋白质组分的分解,导致蛋白质含量下降[9],其比值降低;1 042 cm-1附近是碳水化合物中的-CH弯曲或-C-O、-C-C伸缩振动峰[6],的比值呈现先上升后下降的趋势,有研究表明[9],在重金属胁迫过程中,为适应胁迫环境,植物细胞内物质的代谢水平、代谢途径将发生一系列变化,可溶性糖含量的增加显示植株对胁迫环境的抵抗性反应,可溶性糖在细胞质中的积累,不仅能保持蛋白质的水合度,还可以防止原生质脱水,平衡细胞质与液泡间的渗透势等作用,从而降低质膜受伤害的程度,增强植物对水体重金属胁迫的承受能力,因此在较低浓度胁迫时的值升高,但植株对重金属胁迫耐受能力是有一定限度的,当重金属的胁迫浓度超过这个限度,可溶性糖含量将下降,因此,当Cu2+胁迫浓度> 40 mg/L时已经超过了狗牙根的耐受程度,使狗牙根受到了严重损伤,可溶性糖含量大大下降,因此降低.1 381 cm-1为纤维素中甲基(-CH3)的伸缩振动吸收峰,说明存在纤维素[7],的变化趋势也表现为先升后降,表明Cu2+胁迫时,因为Cu是植物生长所需微量元素,低浓度时随浓度的增加根细胞壁中甲基酯化程度增大,果胶质COO—含量增多因此而升高,当Cu2+胁迫浓度> 40 mg/L后,细胞壁通过降低果胶甲基化程度,增强阳离子的交换能力,配位螯合更多的Cu2+,来增强植物的抗逆性,从而使比值减小.

图1 不同浓度Cu2+胁迫狗牙根根部红外光谱
表2 不同浓度Cu2+胁迫狗牙根根部特征峰的和Ax/值

表2 不同浓度Cu2+胁迫狗牙根根部特征峰的和Ax/值
水体中Cu2+浓度/(mg/L) 2 924 cm-13 410 cm-11 721 cm-11 636 cm-11 512 cm-11 381 cm-11 250cm-11 042 cm-1Ax/A29240 1.095 0 1.582 3 0.719 5 0.865 6 0.675 8 0.775 3 0.802 9 1.164 6 10 1.074 3 1.714 8 0.746 0 0.893 5 0.694 9 0.864 9 0.887 5 1.344 1 20 1.015 6 1.722 1 0.783 3 0.905 5 0.722 0 0.874 7 0.928 6 1.395 3 30 1.125 9 1.731 4 0.782 0 0.941 6 0.747 7 0.893 3 0.934 7 1.440 0 40 0.910 9 1.804 0 0.804 7 0.956 2 0.749 9 0.919 3 0.960 6 1.467 2 80 0.846 2 1.705 4 0.784 8 0.877 2 0.715 7 0.858 2 0.914 1 1.328 2
2.3 狗牙根茎部的FTIR分析
从茎部FTIR可看出,茎部与根部的FTIR相似,吸收峰的波数也相差很小,可认为茎与根的组成成分相差不多,但不同,说明各成分含量不同.1 042 cm-1附近是ROH、RCOOR′、ROR′或ArOH的C-O基团的伸缩振动峰[1],1 381 cm-1附近为含油脂化合物的甲基C-H的变形振动峰,1 728 cm-1处是膜脂和酯类化合物的孤立羧基(-COOR)吸收峰,在1 636 cm-1附近是酰胺化合物的吸收Ⅰ带,1 512 cm-1附近为酰胺化合物的吸收Ⅱ带,1 250 cm-1附近是酰胺Ⅲ带,2 924 cm-1左右的吸收是饱和C-H键的伸缩振动吸收,3 410 cm-1附近的吸收谱带是蛋白质、核酸、氨基酸、维生素等物质中NH键的伸缩振动吸收和典型的缔合羟基伸缩振动吸收的叠加.在重金属迁移富集运输过程中和变化趋势与根部基本相同,但在同浓度下,根部的要比茎部大,表明丙二醛含量更高[9],根部受重金属伤害更大,可能是由于狗牙根根部与水体重金属直接接触,在根部表面吸附和螯合了更多的Cu,而茎中重金属从根中迁移运输而来,不与水体重金属直接接触.张晓斌等[7,10]研究表明,根细胞壁上-OH和自由羧基-COO-参与了重金属铬的结合,因此,可认为-OH和-COOR也对Cu的吸附、结合起关键作用,可用值的大小预知在相同胁迫浓度下重金属在植物不同器官中迁移富集量情况,从表2、表3可知,同浓度下根的大于茎,表明重金属Cu在根中的迁移富集量大于茎,与文献中原子吸收测定结果一致[5],和的比值表示蛋白二级结构中肽键间氢键的结合力的强弱,其值的大小,显示出蛋白质含量的高低,从表3可知狗牙根茎中的和在0~ 30 mg/L浓度范围内无明显变化,表明在水体重金属Cu胁迫下,狗牙根茎部生理过程受影响较小,可能是由于水体中不断增加的外源铜存在时将诱导富脯氨酸蛋白、病害相关蛋白和富甘氨酸蛋白等的合成,从而保护植物细胞,避免或减轻受重金属毒害[8],表现出狗牙根对Cu的耐性特征,Cu2+胁迫浓度 ≥ 40 mg/L时,对核酸的合成起抑制作用,相关蛋白酶活性增大从而加速蛋白质的分解,导致和值下降;的变化趋势与根部相似,先升后降,但根在在40 mg/L达到最大,而茎部在30 mg/L时就已达最大,可能是根可以加速向茎叶迁移重金属,并且根的细胞壁可累积更多Cu来增强抗逆性,从而减轻重金属Cu的毒害,从而使根比茎有更强的耐Cu能力.

图2 不同浓度Cu2+胁迫狗牙根茎部红外光谱
表3 不同浓度Cu2+胁迫狗牙根茎部特征峰的的值

表3 不同浓度Cu2+胁迫狗牙根茎部特征峰的的值
水体中Cu2+浓度/(mg/L) 2 924 cm-1Ax/A29243 410 cm-11 721cm-11 636cm-11 512 cm-11 381cm-11 250cm-11 042cm-10 0.902 7 1.508 8 0.679 30.836 50.664 6 0.768 2 0.740 5 1.118 8 10 0.682 5 1.638 8 0.706 80.947 90.717 6 0.808 0 0.744 3 1.256 1 20 0.903 9 1.938 0 0.727 90.936 10.732 3 0.827 2 0.763 9 1.385 8 30 0.988 0 1.889 3 0.650 90.922 80.748 2 0.853 7 0.818 1 1.420 7 40 0.970 4 1.822 8 0.650 70.893 10.656 1 0.826 2 0.782 4 1.344 5 80 1.035 8 1.821 4 0.644 50.885 30.623 2 0.762 6 0.726 9 1.170 4
2.4 狗牙根叶的FTIR分析
从图3可知,叶的红外光谱与根、茎仍然相似,吸收峰的波数也几乎相同,其组成成分与根、茎相似,与根、茎相比值不同,表明叶中各组分含量与根、茎有差别.表4数据显示2 924 cm-1附近的吸收谱带为羧基中O-H和甲基上C-H键的伸缩振动重叠,主要来自细胞壁、维生素及各种膜的组织成分,这些成分与运输功能相关[8],的变化趋势为先增后降低,表明低浓度狗牙根叶分泌的有机酸不断螯合Cu,高浓度胁迫下,Cu毒害的加重其羧酸螯合力变弱的值变化趋势为先下降后升高,与根、茎的变化趋势不同,说明在较低浓度时,狗牙根叶片表皮细胞壁中组分的羟基吸附螯合了Cu,而使细胞表面的氢键数量减少,在较高浓度下,可促进狗牙根叶片中有机物的分泌和运输,利用渗透作用来增强其叶片对铜的抗逆性,而水体中高浓度的Cu2+将妨碍这些有机物的合成和运输[11];A1636/A2924、A1248/A2924和A1248/A2924的比值在0~30 mg/L浓度范围内变化很小,表明低浓度下狗牙根叶生理过程受影响仍较小,当CCu≥ 40 mg/L时,比值降低,可能因为抑制核酸的合成,薛生国、Didierjean等人[11,12]认为重金属胁迫诱导蛋白具有在一定范围内保护植物细胞免受重金属毒害的作用,高浓度条件下叶因严重毒害破坏了重金属胁迫诱导蛋白合成机制;和的比值在实验浓度范围(0~80 mg/L)表现为先降后升再降的变化趋势,其值降低可能因为脂肪族酮类化合物等物质合成减少,果胶甲基化程度降低或抑制了细胞内含油脂化合物产生,碳水化合物的运输受阻所致,其值升高可能由于Cu的刺激作用加快脂肪族酮类化合物的合成、增大果胶甲基化程度和加深膜脂过氧化程度,促使叶部积累更多的脂肪族酮类化合物过氧化产物,通过渗透调节来增强抗逆性所致.从表2、表3和表4可以看出,同浓度下根、茎和叶的的值是根大于茎和叶,茎大于或相当于叶的值,表明Cu在根、茎、叶的迁移情况为根 > 茎 ≥ 叶,与文献[5]中原子吸收测定结果基本一致.

图3 不同浓度的Cu2+胁迫狗牙根叶的红外光谱
表4 不同浓度Cu2+胁迫狗牙根叶特征峰的的值
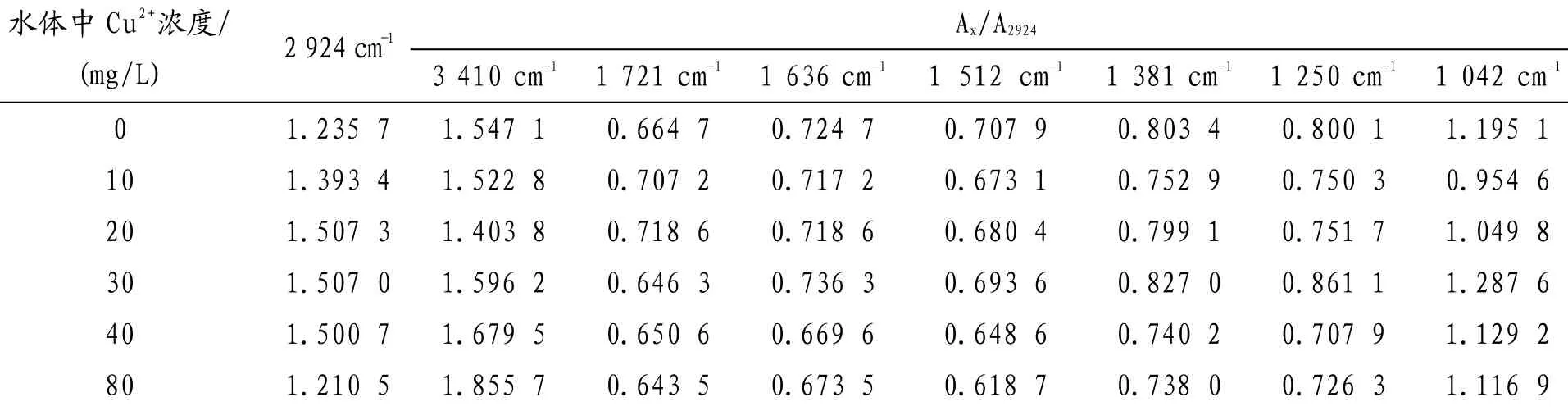
表4 不同浓度Cu2+胁迫狗牙根叶特征峰的的值
Ax/A2924水体中Cu2+浓度/ (mg/L) 2 924 cm-13 410 cm-11 721 cm-11 636 cm-11 512 cm-11 381 cm-11 250 cm-11 042 cm-10 1.235 7 1.547 1 0.664 70.724 70.707 9 0.803 4 0.800 1 1.195 1 10 1.393 4 1.522 8 0.707 20.717 20.673 1 0.752 9 0.750 3 0.954 6 20 1.507 3 1.403 8 0.718 60.718 60.680 4 0.799 1 0.751 7 1.049 8 30 1.507 0 1.596 2 0.646 30.736 30.693 6 0.827 0 0.861 1 1.287 6 40 1.500 7 1.679 5 0.650 60.669 60.648 6 0.740 2 0.707 9 1.129 2 80 1.210 5 1.855 7 0.643 50.673 50.618 7 0.738 0 0.726 3 1.116 9
3 结 论
(1)从狗牙根根、茎、叶的FTIR谱图看,其图谱相似,表明在不同浓度的水体重金属铜处理狗牙根时并不改变其根、茎和叶的基本化学成分,但对各化学成分的含量有影响.当重金属胁迫时,由于植物的应激反应,狗牙根通过生理生化反应来抵御不良环境的迫害,从而使的值发生变化,因而可根据值的变化判断各种组分含量的改变.
(3)一些参与重金属吸附的官能团的吸收峰(3 410 cm-1、1 728 cm-1、1 620 cm-1、1 512 cm-1附近)产生了一定的位移,表明这些波峰处相关基团与重金属之间发生了离子交换、络合,或者这些相关组分是作为运输重金属离子的载体及与重金属离子螯合的大分子物质,2 924 cm-1、1 381cm-1、1 042 cm-1附近的吸收峰没位移.
(4)狗牙根对Cu毒性的耐性存在临界值(40 mg/L),当水体中重金属浓度超过该值时,狗牙根将受到伤害,直接表现为膜脂过氧化.狗牙根根、茎、叶在1 042 cm-1附近吸收峰的的值和水培生长情况变化均证明了这一点.
[1]付川,余顺慧,黄怡民,等.紫花苜蓿对铜胁迫生理响应的傅里叶变换红外光谱法研究[J].生态学报,2014,34(5):1149-1155.
[2]刘景,吕家珑,徐明岗,等.长期不同施肥对红壤Cu和Cd含量及活化率的影响[J].生态环境学报,2009,18(3):914-919.
[3]谭淑端,张守君,张克荣.长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响[J].武汉植物学研究:自然科学版,2009,27(4):391-396.
[4]李星,刘鹏,张志祥.两种水生植物处理重金属废水的FTIR比较研究[J].光谱学与光谱分析,2009,29(4):945-949.
[5]陈明君,傅杨武,周群英.Cu2+、Pb2+、Zn2+在狗牙根中的迁移模拟研究[J].广东农业科学,2011(4):136-138.
[6]程琴,黄庶识,梅岩,等.用红外光谱研究植物响应甲醛胁迫的生理特性[J].浙江大学学报:农业与生命科学版,2010,36(6):674-682.
[7]张晓斌,刘鹏,李丹婷,等.铬诱导植物根细胞壁化学成分变化的FTIR表征[J].光谱学与光谱分析,2008,28(5):1067-1070.
[8]薛生国,黄艳红,王钧,等.采用FTIR法研究酸模叶蓼对锰胁迫生理响应的影响[J].中南大学学报:自然科学版,2011,42(6):1528-1532.
[9]顾艳红,刘鹏,蔡琪敏,等.FTIR结合生理特性研究镉胁迫对果灰藓的影响[J].2009,29(3):620-623.
[10]曾峰,唐永金.高浓度U胁迫下植物物质成分的FTIR研究[J].湖南师范大学自然科学学报,2013,36(5):59-64.
[11]薛生国,王钧,刘恒,等.锰胁迫下商陆生理响应的FTIR分析[J].中南大学学报:自然科学版,2011,42(7):1852-1857.
[12] Didierjean L,Frendo P’Nasser et a1.Heavy metal responsive genes in maize:Identification and comparison oftheir expression upon various forms of abiotic stress[J].Planta,1996,199(1):1-8.
(责任编辑:张新玲)
An FTIR Spectroscopy Analysis of Physiological Response to Cynodondactylon(Linn.) Pers under Water Heavy Metal Ions (Cu2+) Stress
ZHOU Qunying FU Yangwu LIN Run HUANG Wenjun CHEN Mingjun*
(School of Environment and Chemistry Engineering, Chongqing Three Gorges University, Wanzhou, Chongqing 404100)
The hydro-fluctuation Belt Plants (Cynodondactylon(Linn.) Pers of Three Gorges Reservoir was taken as the key target in this study. The Cu2+of different concentrations in the water body has been under treatment for 18 days, and an FTIR analysis reveals the changes of the Cynodon dactylon of root, stem and leaf ofandunder water heavy mental ions stress. The results show that:(1) from the perspective of bermudagrass root, stem and leaf of FTIR spectrum, the absorption peak shapes of the various parts of Cynodon dactylon basically have notmuch change, indicating that the different concentrations of heavy metals in the water (Cu2+) stress does not change the material composition, but changes the content; (2) under the concentrations of Cu of less than 40mg/L, the exudation and transporting situation of Amino acids and soluble sugars and other organic compounds serve as organic osmotic contents to enhance copper tolerance, but when Ccu is ≥ 40 mg/L, its synthesis and transport is limited and the content decreases.(3) significant absorption peak shifts of some functional groups such as hydroxy groups ( 3 410 cm-1), carboxyl groups (1 721 cm-1), and acidamide groups (1 620 cm-1,1 512 cm-1,1 250 cm-1) can be seen when they participate in the process of absorbing heavy metals, indicating that the these groups’ participation in the heavy metals ion exchange, complexation or as macromolecular material carrier to transport heavy metal ions and its chelate. (4) With infrared spectrum data, thevalues can be a simple, fast, accurate prediction of migration of heavy metals in plants, and water heavy metal (Cu2+) migration speed in Cynodon dactylon was root> stem ≥ leaf , and the results are compatible with the conclusion drawn with atomic absorption spectrometry.
FTIR; Cynodondactylon(Linn.)Pers; copper stress; tolerance; comparative study
Q945.7
A
1009-8135(2015)03-0077-06
2015-03-28
周群英(1965-),女,重庆云阳人,重庆三峡学院实验师,主要研究分析化学、环境化学.
陈明君(1965-),男,四川大竹人,重庆三峡学院副教授,主要研究有机化学与环境化学.
重庆三峡学院重点项目(11ZD-13)、重庆市教委科技项目(KJ131102)阶段性成果
