农杆菌介导的燕麦遗传转化体系的建立
2015-06-27王迅婧倪秀珍
王迅婧, 倪秀珍
(1.长春师范大学生命科学学院,吉林 长春 130032;2.吉林省图们市第二中学,吉林 延边 133100)
农杆菌介导的燕麦遗传转化体系的建立
王迅婧1,2, 倪秀珍1
(1.长春师范大学生命科学学院,吉林 长春 130032;2.吉林省图们市第二中学,吉林 延边 133100)
以裸燕麦白燕10号为材料,绿色荧光蛋白为报告基因,建立并优化农杆菌介导的燕麦遗传转化体系,并通过荧光显微镜及PCR方法分别检测燕麦愈伤组织及再生苗中的目的基因。研究结果表明,农杆菌菌体浓度OD600=0.5~0.8,侵染10 min时侵染效率最高,侵染7 d后燕麦愈伤组织可检测到绿色荧光蛋白。PCR检测结果表明,接近60% 的再生苗在基因组水平可检测到GFP基因。
燕麦;遗传转化;GFP;PCR检测
植物遗传转化技术是了解植物基因功能,改善植物性状的一种生物学技术,通过遗传转化制备转基因植物可以提高作物抗性及产量[1-3]。中国吉林省西部土壤盐碱化严重,制约着该省西部农业可持续发展和人民生活水平的提高。自1998年起,中国和加拿大两国专家合作培育出了能生长在盐碱土壤、风沙、干旱等环境的10个燕麦新品系。燕麦的根能够吸收盐碱地中的盐分并将其储存在燕麦秸秆中,通过多次种植燕麦可降低土壤含盐量和PH值,因此燕麦是改善盐碱地土壤环境的优良作物[4-5]。通过遗传转化手段将来源于其它植物(例如羊草和芦苇)的抗逆基因转入燕麦,使这些基因在燕麦中稳定表达,可提高燕麦的抗旱和抗盐碱能力,是进一步提高燕麦产量,扩大燕麦种植面积及改良重度盐碱地的1条有效途径[6-8]。本研究以白燕10号成熟胚作为外植体,以绿色荧光蛋白(GFP)为报告基因,建立并优化了燕麦遗传转化体系,为进一步提高燕麦抗逆品质及改良中国西部土壤环境提供理论基础。
1 材料与方法
1.1 材料
白燕10号裸燕麦种子由白城市农业科学院惠赠;农杆菌EHA105及带有GFP基因的质粒由长春师范大学生命科学学院分子生物学实验室保存。
植物基因组提取试剂盒、总RNA提取试剂盒、质粒提取试剂盒及TaqDNA聚合酶购自TaKaRa公司,琼脂糖为西班牙原装进口。
试验中所用乙醇、升汞、潮霉素、羧苄青霉素、卡那霉素、利福平、2,4-D、IAA、6-BA、NAA、蔗糖、琼脂粉、胰蛋白胨、酵母提取物、NaCl均为国产分析纯试剂。LB固体(液体)培养基及MS培养基均经过121 ℃高压灭菌。
根据质粒pCAMBIA1304中GFP碱基序列设计PCR引物,由上海生物工程有限公司合成:
引物1:5’-GGA GAA GAA CTT TTC ACT GGA G-3’;引物2:5’-TTA CCT GTC CAC ACA ATC TGC-3’。
1.2 方法
1.2.1 目的质粒pCAMBIA1304-GFP的转化及鉴定 将目的质粒pCAMBIA1304-GFP通过冻融法转入农杆菌EHA105 感受态细胞中,在终质量浓度50 mg·L-1卡那、50 mg·L-1的利福平的固体LB培养基中过夜培养12~16 h,挑取单菌落于液体培养基(含50 mg·L-1卡那、50 mg·L-1的利福平)中过夜培养,提取质粒并鉴定目的基因GFP。
1.2.2 农杆菌菌体工作液浓度的优化 收集含GFP质粒的农杆菌EHA105,5000 g·min-1离心弃上清,加入液体 MS 诱导培养基(MS+2,4-D 0.5 mg·L-1+NAA 0.1 mg·L-1)重悬,使菌体侵染液OD600值分别为0.3、0.5、0.8、1.0和1.5,用于侵染燕麦愈伤组织[9,10],每个试验4 个重复,每次处理20 个愈伤组织。经过继代培养(MS培养基中添加25 mg·L-1的潮霉素和350 mg·L-1的羧苄青霉素)统计转化后燕麦愈伤组织再生率。

(1)
1.2.3 菌体侵染时间的优化 将燕麦愈伤组织浸于OD600=0.5的农杆菌侵染液中,分别侵染5、10、15、20 min,再分别接种到终浓度为200 μmol·L-1的乙酰丁香酮共培养基上,培养3 d 后转接到含有(25 mg·L-1的潮霉素和350 mg·L-1的羧苄青霉素)抗生素的分化培养基中(MS培养基+6-BA 1.5 mg·L-1+NAA 0.4 mg·L-1+IAA 0.4 mg·L-1),每个试验 4 个重复,每次处理 20 个愈伤组织。期间统计不同侵染时间愈伤组织再生率。
1.2.4 转化后愈伤组织分子生物学检测 pCAMBIA1304中GFP基因的启动子为组成型启动子CaMV35S,侵染燕麦愈伤组织 7 d 后利用荧光显微镜(AE301)观察愈伤组织,确定绿色荧光蛋白是否表达,试验以未转化的燕麦愈伤组织为阴性对照。
1.2.5 燕麦再生植株基因组水平上GFP基因的检测 根据植物基因组提取试剂盒方法提取燕麦基因组DNA,利用PCR方法对GFP基因进行鉴定,试验以重组质粒作为阳性对照,以去离子水作为空白对照,以未转化的燕麦植株基因组作为阴性对照,并用以下公式计算转化效率。

(2)
PCR扩增条件为:94 ℃,3 min; 94 ℃,50 s; 52 ℃,50 s; 72 ℃,50 s;30 个循环; 72 ℃, 8 min。
1.2.6 燕麦再生植株转录水平上GFP基因的检测 根据试剂盒提取步骤提取燕麦再生苗总RNA,利用RT-PCR在转录水平检测GFP基因。试验以重组质粒作为阳性对照,以去离子水作为空白对照,以未转化的燕麦植株基因组作为阴性对照。PCR扩增条件为: 94℃, 3 min; 94℃ 50 s; 52 ℃ 50 s; 72 ℃, 50 s; 30个循环; 72 ℃,8 min。
2 结果与分析
2.1 农杆菌EHA105中目的质粒pCAMBIA1304-GFP的鉴定
用冻融法将质粒pCAMBIA1304转入农杆菌EHA105,挑取筛选培养基(含有卡那霉素和利福平)上的单克隆菌落,提取质粒并通过PCR法鉴定目的基因GFP,目的质粒图谱及PCR鉴定结果如图1所示。
2.2 农杆菌侵染浓度的优化
利用不同菌体浓度侵染燕麦愈伤组织,统计不同菌液浓度侵染后的植株再生率,试验统计结果表明,当菌体侵染浓度OD600=0.5时燕麦愈伤组织的再生率最高,结果见图2。
2.3 农杆菌侵染时间的优化 选择OD600=0.5的菌体浓度分别侵染燕麦愈伤组织5、10、15和20 min,侵染后统计不同侵染时间的植株再生率,实验结果表明侵染10min的燕麦愈伤组织再生率最高,试验结果如图3所示。
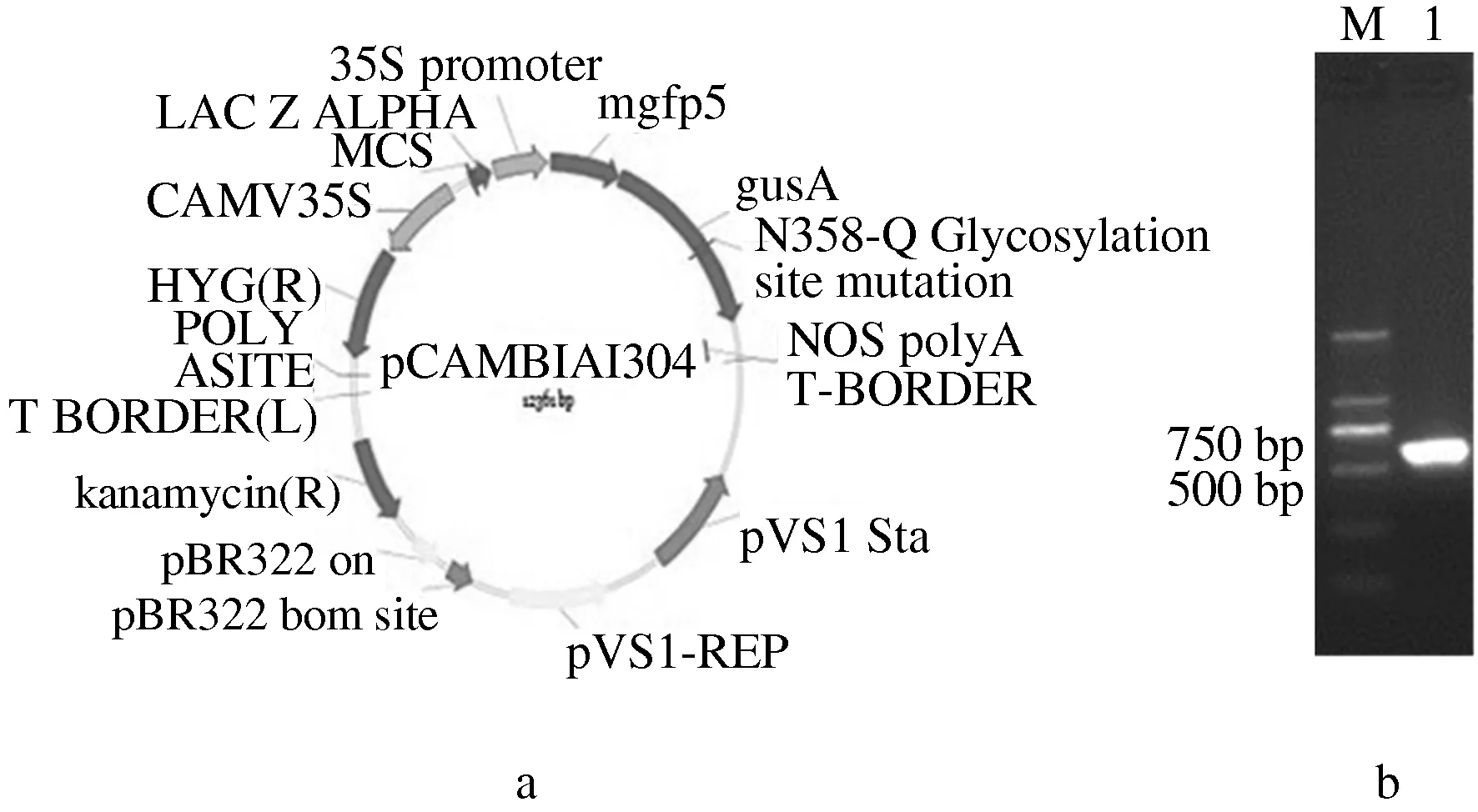
注:M,Marker DL 2000;1,GFP基因的PCR鉴定结果。
2.4 愈伤组织及再生苗的分子生物学检测
2.4.1 绿色荧光蛋白GFP的检测 农杆菌转化燕麦愈伤组织7 d后,将转化的愈伤组织和非转化的愈伤组织分别做成切片,在荧光显微镜(10×40倍)下进行观察,结果如图4所示:a、b为非转化的愈伤组织细胞,在荧光下没有看到绿色荧光;d为转化后的燕麦愈伤组织细胞,在荧光显微镜下可以清楚地看到细胞内的绿色荧光,可以初步证明转化成功。
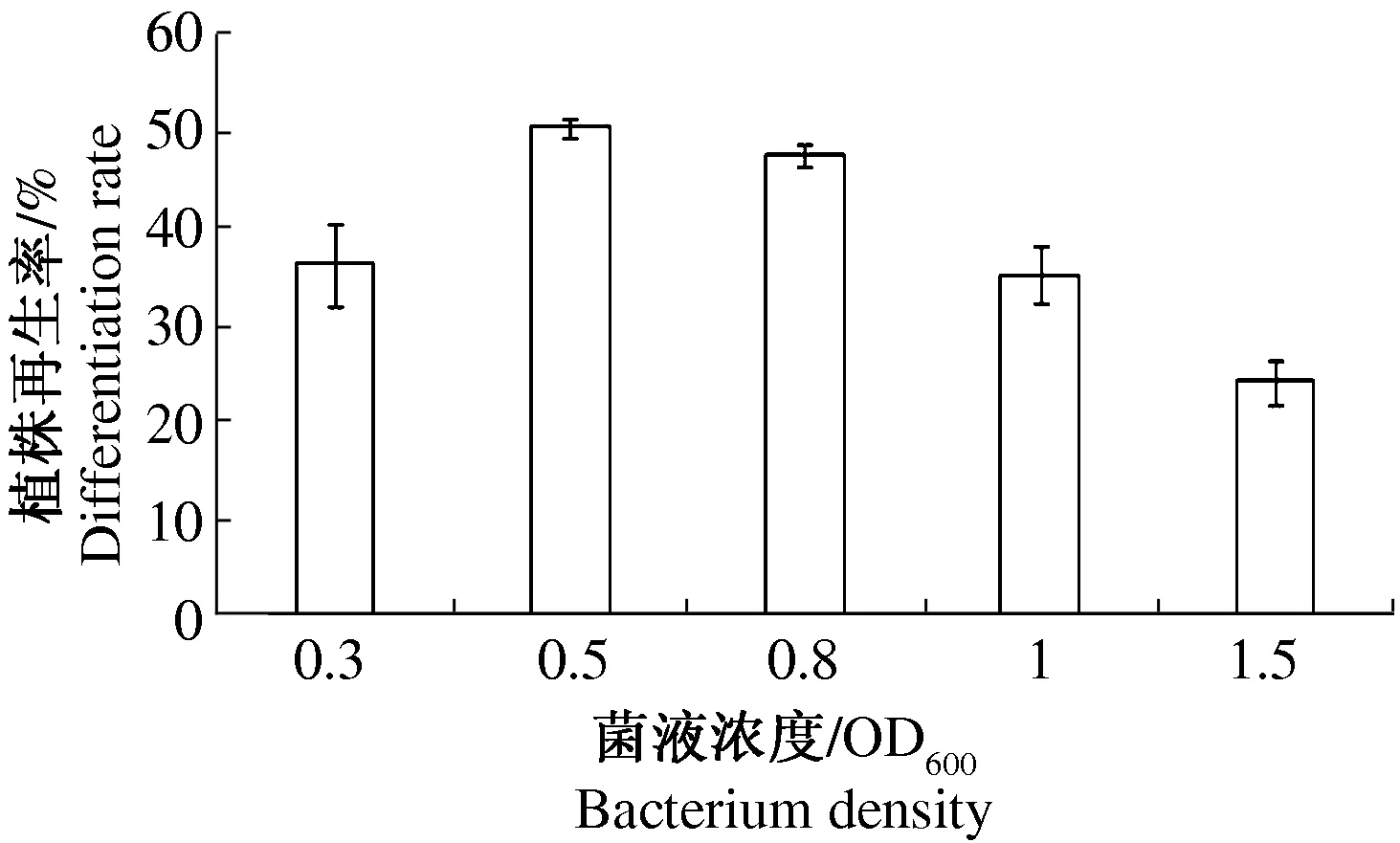
图2 不同农杆菌浓度侵染的燕麦愈伤组织分化率
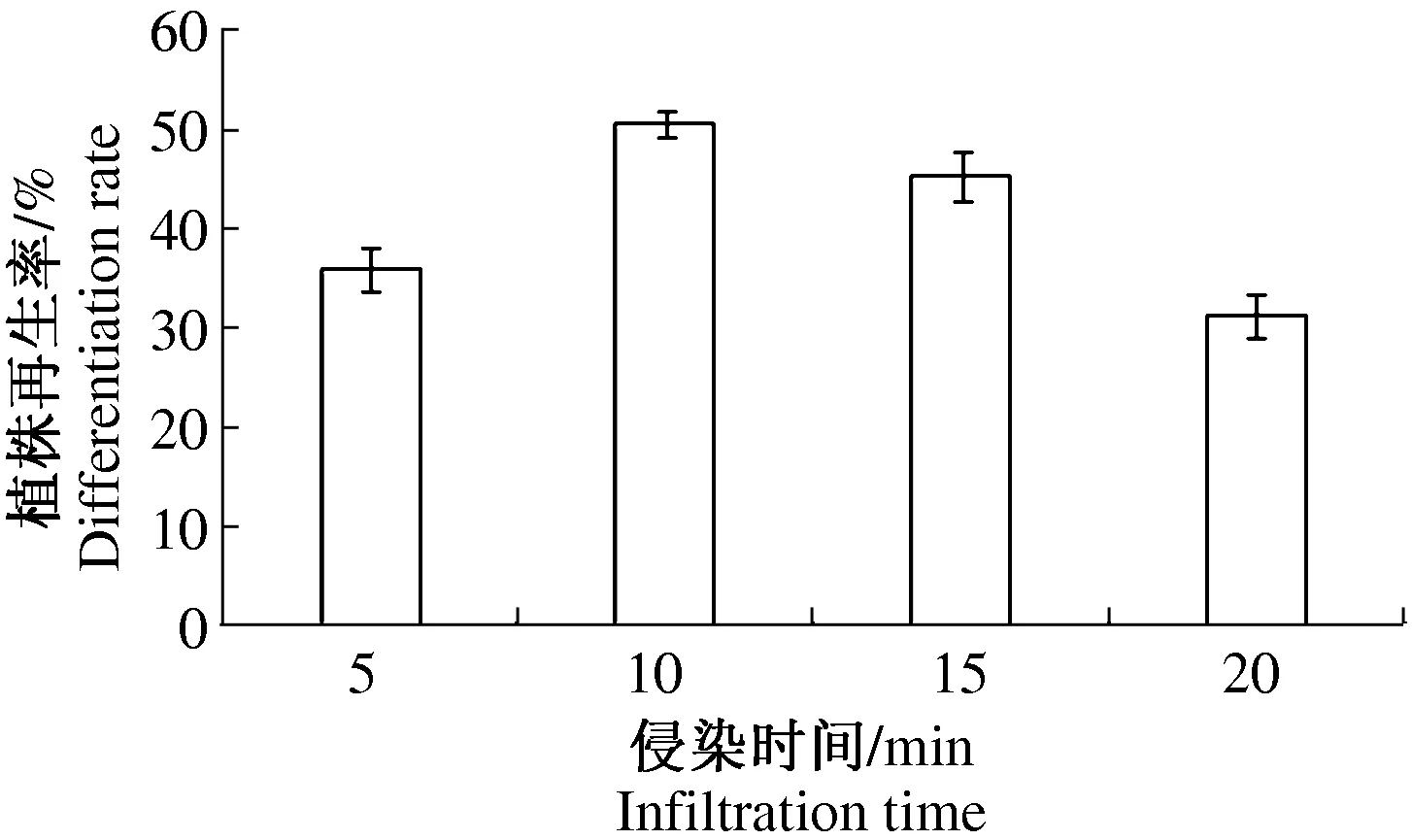
图3 不同时间侵染的燕麦愈伤组织分化率
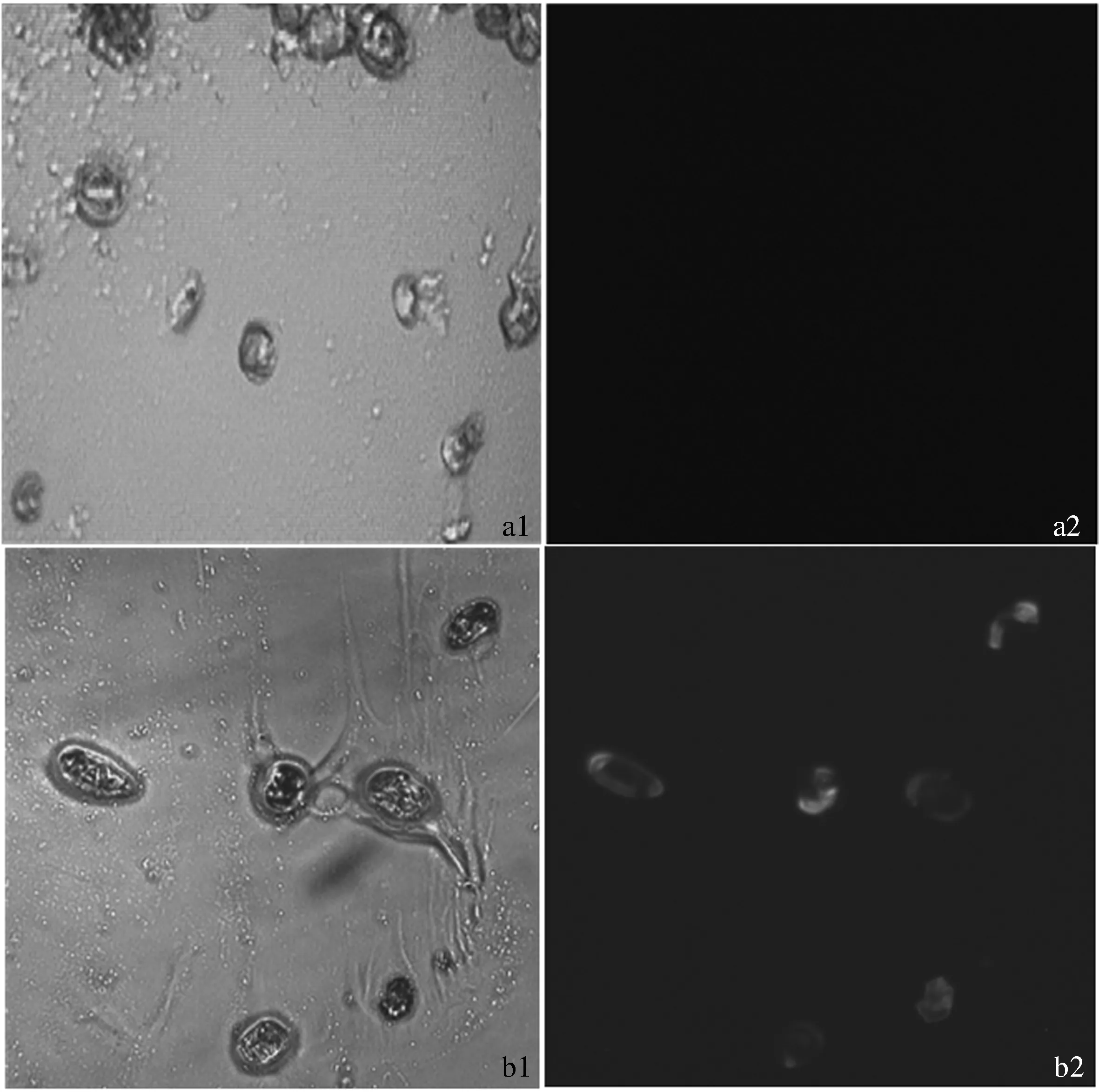
注:a1:光学显微镜下非转化的燕麦愈伤组织细胞(×400),a2: 与a1同视野内荧光显微镜下非转化的燕麦愈伤组织细胞(×400);b1:光学显微镜下转化后的燕麦愈伤组织细胞(×400),b2: 与b1同视野内荧光显微镜下转化后的燕麦愈伤组织细胞(×400)。
Note: a1: Oat callus cells of non-transformation detected by optical microscpe (×400), a2: Oat callus cells of non-transformation detected by fluorescence microscpe (×400); b1: Oat callus cells of transformation detected by optical microscpe (×400), b2: Oat callus cells of transformation detected by fluorescence microscope (×400).
图4 愈伤组织中绿色荧光蛋白的检测结果
Fig.4 GFP detected results of oat callus
2.4.2 燕麦再生苗基因组DNA的PCR检测 提取转化后燕麦再生植株基因组DNA,并以此DNA作为模板检测GFP基因[11],试验共检测132株再生苗,其中78株再生苗的GFP检测呈阳性,转化率接近60%,试验结果如图5所示(仅显示6株再生苗的鉴定结果)。

注:M,DNA Marker DL 2 000;+,质粒对照;-,非转化对照植株;0,以水作为的空白对照;1~6,再生植株检测结果。
Note: M,DNA Marker DL 2 000;+,Postive vector; -,Control plant of non-transformation; 0,H2O for blank; 1 to 6,Regeneration seedlings of transformation.
图5 再生植株的PCR检测结果
Fig.5 PCR results of regeneration seedlings
3 结论与讨论
利用农杆菌侵染法对植物进行遗传转化是一种操作相对简单、费用较低的方式,但不同作物及品种所需条件各异。本试验结果表明,农杆菌工作液浓度及处理时间是影响转化后植株再生率的关键因素,当菌体工作液浓度OD600为0.5时,愈伤组织产生再生苗的数目最高,当工作液浓度过高时一方面会导致麦愈伤组织褐化,另一方面会使抑菌困难,严重污染培养基;在菌体工作液浓度OD600为0.5的条件下,侵染愈伤组织10 min时,燕麦植株再生率最高,侵染时间过短会降低侵染效率致使愈伤组织在筛选过程中降低再生率,而侵染时间过长一方面会对愈伤组织造成伤害引起褐化,另外一方面不利于后期培养过程中抑制农杆菌的生长。 转化7 d后绿色荧光蛋白(GFP)在愈伤组织中表达,再生植株基因组水平检测阳性率可达60%,本研究所建立的高效的燕麦遗传转化体系为进一步研究燕麦提供了理论依据。
[1] QUE Q, ELUMALAI S, LI X,et al. Maize transformation technology development for commercial event generation[J]. Front Plant Sci, 2014,5:539, dio:10.3389/fpls.
[2] JI Q, XU X, WANG K, Genetic transformation of major cereal crops[J]. Int J Dev Biol, 2013, 57(6/8):495-508.
[3] SAKHNO L, KVASKO Y, OLEVINSKA Z, et al. Creation of transgenicBrassicanapusL. plants expression human alpha 2b interferon gene[J]. Tistol Genet, 2012, 46(6):8-12.
[4] 王 波,宋凤斌. 燕麦对盐碱胁迫的反应和适应性[J]. 生态环境,2006,15(3):625-629.
[5] 赵世锋, 田长叶,王志刚,等. 我国燕麦生产和科研现状及未来发展方向[J].杂粮作物,2007,27(6):428-431.
[6] 罗志娜,赵桂琴,刘 欢. 燕麦成熟胚的组织培养及植株再生[J].甘肃农业大学学报,2012,10(5):60-68.
[7] 杨 杞,白肖飞,高 阳,等.沙冬青CBF/DREB1转录因子cDNA的克隆及序列分析[J].基因组学与应用生物学,2009,28(1):1043-1048.
[8] 李科友,朱海兰.植物非生物逆境胁迫DREB/CBF转录因子的研究进展[J].林业科学,2011,1(1):124-131.
[9] 庄志扬.农杆菌介导玉米幼胚遗传转化研究[D].兰州:甘肃农业大学,2010.
[10]孙传波,郭 嘉,陶 蕊,等. 农杆菌介导玉米遗传转化体系的研究[J]. 中国农学通报,2012,28(36):71-75.
[11]黄国平,汪 琳,陈克平.转基因水稻外源蛋白检测技术研究进展[J].中国水稻科学,2010,24(4):410-416.
(责任编辑:李 莹)
Establishment of an agrobacterium mediated genetic transformation system for oat (AvenuenudaL.)
WANG Xunjing1,2, NI Xiuzhen1
(1.Department of Biology, Changchun Normal University, Changchun 130032, China; 2.No.2 Middle School of Tumen, Yanbian 133100, China)
Agrobacterium tumefaciens strain EHA105 harboring the plasmid pCAMBIA1304-GFP was used to transform oat (Baiyan 10)derived mature embryo, and fluorescence microscope and PCR method were used to detect the target gene in the embryogenic calluses and regenerated plants. The experiment results showed that the mature embryo infiltrated with bacterial suspensions (OD600=0.5~0.8) for 10 min was the best condition, the GFP can be detected in the embryogenic calluses by the fluorescence microscope after one week of infiltration, and about 60% regenerated plants were positive by PCR test.
oat; genetic transformation; GFP; PCR test
2014-08-25
吉林省科技发展计划项目(20130102063JC);吉林省教育厅“十二五”科学技术研究项目(2013-258);长春师范大学自然科学基金项目 (2011D010)
王迅婧(1984-),女,吉林延边人,硕士研究生,主要从事植物与植物分子生物学研究。
倪秀珍(1967-),女,吉林长春人,教授,博士。
1000-2340(2015)04-0457-04
Q 819
A
