丛枝菌根真菌对刺槐幼苗机械损伤响应机制的初步研究
2015-06-27胡文涛
李 朕,胡文涛,唐 明
(1西北农林科技大学生命科学学院,陕西杨陵712100;2西北农林科技大学林学院,陕西杨陵712100)
丛枝菌根真菌对刺槐幼苗机械损伤响应机制的初步研究
李 朕1,胡文涛1,唐 明2*
(1西北农林科技大学生命科学学院,陕西杨陵712100;2西北农林科技大学林学院,陕西杨陵712100)
通过对刺槐幼苗每隔3d剪去1片叶片造成持续机械损伤,测定了0~138h抗氧化酶活性变化及刺槐幼苗生长情况;同时使用孔径25μm尼龙网设置三室根箱隔网系统,测定了供体瞬时机械损伤后受体的抗氧化酶活性的持续变化,探讨接种丛枝菌根真菌刺槐幼苗对持续及瞬时机械损伤后的响应机制,以及菌根菌丝桥对刺槐幼苗机械损伤信号的传递特征。结果表明:在持续机械损伤胁迫下,接种丛枝菌根真菌能够促进刺槐幼苗的根系生长、提高幼苗的成活率,接种丛枝菌根真菌的刺槐幼苗成活率及根系鲜重比对照分别增加15.38%和23.52%。瞬时机械损伤后0、48、90、114、138h刺槐幼苗的苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性都呈现先增加后降低的趋势,均在90h达到最大值,并且菌根化幼苗的PAL和POD活性显著高于未菌根化幼苗。瞬时机械损伤后,菌根菌丝桥能够介导刺槐幼苗间相关信号的传递,从而引起菌根化受体刺槐幼苗的PAL和POD活性表现出与供体机械损伤幼苗相同的变化趋势。
刺槐;丛枝菌根真菌;机械损伤;菌根菌丝桥
刺槐(Robinia pseudoacacia L.)在中国西北地区分布广泛,是耐寒、耐旱、耐湿、耐盐碱,抗逆性极强的乔木,具有很好的水土保持、防风固沙作用,因此成为中国西北黄土高原生态脆弱区沙漠化土壤改良的优良树种。然而西北风沙地区沙尘暴频繁,幼苗在移栽过程中受到风沙造成的机械损伤不可避免,加之干旱失水、温度等多种因子的限制,严重影响幼苗的成活[1]。尤其是风沙侵袭与动物取食等对幼苗造成的机械损伤,伴随着病虫害入侵,对幼苗的成活与生长危害更大。
丛枝菌根(arbuscular mycorrhizal,AM)真菌广泛分布于自然界中,能够与绝大多数维管植物根系形成互惠共生结构[2]。AM真菌能够提高植物的营养与水分的吸收利用[3],与其它土壤微生物协同促进植株生长[4],增强植物抗逆性[3,5]。AM真菌的根外菌丝在土壤中扩展时,可以继续侵染其它植株,在植株之间形成菌根菌丝桥[6],植株之间通过菌根菌丝桥进行物质传递和信号的传输[7-9]。
目前,付淑清等[10]接种AM真菌显著提高了刺槐生长状况和营养水平,杜小刚等[11]和刘振坤等[12]研究了不同树龄刺槐丛枝菌根根际微生物的群落多样性、AM真菌空间分布与根际土壤因子的关系,徐辉等[13]研究表明,AM真菌增加了陕北府谷砒砂岩区生长的刺槐对矿质元素的吸收,增强了其耐旱、耐盐能力。但是关于接种AM真菌的刺槐受到机械损伤后的响应及菌根菌丝桥对于机械损伤信号传导的研究尚未见报道。因此,本试验通过对刺槐幼苗模拟机械损伤,研究了接种AM真菌的植株和菌根菌丝桥介导的植株机械损伤后抗氧化酶苯丙氨酸解氨酶(PAL)与过氧化物酶(POD)活性变化。
1 材料和方法
1.1 试验材料
1.1.1 供试菌剂 供试AM真菌为摩西球囊霉(Funneliformis mosseae,原名Glomus mosseae)和根内球囊霉(Rhizophagus intraradices,原名Glomus intraradices)[14]。菌种由北京市农林科学院植物营养与资源研究所提供,经三叶草(Trifolium repens)扩繁(孢子密度R.intraradices为16.4个/g,F.mosseae为12.6个/g),将2种菌剂按照体积1∶1混合为供试菌剂。
1.1.2 供试植物 挑选饱满的刺槐种子(陕西省林业技术推广总站提供),用0.5%KMnO4溶液浸泡20min进行表面消毒,蒸馏水冲洗3次、无菌水浸泡24h后,置于铺有纱布的托盘上,在25℃光照培养箱中催芽,每天光照14h、换1次水。当种子胚根伸出约0.1cm时将种子播种在装有灭菌蛭石的育苗钵中(47cm×33cm,66孔),每孔播种3~4粒,将育苗钵置于25℃光照培养箱中继续培养,每天早上浇水(20mL/孔),待幼苗长至3cm时挑取长势一致的进行移栽。
1.1.3 供试基质 供试土壤采自西北农林科技大学林学院苗圃,过2mm筛,121℃、0.11MPa高压蒸汽灭菌2h;河沙过2mm筛,170℃干热灭菌4 h。将无菌土与河沙以体积比1∶1混合均匀作为供试基质。
1.2 试验设计
1.2.1 机械损伤后刺槐幼苗根系鲜重、成活率和PAL、POD活性测定 将供试基质装在15cm×13 cm的塑料盆中(2kg/盆),于基质表层下2cm处接种100g混合菌剂,每盆移栽1棵刺槐幼苗,以施等量灭菌剂作为对照,每个处理重复50盆,按照完全随机区组排列。置于25~35℃培养,每天光照12 h、浇水200mL/盆,每2周浇1次Hoagland营养液(200mL/盆)。培养4周后进行瞬时机械损伤和持续机械损伤处理:各持续机械损伤处理每隔3d从植株上随机剪去1片叶片,造成持续机械损伤,持续损伤2个月后测定刺槐幼苗成活率、根系鲜重和菌根侵染率;各瞬时机械损伤处理幼苗被剪去1片叶片后分别在0、42、90、114和138h测定PAL、POD活性。
1.2.2 机械损伤刺槐幼苗间信号传导试验 采用三室根箱隔网(25μm孔径尼龙网,菌丝可穿过,根系不能通过)装置[15],高15cm、宽10cm,两边室(A、B室)长3cm,中室(C室)长2cm(图1)。将供试基质装在根箱中(4kg/箱),刺槐幼苗移栽至A、B室。接种方法和培养条件同上,每个处理30箱。试验设置4个处理(表1),其中处理Ⅱ、处理Ⅲ和处理Ⅳ为对照,以分别排除由于根系分泌物、液体流动、地上部分气体挥发物等原因造成的信号传导的可能性[16]。
培养2个月后测定菌根侵染率,然后对A室植株(供体植株)每株随机剪去5片叶片造成机械损伤,每处理于损伤后0、42、90、114和138h随机选取5株B室植株(受体植株)进行POD和PAL活性检测[17],并检测A、B室菌根侵染率。
舒适护理能够有效改善护患关系,缓解患者恐惧、焦虑以及紧张等不良心理,从而以平稳的心态面对手术治疗,提升治疗效果。本次研究具体探究了将舒适护理应用在手术室护理工作中的临床效果,观察组患者手术后的焦虑评分情况、发生并发症的几率以及对护理工作的满意度明显优于对照组,差异有统计学意义(P<0.05)。
1.3 指标测定与方法
1.3.1 幼苗成活率与根系鲜重 统计接种与对照刺槐幼苗成活率。每处理存活植株中随机选取5株,从盆中小心取出刺槐幼苗,剪取根系部分,洗净基质、擦干后称量根系鲜重。
1.3.2 菌根侵染率 对各处理的苗木,随机选取5株,取全部根系,用清水轻轻冲洗干净,选取直径小于2mm的根系,剪成0.5~1.0cm长的根段,进行台盼蓝染色[18]。显微镜观察根段内侵染的菌丝、泡囊或丛枝,共检查150个根段。统计真菌侵染的根段长度,计算菌根侵染率[19]。
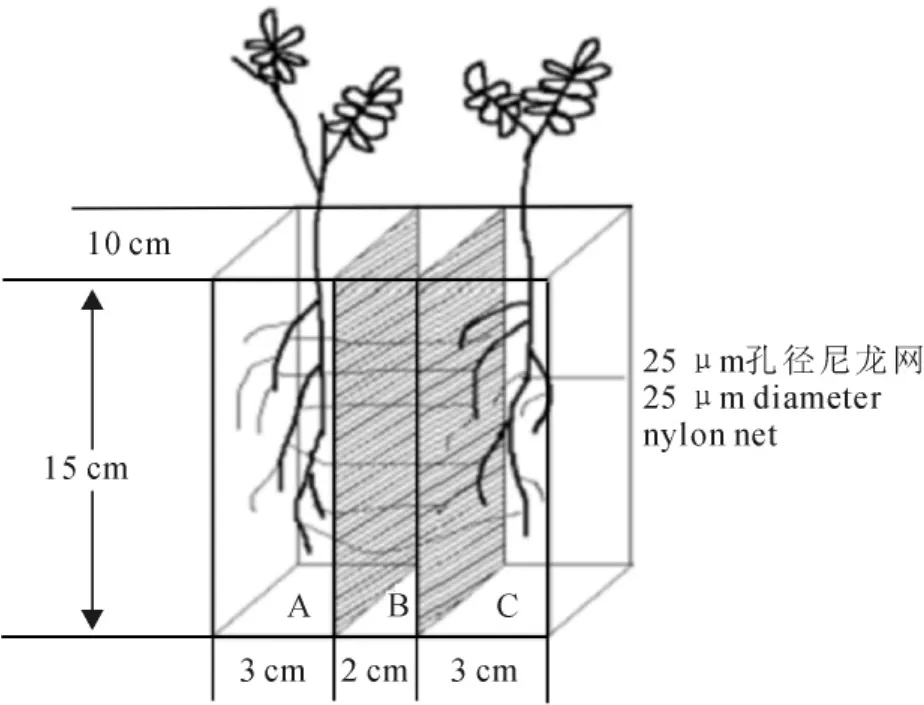
图1 三室根箱隔网系统Fig.1 Three-partments system
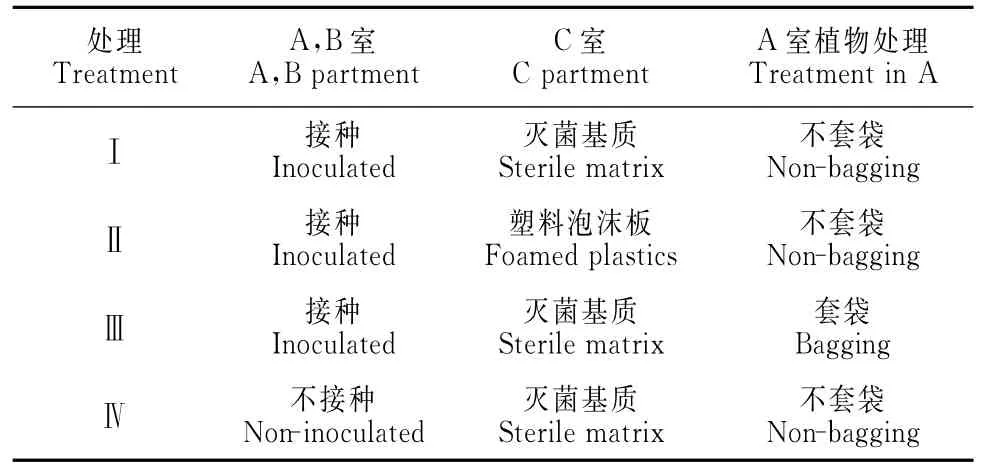
表1 三室根箱隔网系统处理Table 1 Treatments of three-partments system
菌根侵染率(%)=(有真菌侵染的根段长度/检查根段总长度)×100%
1.3.3 POD、PAL活性 对接种和对照各处理的苗木,机械损伤后0、42、90、114和138h随机选取5株,每株采集植株上部第4、5、6片完全展开叶,蒸馏水冲洗3次,擦干后采用高俊凤[17]方法测定PAL与POD活性。
1.4 数据分析
数据整理后,采用SPSS 17.0统计软件进行单因子方差分析(One-way ANOVA),绘图用Sigmaplot 10.0完成。
2 结果与分析
2.1 AM真菌对机械损伤幼苗根系鲜重和成活率的影响
对机械损伤处理刺槐幼苗培养2个月后,统计刺槐幼苗成活率、测定根系鲜重和菌根侵染率,结果见表2。在机械损伤的情况下,接种菌根真菌幼苗的平均菌根侵染率为91.57%;与对照植株相比,其幼苗成活率提高15.38%,根系鲜重提高23.52%(P≤0.05)。说明接种AM真菌能够促进机械损伤的刺槐幼苗根系更好地发育,使根系鲜重显著增加,提高了机械损伤刺槐幼苗的成活率。
2.2 AM真菌对机械损伤幼苗叶片POD、PAL活性的影响
从表3可以看出,接种与对照的刺槐幼苗机械损伤后POD和PAL活性变化现趋势相同,即先升高后降低,并在机械损伤后90h达到最大值,之后开始降低,机械损伤后活性增加,表明机械损伤处理能够引起刺槐幼苗防御反应,导致POD和PAL活性的增加。但是同时也发现接种幼苗的POD和PAL活性均高于对照,POD活性在0、4 2、1 1 4和138h分别比对照高出24.14%、22.13%、33.16%和10.94%,PAL活性则分别高出59.20%、19.42%、25.36%和30.15%,且大多均差异显著(P≤0.05,n=5)。说明接种AM真菌能够使POD和PAL活性显著提高,增强刺槐幼苗对机械损伤的防御反应能力,对于野外环境中刺槐在机械损伤后的正常生长有积极的作用。

表2 机械损伤后刺槐幼苗的菌根侵染率、成活率和根系鲜重Table 2 The infection rate,survival rate and average root fresh weight of black locust seedlings after continuous mechanical damage
2.3 机械损伤信号在幼苗间的传递途径
对根箱隔网系统菌根侵染率进行测定,结果(图2)表明,A室植株菌根真菌平均侵染率为89.8%,B室为85.6%,表明AM真菌已与刺槐幼苗形成了良好共生结构,建立了共生关系。
菌根菌丝桥介导的机械损伤信号对受体植株(B室)POD和PAL活性随时间变化情况见图3。其中,处理Ⅰ和Ⅲ中受体刺槐幼苗的PAL和POD活性随时间先增加后降低,处理Ⅱ和Ⅳ中的受体刺槐幼苗的PAL和POD活性随时间基本无变化。接种处理Ⅰ(不套袋)和处理Ⅲ(套袋)供体植株与受体植株间存在菌根菌丝桥,处理Ⅲ(套袋)隔断气体挥发物;而处理Ⅱ(接种、C室塑料泡沫板隔断)和处理Ⅳ(不接种)供体和受体植株间传递根系分泌物和无法形成菌根菌丝桥(表1),上述的受体植株PAL和POD活性变化趋势表明,刺槐幼苗间能够传递机械损伤信号,且这种信号传递是通过菌根菌丝桥而不是根系分泌物、气体挥发物。

表3 AM真菌对机械损伤幼苗POD、PAL活性的影响Table 3 Activities of POD and PAL of black locust seedlings after continuous mechanical damage

图2 持续机械损伤处理后A室和B室刺槐幼苗根系的菌根侵染率Ⅰ~Ⅳ处理方法见表1Fig.2 Infection rate of plants in A and B partments after continuous mechanical damageⅠ-Ⅳtreatment same as Table 1
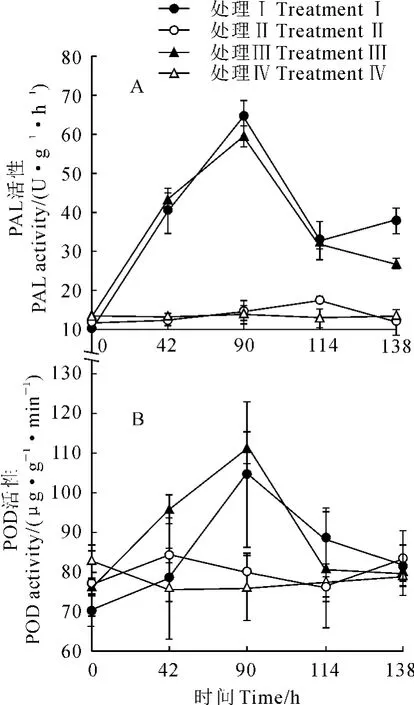
图3 B室植株PAL活性(A)和POD活性(B)Fig.3 Activities of PAL(A)and POD(B)of plants in B partment
2.4 菌根菌丝桥介导的机械损伤信号对POD和PAL活性的影响
对能够形成菌根菌丝桥的处理Ⅰ和处理Ⅲ与无菌根菌丝桥的处理Ⅳ(未接菌)的受体植株PAL与POD活性随时间的变化进行比较(表4),结果表明,处理Ⅰ和处理Ⅲ中B室受体刺槐幼苗PAL活性在机械损伤后42、90、114、138h分别比损伤处理前显著增加了204.1%和222.0%、355.6%和320.2%、155.7%和145.4%、184.6%和102.3%,均显著高于处理Ⅳ中同期的受体刺槐幼苗,而处理Ⅰ和处理Ⅲ之间PAL活性无显著差异。同样,处理Ⅰ和处理Ⅲ中B室受体刺槐幼苗POD活性在机械损伤后42、90、114、138h分别比损伤处理前显著增加了12.0%和26.0%、48.6%和46.4%、25.2%和6.0、16.1%和4.6%。同时,处理Ⅰ与处理Ⅳ中受体植株POD活性在0、42、114和138h没有显著差异,但在90h比处理Ⅳ显著增加了37.7%;处理Ⅲ与处理Ⅳ中受体植株POD活性在0、114和138h时没有显著差异,但在42h和90h处理Ⅲ比处理Ⅳ分别显著增加了26.8%和46.5%;机械损伤后受体POD活性同期处理Ⅰ与处理Ⅲ无显著差异。以上结果说明是菌根菌丝桥,并非挥发物质,能够介导刺槐幼苗间机械损伤信号并引起受体植株POD和PAL活性改变。
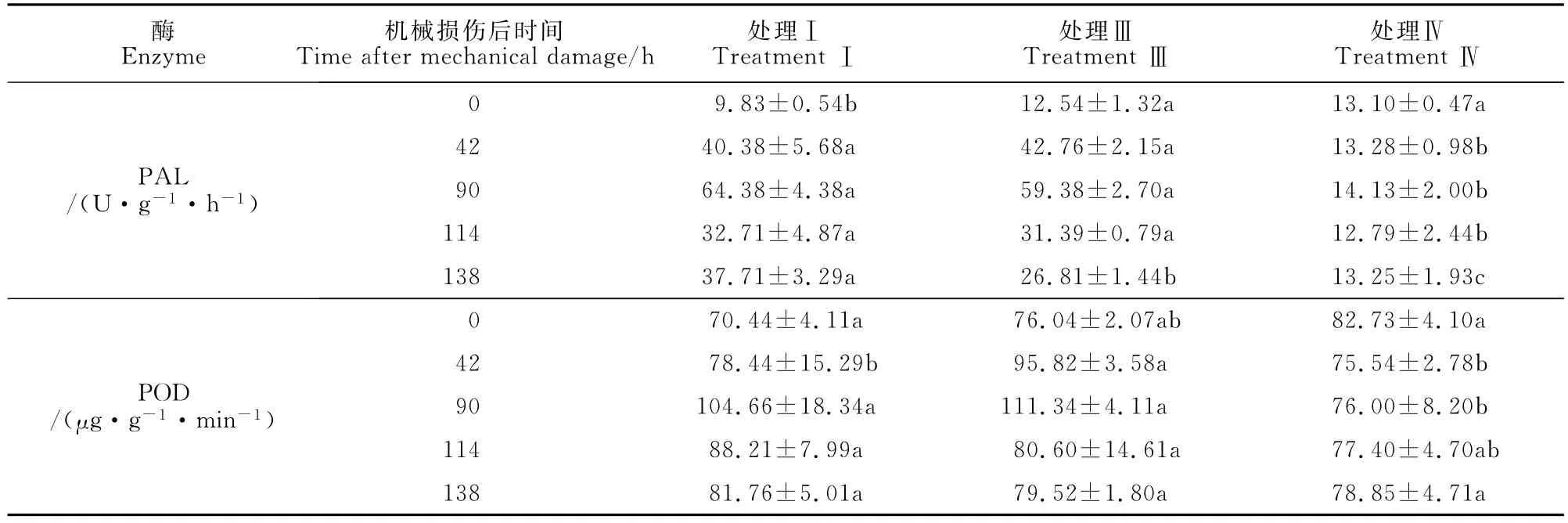
表4 B室植株PAL和POD活性Table 4 Activities of PAL and POD of plants in B partment
3 讨 论
大量研究表明,AM真菌能够促进植物根系的分枝与生长,改善植物营养状况,增加植物根际酶活性,提高植物光合特性等作用来增强植物对干旱、盐碱、病害等抗性[20-23]。本研究结果表明:接种AM真菌的刺槐幼苗接受机械损伤后,与不接种幼苗相比,根系鲜重显著增加,POD和PAL活性显著提高,进而提高了幼苗成活率。这可能是由于接种AM真菌增加了刺槐植株生物量,增强了树势[24];同时,植株POD和PAL活性的提高,有利于减轻植株受到胁迫造成的过氧化损伤[25],使得植株在受到胁迫后能更好地生长,对持续的机械损伤表现出更强的适应性。
有研究发现,14C可以通过菌丝桥从标记的植株(供体植株)向检测的植株(受体植株)体内转移,且该转移过程受生理过程的调节[9,26]。植物可以利用菌根菌丝桥通过茉莉酸途径等传递植物间抗病、抗虫信号引起植株的防御反应[7,27],但关于菌根菌丝桥对于机械损伤信号的传递未见报道。本试验设计排除了根系分泌物、液体流动与气体挥发物的影响,发现接种AM真菌不仅能够引起机械损伤刺槐幼苗POD和PAL活性的显著提高,而且还可通过菌根菌丝桥传递的相应信号,引发周围刺槐幼苗的POD和PAL活性的提高,使周围植物提前对机械损伤做好准备。
由此可见,AM真菌能够帮助刺槐幼苗缓解机械损伤造成的影响,且菌根菌丝桥能够介导刺槐幼苗间的机械损伤信号的传导。这对于中国西北荒漠化地区的刺槐幼苗在遭受风沙或者动物取食造成的机械损伤后更快、更强地产生防御反应,修复损伤,提高其成活率,加快中国西北地区生态恢复具有重要意义。
[1] LI J D(李继东),BI H T(毕会涛),WU Y X(武应霞),et al.Recent advances in effects of different stresses in transplant on the seedling performance[J].Scientia Silvae Sinicase(林业科学),2008,44(6):125-136(in Chinese).
[2] SMITH S E,READ D J.Mycorrhizal Symbiosis(3rd edit)[M].London:Elsevier Academic Publishers,2008.
[3] QIAO G,WEN X P,YU L F,et al.Identification of differentially expressed genes preferably related to drought response in pigeon pea(Cajanus cajan)inoculated by arbuscular mycorrhizae fungi(AMF)[J].Acta Physiologiae Plantarum,2012,34(5):1 711-1 721.
[4] MOHANDAS S,POOVARASAN S,PANNEERSELVAM P,et al.Guava(Psidium guajava L.)rhizophere Glomus mosseae spores harbor actinomycetes with growth promoting and antifungal attributes[J].Scientia Horticulturae,2013,150:371-376.
[5] CHEN S C,JIN W J,LIU A R,et al.Arbuscular mycorrhizal fungi(AMF)increase growth and secondary metabolism in cucumber subjected to low temperature stress[J].Scientia Horticulturae,2013,160:222-229.
[6] ZHANG J L(张俊伶),LI X L(李晓林),YANG ZH F(杨志福).VA mycorrhizal hyphae bridge and its ecological significance[J].World Agriculture(世界农业),1996,11:37-40(in Chinese).
[7] BABIKOVA Z,GILBERT L,BRUCE T J A,et al.Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack[J].Ecology Letters,2013,16(7):835-843.
[8] HUANG J H(黄京华),LUO SH M(骆世明),ZENG R S(曾任森).Mechanisms of plant disease resistance induced by arbuscular mycorrhizal fungi[J].Chinese Journal of Applied Ecology(应用生态学报),2003,5:819-822(in Chinese).
[9] JOHNSON D,LEAKE J R,OSTLE N,et al.In situ13CO2pulse-labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil[J].New Phytologist,2002,153(2):327-334.
[10] FU SH Q(付淑清),QU Q Q(屈庆秋),TANG M(唐 明),et al.Effects of nitrogen and AM fungi on the growth and nutrition metabolism of Robinia pseudoacacia[J].Scientia Silvae Sinicase(林业科学),2011,47(1):95-100(in Chinese).
[11] DU X G(杜小刚),TANG M(唐 明),CHEN H(陈 辉),et al.Mycorrhizae and diversity of microbial community in rhizosphere soils of Robinia pseudoacacia at different ages on the Loess Plateau[J].Scientia Silvae Sinicae(林业科学),2008,44(4):78-82(in Chinese).
[12] LIU ZH K(刘振坤),TIAN SH(田 帅),TANG M(唐 明).Spatial distribution of arbuscular mycorrhizal fungi and its relationship with soil factors in the rhizosphere of Robinia pseudoacaciaat different ages[J].Scientia Silvae Sinicae(林业科学),2013,49(8):89-95(in Chinese).
[13] XU H(徐 辉),TANG M(唐 明),GAO R X(高瑞霞),et al.Influences of soil factors on Robinia pseudoacacia and Hippophae rhamnoides AMF in soft rock zone of Fugu Qingshuichuan Valley[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2008,28(12):2 500 -2 505(in Chinese).
[14] KRüGER M,KRüGER C,WALKER C,et al.Phylogenetic reference data for systematics and phylotaxonomy of arbuscular mycorrhizal fungi from phylum to species level[J].New Phytologist,2012,193(4):970-984.
[15] SONG Y CH(宋勇春),FENG G(冯 固),LI X L(李晓林).Effect of vam fungi on phosphatase activity in the rhizosphere of clover[J].Chinese Journal of Applied and Environmental Biology(应用与环境生物学报),2000,6(2):171-175(in Chinese).
[16] NIE CH R(聂呈荣),LUO SH M(骆世明),ZENG R S(曾任森),et al.Research advances in cyclic hydroxamic acids,main allelochemicals of Zea mays[J].Chinese Journal of Applied Ecology(应用生态学报),2004,15(6):1 079-1 082(in Chinese).
[17] 高俊凤.植物生理学试验指导[M].北京:高等教育出版社,2006.
[18] 弓明钦,陈应龙,仲崇禄.菌根研究及应用[M].北京:中国林业出版社,1997.
[19] 刘润进,陈应龙.菌根学[M].北京:科学技术出版社,2007.
[20] GONG M G,TANG M,CHEN H,et al.Effects of two Glomus species on the growth and physiological performance of Sophora davidii seedlings under water stress[J].New Forests,2013,44:399-408.
[21] SHENG M,TANG M,CHEN H,et al.Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress[J].Mycorrhiza,2008,18(6):287-296.
[22] ZHANG R Q,TANG M,CHEN H,et al.Effects of ectomycorrhizal fungi on damping-off and induction of pathogenesis-related proteins in Pinus tabulaeformis seedlings inoculated with Amanita vaginata[J].Forest Pathology,2011,41:262-269.
[23] LI M(李 敏),LIU P Q(刘鹏起),LIU R J(刘润进).Effect of arbuscular mycorrhizal fungi on Micropagated Taro(Colocasia esculenta Schott.)[J].Acta Horticulturae Sinica(园艺学报),2002,29(5):451-453(in Chinese).
[24] HUANG Z,ZOU Z R,HE C X,et al.Physiological and photosynthetic responses of melon(Cucumis melo L.)seedlings to three Glomus species under water deficit[J].Plant and Soil,2011,339:391-399.
[25] ZHANG S,CHEN L H,DUAN B L,et al.Populus cathayana males exhibit more efficient protective mechanisms than females under drought stress[J].Forest Ecology and Management,2012,275:68-78.
[26] PEARSON J N,JAKOBSEN I.Symbiotic exchange of carbon and phosphorus between cucumber and three arbuscular mycorrhizal fungi[J].New Phytologist,1993,124(3):481-488.
[27] JUNG S C,MARTINEZ-MEDINA A,LOPEZ-RAEZ J A,et al.Mycorrhiza-induced resistance and priming of plant defenses[J].Journal of Chemical Ecology,2012,38(6):651-664.
(编辑:裴阿卫)
Basic Research on Response of Arbuscular Mycorrhizal Fungi to Robinia pseudoacacia L.Seedling with Mechanical Damage
LI Zhen1,HU Wentao1,TANG Ming2*
(1College of Life Sciences,Northwest A&F University,Yangling,Shaanxi 712100,China;2College of Forestry,Northwest A&F University,Yangling,Shaanxi 712100,China)
In this study,we tested the response of black locust(Robinia pseudoacacia L.)with instantaneous and continuous mechanical damage to the arbuscular mycorrhizal(AM)fungi,and using three-partments system tested the role of common mycorrhizal networks(CMNs)in transmitting mechanical damage related signal between black locust seedlings.We set seedlings with a leaf cut and with a leaf cut every 3 days as the instantaneous and continuous mechanical damaged treatments,respectively,and tested the POD,PAL activities at 0-138hand growth of the seedlings.Meanwhile,we used three-partments system with 25μm nylon net to test POD and PAL activities of receptor plants after the donor plants suffered the instantaneous and continuous mechanical damage.The results showed that AM fungi can promote root growth and improve the ratio of transplanting survival of the seedlings with continuous mechanical damages.Suffering from instantaneous mechanical damage,the activities of L-phenylalanin ammo-nialyase(PAL)and peroxidase(POD)increased for 90hand then decreased.Also,the PAL and POD activities ofmycorrhizal seedlings were significantly higher than that of the non-mycorrhizal seedlings.And CMNs can transmit signals relating to mechanical damage,resulting in alteration of PAL and POD activities of donor plants.
Robinia pseudoacacia L.;arbuscular mycorrhizal(AM)fungi;mechanical damage;common mycorrhizal networks(CMNs)
Q945.79
A
10.7606/j.issn.1000-4025.2015.07.1437
1000-4025(2015)07-1437-06
2014-12-03;修改稿收到日期:2015-05-22
林业公益性行业科研专项(201404217);国家自然科学基金(31170567,31270639);长江学者和创新团队项目(IRT1035)
李 朕(1990-),男,在读博士研究生,主要从事微生物生态研究。E-mail:15109241277@163.com
*通信作者:唐 明,博士,教授,博士生导师,主要从事森林微生物学的研究。E-mail:tangmingyl@163.com
