大豆籽粒镉积累QTL的整合及其分子标记的验证
2015-06-27邓小娟赵云云邱岱岱商瑞昕万海波阙祥祥杨存义
邓小娟,赵云云,邱岱岱,商瑞昕,王 朋,万海波,陈 可,阙祥祥,杨存义
(广东省植物分子育种重点实验室,国家大豆改良中心广东分中心,华南农业大学农学院,广州510640)
大豆籽粒镉积累QTL的整合及其分子标记的验证
邓小娟,赵云云,邱岱岱,商瑞昕,王 朋,万海波,陈 可,阙祥祥,杨存义*
(广东省植物分子育种重点实验室,国家大豆改良中心广东分中心,华南农业大学农学院,广州510640)
该研究在收集大豆籽粒镉积累定位信息的基础上,通过参考图谱分子标记比较整合已有的定位信息,进一步在‘中黄24’(籽粒高积累镉)与‘华夏3号’(籽粒低积累镉)衍生的(F6:7)重组自交系群体中,对大豆籽粒镉积累的QTL位点及其分子标记进行验证。结果表明,在不同群体中定位的籽粒镉积累2个主效QTL(Cda1和Cd1)位于第9染色体同一区域;该区段内候选基因GmHMA1的点突变,在籽粒镉积累不同的‘中黄24’和‘华夏3号’之间是一致的;该位点与‘中黄24’和‘华夏3号’各器官的镉浓度并无连锁关系。研究认为,‘中黄24’与‘华夏3号’间籽粒镉积累差异由其它位点控制,需要利用该重组自交系群体进行全基因组定位。
大豆;镉;积累;分子标记
随着采矿业的发展、含镉废水的农田灌溉、污泥的农业利用、磷肥的使用及矿区飘尘的沉降等,镉等重金属被大量输入土壤环境,镉污染已成为一个越来越严重的全球性环境问题[1]。土壤中的镉通过植物根系容易积累在植物体内,但镉是植物的一种非必需元素,不仅影响植物的生长和发育,而且通过食物链最终影响人类的健康[2-4]。因此有必要选育籽粒低积累镉的优良品种,在轻度、中度污染的土地上生产出符合要求的安全食品[5-6]。
大豆是易积累镉的作物之一,不仅在同样土壤上生产的粮食中大豆籽粒中镉浓度高于其他作物[79],而且在镉含量极低的田块中大豆籽粒中镉也会超过0.2mg·kg-1的国际标准[10-11]。大量研究表明不同大豆基因型间籽粒镉积累存在显著差异[5,1216],且是受主效基因控制,受环境影响较小[14],因此可以通过遗传育种手段有效降低籽粒镉积累。在育种群体中进行选择关键是指标,传统育种主要依据表型进行选择。虽然发现幼嫩叶子中镉浓度和成熟籽粒中镉浓度有极好的相关性,可将籽粒镉积累的选择提前到利用幼叶进行[14,17],但仍需要利用化学分析法检测镉含量,使得选育籽粒低积累优良品种仍是一项费时昂贵的工作。
分子标记辅助选择可在早期世代对单株进行基因型选择,能很好地满足镉积累性状的选择需求。开展分子标记辅助育种首先要有性状相关位点的定位信息,目前大豆籽粒镉积累相关位点的定位仅有两例报道,Jegadeesa[18]利用AC Hime×Westag-97、Leo×Westag-97等2个群体将控制籽粒镉积累的主效位点Cda1定位在第9号染色体上,可解释57.3%的表型变异。Benitez[19]利用高积累大豆品种Harosoy与低积累大豆品种Fukuyutaka所衍生的3个不同世代群体将控制籽粒镉积累的主效位点Cd1定位在第9号染色体上,可解释82.0%、57.0%、75.0%遗传变异。在定位的区域内确定GmHMA1/3为候选基因,并利用该基因序列在高积累镉品种和低积累品种间一个碱基的差异开发的CAPS标记,连锁分析证明该基因和籽粒镉积累的完全连锁[20]。同时发现高积累品种中表达的是该基因能转运镉的野生型,而低积累品种中表达的是该基因无转运镉能力的突变型[20-21]。
开展分子标记辅助育种前,有必要验证定位信息在不同遗传背景下的效应[22]。目前大豆籽粒镉积累的分子标记定位结果是在加拿大和日本大豆材料中获得的[18,20],也只在加拿大的大豆材料中做了分子标记验证[18,20]。虽然中国大豆资源的籽粒镉积累也存在显著差异[15-16],但尚未有利用中国大豆材料定位籽粒镉积累的报告,也未在中国大豆育种群体中对已定位信息进行验证。本研究首先整合大豆籽粒镉积累相关QTL定位的标记信息,然后在‘华夏3号’(中抗、低积累)和‘中黄24’(敏感、高积累)衍生的F6:7重组自交系群体中对已有定位信息进行验证,为华南地区大豆籽粒镉低积累的分子标记辅助育种提供依据。
1 材料与方法
1.1 试验材料
‘中黄24’(镉敏感、籽粒高积累)和‘华夏3号’(抗镉、籽粒低积累)及其衍生的168个F6:7代重组自交系(Recombinant inbred lines,RIL)。
1.2 方 法
1.2.1 重组自交系酶切分析 采用SDS法[23]抽提‘中黄24’、‘华夏3号’和168个重组自交系的基因组DNA,根据文献[18,20]设计CAPS标记引物(5′-TGACATCGGTATCTCACTGG-3′和5′-ATGACATTCTCAATTAGCTTTC-3′)。利用该引物对,分别以‘中黄24’、‘华夏3号’和168个重组自交系的DNA为模板,进行PCR扩增,扩增产物于37℃用BmrI酶酶切2h,在10%变性聚丙烯酰胺凝胶电泳,然后银染检测其DNA带型。
1.2.2 大豆籽粒镉积累相关分子标记信息整合
利用Mapchart 2.1软件将参考文献[18,20]中用不同作图群体定位的大豆籽粒镉积累QTL,通过共有标记及其各自标记的物理距离进行整合作图。具体如下:如果某一QTL的分子标记为原始图谱和参考图谱中的共有标记,就直接记录该标记在参考图谱中的对应坐标。对于原始图谱中新开发标记,则根据其在图谱上的物理位置将其映射参考图谱soymap2上,并计算其相对应的在参考图谱的物理距离。
1.2.3 大豆籽粒镉积累相关位点两侧SSR标记合成 依据文献[18,20]提供的序列信息合成了11对分布在第9染色体控制大豆籽粒镉积累主效基因Cda1/Cd1两侧的SSR引物,具体信息见表1。
1.2.4 重组自交系株系的分子标记分析 用与大豆籽粒镉积累主效QTL(Cda1/Cd1)紧密连锁的11对SSR引物,对168个重组自交系株系逐一检测,对扩增条带进行数据统计,将各株系在每个位点的带型和亲本比较,与母本‘中黄24’的带型相同记为1,与父本‘华夏3号’的带型相同记为3。
1.2.5 材料处理和样品镉浓度测定 根据带型统计结果,从群体中选择该区域基因型不同的10个株系,采用污染土盆栽。土壤从轻度污染田间采回后,经自然风干、捶碎、过筛,取样测定土壤背景值,镉浓度为1.03mg·kg-1。设置不加和加镉2个处理,取回的土壤拌匀装盆为不加镉处理,加镉处理为土壤中添加CdCl2·2.5H2O(分析纯,分子量为228.35)拌匀至土壤镉浓度为15.93mg·kg-1。静置1周,每盆装风干土7.0kg。选取籽粒饱满的大豆种子直接播于土壤中,每盆播种9粒,苗出齐后保留生长一致的3株。每处理重复3次,随机区组排列。在大豆生长期间每天以500~700mL自来水浇灌至成熟。
所有品种均在成熟期[24]分别收获,植株分为根、茎叶、荚壳和籽粒四部分在烘箱中烘干,样品至恒重后称重,然后采用硝酸-高氯酸消煮法[25]消煮,用火焰原子吸收分光光度法[26]测定各器官中镉含量。
1.3 数据分析
本实验数据用Microsoft Excel 2007(Microsoft Company,USA)进行平均数、标准误计算及作图,并使用SPSS 18.0统计软件进行方差分析。

表1 大豆籽粒镉积累位点Cda1两侧SSR的引物信息Table 1 SSR primers flanking on Cda1controlling grain cadmium in soybean
2 结果与分析
2.1 不同株系DNA扩增片段酶切带型
以‘中黄24’、‘华夏3号’和重组自交系的基因组DNA为底物,用引物(5′-TGACATCGGTATCTCACTGG-3′,5′-ATGACATTCTCAATTAGCTTTC-3′)进行PCR扩增,扩增产物约140~150bp,限制性内切酶BmrI完全酶切后都出现了2条带,产生一条大小为120bp带(图1)。结果表明,‘中黄24’(籽粒高积累品种)、‘华夏3号’(籽粒低积累品种)及其重组自交系,扩增产物为140~150bp大小且均能被限制性内切酶BmrI酶切成120bp片段,与Benitez等[20]的扩增片段和酶切片段大小均不同。表明‘华夏3号’和‘中黄24’基因组中该位点基因GmHMA1/3均是突变型。
2.2 大豆籽粒镉积累相关分子标记信息整合
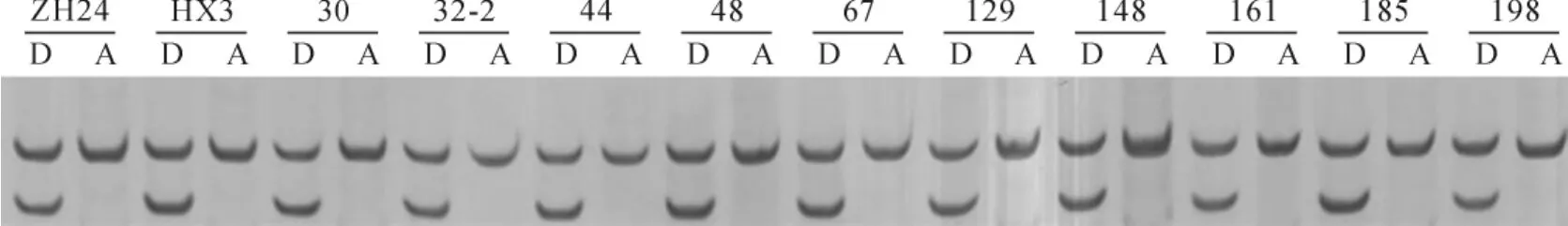
图1 部分株系的DNA扩增片段酶切结果ZH24.中黄24;HX3.华夏3号;30、32-2、44、48、67、129、148、161、185、198是‘中黄24’与‘华夏3号’的部分重组自交系;A.扩增片段;D.酶切片段。Fig.1 Patterns of DNA amplified fragments and digested by enzyme from partial RILs ZH24.Zhonghuang24;HX3.Huaxia3;30,32-2,44,48,67,129,148,161,185,198,are partial RILs derived from Zhonghuang24and Huaxia3;A.Amplified fragments;D.Digested fragments
不同研究组的科学家分别将大豆籽粒镉积累相关的QTLs定位在第9号染色体上,分别命名为Cd1和Cda1,Cda1与分子标记satk138、satk139、satk140、sack149、saatk150紧密连锁[18],Cd1与分子标记Gm09:4770663、Gm09:4790483紧密连锁[19]。通过原始图谱与参考图谱中的共有标记和物理距离进行整合,得到大豆籽粒镉积累相关性状QTL一致性图谱(图2)。从图2中发现2个研究组分别定位的控制大豆籽粒镉积累的QTL均位于大豆第9号染色体上引物Satk113与SatK75之间,定位区间有重叠,因此认为2个研究组定位的是同一个位点,记为Cda1。
2.3 Cda1附近分子标记对重组自交系的基因型分析
根据整合图谱,确定Cda1两侧紧密连锁的SSR引物根据染色体上的位置依次是Satk113、Satk122、Satk135、Satk139、Satk140、Sack149、Saatk150、Saatk155、Satk157、Satk58、Satk75(图2)。利用这些分子标记对‘中黄24’和‘华夏3号’衍生的F6:7重组自交系进行基因型分析,结果发现,在168个重组自交系中有71个株系该区段内的分子标记带型完全和‘中黄24’一样,67个株系该区段内的分子标记带型完全和‘华夏3号’一致,但有30个株系在该区段内发生了交换。
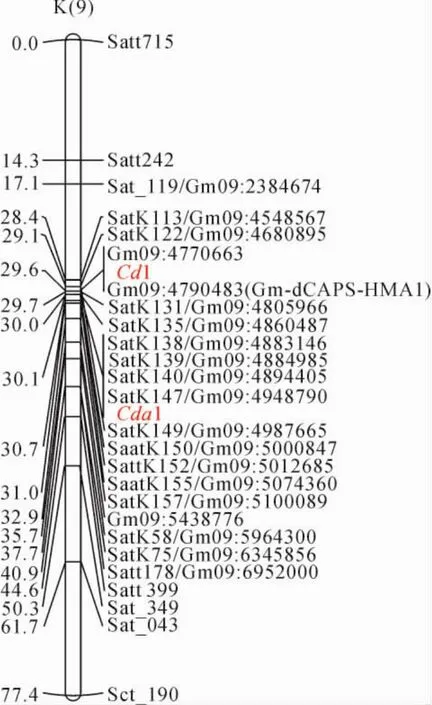
图2 大豆第9号染色体上Cda1/Cd1位点附近分子标记整合图Fig.2 Synthetic map of molecular markers around Cda1on Chr 9

表2 ‘中黄24’ב华夏3号’的重组自交系部分株系的基因型信息Table 2 Genotypes of partial RILs derived from‘Zhonghuang24’בHuaxia3’
根据分子标记分析结果发现,株系67和44在分子标记Satk157至Satk58间发生了交换,分子标记Satk113至Satk157区间和‘中黄24’一样;株系198在分子标记Saatk150和Satk58之间发生了双交换,而两侧标记和‘中黄24’一样;株系185和32-2在分子标记Satk122至Satk135间发生了交换,在分子标记Satk135至Satk75和‘中黄24’一样。因此将Satk135到Saatk155区间与‘中黄24’分子标记一样的株系67、44、198、185、32-2均记为‘中黄24’基因型P1(表2)。
根据分子标记分析的结果发现,株系148在分子标记Satk157至Satk58间发生单交换,分子标记Satk113至Satk157间和‘华夏3号’一样;株系48在分子标记Satk113至Satk122间发生交换,同时在分子标记Saatk155至Satk58间发生双交换,在分子标记Satk122至Saatk155间和‘华夏3号’一样;株系129在分子标记Satk122至Satk135间发生交换,分子标记Satk135至Satk75间和‘华夏3号’一样;株系161在分子标记Satk122至Satk135间、Satk157至Satk58间均发生交换;株系30在分子标记Satk122至Satk157间发生双交换,在分子标记Satk135至Saatk155间和‘华夏3号’一样。因此将在分子标记Satk135至Saatk155间与‘华夏3号’一样的株系148、48、129、161、30均记为‘华夏3号’基因型P2(表2)。
2.4 部分重组自交系各器官中镉浓度差异
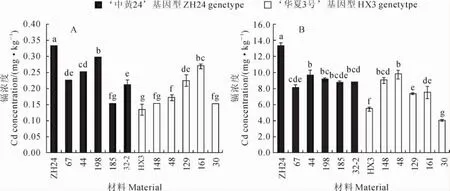
2.4.1 籽粒中镉浓度差异 在不加镉的土种植时,‘中黄24’籽粒镉浓度是0.33mg·kg-1,具‘中黄24’基因型的5个株系(67、44、198、185和32-2)中株系198籽粒镉浓度最高为0.30mg·kg-1,而株系185最低为0.15mg·kg-1,平均为0.23mg· kg-1;‘华夏3号’籽粒镉浓度为0.17mg·kg-1,具‘华夏3号’基因型的5个株系(148、48、129、161和30)中株系148和30的籽粒镉浓度最低为0.15 mg·kg-1,而株系161的籽粒镉浓度最高为0.27 mg·kg-1,平均为0.19mg·kg-1(图3,A)。在加镉的土种植时,‘中黄24’籽粒镉浓度为13.36mg· kg-1,具‘中黄24’基因型5个株系中株系44的籽粒镉浓度最高为9.70mg·kg-1,而株系67的籽粒镉浓度最低为8.09mg·kg-1,平均为8.92mg· kg-1;‘华夏3号’籽粒镉浓度为5.47mg·kg-1,具‘华夏3号’基因型5个株系中株系48的籽粒镉浓度最高为9.78mg·kg-1,而株系30的籽粒镉浓度最低为4.05mg·kg-1,平均7.54mg·kg-1;(图3,B)。结果表明,在2种镉浓度的土壤中具‘中黄24’基因型株系的籽粒镉浓度平均值高于‘华夏3号’基因型株系,但株系的籽粒镉浓度均不能明确依分子标记基因型分组(图3),表明Cda1位点并不是‘中黄24’和‘华夏3号’间籽粒镉积累差异的主效QTL。
比较亲本和重组自交系在高镉和低镉土壤中的表现发现,‘中黄24’籽粒中镉浓度均是最高,而‘华夏3号’籽粒中镉浓度只是在低镉土壤中最低。一些重组自交系在高、低镉浓度土壤中表现不同,如株系185和148的籽粒镉浓度在低镉土壤中与‘华夏3号’无显著差异,但在高镉土壤中显著高于‘华夏3号’,而株系30在2个土壤中籽粒镉浓度均较低。这一结果表明,大豆在不同镉浓度胁迫下籽粒积累可能存在不同的机制。
2.4.2 荚壳中镉浓度差异 在不加镉土壤中种植时,‘中黄24’荚壳中镉浓度为0.26mg·kg-1,具有‘中黄24’基因型的5个株系中株系198镉浓度最高为0.71mg·kg-1,而株系32-2最低为0.26 mg·kg-1,平均为0.45mg·kg-1;‘华夏3号’荚壳镉浓度为0.56mg·kg-1,具有‘华夏3号’基因型的5个株系中株系161和30的荚壳镉浓度最高为0.42mg·kg-1,而株系148最低为0.27mg· kg-1,平均为0.35mg·kg-1(图4,A)。在加镉的土壤中种植时,‘中黄24’荚壳镉浓度为14.93mg· kg-1,具有‘中黄24’基因型的5个株系中株系44的荚壳镉浓度最高为17.11mg·kg-1,而株系67最低为9.29mg·kg-1,平均为14.89mg·kg-1;‘华夏3号’荚壳的镉浓度为9.69mg·kg-1,具有‘华夏3号’基因型的5个株系中株系129荚壳镉浓度最高为12.59mg·kg-1,而株系30最低为8.37 mg·kg-1,平均为10.83mg·kg-1(图4,B)。虽然不同株系间荚壳镉浓度达到显著差异,但在两种浓度镉的土壤中各株系的荚壳镉浓度与分子标记基因型推测结果并不吻合,表明Cda1不是荚壳镉积累的主效位点。

图4 在不加镉(A)和加镉(B)土壤中部分株系豆荚壳的镉浓度Fig.4 Cd concentrations in pod hull of partial NIL lines in background(A)and added Cd soil(B)
比较亲本和重组自交系在不同镉浓度土中表现发现,‘华夏3号’荚壳镉浓度在低镉土壤中比‘中黄24’高,但在高镉土壤中比‘中黄24’低;株系32-2在低镉土壤中荚壳镉浓度较低,但在高镉土壤中荚壳镉浓度较高;株系198在两种镉浓度土壤中豆荚壳镉浓度都相对较高。这一结果表明这些系中控制荚壳镉积累的相关基因不同。
2.4.3 茎叶中镉浓度差异 在不加镉的土壤中种植时,‘中黄24’茎叶镉浓度为1.41mg·kg-1,具有‘中黄24’基因型的株系中株系198的茎叶镉浓度最高为1.85mg·kg-1,而株系67最低为0.82 mg·kg-1,平均为1.16mg·kg-1;‘华夏3号’茎叶镉浓度为0.98mg·kg-1,具有‘华夏3号’基因型的5个株系中株系30的茎叶镉浓度最高为1.21 mg·kg-1,而株系48最低为0.60mg·kg-1,平均为0.74mg·kg-1(图5,A)。在加镉的土壤中种植时,‘中黄24’茎叶镉浓度为44.26mg·kg-1,具有‘中黄24’基因型的5个株系中株系198最高为62.09mg·kg-1,而株系185最低为31.59mg· kg-1,平均为45.34mg·kg-1;‘华夏3号’茎叶镉浓度为19.40mg·kg-1,具有‘华夏3号’基因型的5个株系中株系161最高为51.00mg·kg-1,而株系148最低为27.26mg·kg-1,平均为34.10mg ·kg-1(图5,B)。虽然具有‘中黄24’基因型的株系平均茎叶镉浓度略高于具有‘华夏3号’基因型,但两组材料并不能明显分组,与分子标记基因型结果并不吻合,因此认为Cda1位点不能解释‘中黄24’和‘华夏3号’茎叶镉浓度量的差异。
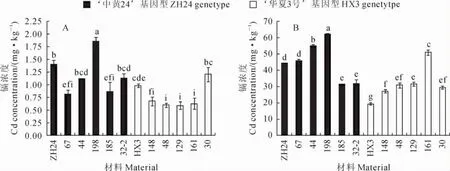
图5 在不加镉(A)和加镉(B)土壤中各株系茎叶镉浓度的差异Fig.5 Cd concentrations in leaves of partial NIL lines in background(A)and added Cd soil(B)
比较亲本和重组自交系在不同镉浓度土中表现发现,‘华夏3号’和株系67在低镉土壤中茎叶镉浓度中等,而在高镉土壤中‘华夏3号’最低的,株系67却相对较高,‘中黄24’和株系198在两种土壤中表现较为一致,株系198在两种土壤中茎叶镉浓度都是最高的。结果表明在不同镉水平下这些株系中茎叶镉积累的机制不相同。
2.4.4 根系镉浓度差异 在不加镉的土壤中种植时,‘中黄24’根系的镉浓度为0.71mg·kg-1,具有‘中黄24’基因型的5个株系中株系44根系镉浓度最高为0.92mg·kg-1,而株系32-2最低为0.71 mg·kg-1,平均为0.84mg·kg-1;‘华夏3号’根系镉浓度为0.92mg·kg-1,具有‘华夏3号’基因型的5个株系中株系48根系镉浓度最高为1.01 mg·kg-1,而株系30最低为0.68mg·kg-1,平均为0.87mg·kg-1(图6,A)。在加镉土壤中种植时,‘中黄24’根系镉浓度为106.25mg·kg-1,具有‘中黄24’基因型的5个株系中株系198最高为105.24mg·kg-1,而株系185最低为43.23mg· kg-1,平均为81.04mg·kg-1;‘华夏3号’根系镉浓度为51.24mg·kg-1高,具有‘华夏3号’基因型的5个株系中株系48最高为136.28mg·kg-1,而株系30最低为32.85mg·kg-1,平均为85.97 mg·kg-1(图6,B)。依据两组株系的根系镉浓度与分子标记基因型结果并不吻合,表明Cda1与根系镉浓度没关系。
所有器官中根系的镉浓度最高,在高镉土壤中根系镉浓度是籽粒的5~18倍。各株系在低镉土壤中根系镉浓度最高1.01mg·kg-1,最低0.68 mg·kg-1,相差0.33mg·kg-1,但高镉土壤中最高136.3mg·kg-1,最低32.85mg·kg-1,相差103.45mg·kg-1。在低镉土壤中,‘中黄24’与‘华夏3号’根系镉浓度无差异,但在高镉土壤中‘中黄24’显著地高于‘华夏3号’。重组自交系表现各不同,具有‘华夏3号’基因型的株系48和株系161在高、低镉土壤中根系镉浓度均是最高,而具有‘华夏3号’基因型的株系30在高、低镉土壤中均是最低;具有‘中黄24’基因型的株系185和具有‘华夏3号’基因型的株系129在低镉土壤和高镉土壤中表现不同。这些结果进一步表明这些系中根系镉积累的基因各不相同。
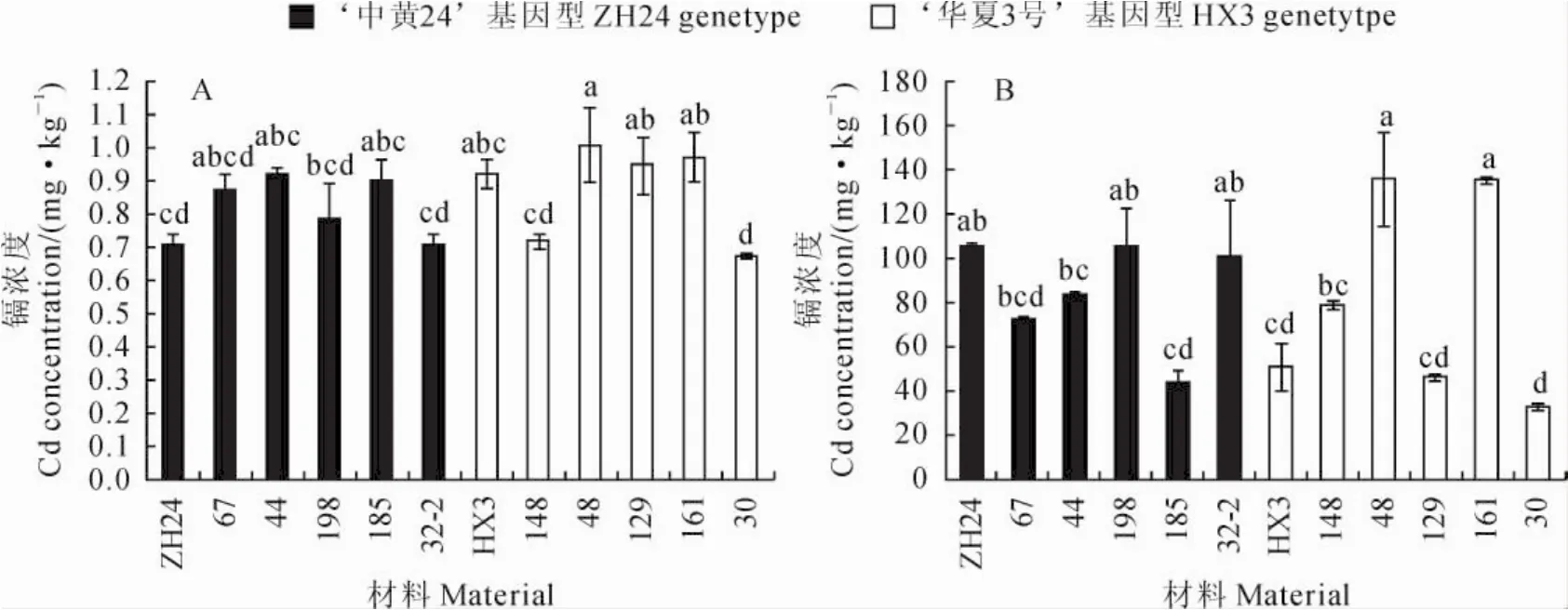
图6 在不加镉(A)和加镉(B)土壤中各株系根系镉浓度的差异Fig.6 Cd concentrations in roots of partial NIL lines in background(A)and added Cd soil(B)
3 讨 论
大豆籽粒镉积累存在着显著的基因型差异[4,1214],是受主效基因控制,受环境影响较小[14]。Jegadeesan[18]和Benitez[19-20]利用不同的群体分别将控制籽粒镉积累的主效位点Cda1和Cd1定位在第9号染色体上。本研究通过将两个研究组定位的分子标记和大豆公共图谱进行了比较,发现2个定位结果均位于第9号染色体的引物Satk113与SatK75区间。在由‘中黄24’ב华夏3号’衍生的F6:7重组自交系群体中对该位点进行了验证,发现具有‘中黄24’基因型的株系和具有‘华夏3号’基因型的株系各器官镉浓度与依据分子标记基因型推测的结果不一致。因此认为基因Cda1并不是决定‘中黄24’和‘华夏3号’各器官镉积累差异的主效位点,另有新的未知位点决定‘中黄24’和‘华夏3号’间籽粒镉积累差异。
利用双亲本遗传群体进行定位时,受遗传背景、群体性质等因素的影响,通常会得到不同的结果[22]。Jegadeesan[18]定位大豆籽粒镉积累主效位点Cda1时群体是由3个加拿大的品种衍生的,而Benitez[19-20]进行定位研究中高积累亲本Harosoy也来自加拿大,因此定位区间相同。而本研究用于验证的F6:7重组自交系群体是由中国大豆品种‘中黄24’和‘华夏3号’杂交衍生的,出现与已有位点不同的新位点。同时发现株系30在高镉土壤中籽粒镉积累远低于‘华夏3号’,出现超亲分离的现象,表明大豆‘中黄24’和‘华夏3号’镉积累是由多个基因决定的。在拟南芥、水稻中发现镉积累是由多个基因控制[27-28]。水稻籽粒镉积累的QTL分别在在第3、4、6、7、8、11染色体上定位到了1个与糙米镉积累能力相关的基因[29],其中第11染色体多次出现,而第7染色体主效QTL在3个不同背景材料中定位[30-32],并被克隆命名为OsHMA3[33-35]。因此,有必要利用‘中黄24’和‘华夏3号’的重组自交系群体来进一步进行全基因组定位,寻找与积累相关的QTL位点,才能在中国开展大豆的镉低积累分子育种。同时认为通过幼嫩叶子中镉浓度来判断成熟籽粒中镉浓度的方法[14,17]并不可靠,且在做镉抗性和积累筛选时要考虑浓度的选择。
[1] LIU J(刘 俊),LIAO B H(廖柏寒),ZENG Q R(曾清如),et al.Advances on physiological and ecological effects of cadmium on legume crops[J].Asian J Ecotoxicol(生态毒理学报),2010,5(2):295-301(in Chinese).
[2] J RUP L.Hazards of heavy metal contamination[J].British Medical Bulletin,2003,68(1):167-182.
[3] LIN Y F,AARTS M G.The molecular mechanism of zinc and cadmium stress response in plants[J].Cell Mol.Life Sci,2012,69(19):3 187-3 206.
[4] LIU J(刘 俊),LIAO B H(廖柏寒),ZHOU H(周 航),et al.Effects of Cd2+on the physiological and biochemical properties of Glycine maxin flowering-poding phase[J].Ecol.Environ.Sci.(生态环境学报),2009,18(1):176-182(in Chinese).
[5] GRANT C A,CLARKE J M,DUGUID S,et al.Selection and breeding of plant cultivars to minimize cadmium accumulation[J].Sci.Total.Environ.,2008,390(2-3):301-310.
[6] ZHAO Y Y(赵云云),GUO X L(郭秀兰),ZHONG C X(钟彩霞),et al.Advance in breeding of Cd-tolerant and low-accumulating soybean cultivars[J].Mol.Plant Breed(on line)(植物分子育种(网络版)),2011,9(96):1 692-1 699(in Chinese).
[7] WOLNIK K A,FRICKE F L,CAPAR S G,et al.Elements in major raw agricultural crops in the United States.1.Cadmium and lead in lettuce,peanuts,potatoes,soybeans,sweet corn,and wheat[J].Journal of Agricultural and Food Chemistry,1983,31(6):1 240-1 244.[8] SALAZAR M J,RODRIGUEZ J H,LEONARDO N G,et al.Effects of heavy metal concentrations(Cd,Zn and Pb)in agricultural soils
near different emission sources on quality,accumulation and food safety in soybean[Glycine max(L.)Merrill][J].J.Hazard Mater.,2012,233-234:244-253.
[9] HAO X,ZHOU D,WANG Y,et al.Accumulation of Cu,Zn,Pb,and Cd in edible parts of four commonly grown crops in two contaminated soils[J].Int.J Phytoremediation,2011,13(3):289-301.
[10] SANITÀD T L,GABBRIELLI R.Response to cadmium in high plants[J].Environmental and Experimental Botany,1999,41(2):105-130.
[11] SHUTE T,MACFIE S M.Cadmium and zinc accumulation in soybean:A threat to food safety?[J].Sci.Total.Environ.,2006,371(1 -3):63-73.
[12] ARAO T,AE N,SUGIYAMA M,et al.Genotypic differences in cadmium uptake and distribution in soybeans[J].Plant and Soil,2003,251(2):247-253.
[13] BOGGESS S F.Differential response of soybean varieties to soil cadmium[J].Agronomy Journal,1978,70(5):756.
[14] ARAO T,ISHIKAWA S.Genotypic differences in cadmium concentration and distribution of soybean and rice[J].Japan Agricultural Research Quarterly,2006,40(1):21-30.
[15] ZHAO Y Y(赵云云),ZHONG C X(钟彩霞),FANG X L(方小龙),et al.Genotypic differences in tolerance and accumulation to Cd among summer-sowing soybean varieties in South China[J].Soybean Science(大豆科学),2013,32(3):336-340(in Chinese).
[16] ZHAO Y Y(赵云云),ZHONG C X(钟彩霞),FANG X L(方小龙),et al.Genotypic differences of cadmium tolerance among spring-soweing soybean varieties in South China[J].Journal of South China Agricultural University(华南农业大学学报),2014,35(3):111-113(in Chinese).
[17] SUGIYAMA M,AE N,ARAO T.Accumulation of large amounts of Cd in the root may limit the accumulation of Cd in edible aboveground portions of the plant[J].Plant Soil,2007,295:1-11.
[18] JEGADEESAN S,YU K,POYSA V,et al.Mapping and validation of simple sequence repeat markers linked to a major gene controlling seed cadmium accumulation in soybean[Glycine max(L.)Merr][J].Theor.Appl.Genet,2010,121(2):283-294.
[19] BENITEZ E R,HAJIKA M,YAMADA T,et al.A major QTL controlling seed cadmium accumulation in soybean[J].Crop Science,
2010,50(5):1 728.
[20] BENITEZ E R,HAJIKA M,TAKAHASHI R.Single-base substitution in P1B-ATPase gene is associated with a major QTL for seed cadmium concentration in soybean[J].J.Hered,2012,103(2):278-286.
[21] WANG Y,YU K,POYSA V,et al.A single point mutation in GmHMA3affects cadimum(Cd)translocation and accumulation in soybean seeds[J].Molecular Plant,2012,5(5):1 154-1 156.
[22] COLLARD B C,MACKILL D J.Marker-assisted selection:an approach for precision plant breeding in the twenty-first century[J].Philosophical Transactions of the Royal Society B:Biological Sciences,2008,363(1 491):557-572.
[23] WANG X D(王晓丹),LÜH Y(吕慧颖),ZHANG J(张 敬),et al.Comparative study on methods of extraction DNA from soybean leaf for PCR[J].Mol.Plant Breed.(分子植物育种),2004,2(6):891-894(in Chinese).
[24] CHIERA J,GRABAU E.Localization of myo-inositol phosphate synthase(GmMIPS-1)during the early stages of soybean seed development[J].Journal of Experimental Botany,2007,58(8):2 261-2 268.
[25] TAO SH H(陶曙华).Improvement of national standard methods to mensurate the content of cadmium in rice[J].China Rice(中国稻米),2007,(3):23-25(in Chinese).
[26] 鲁如坤.土壤农业化学常规分析方法[M].北京:中国农业科技出版社,2000:477-479.
[27] ZHANG B J(张标金),ZHANG X X(张祥喜),LUO L G(罗林广).The major gene families related to cadmium absorption and transportation in plants[J].Genom.Appl.Biol.(基因组学与应用生物学),2013,32(1):127-134(in Chinese).
[28] CLEMENS S,AARTS M G,THOMINE S E B,et al.Plant science:the key to preventing slow cadmium poisoning[J].Trends in Plant Science,2013,18(2):92-99.
[29] ISHIKAWA S,AE N,YANO M.Chromosomal regions with quantitative trait loci controlling cadmium concentration in brown rice(Oryza sativa)[J].New Phytol.,2005,168(2):345-350.
[30] UENO D,KOYAMA E,KONO I,et al.Identification of a novel major quantitative trait locus controlling distribution of Cd between roots and shoots in rice[J].Plant and Cell Physiology,2009,50(12):2 223-2 233.
[31] ISHIKAWA S,ABE T,KURAMATA M,et al.A major quantitative trait locus for increasing cadmium-specific concentration in rice grain is located on the short arm of chromosome 7[J].J.Exp.Bot.,2010,61(3):923-934.
[32] TEZUKA K,MIYADATE H,KATOU K,et al.A single recessive gene controls cadmium translocation in the cadmium hyperaccumulating rice cultivar Cho-Ko-Koku[J].Theor.Appl.Genet.,2010,120(6):1 175-1 182.
[33] UENO D,YAMAJI N,KONO I,et al.Gene limiting cadmium accumulation in rice[J].Proc.Natl.Acad.Sci.USA,2010,107(38):16 500-16 505.
[34] MIYADATE H,ADACHI S,HIRAIZUMI A,et al.OsHMA3,a P1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating efflux into vacuoles[J].New Phytol.,2011,189(1):190-199.
[35] UENO D,KOYAMA E,YAMAJI N,et al.Physiological,genetic,and molecular characterization of a high-Cd-accumulating rice cultivar,Jarjan[J].J.Exp.Bot.,2011,62(7):2 265-2 272.
(编辑:宋亚珍)
Integration and Valuation of QTLs Controlling Cadmium Accumulation in Soybean Grains
DENG Xiaojuan,ZHAO Yunyun,QIU Daidai,SHANG Ruixin,WANG Peng,WAN Haibo,CHEN Ke,QUE Xiangxiang,YANG Cunyi*
(Guangdong Provincial Key Laboratory of Plant Molecular Breeding;Sub-center of National Soybean Improvement Center;College of Agriculture,South China Agricultural University,Guangzhou 510642,China)
In this study,we integrated the mapping information based on collecting of positioning information about QTLs related to cadmium accumulation in soybean grains.Then the recombinant inbred line(RIL)population(F6:7)derived from‘Zhonghuang24(ZH24)’and‘Huaxia3(HX3)’were used to validate one major QTL Cda1/Cd1which controlled the cadmium accumulation in soybean grain.The results showed that the major QTL Cda1/Cd1,which were mapped by two groups,actually located in the same fragment on chromosome 9.The point mutation in GmHMA1,that one of the candidate gene for Cda1,was similar in ZH24and HX3.The Cda1was not linked with the differences of cadmium concentration in various organs between ZH24and HX3.The findings indicated that there were other new QTLs controlling the difference of cadmium accumulation in grain between ZH24and HX3.It is necessary to make genome-wide scanning and identification in future.
soybean;cadmium;accumulation;molecular markers
Q789;Q948.116
A
10.7606/j.issn.1000-4025.2015.07.1394
1000-4025(2015)07-1394-09
2015-03-27;修改稿收到日期:2015-05-25
国家高技术研究发展计划(2012AA101106)、广东省农业科技项目(2013B020301)、国家自然科学基金(31271745)。
邓小娟(1990-),女,硕士,研究方向为大豆分子育种。E-mail:scau_dxj@163.com
*通信作者:杨存义(1966-),男,博士,副教授。主要从事植物营养性状遗传学与改良研究。E-mail:ycy@scau.edu.cn
