番茄红素对血管内皮细胞损伤的保护作用
2015-06-27宁静张松张余杭
宁静,张松,张余杭
(郑州市第九人民医院1.老年二科;2.眼科;3.病理科,郑州 450053)
番茄红素对血管内皮细胞损伤的保护作用
宁静1,张松2,张余杭3
(郑州市第九人民医院1.老年二科;2.眼科;3.病理科,郑州 450053)
目的 研究番茄红素对香烟烟雾提取物致血管内皮细胞损伤的保护作用。方法 将人脐周静脉血管内皮细胞(HUVEC)分为4组,对照组不做任何处理,其余3组分别使用10% 香烟烟雾提取物(CSE)、10%CSE+1.0 μmol·L-1番茄红素及1.0 μmol·L-1番茄红素处理。MTT法分析各组细胞增殖情况,活性氧簇(ROS)检测试剂盒检测各组细胞内ROS水平,流式细胞仪分析各组细胞周期和凋亡率,实时荧光定量PCR(qRT-PCR)、Western blot技术分析各组细胞沉默信息调节蛋白1(SIRT1)表达水平。结果 10%CSE组、10%CSE+1.0 μmol·L-1番茄红素组、1.0 μmol·L-1番茄红素组细胞存活率分别为(56.7±5.1)%,(75.6±7.1)%和(95.5±9.7)%。ROS检测发现,对照组、10% CSE组、10%CSE+1.0 μmol·L-1番茄红素组和1.0 μmol·L-1番茄红素组相对荧光强度分别为25.3±3.9,67.3±4.6,45.3±3.9,20.8±2.9。10%CSE可引起细胞发生G2期阻滞,番茄红素处理可以缓解此效果。对照组、10% CSE组、10%CSE+1.0 μmol·L-1番茄红素组和1.0 μmol·L-1番茄红素组凋亡率分别为(6.2±0.5)%,(30.8±4.3)%,(18.3±1.9)%,(7.6±0.4)%。qRT-PCR分析发现,与对照组比较,10%CSE组 SIRT1 mRNA表达是其(0.51±0.03)倍,10%CSE+1.0 μmol·L-1番茄红素组为(0.84±0.05)倍、1.0 μmol·L-1番茄红素组为(1.31±0.08)倍。Western blot蛋白条带分析结果与qRT-PCR结果一致。结论 番茄红素可以减轻CSE对HUVEC的损伤作用,其机制可能与番茄红素提高SIRT1表达有关。
番茄红素;血管内皮细胞,人脐周静脉;香烟烟雾;沉默信息调节蛋白1
老年人是动脉粥样硬化(atherosclerosis,AS)常见发病人群,因为老年人常伴有高血压、血脂代谢异常、糖尿病等,这些均是AS发生的高危因素。AS可导致动脉管腔变窄、弹性减弱,引起血栓以及供血障碍,是心脑血管病的病理基础[1]。发生于冠状动脉的AS可引起心绞痛、猝死,严重威胁老年人群健康。AS发生的机制之一是血管内皮细胞(vascular endothelial cell,VEC)损伤,VEC损伤后屏障功能减弱,通透性增高,大量脂质在内皮下沉积;损伤的VEC对单核细胞粘附增加,单核细胞粘附后迁入内皮下间隙,分化为巨噬细胞,摄取低密度脂蛋白胆固醇,成为泡沫细胞,引发AS[2-3]。吸烟是导致AS的危险因素,因为香烟烟雾可以损伤VEC,引起VEC增殖抑制,诱导凋亡,其机制之一为香烟烟雾中的大量氧化物质能造成VEC的氧化损伤[4]。因此抗氧化可以作为防治香烟烟雾损伤的切入点。番茄红素的抗氧化性已有报道[5],但番茄红素能否对抗香烟烟雾引起的氧化损伤笔者少见报道,其机制有待研究。沉默信息调节蛋白1(silent information regulator 1,SIRT1)在抑制氧化应激、保持内皮稳态方面起着重要作用[6]。笔者以人脐周静脉VEC(human umbilical vein endothelial cell,HUVEC)为对象,观察番茄红素能否减轻香烟烟雾提取物造成的VEC损伤,并观察此过程中SIRT1的表达变化,以期揭示番茄红素对抗香烟烟雾损伤的机制。
1 材料与方法
1.1 细胞 HUVEC细胞株(上海拜力生物科技有限公司)。
1.2 试剂与仪器 小牛血清(杭州天杭生物制品有限公司,批号:20130813),达尔伯克必需基本培养液(Dulbecco's minimum essential medium,DMEM)购自美国Gibco公司(批号:12491-015),活性氧簇(reactive oxygen species,ROS)检测试剂盒(北京碧云天生物制品有限公司,批号:S0033),90%~95%番茄红素(批号:75051)、噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT]试剂(批号:M5655)、凋亡检测试剂盒(批号:APOAF-20TST)、碘化丙啶(propidium iodide,PI,批号:P4170)均购自美国Sigma公司,RNA提取试剂盒购自美国QIAGEN公司(批号:931636),ImProm-Ⅱ®反转录试剂盒(批号:K1005S)、GO Taq®qPCR Master Mix(批号:A6001)均购自普洛麦格(北京)生物技术有限公司,小鼠抗人SIRT1多克隆抗体(批号:sc-74504)、小鼠抗人β-actin多克隆抗体(批号:sc-130300)、辣根过氧化物酶(horse radish peroxidase,HPR)标记山羊抗小鼠二抗(批号:sc-2005)均购自美国SANTA CRUZ公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:P1511)、超敏电化学发光液(super electrochemistry liquid,Super ECL)(批号:P1020)均购自北京普利莱基因技术有限公司。ELx800酶标仪(美国biotek公司),FC500MCL流式细胞仪(美国贝克曼公司),S1000PCR仪(美国BIO-RAD公司),7700型荧光定量PCR分析系统(美国Applied Biosystems公司)。Western blot系统(北京六一仪器厂)。
1.3 细胞的培养 细胞培养环境为37 ℃,5%二氧化碳(CO2)培养箱,培养液使用含10%小牛血清的DMEM培养液。细胞消化采用0.25%胰酶,细胞汇合度70%~80%时传代,取对数期细胞进行后续实验。
1.3 香烟烟雾提取物(cigarette smoke extract,CSE)的制备与番茄红素的配制 参考YOON LEE等方法并根据实际情况改进,搭建CSE采集系统,10 mL注射器反复抽吸3支去过滤嘴香烟产生的烟雾,并将所有烟雾溶于20 mL无血清DMEM培养液,调整pH为7.5,以灭菌后的孔径0.22 μm过滤器除去细菌和大颗粒杂质。以此溶液作为100%CSE原液,10%CSE在此基础上使用无血清DMEM培养液稀释,所制备的CSE需在0.5 h内使用。番茄红素溶解于四氢呋喃,制备成10 mmol·L-1母液,冻存于-80 ℃超低温冰箱备用。每次实验时临时用DMEM培养液稀释10 000倍,制备成1.0 μmol·L-1工作液。
1.4 MTT分析 取对数期细胞接种于96孔培养板,细胞贴壁后,随机分为4组:对照组,不做任何处理;10%CSE组,仅用10%CSE处理细胞;10%CSE+1.0 μmol·L-1番茄红素组,同时使用10%CSE和1.0 μmol·L-1番茄红素处理细胞;1.0 μmol·L-1番茄红素组,仅用1.0 μmol·L-1番茄红素处理细胞。各组设5个平行孔,并设置空白调零孔。继续培养24 h,各孔加入MTT15 μL后继续培养4 h,小心弃去上清液,二甲亚砜150 μL充分溶解孔底蓝紫色结晶,酶标仪测定波长490 nm处吸光度(A)值,计算各组细胞存活率,实验重复3次。细胞存活率(%)=(实验组A值/对照组A值)×100%。
1.5 细胞内ROS水平检测 细胞分组和处理同“1.4”项,用各浓度CSE处理细胞24 h后,小心吸取培养液,消化细胞,将细胞重悬浮于含有终浓度为1.0 μmol·L-12',7'-二氯荧光黄双乙酸盐(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针无血清培养液。混匀后放入培养箱避光孵育0.5 h。随后800 r·min-1(r=11 cm)离心5 min,去除上清液,使用无血清培养液小心反复洗涤、离心3次,洗去残留探针。最终用磷酸盐缓冲液(phosphate buffered solution,PBS)2 mL重新悬浮细胞,确保细胞密度为1×106个·mL-1,使用荧光酶标仪上机测量各组细胞荧光强度,激发波长488 nm,发射波长525 nm。实验重复3次。
1.6 细胞周期分析 细胞分组和处理如“1.4”项,培养24 h后,收集细胞,使用预冷的冰PBS洗涤细胞,然后使用70%预冷乙醇,4 ℃固定12 h。使用PBS再次洗涤细胞,加入50 μg·mL-1PI 500 μL,4 ℃避光染色30 min。随后,使用流式细胞仪分析细胞周期。实验重复3次。
1.7 细胞凋亡分析 细胞分组和处理同“1.4”项。培养24 h后,收集细胞,使用预冷冰PBS洗涤细胞,离心后使用Annexin V-FITC 凋亡检测试剂盒缓冲液500 μL重悬浮细胞。依次加入Annexin V 5 μL以及PI10 μL,常温避光静置10 min后,使用流式细胞仪分析细胞凋亡率。实验重复3次。
1.8 实时荧光定量PCR检测SIRT1的mRNA表达 细胞分组和处理同“1.4”项。使用RNA提取试剂盒提取各组细胞RNA。使用ImProm-II®反转录试剂盒对提取出的RNA进行反转录,以合成cDNA。反转录体系参照试剂盒提供的说明书。使用GO Taq®qPCR Master Mix试剂盒对上述合成的cDNA进行PCR扩增。反应体系和方案参照试剂盒说明书。SIRT1上游引物为5′-GTATTTATGCTCGCCTTGCTG -3′,下游引物为5′-TGACAGAGATGGCTGGAAT-3′;内参GAPDH上游引物为5′-AGAAGGCTGGGGCTCATTTG -3′,下游引物为5′-AGGGGCCATCCACAGTCTTC -3′。使用2-△△CT法分析各样本SIRT1mRNA相对表达情况。实验重复3次。
1.9 Western blot 检测SIRT1蛋白表达 使用含有1%蛋白酶抑制剂混合物的RIPA蛋白裂解液(每孔500 μL)裂解细胞10 min,4 ℃12 000×g离心,取上清液。使用BCA蛋白定量分析盒,按说明书确定每孔蛋白的浓度。将总蛋白样本与5倍浓缩(5×)缓冲液混匀,煮沸5 min后上样,每孔上样量保证为30 μg。使用12%聚丙烯酰胺凝胶电泳,电压110 V,时间1.5 h。随后在冰浴中转膜,使用聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,转膜条件为恒流250 mA,时间1.5 h。转膜结束后,使用5%脱脂奶粉室温封闭1 h。分别使用小鼠抗人SIRT1多克隆抗体(1:500),小鼠抗人β-actin多克隆抗体(1:1 500)4 ℃孵育12 h。接着使用磷酸盐-聚山梨酯-20缓冲液(phosphate-tween-20 buffer,PBST)洗涤3次,除去未结合的一抗。使用HPR标记的二抗避光孵育膜2 h。用超敏电化学发光液(super electrochemistry liquid,Super ECL)发光试剂盒处理膜条,曝光显影后分析蛋白条带。实验重复3次。
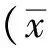
2 结果
2.1 细胞增殖情况 见图1。10% CSE处理HUVEC细胞后,细胞增殖被明显抑制,细胞存活率降至(56.7±5.1)%,与对照组比较,差异有统计学意义(P<0.05),提示10%CSE可以抑制细胞增殖。10%CSE+1.0 μmol·L-1番茄红素组细胞增殖受到抑制,细胞存活率(75.6±7.1)%,与对照组比较,差异有统计学意义(P<0.05),但该存活率明显高于10%CSE处理组(P<0.05),提示1.0 μmol·L-1番茄红素可以削弱CSE增殖抑制作用。1.0 μmol·L-1番茄红素处理组细胞存活率(95.5±7.8)%,与对照组比较,差异无统计学意义。
与对照组比较,*1P<0.05;与10%CSE组比较,*2P<0.05
图1 4组细胞存活率
Compared with control group,*1P<0.05;compared with 10% CSE group,*2P<0.05
Fig.1 Cell survival rates of 4 groups of cells
2.2 细胞内ROS水平 装载ROS检测试剂盒中的DCFH-DA探针后,对照组相对荧光强度(25.3±3.9),10%CSE组相对荧光强度(67.3±4.6),两组比较,差异有统计学意义(P<0.05),提示10%CSE处理后细胞内ROS水平升高。10%CSE+1.0 μmol·L-1番茄红素组相对荧光强度为(45.3±3.9),与对照组和10%CSE组比较,差异有统计学意义(P<0.05)。1.0 μmol·L-1番茄红素组相对荧光强度为(20.8±2.9),与对照组比较,差异无统计学意义(图2)。

与对照组比较,*1P<0.05;与10%CSE组比较,*2P<0.05
图2 4组细胞ROS水平
Compared with control group,*1P<0.05;compared with 10% CSE group,*2P<0.05
Fig.2 ROS levels of 4 groups of cells
2.3 CSE可以引起细胞发生G2期阻滞,番茄红素可以减轻该效果 见图3。流式细胞仪分析可见对照组G1/G0百分比为(72.0±6.3)%,G2/M期的百分比为(10.5±2.1)%。;10%CSE组G1/G0百分比为(53.1±7.2)%,G2/M期百分比为(27.5±1.6)%,与对照组比较,差异有统计学意义(P<0.05),提示10%CSE处理导致细胞G2期阻滞。10%CSE+1.0 μmol·L-1番茄红素组G1/G0百分比为(65.0±3.3)%,G2/M期百分比为(17.5±3.1)%。与对照组和10%CSE组比较,均差异有统计学意义(P<0.05)。1.0 μmol·L-1番茄红素组G1/G0百分比为(70.5±3.5)%,G2/M期百分比为(9.3±3.6)%,与对照组比较,差异无统计学意义。
2.4 CSE诱导细胞凋亡,番茄红素减轻该效果 见图4。流式细胞仪分析后获得各组散点图,以右上象限+右下象限所占比例作为细胞凋亡率。10%CSE处理组凋亡率(30.8±4.3)%,对照组凋亡率(6.2±0.5)%,10%CSE处理组明显高于对照组(P<0.05),提示CSE处理可以诱导细胞凋亡。10%CSE+1.0 μmol·L-1番茄红素组凋亡率(18.3±1.9)%,与对照组和10%CSE组比较,均差异有统计学意义(P<0.05),提示对于CSE处理的HUVEC,番茄红素有抗凋亡作用。单纯番茄红素处组细胞凋亡率为(7.6±0.4)%,与对照组比较,差异无统计学意义。
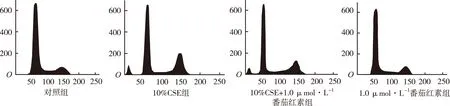
图3 流式细胞仪分析4组细胞的细胞周期

图4 流式细胞仪分析4组细胞凋亡率
2.5 CSE处理后SIRT1表达水平降低,番茄红素可以提高SIRT1表达 见图5。qRT-PCR检测发现,10%CSE处理后,SIRT1 mRNA表达显著下降,相对表达水平为(0.51±0.03),与对照组比较,差异有统计学意义(P<0.05)。10%CSE+1.0 μmol·L-1番茄红素组细胞SIRT1 mRNA表达下降,相对表达水平为(0.84±0.05),与对照组和10%CSE组比较,均差异有统计学意义(P<0.05)。1.0 μmol·L-1番茄红素组SIRT1mRNA表达增高,与对照组比较,增高了(1.31±0.08)倍(P<0.05)。Western blot分析结果与qRT-PCR结果一致,10%CSE组细胞SIRT1蛋白水平降低,10%CSE+1.0 μmol·L-1番茄红素组SIRT1与对照组比较,亦有所降低,但显著高于10%CSE组,蛋白条带灰度值分析,差异有统计学意义(P<0.05)。1.0 μmol·L-1番茄红素组SIRT1蛋白表达增高(图6)。上述结果提示番茄红素对HUVEC的保护作用可能通过提高SIRT1蛋白表达来实现。
3 讨论
香烟烟雾中含有大量自由基之类的强氧化剂,这些物质进入人体后,通过复杂的反应生成ROS,包括过氧化氢、超氧阴离子等。这些物质在细胞内蓄积导致细胞氧化应激损伤[8]。氧化应激损伤范围广泛,能够对蛋白、糖、脂质、核酸造成损伤,从多个通路途经引起细胞的结构和功能障碍,其中较为严重的损伤是影响细胞的增殖,诱导细胞凋亡[9-10]。笔者在本研究中发现,使用10%CSE处理HUVEC,细胞增殖受到抑制,发生G2期阻滞,同时凋亡显著增多。证实CSE确实能够造成血管内皮损伤,同时细胞内ROS水平检测证实,CSE可能通过提高细胞内ROS水平,引发氧化应激损伤VEC。VEC的损伤是AS发生初期的关键环节,大量研究表明,AS发生过程中如脂质斑块的形成等环节均存在VEC的凋亡。VEC凋亡或因增殖障碍不能及时更新,会导致其屏障功能丧失,脂质异常渗入,还可引起血小板黏附聚集,导致血栓形成,同时还会造成单核细胞浸润,进而形成大量泡沫细胞[11]。因此使用抗氧化药物抵抗氧化损伤是预防AS的重要切入点,尤其对于有长期吸烟史的老年人更为重要。
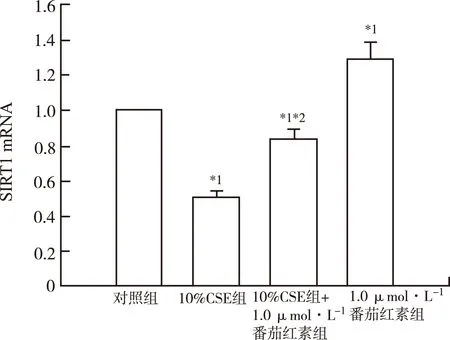
与对照组比较,*1P<0.05;与10%CSE组比较,*2P<0.05
图5 4组细胞SIRT1 mRNA表达水平
Compared with control group,*1P<0.05.compared with 10% CSE group,*2P<0.05
Fig.5 mRNA expression of SIRT1 in four groups of cells
番茄红素是一种不饱和类胡萝卜素,主要存在与茄科植物如西红柿中,是天然的、具有清除自由基、消除单线氧态能力的抗氧化剂。研究证实番茄红素能够通过抗氧化作用保护神经细胞,缓解缺血-再灌注损伤,并且具有一定的抗癌作用[5,12]。 本研究使用番茄红素处理HUVEC后,明显缓解CSE造成的损伤效果,同时降低细胞内ROS水平,提示番茄红素能够抑制CSE造成的氧化损伤。进一步研究其机制发现,CSE处理能够降低SIRT1表达水平,而番茄红素能够从一定程度上提高SIRT1表达。SIRT1具有去乙酰酶活性,与心血管疾病中的关系较紧密,它主要通过调节乙酰化/去乙酰化平衡来调控组蛋白及其他转录调节因子,进而维持与凋亡、氧化相关的一系列蛋白的活性[13]。如SIRT1可以通过FOXO通路抑制细胞凋亡、通过AMPK通路减少ROS水平,当然AS中存在SIRT1的低表达也已被证实[14-15]。这些机制能够解释本研究中CSE处理后,HUVEC的SIRT1表达降低。同时本研究结果也提示番茄红素的抗氧化作用的其中一个机制是提高SIRT1表达。总之,本研究发现番茄红素能够缓解CSE造成的VEC损伤,其机制与SIRT1的表达有关。
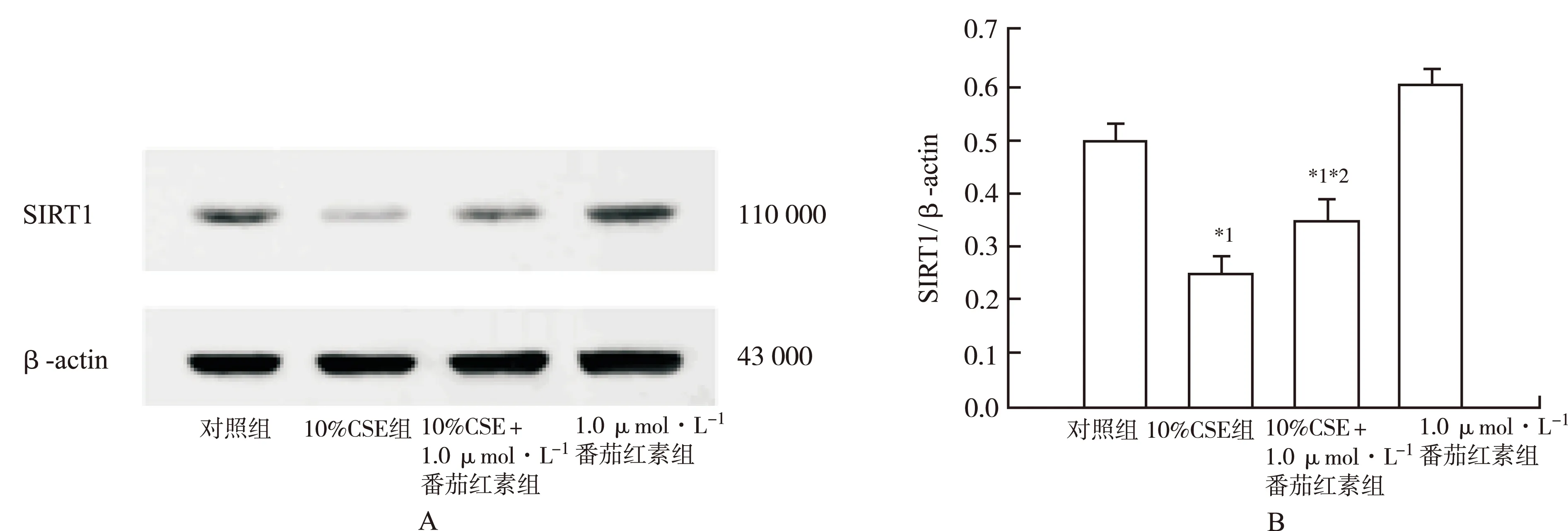
与对照组比较,*1P<0.05;与10%CSE组比较,*2P<0.05;A.蛋白条带;B.SIRT1条带相对于β-actin条带的灰度值
图6 4组细胞SIRT1 蛋白表达水平
Compared with control group,*1P<0.05.compared with 10% CSE group,*2P<0.05.A.protein bands in western blot.B.band indensity(SIRT1/β-actin)
Fig.6 Potein expression of SIRT1 in 4 groups of cells
[1] 陈汇.他汀类药物抗动脉粥样硬化研究进展[J].医药导报,2007,26(4):331-334.
[2]FIGAROLA J L,SINGHAL J,RAHBAR S,et al.LR-90 prevents methylglyoxal-induced oxidative stress and apoptosis in human endothelial cells[J].Apoptosis,2014,19(5):776-788.
[3] PEJKOV H, KEDEV S, PANOV S,et al.Atherosclerosis of coronary blood vessels-local or systemic inflamation?[J].Prilozi,2013,34(3):5-11.
[4] MESSNER B,BERNHARD D.Smoking and cardiovascular disease:mechanisms of endothelial dysfunction and early atherogenesis[J].Arterioscler Thromb Vasc Biol,2014, 34(3):509-515.
[5] DITOMO P,CANALI R,CIAVARDELLI D,et al.beta-Caro-tene and lycopene affect endothelial response to TNF-alpha reducing nitro-oxidative stress and interaction with monocytes[J].Mol Nutr Food Res,2012,56(2):217-227.
[6]YAO H,SUNDAR I K,AHMAD T,et al.SIRT1 protects against cigarette smoke-induced lung oxidative stress via a FOXO3-dependent mechanism[J].Am J Physiol Lung Cell Mol Physiol,2014,306(9):L816-828.
[7] YOON J S, LEE H J, CHAE M K, et al. Cigarette smoke extract-induced adipogenesis in Graves' orbital fibroblasts is inhibited by quercetin via reduction in oxidative stress[J].J Endocrinol,2013,216(2):145-156.
[8] KHANNA A,GUO M,MEHRA M,et al.Inflammation and oxidative stress induced by cigarette smoke in Lewis rat brains[J].J Neuroimmunol,2013,254(1-2):69-75.
[9] WALCZAK-JEDRZEJOWSKA R,WOLSKI J K,SLOWIKO-WSKA-HILCZER J.The role of oxidative stress and antioxidants in male fertility[J].Cent Eur J Urol,2013,66(1):60-67.
[10] JUNG W W.Protective effect of apigenin against oxidative stress-induced damage in osteoblastic cells[J].Int J Mol Med,2014,33(5):1327-1334.
[11]ROBASZKIEWICZ A, BARTOSZ G, PITTA R, et al.HOCl-modified phosphatidylcholines induce apoptosis and redox imbalance in HUVEC-ST cells[J].Arch Biochem Biophys,2014,548:1-10.
[12] SILBERSTEIN T, SILBERSTEIN E, SAPHIER O.Lyco-pene and tomatoes-their effect on prevention of prostatic cancer[J].Harefuah,2013,152(8):461-499.
[13] IIJIMA K.Bone and calcium update;diagnosis and therapy of bone metabolism disease update.Regulatory mechanism of mammalian sirtuin SIRT1 in vascular calcification:impact of vascular smooth muscle cell senescence[J].Clin Calcium,2011,21(12):53-60.
[14] HORI Y S, KUNO A, HOSODA R, et al.Regulation of FOXOs and p53 by SIRT1 modulators under oxidative stress[J].PLoS One,2013,8(9):e73875.
[15] IIJIMA K.Hyperphosphatemia and cardiovascular diseases :impact of vascular calcification and endothelial dysfunction[J].Clin Calcium,2012,22(10):1505-1513.
DOI 10.3870/yydb.2015.07.004
Protection of Lycopene Against the Injury of Vascular Endothelial Cells
NING Jing1, ZHANG Song2, ZHANG Yuhang3
(1.TheSecondDepartmentofGeriatrics;2.DepartmentofOphthalmology;3.DepartmentofPathology,the9thPeople’sHospitalofZhengzhouCity,Zhengzhou450053,China)
Objective To study the protective effect of lycopene on vascular endothelial cell injury by cigarette smoke extract (CSE). Methods CSE was prepared and the human umbilical vein endothelial cells (HUVECs) were assigned into four groups, cells in control were untreated,and cells in other three groups were treated by 10%CSE, 10%CSE+1.0 μmol·L-1lycopene and 1.0 μmol·L-1lycopene, respectively.Cell viability was evaluated using MTT assay.The intracelluar reactive oxygen species (ROS) level was detected by ROS assay kits.Cell cycle and apoptosis were analyzed by flow cytometry.SIRT1 expression was detected by real-time fluorescence quantification PCR (qRT-PCR) and Western blot. Results Cell viability in 10%CSE group, 10%CSE+1.0 μmol·L-1lycopene or 1.0 μmol·L-1lycopene group was (56.7±5.1)%,(75.6±7.1)% and (95.5±9.7)%, respectively.ROS assay showed that the relative fluorescence intensity in the control was 25.3±3.9, however, in 10%CSE group, 10%CSE+1.0 μmol·L-1lycopene group or 1.0 μmol·L-1lycopene group were 67.3±4.6, 45.3±3.9 and 20.8±2.9, respectively.10%CSE could induce G2arrested and which could be antagonized by 1.0 μmol·L-1lycopene.The apoptosis rate in the control, 10%CSE group, 10%CSE+1.0 μmol·L-1lycopene group or 1.0 μmol·L-1lycopene group was (6.2±0.5)%, (30.8±4.3)%, (18.3±1.9)% and (7.6±0.4)%, respectively.As shown in qRT-PCT testing, compared with the control, mRNA of SIRT1 in 10%CSE group, 10%CSE+1.0 μmol·L-1lycopene group and 1.0 μmol·L-1lycopene group was (0.51±0.03) fold, (0.84±0.05) fold, and (1.31±0.08) fold compared to the control, the data from western blot were consistent with qRT-PCR results. Conclusion Lycopene can prevent HUVECs from injury induced by CSE by upregulation of SIRT1.
Lycopene;Vascular endothelial cell, human umbilicalvien;Cigarette smoke;Silent information regulator 1
2014-05-27
2014-06-20
宁静(1974-),女,河南郑州人,副主任医师,学士,主要研究方向:老年病及心脑血管疾病。E-mail:zhengzhou9yningj@163.com。
R286;R965
A
1004-0781(2015)07-0860-06
