关节外整块切除肩胛带恶性肿瘤的手术及术后功能研究
2015-06-26谢璐郭卫汤小东杨荣利
谢璐 郭卫 汤小东 杨荣利
关节外整块切除肩胛带恶性肿瘤的手术及术后功能研究
谢璐 郭卫 汤小东 杨荣利
目的 研究关节外整块切除肩胛带恶性肿瘤的手术方法及术后功能。方法 回顾性研究了北京大学人民医院骨与软组织肿瘤中心自2001年7月1日至2013年9月30日期间因肩胛带恶性肿瘤行关节外整块切除全肩胛骨或部分肩胛骨的病例33例,并对不同手术方式、软组织重建的功能学预后进行总结。26例肿瘤起源于肩胛骨或其周围软组织的恶性肿瘤行经典的Tikhoff-Linberg术式,7例起源于肱骨近端且累及肩关节的恶性肿瘤行改良的Tikhoff-Linberg术式。其中9例使用韧带增强重建系统特制的人工韧带材料(ligament advanced reinforcement system,LARS)韧带进行了软组织重建,随访不同软组织重建方式患者的功能恢复情况。结果 平均骨与软组织肿瘤功能评分(musculoskeletal tumor society score,MSTS)为17.6(95%CI15.9~19.4),经典的Tikhoff-Linberg术式的MSTS评分为17.6(95%CI15.5~19.6),而改良的Tikhoff-Linberg术式评分为18.1(95%CI13.8~22.3)。LARS韧带重建后的患者平均得分为18.6(95%CI13.9~22.4),而未行LARS韧带软组织重建的患者得分为17.2(95%CI15.5~19.6)。结论 Tikhoff-Linberg术对累及肩关节的肩胛带恶性肿瘤是一种有效而广泛地切除肿瘤的术式,并且保留了手和肘关节的功能。采用LARS韧带进行软组织修复并不能显著改善肩关节的功能。
肩胛带;恶性肿瘤;手术;功能
肩胛带是一个相对常见的骨与软组织原发恶性肿瘤好发的部位[1-2]。这个区域的特殊解剖学特点使骨肿瘤外科医师很难在切除肿瘤的同时最大限度地保留肩关节的功能及外观。上肢切断术和肩关节离断术曾是切除肩胛带恶性肿瘤公认的术式,但随着肿瘤早期诊断技术的进步以及对肿瘤生物学特性认识的加深,通过保肢术关节外整块切除恶性肿瘤越来越为大家所采用。Tikhoff-Linberg术式[3]最早于1928年被提出。进而,该术式的各种改良术式相继出现,并最后由Malawer提出了详细的肩胛带肿瘤切除方式的分型[4]。
起源于肩关节的高级别肉瘤经常浸润盂肱关节,若关节本身被浸润,则需行关节外整块切除以保证满意的肿瘤边界。多项研究[1,5-6]证实关节外切除盂肱关节(Malawer分型Ⅴ)[4]可达到满意的局部肿瘤控制。因为该项改良术式保留了大部分肩胛骨及周围的多数肌肉,使其可获得更令人满意的外形及上肢功能。相比而言,肩胛骨或肩胛骨周围肉瘤因外展肌群不得不被切除,术后长期功能更难以恢复。
本文旨在对我中心因肩胛带恶性肿瘤行经典或改良的Tikhoff-Linberg术(Malawer Ⅳ、Ⅵ或Ⅴ)[4]的病例进行肿瘤学及功能学预后的随访和比较,并进一步讨论手术技术及不同的软组织重建方式对患者肩关节长期功能可能产生的影响。
对 象 与 方 法
回顾研究了自2001年7月至2013年9月在北京大学人民医院骨与软组织肿瘤中心行肩胛带肿瘤切除的194例连续病例。肿瘤起源于肱骨近端130例,肩胛骨40例,周围软组织24例。入组标准包括:(1)所切除的肿瘤为肩胛带原发的肉瘤或已造成肩关节明显骨质破坏的孤立转移癌;(2)入组病例为我中心初治,事先未行活检及手术;(3)所行术式为经典或改良的Tikhoff-Linberg术(Malawer Ⅳ、Ⅵ或Ⅴ)[4]。我们排除了经过不恰当术前活检或先前局部已行手术治疗后肿瘤复发和经关节内的全肩胛骨切除或仅切除了肱骨近端而未行肩胛盂切除的病例。
最后入组35例病例,其中2例因未随访而被排除。剩下的33例中男性22例,女性11例,平均年龄43(17~82)岁。根据Malawer肩胛带切除分型[4],21例行关节外肱骨头和全肩胛骨切除(Ⅳ型),7例行关节外肱骨近端及部分肩胛骨切除(Ⅴ型),5例行关节外肱骨近端及全肩胛骨切除(Ⅵ型),见表1。
术前,所有的患者均行肿瘤病灶局部的X线、CT和MRI检查,以及胸部CT、全身骨扫描,确认肿瘤分期。若考虑到肿瘤有臂丛或腋血管浸润的可能,则需行肿瘤血管造影,以便设计手术策略。
肿瘤的分期情况主要根据Enneking分期系统[1]。对骨肉瘤、尤文肉瘤/PNET以及软组织恶性肿瘤的患者还需给予新辅助化疗。肿瘤的切缘肉眼及镜下由两位有经验的病理科医师分别进行评估,若他们之间意见分歧,则由第三位,通常是更高年资的病理学医师进行判定。
手术根据已有的手术报道[7]进行。患者一般侧卧位,切口通常需考虑联合前、后入路。前侧切口始自锁骨的内、中1/3处,沿胸大肌、三角肌间隙下行,至上肢的二头肌内缘。活检部分应距正常皮肤2~3 cm处切除。切开皮肤及浅筋膜,保留深筋膜,前方皮瓣自胸大肌分离至远侧1/3,暴露胸大肌止点,并在止点处切断。先行前路分离锁骨,并于中、内1/3处断开,以便分离和保护锁骨下动脉。同时,这项操作步骤有利于分离腋血管和臂丛,以便观察肿瘤浸润情况进而判断该肿瘤是否为可切除的肿瘤,以便选择恰当的治疗策略(转移癌可判定行根治性手术还是姑息治疗,原发肿瘤可选择保肢还是截肢)。向内侧掀起胸大肌,即可暴露神经血管束和喙突。为了充分显露血管,神经鞘、胸小肌、二头肌短头以及喙肱肌在喙突上的止点可切断。所有肌肉均应进行标记,便于以后辨认和重建。在探查神经血管束以前,皮瓣应小范围扩大,患者的肿瘤可能不适合行保肢手术,这时更大的皮瓣游离可引起肿瘤污染到行肩胛带离断术所需要的皮瓣。接着需显露腋神经、肌皮神经和桡神经,尽可能保留这些神经以便功能恢复。尽管肌皮神经偶然因肿瘤的安全切除而被牺牲,但它的丧失意味着术后屈肘功能的丧失。肱二头肌的长、短头间的深筋膜可在肿瘤以下切断,以最大程度地分离二头肌长、短头,这样可以更容易地看到肌皮神经。桡神经在背阔肌的下缘辨认,它环绕肱骨后方进入三头肌群,桡神经在肱骨中段的后侧通过(桡神经沟),自肱骨上钝性分离该神经。同样分离尺神经,术者必须在二头肌与三头肌肌间隔膜清楚地看到尺神经。本组病例中的大多数患者均保留了肌皮神经和桡神经,但当肿瘤浸润了腋神经周围的软组织时,需将腋神经和肿瘤标本一起切除。将血管神经束与肩胛骨、肱骨近端和肿瘤分离。广泛游离二头肌的长、短头来显露肱骨,决定肱骨截骨面后,在这个水平横断二头肌长头以及肱骨,切断背阔肌和大圆肌止点,外旋肱骨显露肩胛下肌,在喙突水平横断。应注意不要进入关节间隙,肌肉残端用线标志以利后期重建。横断这些肌肉后,肩胛颈的前部就可显露。后侧切口起于锁骨的中、外1/3处,切口沿至肩胛骨的外1/3,直至肩胛下角。自肩胛冈上切断三角肌起点及斜方肌止点,在肩胛颈水平切断冈上肌、冈下肌和小圆肌(若为Malawer Ⅴ型,部分肩胛骨切除)。若行全肩胛骨切除,则皮瓣必须后延至肩胛骨内缘。菱形肌、肩胛提肌以及斜方肌均在肩胛骨止点处切断,而大、小圆肌和冈上肌、冈下肌以及肩胛下肌不必切断。在保护桡、尺神经的同时,在选择的水平切断三头肌。后路将肿瘤连同周围正常组织一起切除,肩袖等外展肌群应与肩胛骨一齐被切除。最后通过肱骨的截骨完成关节外整块切除肩胛带恶性肿瘤。对经典的Tikhoff-Linberg术式,肱骨的截骨平面取决于肿瘤的范围。如果肿瘤主要局限在肩胛骨,就意味着可能会有肿瘤细胞镜下浸润到盂肱关节囊内,那么关节外将肱骨头合并肿瘤大体标本一并切除被认为达到了满意的肿瘤学边界(Malawer Ⅳ型)。但如果肿瘤肉眼可见浸润到了关节囊和肱骨近端,那么肱骨的截骨段应距肿瘤至少2 cm(通常是3~5 cm)(Malawer Ⅵ型)。若肿瘤起源于肱骨近端,那么很可能浸润到了盂肱关节囊内,但肉眼未见关节盂的明显破坏,则可将肩胛颈和肿瘤一起切除(Malawer Ⅴ型),就被认为已达到广泛的肿瘤切除,其中肩胛体可用作重建。切除肿瘤后术者应注意到肿瘤表面肌肉的多少。三头肌的长、外侧头仍保留在肱骨上,二头肌的长头的上部分和肱肌的上部分和肿瘤一起切除。肿瘤由完整的三角肌覆盖,冈上肌、冈下肌、胸大肌、背阔肌、大圆肌、小圆肌和肩胛下肌的止点也随肿瘤一起切除,形成自然边界。

表1 行经典及改良的Tikhoff-Linberg手术的33例患者的临床病理资料及预后情况
注:NED为无病生存;DOD为死于疾病;AWD为带瘤生存;MSTS为骨与软组织肿瘤功能学评分
我们利用组配或定制的肱骨近端假体来重建上肢的长度(图1)。总体来说,我们使用两种假体进行骨性重建[8]。30例病例主要采用简单的肱骨近端人工假体悬吊,而对其中的3例行全肩胛骨切除的患者,我们尝试使用限制型肩胛骨假体联合肱骨近端假体进行置换。每种重建方式的最后确定均结合了手术医师的考虑以及患者意愿。肱骨假体的固定一般采用聚甲基丙烯酸甲酯水泥固定于肱骨残余髓腔和非可吸收材料所制的韧带缝合线固定于第2肋、锁骨残端(经典Tikhoff-Linberg)或者肩峰、肩胛颈的残端(改良Tikhoff-Linberg)。
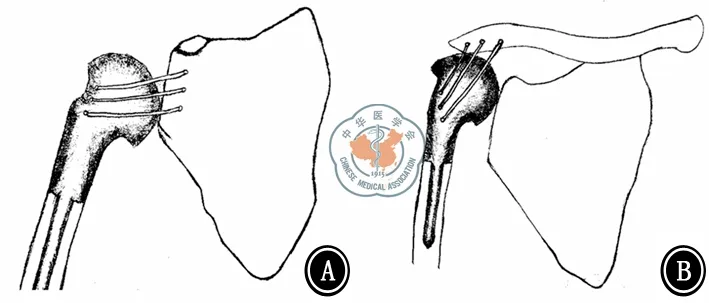
图1 两类 (A and B)改良的Tikhoff-Linberg术式后肱骨近端假体的悬吊方式 (Malawer Ⅴ型)
我们采用两种不同的方式进行软组织重建。第一种为LARS韧带(利用对酞聚乙烯聚酯纤维制成的材料)(JK Orthomedic,Dollard-des-Ormeaux,Quebec,Canada)[9],将剩余的肌肉、肌腱围绕肱骨头假体与胸壁缝合在一起,以防半脱位(图2)。第二种重建即单纯使用非可吸收线直接将假体缝合悬吊在周围软组织上。通过前入路,胸小肌腱如果可能也缝合回其起点,或者缝合到肩胛骨以保护神经血管束,使它不受假体损伤。胸大肌紧贴假体到达肩胛骨截骨端或原肩胛骨的区域(后方入路),并通过LARS韧带与截骨端或周围软组织缝合,然后将斜方肌、冈上肌、冈下肌和部分小圆肌腱缝到横断的胸大肌的上界和外缘,小圆肌和背阔肌以及胸大肌的下缘缝合。二头肌的短头的腱性部分在前侧、在适当的张力下(肘屈曲90°)与锁骨残端缝合,二头肌长头和肱肌在适当的张力下与短头缝合,这样这两个肌肉就可以通过短头的肌腱来发挥作用。三头肌的残端在前方沿二头肌的外缘缝合来覆盖假体的下段和侧方。使整个假体都被肌肉或肌腱、筋膜包被。背阔肌远端横断边缘也可被直接缝在三角肌残端或者其他肌腱上,以稳定肩关节。在部分肩胛骨切除的手术中,肩胛冈水平钻两孔,这两个孔通过肩胛骨外缘和锁骨残端远端,假体头用LARS韧带固定于肩胛骨残端,这样假体就内、外两侧悬吊(水平稳定),沿纵轴方向用另一韧带自锁骨终端悬吊(纵向稳定)。这些操作的平均出血量为1 550 ml(450~3 500 ml),平均手术时间为176 min(110~240 min)。
术后肩关节被固定悬吊于吊带约4周,但鼓励患者在术后早期开始进行手、腕及肘的主动活动。所有的患者均进行临床及影像学随访。肿瘤学观测指标主要为是否发生转移、是否复发及生存期的记录,同时记录围手术期及假体相关的并发症。术后每3个月采用MSTS评分系统[9-10](针对上肢)进行一次功能学的评估。该评分系统主要包含疼痛、活动功能、情感接受程度、手的位置、手的灵活度以及举物功能。这六个方面根据功能情况的不同,分别给予0~5分的评分,因而MSTS评分系统总分为30分。我们将随访过程中记录下的最好的评分情况作为患者最后的功能评分,以便排除因局部肿瘤复发而导致的功能变差。
我们使用SPSS 17.0 (SPSS,Inc.,Chicago,Illinois)里的Kaplan-Meier生存分析及Wilcoxon检验来比较不同切除方式及重建方式对长期功能的影响。
结 果
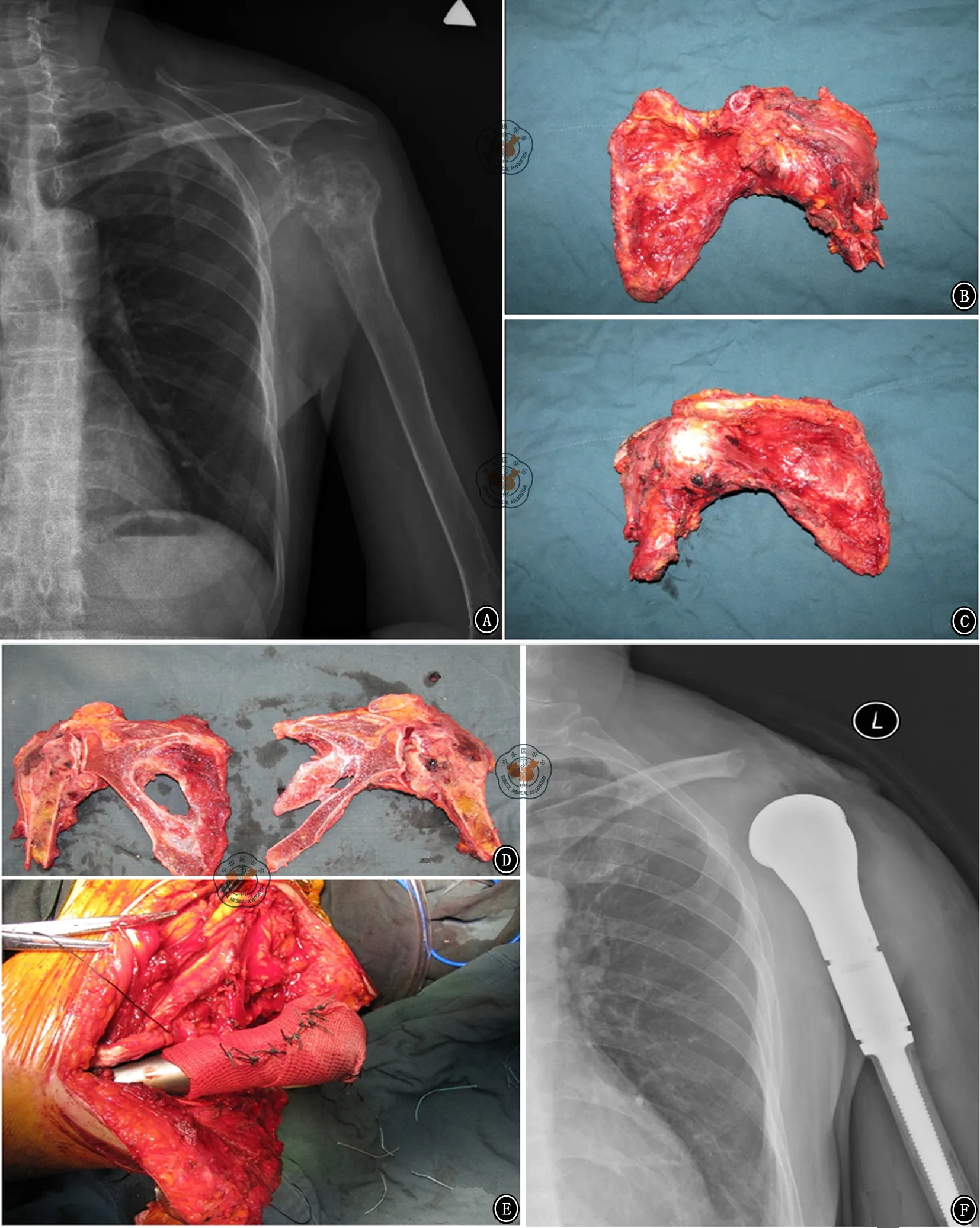
图2 45岁软骨肉瘤的男性病例图片。A.术前平片显示左侧肱骨近端肿瘤侵犯肩关节伴腋窝巨大软组织包块; B、C.关节外整块切除的肩胛骨及肱骨近端大体标本,B标本内侧面,C标本外侧面; D.剖开标本可见肿瘤侵犯肩关节囊内;E.术中图片显示LARS重建周围软组织;F.术后X线片显示肱骨近端假体悬吊于锁骨残端
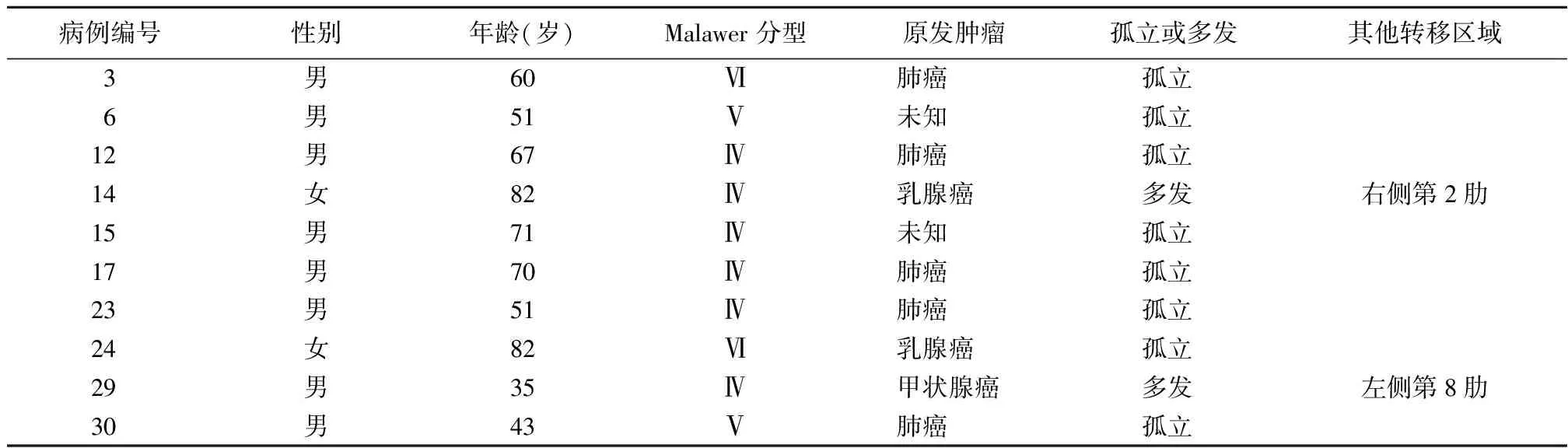
表2 10例转移癌患者的临床信息
最后随访,25例患者死于肿瘤,2例带瘤生存,6例无病生存。10例转移癌的患者中(表2),9例死于肿瘤,1例带瘤生存。4例软骨肉瘤患者中2例出现局部复发,4例骨肉瘤患者1例出现复发,2例恶性外周神经鞘瘤患者1例出现复发,3例滑膜肉瘤患者中1例出现复发。3年无复发生存率为81.8%,总生存率为41.4%(图3);中位生存期为31个月(IQR 18.5~46.0)。平均随访时间为34(6~109)个月。

图3 33例行经典的或改良的Tikhoff-Linberg手术后的3年无复发生存率和总生存率

图4 76岁老年女性患有肩胛带软骨肉瘤。A.术前平片显示左侧肩胛带骨质破坏; B.术后平片显示肱骨近端假体悬吊于肩胛骨体部的残端; C.术后四月出现远端假体向前侧半脱位
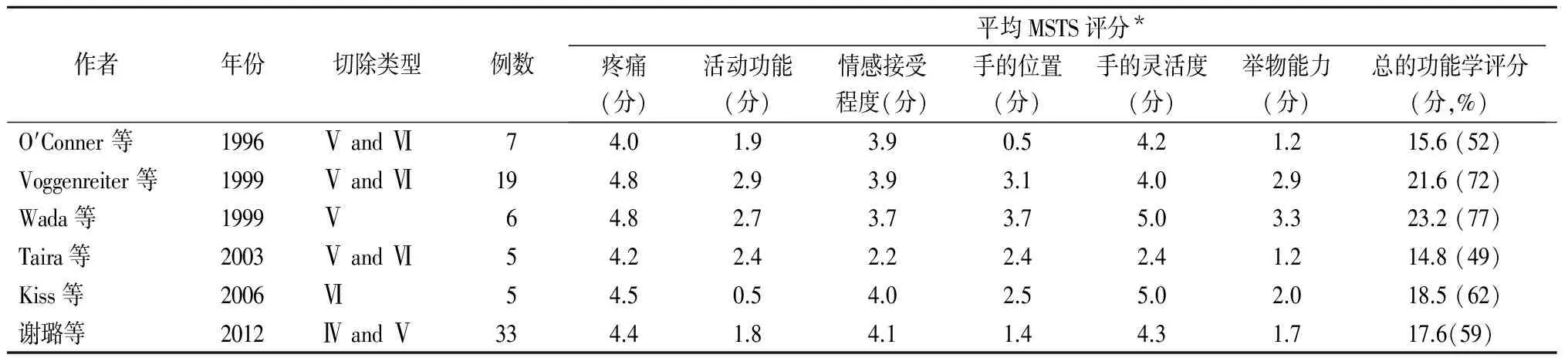
表3 文献复习及比较其他采用MSTS评分评价肩胛带恶性肿瘤术后的功能情况
注: 切除类型基于Linberg,Malawer等提出的手术分型;*每个组成部分的总分为5分
3例出现术后早期并发症:1例患者出现一过性桡神经麻痹,但4个月后完全恢复了神经功能;2例进行过术前放疗的患者(<45Gy)出现了伤口延迟愈合,经清创及定期换药后,伤口均在清创术后2周缓慢愈合。2例患者出现延迟并发症:1例行限制型肩胛骨假体置换术的患者术后20个月出现了假体肩关节脱位,给予行手术翻修;另1例单纯行肱骨近端假体悬吊但未使用LARS韧带包裹的患者,术后4个月出现了假体的前脱位(图4),但该患者手的活动灵活,日常生活未受脱位影响,故未做处理,继续观察。
随访过程中总的MSTS评分平均为17.6分(MSTS 93评分 59%,0~24分)(表3)(MSTS 93评分为MSTS评分的百分制[10])。大多数患者疼痛得到缓解,平均得分为4.4分(0~5分)(MSTS 93评分88%),情感接受程度(4.1分,83%,0~5分)和手的灵活度(4.3分,86%,0~5分)得分较高。虽然大部分患者保留了正常的手和肘的功能,但是举物功能的限制在MSTS评分上表现得很明显,平均得分仅1.7分(34%,0~3分),手的位置得分也仅1.4分(28%,0~2.5分),外展功能得分也比较低,仅1.8分(35%,0~2分)。我们比较了不同切除方式的功能学评分情况,结果提示不同分组间差异无统计学意义。我们也比较了术中重建是否使用LARS韧带的不同分组间长期功能评分情况,结果发现差异无统计学意义(P=0.23)。
讨 论
经典的Tikhoff-Linberg术[3]最先于1928年被描述,此后一直用于治疗累及肩关节的恶性或局灶侵袭性良性肿瘤。1977年Marcove介绍了改良的Tikhoff-Linberg术[9],其中保留了未受侵的肩胛骨体部,使得肱骨近端的假体可固定于残留的肩胛骨进而获得更好的功能和肩关节外观[5,11-12]。
通常我们根据术前的CT及MRI检查结果在肱骨距肿瘤3~5 cm的位置截骨。而肱骨的骨性缺损则需进行恰当的重建以便为肘关节的活动提供支点,并保证肩关节的稳定性。目前,肱骨的部分置换相比于肱骨短缩在肱骨肿瘤的切除后更为推崇[13-16]。在行Tikhoff-Linberg手术及使用肱骨近端人工假体置换术近10年后,我们认为使用人工假体进行重建不失为一种可靠的重建方式,可使手术失败率降低,不容易出现短期或长期合并症。由于在大多数病例中肩袖结构均被切除,因此通常容易出现一些内固定物的远端半脱位,具体说来即行影像学检查发现假体头部直接位于肩峰的下方。但是这种前脱位通常无明显症状,仅影响肩部外形而并不影响手的功能。

表4 不同的手术切除方式及重建方法的MSTS功能学评分
注:切除类型基于Linberg,Malawer等提出的手术分型;*每个组成部分的总分为5分:LARS为软组织修复使用韧带增强重建系统特制的人工韧带材料(Ligament Advanced Reinforcement System)
重建后,盂肱关节的功能恢复主要取决于关节周围肌肉的保留情况[15]。不幸地是,几乎所有病例肩袖肌群均被切除,因而本组病例的术后外展功能较差。在MalawerⅣ和Ⅴ的切除中,三角肌尽量被保留或被重建。然而,当肱骨近端或肩胛骨起源的肿瘤累及三角肌时,需要将三角肌连同肿瘤一并整块切除才能保证合适的肿瘤学边界。在我们的病例中桡神经和肌皮神经均被分离和保留,而腋神经则在4例MalawerⅥ型和1例MalawerⅤ型的病例中因受肿瘤浸润而连同肿瘤标本一并被切除。
在复习采用MSTS评分系统评价关节外整块切除肩胛带恶性肿瘤的功能情况的文献后,我们发现到目前为止,行该类手术的患者数量有限[11,17-21]。Capanna等通过每组12例病例进行配对研究,比较了经典的Tikhoff-Linberg术式和改良术式切除肩胛带恶性肿瘤的功能学预后。但他们没有使用MSTS评分系统来评价功能情况,因而我们无法将他们的功能学结果与本研究及其他研究进行比对。总结目前已有的采用MSTS评分来评价功能的文献,我们发现总的功能学平均评分在15.6分[21]和23.2分[22]不等,而我们的总分在他们之间。所有的研究者均发现患者在疼痛、情感接受程度和手的灵活性方面获得令人满意的评分。而多数患者在问及他们是否能将物体举过头部及是否能参与到他们的日常体育活动时,评分较低。本研究中包含7例改良的Tikhoff-Linberg术式和26例经典的Tikhoff-Linberg术式,平均活动评分和举物评分分别为1.8分(0~2分)和1.7分(0~3分)。但当用本组病例比较不同的切除方式对功能的影响时,我们发现差异无统计学意义(表4,P=0.75)。
软组织的重建取决于骨与软组织的切除范围[17]。在保肢手术中,如果要让肢体远端满足功能的需要,软组织重建和骨性重建一样重要。许多研究已得出结论,使用LARS韧带来进行软组织重建可获得静态的、更加稳定的假体悬吊和避免过多神经血管束的牵拉。而术后神经血管束的被牵拉是许多研究中比较多见的并发症[23-24]。但是,因为肌肉的大量剥离和切除,我们仅能达到形态上的重建和软组织的简单固定以保证关节稳定。我们使用LARS韧带缝合和包裹肱骨头假体于残留的周围肌肉、肌腱及其他软组织中,以期能限制假体的活动。但当我们比较使用LARS韧带重建和简单使用韧带缝合线缝合周围软组织的情况时,并未发现明显功能的改善。
在本研究中,有10例转移癌的患者,在局部我们也选择了如此广泛、彻底的肿瘤切除方式,主要是基于他们大多数为孤立的转移灶,且出现了顽固性疼痛,严重影响他们的日常生活,需彻底切除病灶才能得到缓解。同时,仅有的2例有多发转移灶的患者,因原发肿瘤分别为乳腺癌和甲状腺癌,预期生存期比较长,因而局部采取了较为彻底的切除方式。和局部原发肉瘤不同,这些肩胛带的转移灶,即使出现了大量骨质破坏,软组织浸润范围也相对较小,比较容易施行如此广泛的切除手术,进而降低局部肿瘤复发率。
本文除了是回顾性研究,还有许多其他不足。首先,部分患者的随访时间较短。但这是由于某些病例为原发或转移性的高级别恶性肿瘤,预期生存期较短。同时肿瘤的局部复发也对这些患者术后长期功能情况产生了巨大影响。第二,在我们的功能学评估中,MSTS评分过程也略显粗略,我们没有相对精确的数值去测量术后肩关节各个方向的主动及被动活动角度,上肢等距活动的肌力强度和采用其他可以精确记录肩关节、肘关节及手的功能情况的参数。因而我们利用MSTS评分所做的各组比较可能缺乏精细的区分度,使结果差异无统计学意义。
总之,关节外、整块切除累及肩关节的肩胛带恶性肿瘤,并采用人工假体进行重建,可保留相对良好的上肢功能,围手术期并发症较少。采用LARS韧带进行软组织重建似乎并未明显改善这部分患者的长期功能学预后。
[1] Enneking FW.A system of staging musculoskeletal neoplasms[J].Clin Orthop Relat Res,1986,204(1):9-24.
[2] Wittig JC,Bickels J,Kellar-Graney KL,et al.Osteosarcoma of the proximal humerus:long-term results with limb-sparing surgery[J].Clin Orthop Relat Res,2002,397:156-176.
[3] Linberg BE.Interscapulo-thoracic resection for malignant tumors of the shoulder joint region[J].Clin Orthop Relat Res,1999,358(1):3-7.
[4] Malawer MM.Tumors of the shoulder girdle.Technique of resection and description of a surgical classification[J].Orthop Clin North Am,1991,22(1):7-35.
[5] Capanna R,Van Horn JR,Biagini R,et al.The Tikhoff-Linberg procedure for bone tumors of the proximal humerus:the classical "extensive" technique versus a modified "transglenoid" resection[J].Arch Orthop Trauma Surg,1990,109(2):63-67.
[6] Damron TA,Rock MG,O′connor MI,et al.Functional laboratory assessment after oncologic shoulder joint resections[J].Clin Orthop Relat Res,1998,348:124-134.
[7] 郭卫.肩部肿瘤的外科治疗进展[J/CD].中华肩肘外科电子杂志,2013,1(1):8-12.
[8] 郭卫,汤小东.人工关节假体重建肘部肿瘤切除后骨缺损[J/CD].中华肩肘外科电子杂志,2013,1(1):46-53.
[9] Marcove RC,Lewis MM,Huvos AG.En bloc upper humeral interscapulo-thoracic resection.The Tikhoff-Linberg procedure[J].Clin Orthop Relat Res,1977,124:219-228.
[10] Enneking WF,Dunham W,Gebhardt MC,et al.A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system[J].Clin Orthop Relat Res,1993,286:241-246.
[11] Voggenreiter G,Assenmacher S,Schmit-Neuerburg KP.Tikhoff-Linberg procedure for bone and soft tissue tumors of the shoulder girdle[J].Arch Surg,1999,134(3):252-257.
[12] Janecki CJ,Nelson CL.En bloc resection of the shoulder girdle:technique and indications.Report of a case[J].J Bone Joint Surg Am,1972,54(8):1754-1758.
[13] Bos G,Sim F,Pritchard D,et al.Prosthetic replacement of the proximal humerus[J].Clin Orthop Relat Res,1987,224:178-191.
[14] Jensen KL,Johnston JO.Proximal humeral Reconstruction after excision of a primary sarcoma[J].Clin Orthop Relat Res,1995,311:164-175.
[15] Kumar D,Grimer RJ,Abudu A.Endoprosthetic replacement of the proximal humerus.Long-term results[J].J Bone Joint Surg Br,2003,85(5):717-722.
[16] Ross AC,Scales JT.Endoprosthetic replacement of the proximal humerus[J].J Bone Joint Surg Br,1987,69(4):656-661.
[17] O′Connor MI,Sim FH,Chao EY.Limb salvage for neoplasms of the shoulder girdle.Intermediate reconstructive and functional results[J].J Bone Joint Surg Am,1996,78(12):1872-1888.
[18] Taira H,Yoshida S,Takasita M,et al.Limb salvage for malignant bone and soft-tissue tumours of the shoulder girdle[J].Int Orthop,2003,27(3):136-140.
[19] Kiss J,Sztrinkai G,Antal I,et al.Functional results and quality of Life after shoulder girdle resections in musculoskeletal tumors[J].J Shoulder Elbow Surg,2007,16(3):273-279.
[20] Schwab HJ.Function correlates with deltoid preservation in patients having scapular replacement[Z],2006:225-230.
[21] Pritsch T,Bickel J,Wu CC,et al.Is scapular endoprosthesis functionally superior to humeral suspension?[J].Clin Orthop Relat Res,2007:188-195.
[22] Nau T,Lavioe P,Duval N.A new Generation of artificial ligaments in Reconstruction of the anterior cruciate ligament.Two-year follow-up of a randomised trial[J].J Bone Joint Surg Br,2002,84(3):356-360.
[23] Giannotti S,Dell′osso G,Bugelli G,et al.Surgical treatment of acromioclavicular dislocation with LARS artificial ligament[J].Eur J Orthop Surg Traumatol,2013,23(8):873-876.
[24] Ioannou M,Papanastassiou J,Athanassiou AE,et al.Surgical options in cases of tumorous destruction of the proximal humerus:twenty-one patients followed from 4-9 years[J].J BUON,2009,14(1):57-61.
(本文编辑:李静)
谢璐,郭卫,汤小东,等.关节外整块切除肩胛带恶性肿瘤的手术及术后功能研究[J/CD].中华肩肘外科电子杂志,2015,3(1):43-52.
Limb-sparing resections for malignant tumors of shoulder girdle:11-year experience of classical or modified tikhoff-linberg procedures in a single institution
XieLu,GuoWei,TangXiaodong,YangRongli.
PekingUniversityPeople′sHospital,MusculoskeletalTumorCenter,Beijing100044,China
GuoWei,Email:bonetumor@163.com
Background We evaluated the functional and oncologic outcome of 33 patients with malignant tumors of the shoulder girdle who were managed with classical or modified Tikhoff-Linberg procedures in our centre so as to compare the influence of different methods of soft tissue reconstruction on the function of upper limbs and to share some experience in limb-sparing operations for malignant tumors of shoulder girdle.Methods From July 1st 2001 to September 30th 2013,one hundred and ninety-four consecutive patients who had resection of tumors around shoulder girdle were reviewed.The tumors originated from the proximal humerus in 130 patients,scapula in 40 and circumambient soft tissue in 21.Preoperatively,in addition to general routine examinations,X-ray radiography,CT and MRI of the tumors,chest CT and ECT scanning were all performed in those patients.Angiography was added if there was neurovascular (brachial plexus and axillary vessels) involvement.The inclusion criteria contained:(1) patients had classical or modified Tikhoff-Linberg procedures (Malawer Type Ⅳ,Ⅵ or Ⅴ) in our centre; (2) patients were firstly treated in our centre and they had not undergone any kind of biopsy or operation of the shoulder girdle before;(3) the proximal humerus or the humeral head were resected with total or partial scapular extraarticularly.Patients who had amputation,intraarticular total scapulectomy,or proximal humerus resection without glenoid resection were excluded.Thirty-five patients were included in this study,but two patients who lost follow-up were excluded.According to the classifications of shoulder girdle resections of Malawer et al.,7 patients had extraarticular proximal humerus and partial scapular resection (type Ⅴ),21 patients had extraarticular humeral head and total scapular resection (type Ⅳ) and 5 patients had extraarticular proximal humeral and total scapular resection (type Ⅵ).There were 11 female and 22 male with average age of 43 years old (range,17 to 82 y).All patients were followed up for a mean of 34 months (range,6 to 109 months).The pathologic diagnosis obtained by needle or open biopsies included 10 metastatic tumors (4 from lung cancer,3 from breast cancer,1 from thyroid cancer and 2 from unknown origin),7 chondrosarcomas,4 osteosarcomas,3 Ewing sarcoma/PNET,3 synovial sarcomas,2 malignant peripheral nerve sheath tumors,1 malignant fibrous histocytoma,1 fibrous sarcoma,1 liposarcoma and 1 malignant hemangiopericytoma.The stage and extent of the tumor were evaluated according to the Enneking system.Neoadjuvant chemotherapy was administered to patients with osteosarcoma,Ewing's sarcoma/PNET and partial malignant soft tissue sarcoma.As for other anatomical sites,limb salvage procedures for bone tumors of the shoulder girdle comprise three steps:complete resection of tumors,reconstruction of bone defects and good soft tissue covering.According to the surgical classification system proposed by Linberg and Malawer et al,classical Tikhoff-Linberg resection (also called shoulder girdle resection Malawer type Ⅳ) contained extraarticular en bloc resection of proximal humerus or humeral head,glenohumeral joint,the whole scapular and lateral clavicle.While modified Tikhoff-Linberg procedure (Malawer type Ⅴ) meant extra-articular resection of proximal humerus,glenohumeral joint,lateral clavicle and the neck of scapular glenoid.The surgical margins of the resected tumor were grossly and microscopically evaluated by two different experienced pathologists respectively.If they disagreed in opinion,the margins would be judged by another doctor who usually would be a senior pathologist.Results All those 33 patients survived the perioperative period and were followed up clinically after surgery (mean follow-up time 34 m,range 6 to 109 m).At the final follow-up,6 patients were alive without evidence of disease,2 patients remained alive but with disease,and 25 had died of their disease.In patients with metastatic bone tumor,9 had died of their disease and 1 were alive with disease.Local recurrence developed in 2 patients with chondrosarcomas,1 patient with osteosarcoma,1 patient with malignant schwannoma and 1 patient with synovial sarcoma.The 3-year recurrence-free survival and overall survival were 81.8% and 41.4% respectively by the Kaplan-Meier Survival analysis (SPSS v 17.0; SPSS,Inc.,Chicago,IL) and the median survival time was 31 month.Early complications related to tumor resection occurred in 3 patients.One patient presented with temporary radial nerve palsy postoperatively,and fully recovered after 4 months of conservative treatment.Two patients who
radiotherapy before operation (doses of the radiotherapy were above 45 Gy) presented with delayed wound healing.They received debridements and got healed two weeks later.One patient who received constrained scapular prosthetic replacement had prosthesis dislocation 20 months after surgery while another female patient with proximal humeral prosthetic replacement had anterior subluxation four months after surgery (Fig.6).Although the shoulder joint revision surgery was only carried out for the former patient,those two patients had satisfactory manual dexterity and did not affect much of their daily lives.For all patients at the final follow-up,the average MSTS 93 score was 17.6 of 30 points (59%;range,0%-80%).Pain was relieved in most patients,with a mean score of 4.4(87.5%).High scores were achieved in emotional acceptance and hand dexterity,with an average of 4.1(82.5%) and 4.3(86.3%),respectively.The abduction of shoulder was restricted severely,only 6 patients could position their hands above the waist on front plane.The ranges of active shoulder abduction and forward flexion motion were 0°-40° and 10°-45°,respectively.Although normal hand and elbow functions were retained in most patients,limitations in lifting ability and abduction function were reported.The average score for these two items was 1.7(33.8%) and 1.8(35%),respectively.We compared the functional outcomes with Muscolo-Skeletal Tumor Society (MSTS) rating scale in different types of resection and did not find any difference in statistical analysis (Wilcoxon test,SPSS v 17.0; SPSS,Inc.,Chicago,IL) no matter in total points (P=0.88) or in scores of different aspects (Table Ⅲ).As for soft tissue reconstruction,we also compared the MSTS rating scores between using LARS or not,and there seemed not to have any statistical differences in over-all functional scores (P=0.23)(Wilcoxon test,SPSS v 17.0; SPSS,Inc.,Chicago,IL) (Table Ⅲ).However of all the detailed functional scores,the manual dexterity tended to be better in the group of using LARS (Wilcoxon test,P=0.05).Conclusion The Tikhoff-Linberg procedure not only provided a feasible method for wide resection of malignant tumors involving shoulder girdle but also preserved much of manual and elbow functions.However the abduction function of the shoulder was poor because the rotator cuff and deltoid had been sacrificed.We have not found any major long-term functional difference either between classical and modified Tikhoff-Linberg procedures or between different soft tissue reconstructions in the follow-up.
Shoulder girdle;Malignant tumor;Operation;Function
10.3877/cma.j.issn.2095-5790.2015.01.009
卫计委科研专项(201402016)
100044北京大学人民医院骨肿瘤科
郭卫,Email:bonetumor@163.com
2014-12-20)
