鸡源致病性沙门菌多重PCR检测方法的建立及应用
2015-06-25李凤梅施开创许心婷邹联斌
李凤梅,施开创,许心婷,胡 杰,邹联斌,钟 诚*
(1.广西大学动物科学技术学院,广西南宁530005;2.广西动物疫病预防控制中心,广西南宁530001)
沙门菌(Salmonella)是常见的重要人兽共患病原菌,根据沙门菌对不同宿主的侵袭力差异可以分为广嗜性沙门菌和宿主专嗜性特异性沙门菌。鸡是沙门菌最主要的宿主,鸡白痢沙门菌(S.pullorum)和鸡伤寒沙门菌(S.gallinarum)仅感染鸡和火鸡,具有高度宿主适应性和宿主专嗜性,可以引起雏鸡急性败血症,导致很高的发病率和病死率[1];对成年鸡主要侵害生殖器官,引起产蛋下降或生长发育受阻。同时,沙门菌具有水平传播和垂直传播的特点,一旦传入鸡群,难以控制和根除,是目前危害养鸡业最重要的病原菌之一[2]。及时、准确地检测病原菌和诊断对鸡场有效防治与净化鸡沙门菌病具有重要作用。传统的沙门菌检测方法是通过细菌分离培养、生化及血清学鉴定,耗时费力,且肠杆菌科细菌间的生化反应多有交叉,灵敏性与特异性受到局限;目前对沙门菌的快速检测方法则多采用免疫学方法、核酸分子杂交及PCR扩增技术等检测抗体和病原[3]。国内外针对沙门菌已建立的单重及多重PCR方法,多用于检测菌株的血清型、毒力基因或耐药基因,迄今未见报道有能够同时检测具有致病性沙门菌属特异性及鸡宿主特异性的多重PCR方法。本研究分别针对沙门菌属特异性毒力因子invA 基因[4]、鸡宿主特异性毒力因子fliC 基因[5]、质粒毒力因子spvR基因[6]设计3对特异性引物,建立能够同时检测具有致病性并携带毒力质粒的鸡沙门菌的多重PCR方法,以期为鸡源致病性沙门菌的快速鉴别检测和流行病学调查提供有效的技术手段。
1 材料与方法
1.1 材料
1.1.1 菌株及实验动物 鸡沙门菌标准株(CVCC538)、大肠埃希菌标准株(ATCC25922)、鼠伤寒沙门菌(ATCC14028)来自中国微生物菌种保存中心;鸡源多杀性巴杆菌、痢疾志贺菌和普通变形杆菌由广西动物疫病预防控制中心实验室提供;猪霍乱沙门菌由广西大学预防兽医学实验室惠赠;4周龄SPF级雄性昆明小鼠购自广西中医药大学实验动物繁殖中心。
1.1.2 主要试剂 MinBEST Viral DNA/RNA Extraction Kit Ver.4.0试剂盒、质粒 DNA 小量提取试剂盒、pMD18-T载体、2×TaqPCR MasterMix试剂盒、HindⅢ及EcoRⅠ内切酶、DNA标准DL 5 000/DL 2 000/DL 1 500均为宝生物工程(大连)有限公司产品;EscherichcoliDH5α感受态细胞为北京天根生化科技有限公司产品。
1.2 方法
1.2.1 模板制备 按照 MinBEST Viral DNA/RNA Extraction Kit Ver.4.0试剂盒使用说明书提取细菌总DNA。
1.2.2 引物设计 根据GenBank已发表的沙门菌属特异性毒力基因invA、质粒毒力基因spvR、鸡宿主特异性毒力基因fliC的序列,设计3对特异性引物(表1)。其中,INVA引物对扩增的invA基因片段为285bp,SPVR引物对扩增的spvR基因片段为507bp,FLIC引物对扩增的fliC基因片段为600bp。引物由天地杨生物科技(广州)有限公司合成。
1.2.3 重组质粒标准品的制备 按照 MinBEST Viral DNA/RNA Extraction Kit Ver.4.0试剂盒使用说明书提取鸡沙门菌标准株总DNA。用3对特异性引物分别配制50μL PCR反应体系:2×TaqPCR MasterMix 25μL,上、下游引物(25pmol/μL)各1μL,DNA模板1μL,灭菌双蒸水补至50μL。PCR反应程序为:94℃5min;94℃30s,56℃30s,72℃35s,35个循环;72℃10min。反应结束后,应用胶回收试剂盒回收PCR产物,连接pMD18-T载体后,转化到E.coliDH5α感受态细胞,阳性克隆培养后应用质粒DNA小量提取试剂盒提取质粒,进行PCR、酶切及测序鉴定。本研究共构建3种重组质粒,由引物INVA、SPVR和FLIC扩增产物构建的重组质粒分别命名为pMDINVA、pMD-SPVR和pMD-FLIC。
1.2.4 多重PCR最佳反应条件的确定 建立50μL PCR反应体系,分别对模板量(将3种重组质粒稀释成1010拷贝/μL后等比例混合,然后以3、4、5、6、7μL混合液作为模板)、退火温度(分别为54.1、55.3、56.5、57.7、58.9、60.1 ℃)、引物浓度(3对引物终浓度分别为 0.125、0.25、0.5、0.625、0.75、1.0、1.25、1.5pmol/μL,进行不同浓度的排列组合)及循环数(分别为25、30、35、40、45个循环)进行试验,确定各自最佳的反应条件。
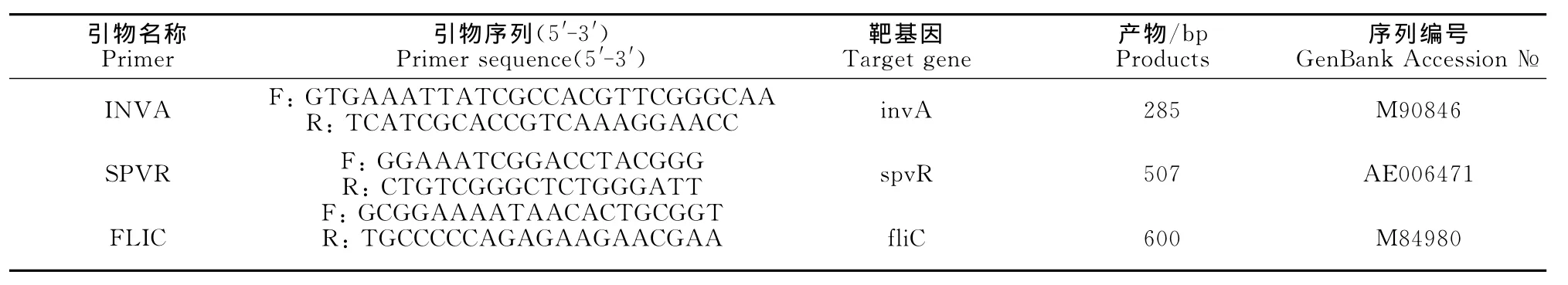
表1 多重PCR特异性引物Table 1 The specific primers used for multiplex PCR
1.2.5 多重PCR的特异性试验 提取鸡沙门菌标准株、大肠埃希菌、鼠伤寒沙门菌、猪霍乱沙门菌及鸡源多杀性巴氏杆菌、痢疾志贺菌、普通变形杆菌的DNA作为模板,在优化反应条件下进行多重PCR,分析其特异性。
1.2.6 多重PCR的敏感性试验 将鸡沙门菌标准株于普通培养基振荡增菌过夜,取其菌液进行10倍系列稀释,涂板计数,重复3次,计算菌液浓度;每个梯度提取DNA作为模板,在优化条件下进行单重及多重PCR,分析其敏感性。此外,将3种重组质粒标准品10倍系列稀释成1.67×1010拷贝/μL~1.67×101拷贝/μL(50μL反应体系终浓度为1.67×109拷贝/μL~1.67×100拷贝/μL)共10个浓度梯度,在优化反应条件下进行单重及多重PCR,检测其敏感性。
1.2.7 多重PCR的重复性试验 以终浓度均为1.67×107拷贝/μL的3种重组质粒标准品等体积混合后作为模板,在优化反应条件下进行多重PCR,重复5次反应,分析其重复性。
1.2.8 多重PCR的临床应用 2013年-2014年采集的223份来自广西各地疑似病死鸡病料,取心、肝、脾、十二指肠各约1g,混合研磨后按1∶4(W/V)加入 PBS(pH7.2),反复冻融3次,12 000r/min离心5min,取上清提取总DNA作为模板,应用所建立的多重PCR方法进行检测。
1.2.9 沙门菌致病性试验 选择4周龄健康昆明小鼠12只,随机分成4组,每组3只。A组为空白对照,B组为invA+spvR基因阳性菌组,C组为invA+spvR+fliC基因阳性菌组,D组为invA+fliC基因阳性菌组。对照组腹腔注射生理盐水0.18mL/只,试验组腹腔注射相应菌液0.8 ×108CFU/只(0.18mL/只)。每隔8h观察1次,直至96h。1.2.10 统计学分析 应用t检验法对致病性试验中不同组菌株的致病性差异情况进行统计学分析。
2 结果
2.1 重组质粒标准品的构建
提取鸡沙门菌标准株的总DNA为模板进行PCR,扩增相应基因的目的片段,经回收、连接pMD18-T载体、转化E.coliDH5α感受态细胞,阳性克隆増菌后提取质粒,用HindⅢ和EcoRⅠ内切酶进行双酶切鉴定,获得两个片段的酶切产物,其中一个片段包含插入的目的基因片段以及HindⅢ和EcoRⅠ酶切位点之间62bp的载体片段,另一片段则是不含目的基因的载体片段,表明成功构建了沙门菌属毒力基因invA、spvR、fliC的重组质粒标准品,分别命名为pMD-INVA、pMD-SPVR和pMDFLIC(图1)。
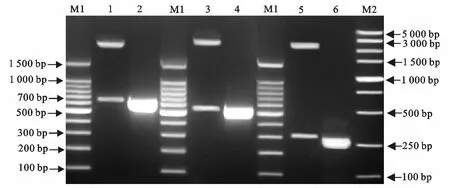
图1 重组质粒的酶切及PCR鉴定Fig.1 Identification of the recombinant plasmids by restriction enzyme digestion and PCR
2.2 最佳反应条件的确定
对模板浓度、退火温度、引物浓度、循环数等条件进行优化(以引物浓度的优化结果为例,见图2)。经过优化,确定了多重PCR最佳反应条件,包括PCR反应体系和反应程序。PCR反应体系为:2×TaqPCR MasterMix 25μL,FLIC引物(25pmol/μL)上、下游各1μL,SPVR引物(25pmol/μL)上、下游各1μL,INVA 引物(25pmol/μL)上、下游各0.25μL,模板量5μL,灭菌双蒸水补至50μL。反应程序为:94℃5min;94℃30s,56.5℃30s,72℃35s,35个循环;72℃10min。
2.3 特异性试验
提取鸡沙门菌标准株、大肠埃希菌、鼠伤寒沙门菌、猪霍乱沙门菌及鸡源多杀性巴氏杆菌、痢疾志贺菌、普通变形杆菌总DNA作为模板进行多重PCR扩增。结果显示,鸡沙门菌标准株阳性对照可以扩增到3条明显的条带,而大肠埃希菌、鸡源多杀性巴氏杆菌、痢疾志贺菌及普通变形杆菌均为阴性,没有交叉反应(图3)。
2.4 敏感性试验
将鸡沙门菌标准株菌液进行10倍系列稀释,提取总DNA作为模板进行单重和多重PCR。结果显示,针对invA、spvR、fliC基因的单重PCR的检出下限均为4.5×101CFU/mL(图4A),而多重PCR的检出下限均为4.5×102CFU/mL(图4B)。同时,以3种重组质粒标准品作为模板进行单重和多重PCR,结果显示,针对invA、spvR、fliC基因的单重PCR的检出下限均为1.67×102拷贝/μL(图5A),而多重PCR的检出下限均为1.67×10 拷贝/μL(图5B)。表明单重PCR的敏感性高于多重PCR。
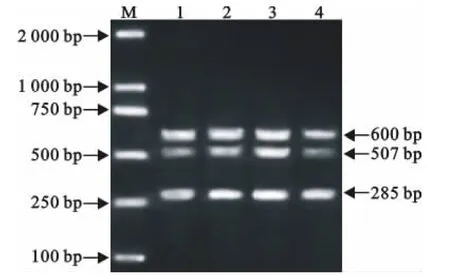
图2 引物浓度的优化Fig.2 Optimization of the primer concentration for multiplex PCR
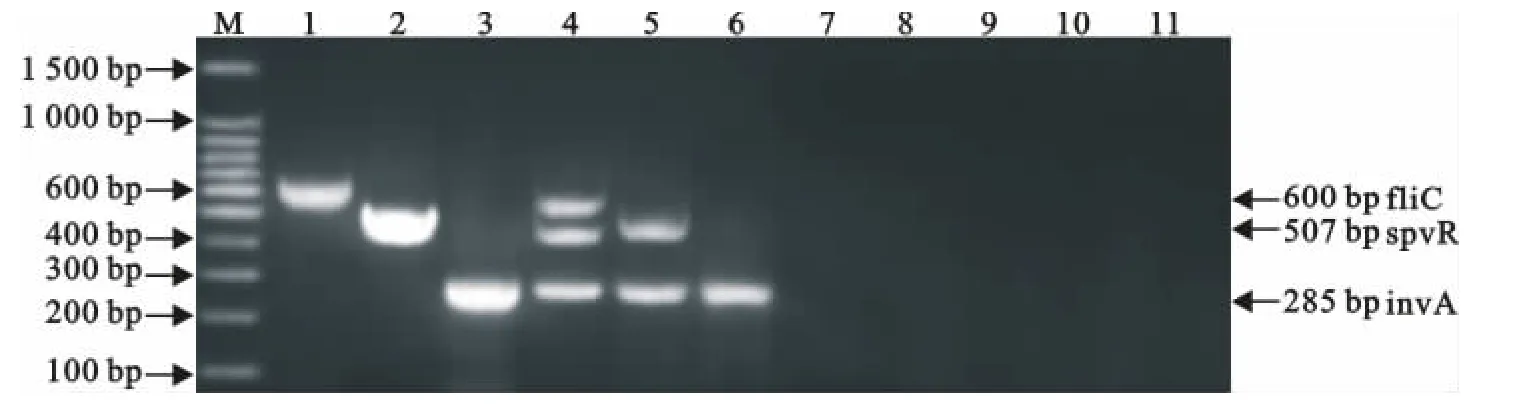
图3 多重PCR的特异性试验Fig.3 The specificity test of multiplex PCR
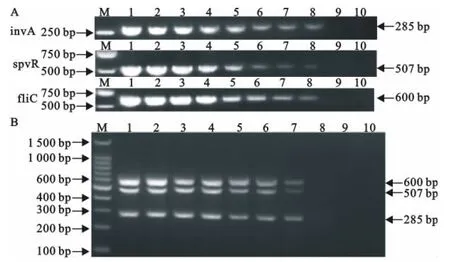
图4 菌液PCR的敏感性试验Fig.4 The sensitivity test of PCR from bacterial solution
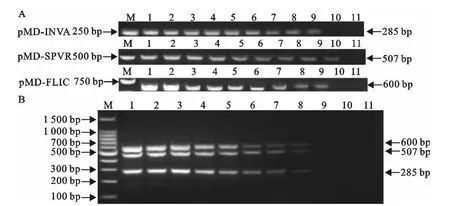
图5 重组质粒PCR的敏感性试验Fig.5 The sensitivity test of PCR from recombinant plasmids
2.5 重复性试验
以终浓度均为1.67×107拷贝/μL的3种重组质粒混合物为模板,在优化条件下进行多重PCR,结果5次重复反应均能够扩增出均匀一致的目的片段,重复性好(图6)。
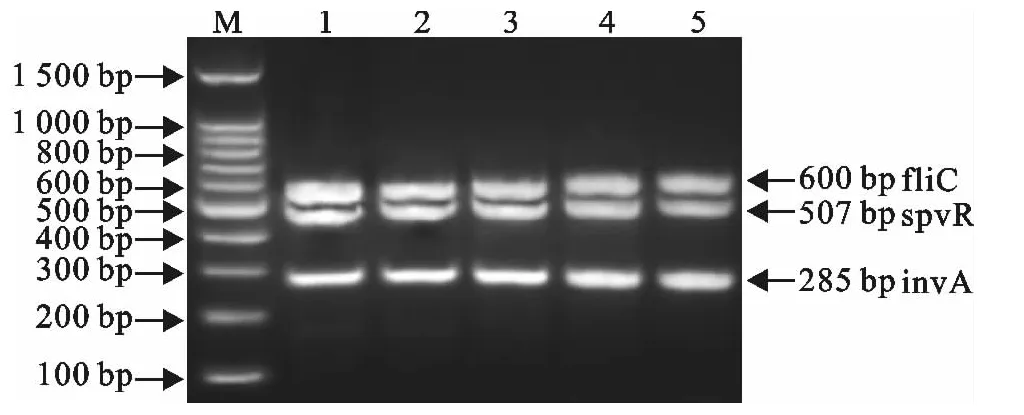
图6 多重PCR的重复性试验Fig.6 The repeatability test of multiplex PCR
2.6 临床检测
应用所建立的多重PCR方法对采集的223份临床疑似病料进行检测,结果检出invA基因阳性27份,占12.11%(27/223),其中invA+spvR基因阳性19份,占8.52%(19/223);invA+fliC基因阳性2份,占0.89%(2/223);invA+spvR+fliC基因阳性6份,占2.69%(6/223)。应用国家标准GB4789.4-2010《食品微生物学检验 沙门氏菌检验》中规定的方法对以上223份临床疑似病料进行检测,结果沙门菌阳性为27份。两种方法的符合率为100%(图7)。
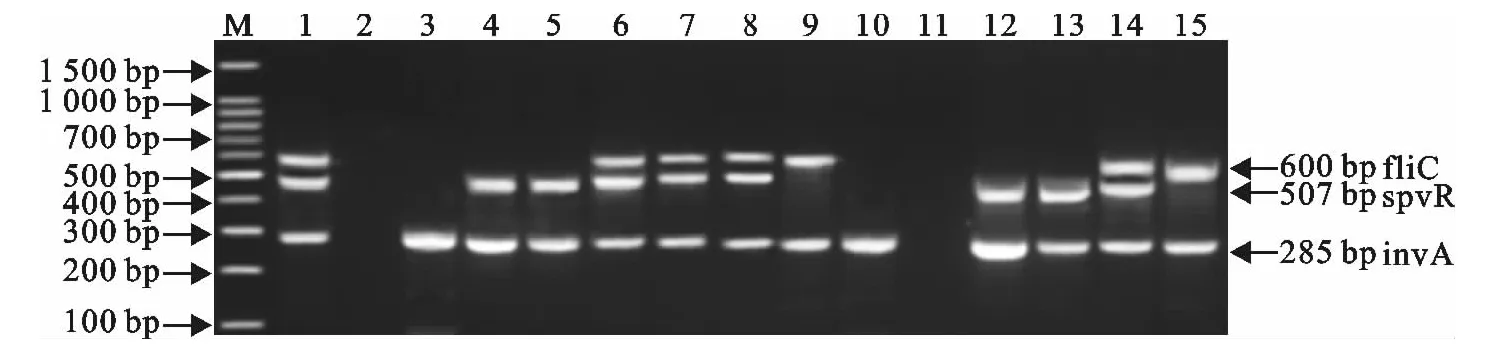
图7 部分临床样品的检测结果Fig.7 The detection results of partial clinical samples by multiplex PCR
2.7 致病性试验
观察接种后的小鼠,A组(正常对照组)直至96h无异常,B、C、D组小鼠均在72h内死亡,临床症状表现为精神委靡,毛粗糙松乱,粪便有黏液;剖检以肝、脾肿大为主,肝脏表面有针尖大小的灰白点。应用国家标准GB4789.4-2010中规定的检测方法,可从肝、脾分离到沙门菌;同时,取肝、脾组织提取总DNA,应用所建立的多重PCR进行检测,A组均为阴性,而B组可扩增出285bp和507bp条带(即invA+spvR基因扩增条带)、C组可扩增出285、507、600bp条带(即invA+spvR+fliC基因扩增条带)、D组可扩增出285bp和600bp条带(即invA+fliC基因扩增条带),与所接种菌株完全一致。
经用t检验法进行统计学分析,表明分别携带invA+spvR基因(B组)、invA+fliC基因(D组)、invA+spvR+fliC基因(C组)的沙门菌的发病率、死亡率无显著差异。
3 讨论
沙门菌种类繁多,已知有2 600多种血清型,其中禽类中已报道有38种,分属于6个血清群。鸡源致病性沙门菌除了在养殖环节感染鸡只致病外,也可在流通环节污染鸡蛋、鸡胴体及鸡肉制品等,是目前世界上最为常见的引发食源性中毒的病原菌,WHO将沙门菌列入具有严重危害和中等危害的食物传播性病原[7]。建立鸡源致病性沙门菌的快速鉴别检测方法,对疫病的快速诊断、有效防控及食品安全具有重要意义。致病性沙门菌inv基因簇编码吸附和侵袭上皮细胞表面蛋白,其中invA是主要的毒力因子,为沙门菌属特有的保守序列,在非沙门菌中尚未发现,具有极高的属特异性[4];fliC基因编码H1相抗原,H1相又称特异相,特异性高,其Ⅰ区和Ⅷ区的保守性达100%。鸡白痢沙门菌和鸡伤寒沙门菌具有高度宿主适应性,正常状态下无功能性鞭毛,有研究发现这些无运动性鞭毛的沙门菌在其fliC基因的可变区存在位点变化,可由这些序列差异识别无运动性的沙门菌[5];spvR是编码沙门菌毒力相关质粒的基因,与致病力表型存在相关性,含毒力因子的质粒在自主复制过程中将毒力因子传给子代或在细菌之间发生转移,对毒力因子在细菌间的传 递 发 挥 重 要 作 用[6]。Radhika M 等[8]、李 小 玲等[9]均证实基于invA基因设计的引物,可以特异性地检测致病性沙门菌,而在非沙门菌中未能发现invA 基因;LI J等[10]和徐耀辉等[11]针对fliC 基因Ⅰ区设计引物扩增沙门菌,证实fliC基因具有鸡宿主适应特异性;Derakhshandeh A等 和刘华伟等针对spvR基因设计引物,可以特异性检测到含有该毒力基因的沙门菌,而不含质粒以及质粒无该毒力基因的沙门菌则表现阴性。本研究根据上述invA、fliC和spvR基因的特点,设计3对特异性引物,经过对模板浓度、退火温度、引物浓度、循环数等条件进行优化,成功建立了能够检测具有致病性并携带质粒毒力基因的鸡沙门菌的多重PCR检测方法,并应用于223份临床病料的检测,进一步证实了所建立的多重PCR方法的可靠性。相较于传统的细菌分离、血清型鉴定、动物致病性试验等传统方法,以及检测菌株血清型、毒力基因或耐药基因的单重和多重PCR方法,本研究所建立的多重PCR检测方法利用一个反应即可同时检测具有致病性沙门菌属特异性、鸡宿主特异性并携带毒力质粒的沙门菌,准确、快速、省时、省力。
对来自广西的223份临床病料进行多重PCR检测,检出沙门菌属invA基因27份,检出率为12.11%(27/223),其中invA+spvR 基因阳性19份,占70.37%(19/27);invA+spvR+fliC基因阳性6份,占22.22%(6/27);invA+fliC基因阳性2份,占7.41%(2/27),表明广西鸡群感染致病性沙门菌比较严重,而且流行毒株呈现多样性。胡杰等[14]对广西2006年-2012年鸡沙门菌感染情况的调查表明,规模鸡场沙门菌感染普遍,而且鸡场阳性率和鸡群个体阳性率逐年升高。近年来,对国内不同省份的流行病学调查表明,鸡群沙门菌感染率居高不下,血清型种类繁多[15-16],而且致病性沙门菌耐药性日益严重[17-18],给沙门菌病的预防、治疗和控制带来了严峻的挑战。当前,加强沙门菌流行菌株的监测,掌握流行优势菌株的动态,及时加以检测和诊断,合理有效用药,是有效防控乃至净化鸡沙门菌病的重要基础。
本研究针对沙门菌属特异性毒力因子invA基因、鸡宿主特异性毒力因子fliC基因、质粒毒力因子spvR基因所建立的鸡源致病性沙门菌多重PCR方法,具有特异性强、敏感性高、重复性好,高效、快速等特点,省时、省力、节约成本,不仅可用于沙门菌的临床检测和流行病学调查,也可用于沙门菌的致病机理和免疫机理研究,不仅可用于养殖环节的沙门菌检测,也可用于流通环节的沙门菌监测,应用前景十分广阔。
[1]李静怡,崔可琦,冯赛祥,等.鸡白痢沙门菌的分离鉴定、耐药性及分子分型研究[J].动物医学进展,2013,34(9):62-65.
[2]Lutful Kabir S M.Avian colibacillosis and salmonellosis:a closer look at epidemiology,pathogenesis,diagnosis,control and public health concerns[J].Int J Environ Res Public Health,2010,7(1):89-114.
[3]唐 攀,崔恩慧,刘万华,等.鸡源沙门菌PFGE分型及耐药性研究[J].动物医学进展,2013,34(11):1-5.
[4]Bohaychuk V M,Gensler G E,McFall M E,et al.A real-time PCR assay for the detection ofSalmonellain a wide variety of food and food-animal matricest[J].J Food Prot,2007,70(5):1080-1087.
[5]EI-Aziz D M.Detection ofSalmonellatyphimuriumin retail chicken meat and chicken giblets[J].Asian Pac J Trop Biomed,2013,3(9):678-681.
[6]Guiney D G,Fierer J.The role of the spv genes inSalmonellapathogenesis[J].Front Microbiol,2011(2):129.
[7]Breuil J,Brisabois A,Casin I,et al.Antibiotic resistance inSalmonellae isolated from humans and animals in France:comparative data from 1994and 1997[J].J Antimicrob Chemother,2000,46(6):965-971.
[8]Radhika M,Saugata M,Murali H S,et al.A novel multiplex PCR for the simultaneous detection ofSalmonellaentericaandShigellaspecies[J].Braz J Microbiol,2014,45(2):667-676.
[9]李小玲,刘 斌,但现龙,等.沙门菌内标PCR快速检测试剂盒的研制与应用[J].中国农业科学,2011,44(16):3395-3402.
[10]Li J,Smith N H,Nelson K,et al.Evolutionary origin and radiation of the avian-adapted non-motileSalmonellae[J].J Med Microbiol,1993,38(2):129-139.
[11]徐耀辉,焦新安,胡清海,等.鸡白痢和鸡伤寒沙门菌的PCRRFLP分子鉴定[J].扬州大学学报:农业与生命科学版,2005,26(1):1-4.
[12]Derakhshandeh A,Firouzi R,Khoshbakht R.Association of three plasmid-encoded spv genes among differentSalmonellaserotypes isolated from different origins[J].Indian J Microbiol,2013,53(1):106-110.
[13]刘华伟,马立农,郭蔼光,等.具毒性质粒沙门菌的快速检测[J].西北农学报,2009,18(6):382-384.
[14]胡 杰,张步娴,屈素洁,等.2006年-2012年广西鸡沙门菌感染情况调查[J].上海畜牧兽医通讯,2013(6):4-6.
[15]薛俊龙,田林君,张国权,等.山西省鸡沙门菌病流行病学调查分析[J].山西农业科学,2010,38(9):58-62.
[16]张纯燕,宁宜宝,宋 立,等.临床健康肉鸡沙门菌的携带与血清学感染状况调查[J].中国家禽,2014,36(17):58-60.
[17]刘芳萍,赵玉林,李昌文,等.鸡源性沙门菌耐药基因检测与耐药相关性分析[J].中国预防兽医学报,2013,35(8):627-630.
[18]戴建华,吴 植,袁维峰.禽源致病性沙门菌耐药表型与耐药基因的分析[J].中国畜牧兽医,2014,41(4):245-248.
