布鲁菌S2疫苗株的核酸探针检测方法的建立
2015-06-25宫利娜高航飞李旭东安维雪申之义
张 岩,李 建,宫利娜,高航飞,李旭东,安维雪,申之义
(内蒙古农业大学兽医学院农业部动物疾病临床诊疗技术重点实验室,内蒙古呼和浩特010018)
布鲁菌病(Brucellosis)是一种全世界广泛分布的人兽共患慢性传染病,布鲁菌病流行范围广,不易根除,不仅给畜牧业造成巨大的经济损失,还严重威胁着人类和动物的健康[1]。控制布鲁菌病传播的最有效手段是疫苗免疫接种,而目前预防布鲁菌病的最好疫苗是减毒活疫苗[2],主要有 S2、M5、S19、Rev.1等,我国主要使用S2疫苗。目前,布鲁菌的检测主要依靠细菌学和免疫学检验技术,细菌培养虽然可以直接观察到布鲁菌,得出确定的诊断结论;但布鲁菌的培养通常需要3d~7d时间,操作具有一定的危险性,并且阳性率偏低,需要专业的技术人员进行操作[3];免疫学技术是动物布鲁菌检测的常规方法,具有快速、简便、费用低等优点,但也存在不足,如检测依赖于动物体内抗体水平会因为抗体交叉反应而出现假阳性,血清学阳性只能推断感染,却不能确定感染状态是持续感染还是耐过状态[4]。
PCR方法无需高级别防护要求,具有快速、特异、灵敏等优点,已成为目前较为重要的布鲁菌检测手段。虽然布鲁菌基因片段在种属之间具有较高的同源性[5],易出现特异性不佳、假阳性等情况[6],但仍然可以区分布鲁菌属及大部分种[7-9],甚至区分S19疫苗株和野毒株[10],只是目前尚无实用的PCR方法能鉴别出S2疫苗株。实时荧光定量PCR(realtime PCR)是近年来发展起来的分子生物学技术,突出特点是快速、无需电泳并能避免污染,但是realtime PCR成本高,限制了其应用范围和普遍适用性[11]。为了鉴别出疫苗免疫和布鲁菌感染,通过查阅文献和对NCBI公布的布鲁菌毒株基因序列比对,发现只有S2疫苗株在IclR基因存在25bp的缺失,根据缺失部分设计核酸探针,用以检测S2疫苗株,新的诊断方法对布鲁菌病的预防和控制有重大意义。
1 材料与方法
1.1 材料
1.1.1 菌株 布鲁菌S2疫苗株由金宇保灵生物公司提供;布鲁菌M5株、M28株、16M株、猪1330株、牛544A株由中国动物卫生与流行病学中心提供;流产沙门菌、多杀性巴氏杆菌、葡萄球菌、大肠埃希菌、牛支原体由内蒙古农业大学传染病实验室和微生物实验室提供。
1.1.2 主要仪器与试剂 PCR仪(eppendorf AG 22331Hamburg Garrmany)为 Eppendorf产品;水浴锅(HW.SY11-K)为北京市长风仪器仪表公司产品;凝胶成像仪(SYDR412391)为 Gene Campany Limited GBOX HR made in the VK 产品 ;DNA 提取试剂盒、普通琼脂糖凝胶DNA回收试剂盒、DH5α感受态细胞均购自北京天根生化科技有限公司;2×EasyTaqPCR SuperMix、pMD19-T 连接试剂盒、DNA Marker 500为 TaKaRa公司产品;质粒提取试剂盒为美国AXYGEN公司产品;Gene JET Gel Extraction Kit为宝生物工程(大连)有限公司产品;DIG High Prime DNA Labeling and Detection Starter KitⅡ为Roche公司产品;其他试剂为实验室分析纯;耗材为内蒙古农业大学传染病实验室提供。
1.1.3 引物设计与合成 参照NCBI公布的Brucella suis bv.1str.S2chromosome1全序列(CP 006961.1),利用 Oligo6.0软件设计一对引物和一条探针,由上海生工生物工程技术服务有限公司合成。上 游 引物:5′-ATGAAGGGCGTGGCGAAGGA-3′下 游 引 物:5′-AAGGCGATTTGCGGGTGG-3′S2 探 针:5′-CAGTTTCCAAGGTCGGCTACGAACAGCGT-3′。
1.2 方法
1.2.1 细菌基因组DNA提取 试验菌种复苏后,各挑取单个菌落到1.5mL适宜液体培养基中,37℃培养至对数生长中期,80℃水浴锅灭活1h,然后按细菌基因组DNA提取试剂盒说明书提取各细菌基因组DNA,经初步定量的核酸置-20℃保存备用。
1.2.2 PCR方法的建立 25μL的反应体系中,8.5μL去离子水,稀释好的上、下游引物各1μL,模板2μL,2×EasyTaqPCR SuperMix 12.5μL;PCR反应程序为:94℃5min;94℃45s,56℃45s,72℃45s,30个循环;72℃10min。扩增产物用30g/L琼脂糖凝胶进行电泳鉴定,然后用Gene JET Gel Extraction Kit试剂盒胶回收目的片段,定量后置-20℃保存。
1.2.3 PCR产物鉴定 S2疫苗株PCR扩增的特异性条带胶回收后,按常规方法克隆进pMD19-T载体,送华大基因公司进行测序。
1.2.4 探针特异性检测 杂交过程按罗氏DIG High Prime DNA Labeling and Detection Starter KitⅡ试剂盒说明书进行:分别将纯化的布鲁菌S2株、M5株、M28株、16M 株、猪1330株和牛544A的PCR扩增的回收产物于沸水中变性10min后迅速置冰水浴冷却10min;取变性样品2μL,点于处理好的NC膜上120℃烘烤固定30min;预杂交30min后42℃杂交液(地高辛探针25ng/mL)中杂交4h。杂交完成后,首先以2×SSC(含1g/L SDS,W/V)25℃晃动洗涤2次,每次5min;再以0.5×SSC(含1g/L SDS,W/V)51℃洗涤2次,每次15min;洗涤后的NC膜置100mL封闭液中,25℃封闭30min;然后置于抗DIG抗体液(1∶5 000)中25℃孵育30min,接着用洗涤缓冲液洗涤两次,每次15min;以检测缓冲液室温平衡5min,置于20mL底物显色液中,避光显色1h;最后以适量灭菌双蒸水洗涤5min终止反应,观察结果并照相(重复3次)。
1.2.5 探针敏感性检测 将变性的胶回收产物稀释为25、1ng/μL、100、10、1、0.1pg/μL及阴性对照,分别取2μL点于处理好的NC膜上,按1.2.4步骤进行斑点杂交和显色,观察结果并照相(重复3次)。
1.2.6 病料中S2疫苗的检测 从某免疫过S2疫苗的牛场随机采取10份血样,提取DNA进行PCR扩增,并应用建立的布鲁氏菌S2疫苗株的斑点杂交检测方法进行检测。
2 结果
2.1 PCR扩增结果
采用细菌基因组DNA提取试剂盒分别提取试验菌株基因组DNA为模板,使用自主设计的引物进行常规PCR扩增。取常规PCR扩增产物10μL,在30g/L琼脂糖凝胶点样进行电泳,采用紫外凝胶成像仪观察结果,按照25μL反应体系和PCR循环程序,在退火温度为56℃时,选取的布鲁菌株都能获得预期的PCR条带。M5、M28、16M、猪1330、牛544A株均能扩增出约360bp左右的条带;S2疫苗株扩增出约330bp的条带;流产沙门菌、多杀性巴杆菌、葡萄球菌、大肠埃希菌、牛支原体均没有任何可见条带。PCR产物电泳结果见图1。
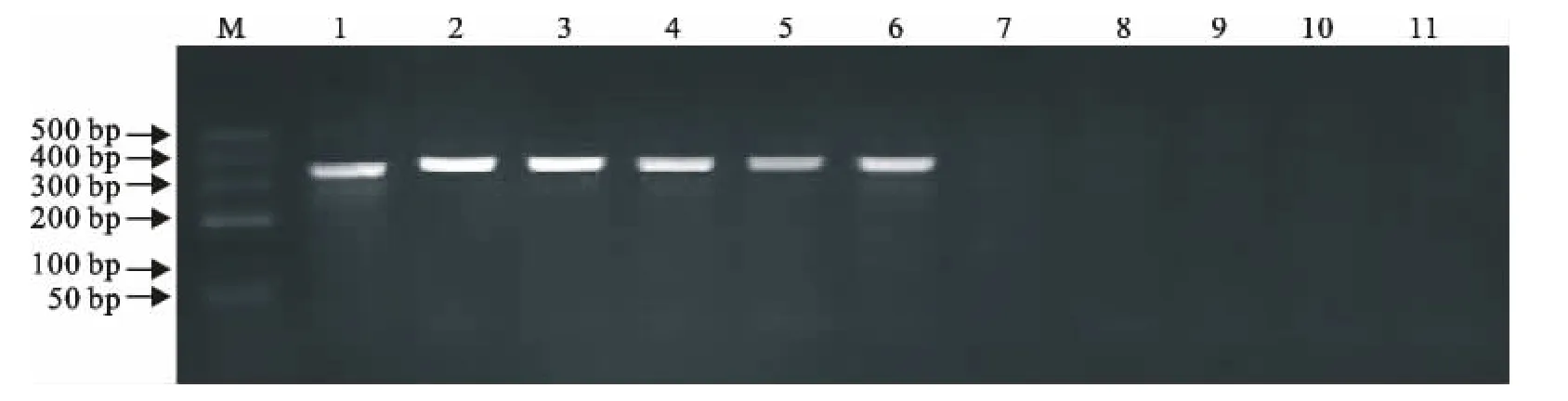
图1 布鲁菌PCR扩增结果Fig.1 PCR results of Brucellastrains
2.2 PCR产物鉴定结果
S2疫苗株PCR扩增的特异性条带胶回收后,按常规方法克隆进pMD19-T载体,阳性菌株送华大基因公司进行测序。将测序获得的基因序列使用DNA Star软件中的MegAlign进行拼接,然后登陆NCBI,使用Blast进行比对,S2疫苗株PCR产物的测序结果与Brucellasuisbv.1str.S2chromosome1,complete sequence(Sequence ID:gb|CP 006961.1|246683-247016)序列一致,说明扩增的片段正确。
2.3 探针特异性检测结果
经过42℃杂交液杂交4h及免疫显色反应后,杂交膜上仅阳性对照和S2疫苗株出现斑点,其他菌株未出现斑点(3次重复结果一致),结果见图2,因此该探针具有特异性。
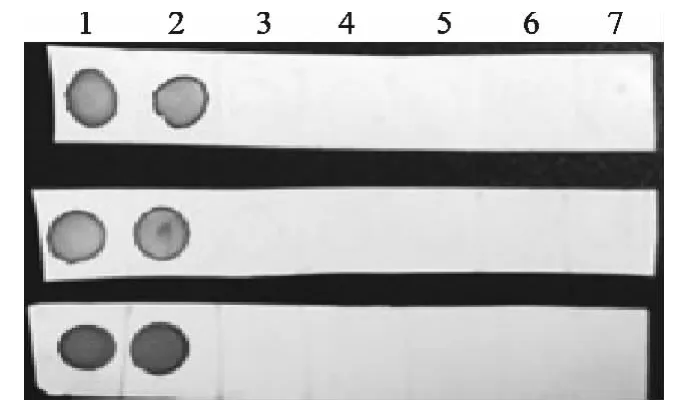
图2 探针特异性结果Fig.2 The results of probe specificity
2.4 探针敏感性检测结果
经过42℃杂交液杂交4h及免疫显色反应后,结果显示,25、1ng/μL、100、10pg/μL均能显色,且斑点颜色随着浓度的递减而变淡,而1、0.1pg/μL、阴性对照未显色(3次重复结果一致),结果见图3,因此该探针最低检测量为10pg/μL。
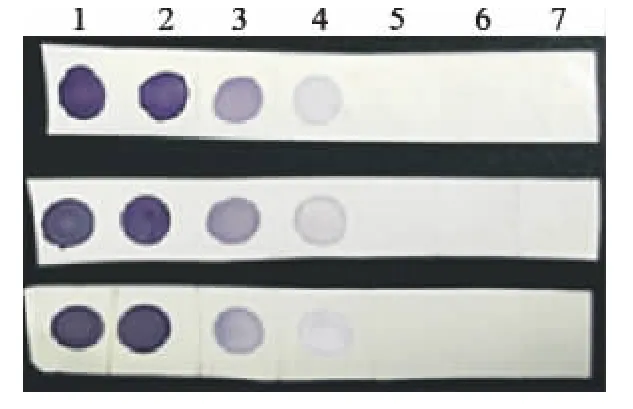
图3 探针敏感性结果Fig.3 The results of probe sensitively
2.5 病料中S2疫苗的检测结果
提取的样本DNA用自主设计的引物进行常规PCR扩增,结果显示10个样本有6个能扩增出约330bp的片段,其他4个没有片段(图4)。PCR扩增出的片段经过回收、变性、烘烤固定,然后进行斑点杂交和免疫显色,结果全部出现斑点(图5),说明扩增的PCR产物为S2疫苗株基因序列。
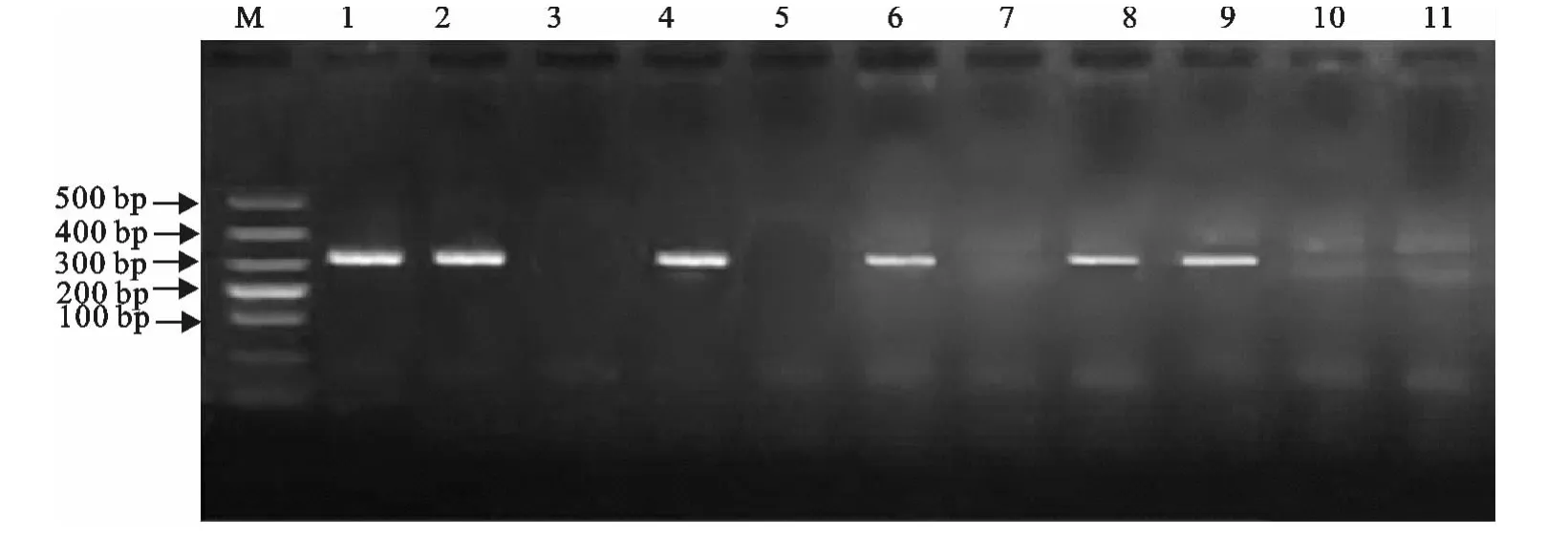
图4 样本PCR检测结果Fig.4 PCR results of samples
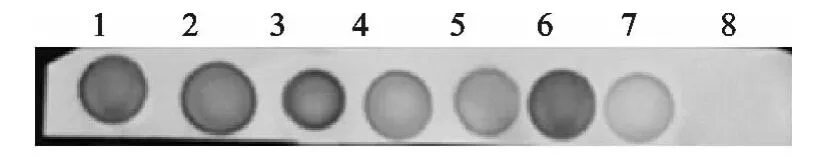
图5 斑点杂交结果Fig.5 The results of dot blot hybridization
3 讨论
布鲁菌作为目前全世界反弹最为严重的重要人畜共患病病原,已经成为相关学科研究的热点。近10年来,布鲁菌病在中国流行情况越来越严重,畜群和人群中布病感染率逐年上升,再次严重地威胁着畜牧业和公共卫生[12]。目前布鲁菌病的诊断方法有多种,以病原学和免疫学为主[13],但是这些方法大多不完善,而且没有快速、准确、易操作的检测方法能鉴别出疫苗免疫和自然菌株感染,鉴于布鲁菌病对公共卫生和经济发展的严重影响,全球各国对净化、根除布病的要求也愈来愈迫切 。通过查阅文献和对NCBI发表的布鲁菌株基因序列比对,发现S2疫苗株在IclR基因存在25bp(SequenceID:gb|CP006961.1|:246968-246969)的缺失,而其他菌株没有缺失,根据缺失部分,设计了长度为29bp的探针,针对该探针位点,设计PCR引物,扩增出的基因包含探针,这样就将PCR的敏感结合进来,使该诊断方法具有高特异性,高敏感性。
本试验建立了相对完善的布鲁菌斑点杂交鉴别方法,能准确的鉴别出布鲁菌S2疫苗株,具有重要的生产实际意义。斑点杂交方便快捷,膜制备时间短,并且可以大量制备后置于4℃保存半年之久,探针可以重复利用,从病料中提取DNA开始,经过一次PCR扩增和一次杂交就能准确快速进行诊断,鉴定过程不超过10h,既可以确定是否是布鲁菌属,又可以区分S2疫苗株和其他菌株。本研究建立的核酸探针检测方法充分利用了PCR的高灵敏度和斑点杂交的高特异性,不仅为布鲁菌病的防控及生物安全提供了快速、安全、便捷的技术支持,也可作为布鲁菌病临床诊断的辅助手段。
[1]谷玉静,尹力华,郝满良.布鲁菌病的诊断与防控研究进展[J].动物医学进展,2014,35(2):110-114.
[2]Schurig G G,Sriranganathan N,Corbef M J.et al.Brucellosis vaccines:past,present and future[J].Vet Microbiol,2002,90(1):479-496.
[3]Gotuzzo E,Carrillo C,Guerra J.et al.An evaluation of diagnostic methods for brucellosis-the value of bone marrow culture J .J Infect Dis1986153122-125.
[4]高明春,王君伟.布鲁菌病实验室诊断技术及其适用性评析[J].中国奶牛,2012(4):35-37.
[5]Redkar R,Rose S,Bricker B,et al,Real-time detection ofBrucellaabortus,BrucellamalitensisandBrucellasuis[J].Mol Cell Probe,2001,15(1):43-52.
[6]Probert W S,Schrader K N,Khuong N Y,et al.Real-time multi-plex PCR assay for detection ofBrucellaspp.,B.abortus,andB.melitensis[J].J Clin Microbiol,2004,42(3):1290-1293.
[7]Bricker B J,Halling S M.Differentiation ofBrucellaabortusbv.1,2and 4,Brucellamelitemsis.Brucellaovis,andBrucella suisbv.1by PCR[J].J Clin Microbiol,1994,32:2660-2666.
[8]Bricker B J,Halling S M.Enhancement of theBrucellaAMOS PCR assay for differentiation ofBrucellaabortusvaccine strains Sl9and RB51[J].J Clin Microbiol,1995,33:1640-1642.
[9]Ewalt D R,Bricker B J.Validation of the abbreviatedBrucellaAMOS PCR as a rapid screening method for differentiation ofBrucellaabortusfield strain isolates and the vaccine strains 19 and RB51[J].J Clini Microbiol,2000(3):3085-3086.
[10]钟 旗,范伟兴.AMOS-PCR对布氏杆菌种型鉴定的研究[J].中国人兽共患病学报,2007,23(7):386-387.
[11]Gopaul K K,Koylass M S.Rapid identification ofBrucellaisolates to the species level by real time PCR based single nucleotide polymorphism(SNP)analysis[J].BMC Microbiol,2008(8):86.
[12]丁家波,王 芳,杨宏军,等.一株中等毒力牛种布鲁菌的鉴定和毒力测定[J].中国农业科学,2014,47(13):2652-2658.
[13]赵林立,唐泰山,赵治国,等.呼和浩特地区牛羊布鲁菌流行株种及生物型鉴定[J].动物医学进展,2011,32(9):32-36.
[14]董 浩,吴清民.布鲁菌群体感应系统研究进展[J].动物医学进展,2013,34(2):88-91.
