两株不同致病力H9N2亚型禽流感病毒全基因组序列分析
2015-06-25刘琳琳郭学金范丹丹朱梅胜王守春徐守振王建琳毕玉海尹燕博
刘琳琳,张 毅,郭学金,范丹丹,朱梅胜,王守春,徐守振,王建琳,毕玉海,尹燕博*
(1.青岛农业大学动物科技学院,山东青岛266109;2.中国动物卫生与流行病学中心,山东青岛266032;3.中国科学院微生物研究所,北京100101)
禽流感病毒(Avian influenza virus,AIV)变异频繁,血清型众多,目前已发现16种HA亚型和9种NA亚型。1966年,首次在美国威斯康辛州的火鸡中分离到H9N2亚型禽流感病毒[1]。在中国大陆,1994年陈伯伦等[2]首次从广东某鸡场发病鸡体内分离到6株H9N2亚型禽流感病毒。香港大学和中国农业科学院哈尔滨兽医研究所等单位发表的监测数据显示,H9N2亚型流感病毒在我国持续流行,且宿主范围广泛,包括鸡、鸭、珍珠鸡、鹌鹑等[3]。2013年以来,在我国发现的新型H7N9亚型和H10N8亚型流感病毒,其内部基因均来自于H9N2亚型禽流感病毒。
H9N2亚型禽流感病毒为低致病性禽流感病毒,在实验条件下接种SPF鸡,一般不表现临床症状,或表现出轻微的临床症状。在养殖环境下,可引起鸡呼吸困难、腹泻、产蛋下降等症状,当继发细菌感染时,可引起部分病鸡的死亡。近些年来,根据本实验室对临床分离的H9N2亚型毒株研究发现,部分分离株对鸡和鸡胚的致病性显著增强。强致病力毒株在鸡体内复制力强、排毒时间长,且可以造成鸡系统性感染,接种鸡胚后,能够致死鸡胚[4]。这种强致病力H9N2毒株的出现,对于养禽业和公共卫生均构成威胁。
为了探究H9N2亚型毒株致病力增强的原因,本实验室选取2株分离自同一地区,而致病力存在显著差异的H9N2亚型毒株,测定了其全基因组序列,现将序列分析结果报告如下。
1 材料与方法
1.1 材料
1.1.1 病 毒 A/chicken/Shandong/196/2011(SD/196)、A/chicken/Shandong/818/2010(SD/818)2株H9N2亚型禽流感毒株均分离自山东某地区发病鸡场采集的组织样本,随后采用鸡胚有限稀释方法纯化3次,并收集24h后自然死亡或未死亡鸡胚的尿囊液,放置-80℃保存备用。按照OIE指定的方法对毒株的各种参数进行测定,结果见表1。

表1 病毒生物学特性鉴定结果Table 1 The identification of biological characteristics of viruses
1.1.2 试剂 裂解液、TaqDNA 聚合酶、dNTP、M-MLV反转录酶、胶回收试剂盒、pMD19-T Vector、DNA液体纯化试剂盒、大肠埃希菌DH5α感受态细胞,宝生物工程(大连)有限公司产品;2×EasyTaqPCR Super Mix、Fast PFU、Trans5KDNA Maker,北京全式金公司产品。
1.1.3 引物设计与合成 参考GenBank上已公布的H9N2亚型禽流感病毒基因序列,应用Primer5.0软件设计引物,由宝生物工程(大连)有限公司合成,引物序列略。
1.2 方法
1.2.1 目的基因的获取 取250μL含病毒的尿囊液加入到750μL裂解液中,轻轻混匀;加入300μL三氯甲烷,颠倒混匀,冰浴10min,4℃、12 000r/min离心15min;取600μL上清液至等体积异丙醇中,颠倒混匀,冰浴10min,4℃、12 000r/min离心10 min;弃去上清,用1mL 750mL/L冰乙醇洗涤,弃上清,待乙醇挥发完后,用30μL DEPC水溶解核酸。取病毒RNA悬液14μL,依次加入12碱基反转录引物1μL,dNTPS(2.5mmol/L)2μL,5×MLV buffer 5μL,RNA酶抑制剂1μL,MLV反转录酶1μL,DTT 1μL,42℃水浴中作用1h。PCR反应体系:5 × PFU buffer 10μL,dNTPs(2.5 mmol/L)5μL,上、下游引物(25pmol/μL)各2μL,高保真聚合酶PFU 1μL,用无菌水补足至50μL。PCR反应条件为:95℃4min;94℃30s,58℃45 s,72℃1min,35个循环;72℃10min。反应结束后取5μL PCR产物以5V/cm恒定电压于10g/L琼脂糖凝胶中电泳。
PCR产物回收后与pMD18-T载体连接,转化大肠埃希菌DH5α感受态细胞,经PCR鉴定,阳性克隆质粒送至北京六合华大基因科技股份有限公司测序。测序结果经DNA Star软件分析拼接,得到完整的目的基因序列。
1.2.2 序列比较分析及进化树的构建 从Gen-Bank中下载已知的H9N2亚型AIV全基因序列作为参考序列,将参考序列及获得的目的基因序列导入MEGA 4.0软件,应用最大似然法绘制系统发育进化树,Bootstrap值设为1 000。用DNA Star软件包中的Meg Align程序进行序列比对,分析序列的同源性及氨基酸序列的差异。
2 结果
2.1 病毒的全基因序列测定
提取2个毒株鸡胚尿囊液的总RNA,对其8个基因片段进行分段RT-PCR扩增,10g/L琼脂糖凝胶电泳鉴定,每株病毒获得了8个预期的目的片段。纯化后,与pMD18-T连接,转化至DH5α大肠埃希菌感受态细胞,经蓝白斑筛选挑取白色菌落克隆,通过PCR扩增鉴定,2个毒株分别筛选出8个阳性克隆测序,得到SD/196和SD/818两毒株的全基因组序列。
2.2 HA基因序列分析
通过克隆测序得到2个毒株的HA基因开放阅读框(ORF)为1 683bp,共编码560个氨基酸,包括18个氨基酸的信号肽部分,321个氨基酸的HA1部分和221个氨基酸的HA2部分。2毒株的HA基因同源性为97.93%,推导的氨基酸同源性为97.9%。序列分析表明,SD/196分离株HA基因裂解位点氨基酸序列为PSKSSR↓GLF,SD/818分离株为PSRSSR↓GLF,均符合低致病性禽流感病毒的特征。2株病毒HA基因均含有8个潜在糖基化位点,与参考株 D/Hong Kong/Y280/97(Y280)相比,在313位和551位分别多了一个潜在糖基化位点。H9亚型 AIV的 HA基因在109、161、163、163、191、198、202、203位和146~150及232~237位构成了受体结合位点的袋状结构。2株病毒HA基因受体结合位点左侧壁(232bp~237bp)均为NGLQGR,右侧臂(146bp~150bp)为 GTSKA。受体结合位点的不同体现在191位上,SD/196为H,SD/818为N。值得注意的是,2个分离株病毒HA基因在234位都是L,具有与哺乳动物唾液酸α,2~6受体结合的特性(表2)。

表2 HA关键位点的序列比较Table 2 Comparison of key amino acid sites of HA protein
2.3 NA序列分析
2毒株NA基因ORF为1401个核苷酸,共编码466个氨基酸,同源性为98.03%。与参考株Ck/Beijing/1/94(BJ94)相比,NA基因在颈部63、64、65处缺失了T、E、I 3个氨基酸,导致了61位点处的糖基化位点缺失。SD/196有6个潜在的糖基化位点,SD/818株在245位多了一个潜在的糖基化位点。2个毒株的NA蛋白的唾液酸结合位点(hemadsorbing site,HB)在399位存在差异,SD/196株为 D,SD/818株为G(表3)。

表3 NA关键位点的序列比较Table 3 Comparison of key amino acid sites of NA protein
2.4 内部基因序列分析
2个毒株PB2基因ORF均编码759个氨基酸,同源性为98.6%。627位和701位氨基酸没有发现E/K或D/N的突变,仍为禽源病毒特征。2株病毒的PB1、NP、M、NS基因同源性较高,均在98.0%以上,相比其他经典H9N2亚型分离株,均未发现明显变异。值得注意的是,2株病毒的PA基因差异较大,同源性为97.1%。序列分析发现,相比其他经典H9N2亚型毒株或近期大陆地区分离株,SD/818在第55位、99位、226位、336位、521位氨基酸处分别出现D→N、G→R、F→L、L→M、V→I的变异(表4)。通过对截至2014年底GenBank中H9N2亚型毒株PA蛋白的氨基酸序列进行统计发现,这5个位点的氨基酸出现这种变异的频率较低(表5)。
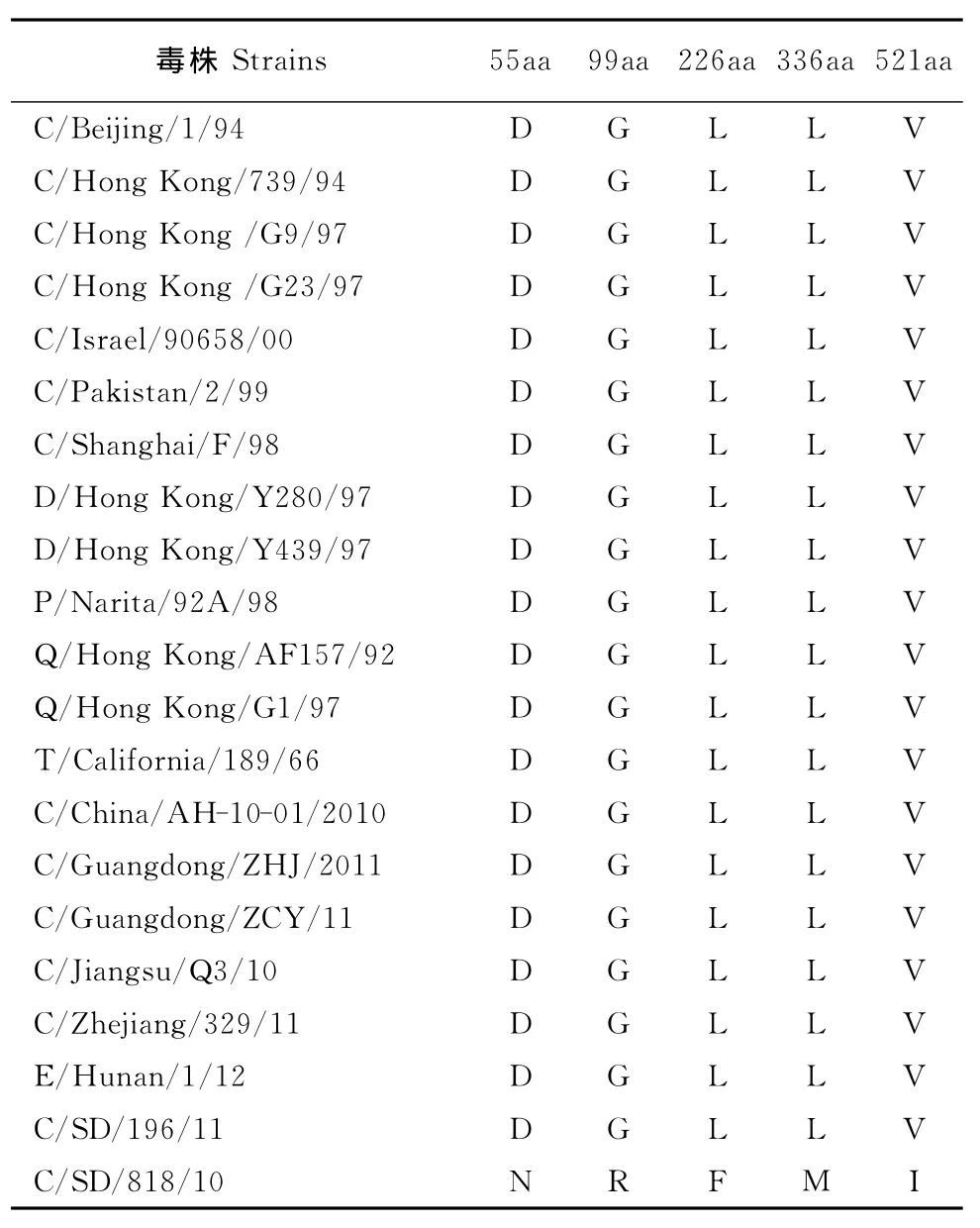
表4 SD/818分离株与其他H9NA亚型AIV PA基因突变位点的比较Table 4 Comparison of mutation sites of PA gene of SD/818with other H9N2virus strains
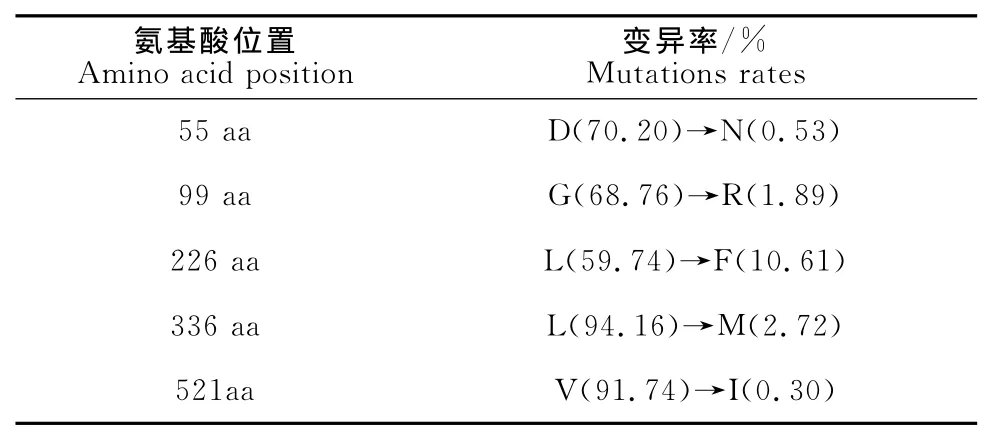
表5 GenBank中统计的H9N2亚型毒株PA蛋白5个位点的变异率Table 5 Mutation rates of 5amino acids of PA protein of H9N2virus strains in GenBank
2.5 H9N2亚型AIV基因组的遗传进化分析
应用MEGA 4.0软件分别绘制了2株病毒的遗传进化树,结果显示,我国H9N2亚型流感病毒HA基因主要分为两大分支,即BJ/94-like(代表株:C/Beijing/1/94)和 G1-like(代表株:Q/Hong Kong/G1/97)分支。2株病毒的HA基因属欧亚系C/Beijing/1/94这一大分支,与代表株 CK/Shanghai/F/98 及 BJ/1/94 有 一定的遗传距离,与 D/Hong Kong/Y280/97同源性最高,属于Y280亚系。我国H9N2亚型病毒的NA基因主要包括BJ/94-like和G1-like分支,与HA基因相似,本研究的2株病毒都属于欧亚大陆禽分支,均在BJ/94分支内,属于Y280亚系(图1)。对内部基因(PB2、PB1、PA、NP、M、NS)的系统进化分析发现,H9N2亚型AIV内部基因呈现多样性的特点,其分支主要包括了BJ/94-like、G1-like、F/98-like等(图2)。PB2基因进化树中,两毒株均与标准流感病毒毒株的遗传进化关系较远,在相应的进化树上另成Unknown Avian分支。PB1、PA和NP基因均来自F98亚系。从M蛋白基因进化树上分析,我国H9N2亚型AIV的M基因多数属于G1/97分支。NS基因为BJ/1/94分支。参照Li C等[5]基因分型方法,2毒株蛋白基因形成了1个独特的基因群,如表6所示。

表6 H9N2亚型毒株不同基因分群Table 6 Different genotypes of H9N2strains

图1 H9N2亚型AIV表面基因遗传进化树Fig.1 Phylogenetic tree of surface genes of H9N2AIV isolates
3 讨论
自1966年以来,H9N2亚型AIV在世界范围内广泛流行,给养禽业造成了巨大的损失[6]。自2008年,本实验室临床监测中,分离到一定比例的可以致死鸡胚的H9N2亚型毒株,且这些毒株对SPF鸡的致病力显著增强[4]。为了找到H9N2亚型病毒致病力增强的分子线索,本研究以山东省分离的2株致病力存在明显差异的H9N2亚型毒株为研究对象,对其进行了全基因组克隆、序列测定和序列分析。研究发现,2个毒株所处的进化分支基本相似,但是强致病力毒株SD/818的HA、NA和PA基因出现了某些特征性的突变,其可能对病毒各功能蛋白的结构和功能产生影响,进而影响毒株的致病力。
研究发现,与弱致病力毒株SD/196相比,SD/818在HA蛋白191位受体结合位点和NA蛋白399位唾液酸结合位点处,均存在差异,另外在NA蛋白245位多了1个潜在的糖基化位点。流感病毒受体结合位点、唾液酸结合位点或糖基化位点处单独的突变,或结合其他重要位点的突变,均可能改变病毒的致病力、组织嗜性等生物学性质[7-9]。这些重要位点的变异是否对其生物学功能产生影响,需要利用反向遗传技术进行深入研究。内部基因中,SD/818的PA基因存在明显变异,在55、99、226、316、521aa出现了一些特征性的突变,这些突变在H9N2亚型毒株中并不常见。有研究证明,PA蛋白的55N、100A、225C、268I均是人流感病毒的特征性特点,这些位点的突变会增强病毒的致病力[10];PA蛋白85I、186S、336M三个位点能够增强流感病毒聚合酶活性,在流感病毒感染宿主细胞早期加快病毒蛋白质的合成[11]。本研究发现,SD/818株PA基因在第55位、99位、226位、336位、521位氨基酸处分别出现D→N、G→R、F→L、L→M、V→I的变异,其中,55N和336M的突变可能是导致SD/818株致病力增强的重要原因,99位、226位及521位点的变异影响还有待研究。
目前H9亚型禽流感病毒可分为北美和欧亚2大分支。Sun Y 等[12]研究表明,2000年之前,在中国主要流行的H9N2亚型AIV为Y280-like基因型。2001年以来,F98-like基因型开始在我国流行,至2004年以后,F98-like基因型毒株逐渐成为了我国南北方流行的优势毒株[13-14]。本研究分离到的2株H9N2亚型AIV毒株的遗传进化分析显示,2株H9N2亚型禽流感病毒全基因发生了重配。HA、NA基因片段属于Y280-like。M基因属于G1-like,PB1、PA、NP 3个基因片段均属于F98-like,PB2在相应的进化树上另成Unknown Avian分支。

图2 H9N2亚型AIV的内部基因进化树Fig.2 Phylogenetic tree of internal genes of H9N2AIV isolates
综上所述,本研究中的2个H9N2亚型AIV分离株为重组毒株,基因片段的来源具有多样性。SD/818株HA、NA、PA基因多个重要氨基酸位点的变异,可能是使其致病力增强的重要原因。H9N2毒株在我国流行广泛,且感染的宿主类型众多,强致病力H9N2毒株的出现需要引起业内高度的重视,引起这种变异的原因也需要深入研究。
[1]Homme P J,Easterday B C.Avian influenza virus infections.I.Characteristics of influenza A/Turkey/Wisconsin/1966virus[J].Avian Dis,1970,14(1):66-74.
[2]陈伯伦,张泽纪,陈伟斌.鸡A型禽流感病毒的分离与血清血初步鉴定[J].中国兽医杂志,1994,20(10):3-5.
[3]姚美玲.H9N2亚型禽流感病毒气溶胶发生与传染机制及其感染SPF鸡的特点[D].山东泰安:山东农业大学,2010.
[4]王守春,张 毅,卢春晓,等.2007年~2010年 H9N2亚型禽流感病毒分离株对SPF鸡的致病特性研究[J].中国兽医杂志,2013(3):3-6.
[5]Li C,Yu K,Tian G,et al.Evolution of H9N2influenza viruses from domestic poultry in Mainland China[J].Virology,2005,340(1):70-83.
[6]Nili H,Asasi K.Natural cases and an experimental study of H9N2avian influenza in commercial broiler chickens of Iran[J].Avian Pathol,2002,31(3):247-252.
[7]吴玉厚,吴冰洁,朱 奇,等.禽流感病毒与人流感[J].生物学教学,2006,31(6):4-6.
[8]贾红玲,苏 艳,吴 润.禽流感病毒血凝素保守氨基酸对其受体结合位点的影响[J].中国预防兽医学报,2008,30(7):500-504.
[9]王守春,尹燕博,王晓红,等.63株H9N2亚型禽流感病毒NA基因序列分析[J].畜牧兽医学报,2011,42(2):297-305.
[10]Jakhesara S J,Bhatt V D,Patel N V,et al.Isolation and characterization of H9N2influenza virus isolates from poultry respiratory disease outbreak[J].Springer Plus,2014,3(1):1-8.
[11]Bussey K A,Desmet E A,Mattiacio J L,et al.PA residues in the 2009H1N1pandemic influenza virus enhance avian influenza virus polymerase activity in mammalian cells[J].J Virol,2011,85(14):7020-7028.
[12]Sun Y,Pu J,Jiang Z,et al.Genotypic evolution and antigenic drift of H9N2influenza viruses in China from 1994to 2008[J].Vet Microbiol,2010,146(3):215-225.
[13]刘琳玉,姜双应,汪立杰,等.青海湖地区5株H9N2亚型禽流感病毒全基因组序列进化分析[J].病毒学报,2014,30(2):5-14.
[14]Zhu G,Wang R,Xuan F,et al.Characterization of recombinant H9N2influenza viruses isolated from wild ducks in China[J].Vet Microbiol,2013,166(3):327-336.