铜胁迫对小白菜幼苗生长的影响
2015-06-24韩志平张海霞赵智灵等
韩志平 张海霞 赵智灵 等
摘 要:以北京新一号四季小白菜为材料,研究了CuSO4胁迫对基质栽培小白菜幼苗生长、光合色素含量和膜脂过氧化的影响。试验结果表明,较低浓度CuSO4使株高、叶片数、最大叶长、最大叶宽、根长及地上部、根系鲜质量和干质量显著增加,较高浓度CuSO4则显著抑制了各形态指标和生物量积累;20 μmol/L CuSO4使叶绿素a、叶绿素b和类胡萝卜素含量显著增加,较高浓度CuSO4则使各光合色素含量显著降低;随CuSO4浓度提高,叶片质膜透性显著增加,抗坏血酸含量则呈先升高后降低的趋势。说明低浓度CuSO4处理对小白菜生长有一定的促进作用,高浓度CuSO4胁迫则使光合能力降低,膜脂过氧化程度加剧,最终造成小白菜生长受到显著抑制。
关键词:小白菜;铜胁迫;生长;光合色素;质膜透性
中图分类号:S634.3;X171.5 文献标识码:S634.3 文章编号:1001-3547(2015)12-0028-05
近年来,我国工业化水平迅速提高,采矿、冶炼、印染、化工等重金属污染型企业遍布城乡,工业“三废”、城市垃圾的大量排放,高铜畜肥、杀菌剂、杀虫剂等的不合理施用,使土壤铜污染日益严重[1~3]。蔬菜对土壤铜污染十分敏感,加上蔬菜需肥水量大,吸收能力强、产品采收期长,使得其铜中毒的几率大大增加。土壤铜污染不仅降低了蔬菜作物的产量和品质,而且还可能通过食物链的传递为害动物和人类的健康[4,5]。
铜是植物必需的一种微量元素,也是细胞色素氧化酶、多酚氧化酶、抗坏血酸氧化酶及超氧化物歧化酶等多种酶类的组分,参与植物的许多生理代谢过程,对作物的生长、发育、产量和品质等有重要的影响[6,7]。但是铜具有累积性,过量的Cu2+对植物细胞具有破坏作用,可引起水分代谢、光合作用、呼吸作用、营养吸收等各种生理代谢过程的紊乱[8~10],最终抑制植株生长,导致作物减产[11,12]。
小白菜[Brassica campestris ssp. chinenses (L.) Makino]又名不结球白菜、青菜、油菜,属十字花科芸薹属草本植物。由于其茎叶可食用,营养丰富、适应性广、高产省工,可周年生产和供应,在我国栽培十分广泛。但土壤铜污染已对小白菜栽培造成了极大的威胁。为此,研究了铜胁迫对小白菜生长和膜脂过氧化的影响,为深入研究铜胁迫下小白菜的生理和分子机制奠定基础。
1 材料与方法
1.1 试验材料
试验于2013年5~6月在大同大学生命科学实验教学中心进行。供试材料为北京新一号四季小白菜,种子由河北恒通种业有限公司提供。
1.2 试验方法
种子用55℃温水烫种15 min后,清水浸泡
5 h,而后在25℃培养箱中避光催芽。5月15日种子发芽后,播于装有石英砂∶蛭石=2∶1(体积比)混合基质的塑料盘中育苗,白天温度18~22℃,夜间10~15℃。播种后每天上午浇1次1/2 Hoagland营养液(开始每盘浇0.75 L,处理15 d后每盘浇1 L),下午叶面喷施含有相应浓度CuSO4的1/2 Hoagland营养液(开始每盘喷100 mL,处理15 d后每盘喷150 mL)。共设8个处理:①CK:喷施正常营养液,含0.16 μmol/L CuSO4;②T1:喷施含20 μmol/L CuSO4的营养液;
③T2:喷施含40 μmol/L CuSO4的营养液;④T3:喷施含80 μmol/L CuSO4的营养液;⑤T4:喷施含120 μmol/L CuSO4的营养液;⑥T5:喷施含180 μmol/L CuSO4的营养液;⑦T6:喷施含240 μmol/L CuSO4的营养液;⑧T7:喷施含300 μmol/L CuSO4的营养液。完全随机排列,3次重复,每重复21株。
处理后15、20、25 d取叶片测定相关生理指标,处理后25 d测定相关生长指标。240 μmol/L 浓度(T6处理)以上的CuSO4胁迫的幼苗生长缓慢,植株矮小,处理后18 d即开始死苗,到25 d时死苗率47.06%;300 μmol/L CuSO4(T7处理)胁迫死苗63.64%,故未测定T6、T7处理的生理指标。
1.3 指标测定方法
①生长指标 测量基质表面到植株最大叶尖端的高度为株高,从根茎结合处到整株最长根根尖的长度为根长;以完全展开叶为标准计叶片数,并测量植株最大叶的长度和宽度。植株用蒸馏水洗净后吸干水分,从根茎相连处剪断,分为地上部和根系,分别称量鲜质量;在通风烘箱中105℃下杀青15 min后降温到75℃下烘干到恒重,称量干质量。
②生理指标 参照沈伟其[13]的方法提取光合色素,用打孔器在叶片上取圆片,置于乙醇丙酮混合液中暗提取24 h,而后测定OD440 nm、OD645 nm、OD663 nm,根据王素平等[14]的方法计算叶绿素a、叶绿素b和类胡萝卜素含量。质膜透性用电导率仪测定,用相对电导率表示[15];抗坏血酸含量按照赵会杰[16]的方法测定。
数据用DPS软件进行方差分析,Duncan's新复极差法进行平均数间的多重比较。
2 结果与分析
2.1 CuSO4胁迫对小白菜幼苗生长的影响
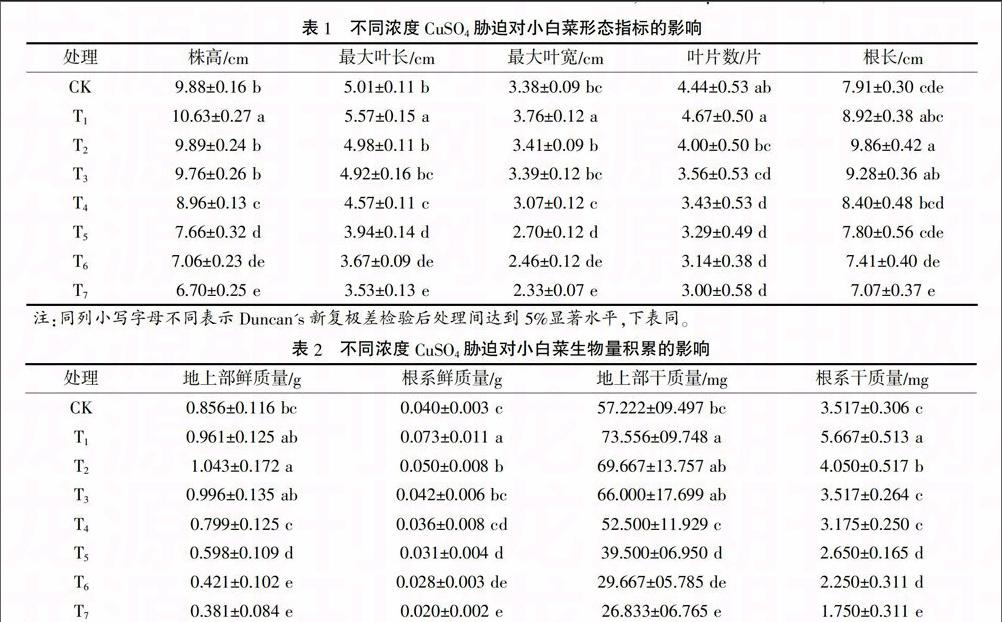
①对形态指标的影响 由表1数据表明,小白菜株高、最大叶长、最大叶宽在20 μmol/L CuSO4胁迫下均显著增大,40、80 μmol/L CuSO4处理与CK无显著差异,120 μmol/L浓度以上则随CuSO4浓度提高而显著减小;除20、40 μmol/L CuSO4处理与CK无显著差异外,叶片数随CuSO4浓度的增加显著减少;根长随CuSO4浓度提高呈先增加后减少的趋势,在40 μmol/L CuSO4下达最大值,120 μmol/L浓度以下均大于CK,180 μmol/L浓度以上则小于CK。
②对生物量积累的影响 由表2可知,小白菜地上部和根系的鲜质量和干质量均随CuSO4浓度提高呈先增加后降低的趋势,地上部鲜质量在
40 μmol/L CuSO4处理下达到最大值,地上部干质量、根系鲜质量和干质量均在20 μmol/L CuSO4下达到最大值,但80 μmol/L CuSO4浓度以下各生物量积累均大于CK,120 μmol/L浓度以上则均小于CK,180 μmol/L浓度以上CuSO4处理各生物量与CK间差异达到显著水平。结合形态指标数据可看出,较低浓度CuSO4处理有利于促进小白菜植株的生长,较高浓度CuSO4胁迫则会显著抑制小白菜的生长。
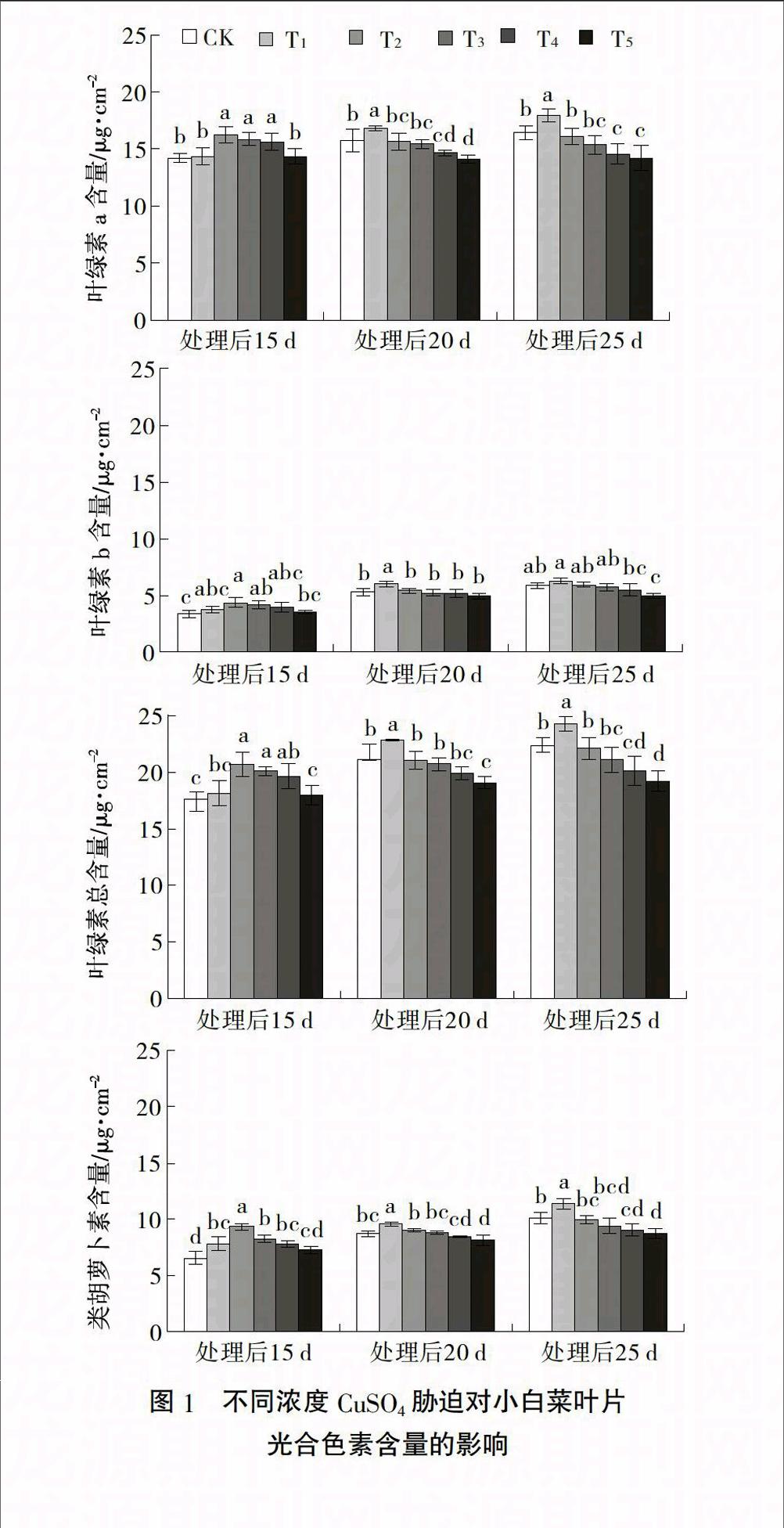
2.2 CuSO4胁迫对小白菜叶片光合色素含量的影响
图1显示,小白菜叶片各光合色素含量均随CuSO4浓度提高呈先增加后降低的趋势,处理后
15 d,各光合色素含量在40 μmol/L CuSO4处理下达到最大值,在180 μmol/L CuSO4处理下与CK无显著差异;处理后20 d和25 d,各光合色素含量均在20 μmol/L CuSO4处理下达到最大值,40、80 μmol/L CuSO4处理下与CK无显著差异,120、180 μmol/L CuSO4处理下均显著低于CK。结果说明,较低浓度CuSO4处理对小白菜光合色素合成有一定的促进作用,但随处理时间延长这种促进作用减弱,高浓度CuSO4胁迫则会抑制光合色素的合成,加快其降解。
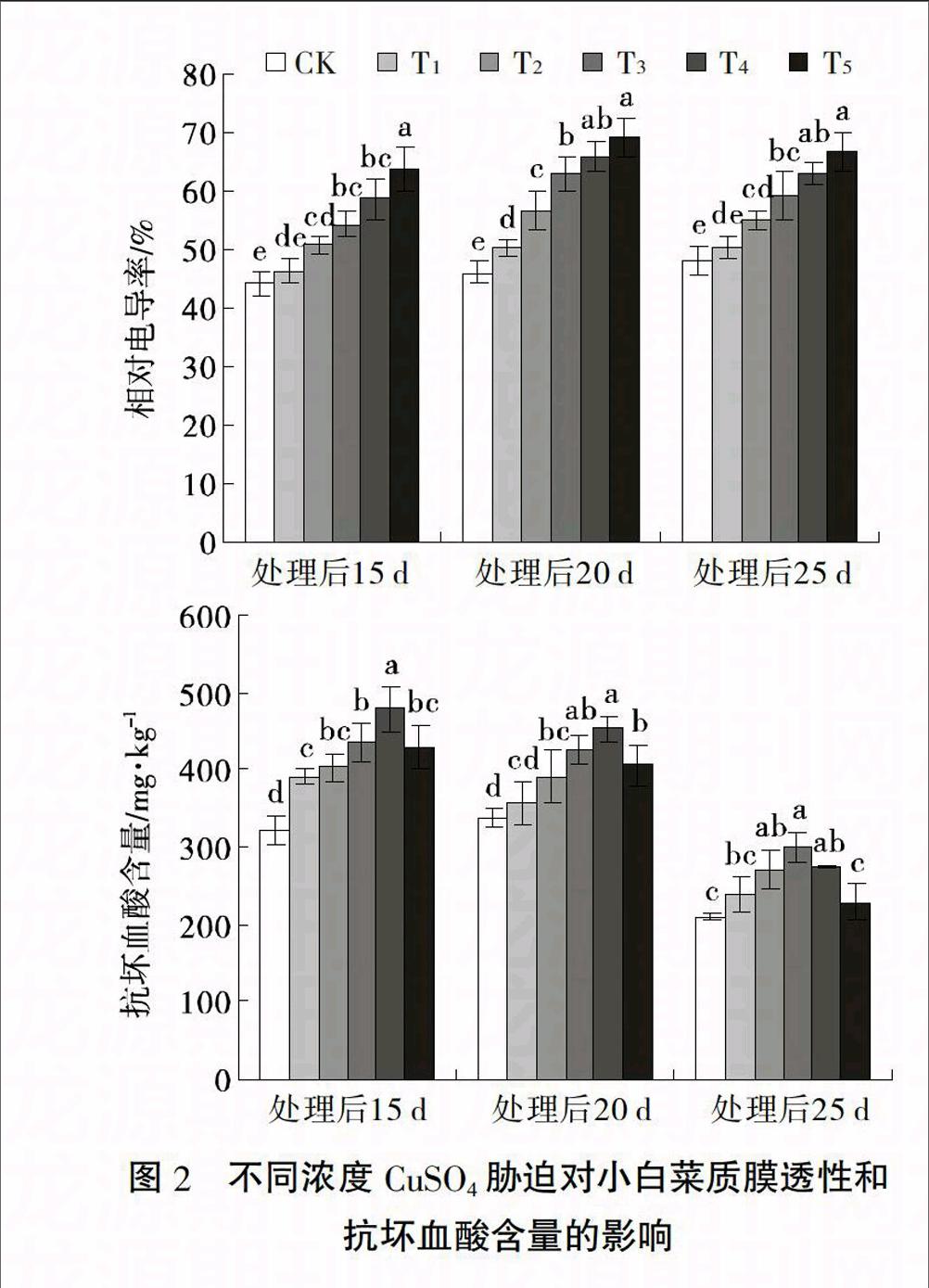
2.3 CuSO4胁迫对小白菜叶片质膜透性和抗坏血酸含量的影响
由图2可以看出,随CuSO4浓度提高,小白菜叶片相对电导率均较CK增加,抗坏血酸含量呈先增加后降低的规律,处理后15 d和20 d 时抗坏血酸含量在120 μmol/L CuSO4处理下达到最大值,处理后25 d 时在80 μmol/L CuSO4处理下达到最大值。小白菜抗坏血酸含量除25 d时180 μmol/L CuSO4处理下与CK间无差异外,其他浓度CuSO4处理下均显著高于CK,且随处理时间延长,不同处理间抗坏血酸含量的变化幅度减小。说明CuSO4胁迫严重破坏小白菜叶片细胞膜,使其叶片电解质渗透率显著增加,且胁迫程度越大,质膜伤害越重;同时CuSO4胁迫诱导抗坏血酸合成以抵抗质膜的过氧化伤害,但CuSO4浓度超过120 μmol/L,抗坏血酸的合成速度慢于自由基产生的速度。
3 讨论与结论
重金属胁迫会导致植物生长发育受阻、产量下降,甚至物种消失[17,18]。不同植物对铜的需求量存在差异,在铜胁迫下生长发育受到抑制的程度也不相同[3,4,17,19,20]。一些研究表明,叶菜类蔬菜对铜的吸收富集一般大于果菜类和根菜类蔬菜,而小白菜又是叶菜类当中对铜的吸收富集较强的一种蔬菜[3,20~22]。本研究中,低浓度CuSO4处理明显促进了小白菜幼苗的生长,高浓度CuSO4胁迫则显著抑制了小白菜的生长,也证明了小白菜对铜胁迫的耐受性较强。
研究表明,铜胁迫使植物叶绿素酶活性提高,加快叶绿素分解,使叶绿素合成受到抑制,导致光合色素含量降低[23,24]。光合色素含量的降低使得光合作用无法达到正常水平,有机物质合成受阻,植株生长发育受到很大影响[25,26]。本研究中,小白菜叶片光合色素含量在较低浓度CuSO4处理下增加,可能是低浓度CuSO4处理促进了光合色素的合成,这与王友保等[27]的研究结果一致;较高浓度CuSO4胁迫使叶片光合色素含量显著降低,且随胁迫时间的延长降低幅度增大,这可能是由于CuSO4胁迫使叶绿素酶活性提高,加快叶绿素分解而使其合成受阻,且这种效应随胁迫时间延长而逐渐显现。
膜系统是保护细胞抵御重金属胁迫伤害的关键部位,高浓度铜会导致细胞内自由基大量产生,造成质膜的过氧化伤害,膜蛋白结构发生改变,选择透性增大,使生物体内各种物质的运输和许多生理代谢过程受到影响[3,28,29]。植物可通过酶促和非酶促的抗氧化系统清除体内产生的活性氧,降低活性氧大量积累对膜脂的过氧化伤害,抗坏血酸就是细胞内一种有效的非酶抗氧化物质[24,28,30,31]。本研究中,CuSO4胁迫使小白菜叶片质膜透性和抗坏血酸含量显著增加,说明CuSO4胁迫造成小白菜体内活性氧大量产生,使膜脂过氧化加剧、电解质大量渗漏,同时诱发抗坏血酸大量合成,以消除活性氧,抵制膜脂过氧化对细胞的伤害,但超过一定程度后,小白菜的抗氧化能力就难以抵抗胁迫造成的过氧化伤害。
总之,低浓度CuSO4处理有助于促进小白菜叶片光合色素的合成,使光合作用加强,从而在一定程度上促进小白菜的生长。高浓度CuSO4胁迫则使小白菜光合色素合成受阻而分解加速,且活性氧大量产生,膜脂过氧化加剧,同时大量合成抗坏血酸以清除活性氧,但细胞内活性氧产生-清除的平衡失调,使小白菜的生理代谢受到抑制,进而抑制小白菜的生长。本研究中,180 μmol/L CuSO4胁迫使小白菜生物量降低将近一半,但小白菜仍能维持其生长发育,240 μmol/L 浓度以上CuSO4胁迫则使叶片枯黄、植株萎蔫,并有植株死亡,说明180 μmol/L是CuSO4胁迫抑制小白菜生长的阈值浓度。
参考文献
[1] 刘小红.九华铜矿重金属污染调查及耐铜植物的筛选耐性机理研究[D].合肥:安徽农业大学,2005.
[2] Ramos M C. Metals in vineyard soils of the penedes area (NE Spain) after compost application[J]. Journal of Environmental Management, 2006, 72: 1-7.
[3] 黄永东,黄永川,于官平,等.蔬菜对重金属元素的吸收和积累研究进展[J].长江蔬菜,2011(10):1-6.
[4] 王松华,杨志敏,徐朗莱.植物铜素毒害及其抗性机制研究进展[J].生态环境,2003,12(3):336-341.
[5] 孙权,何振立,杨肖娥,等.铜对小白菜的毒性效应及其生态健康指标[J].植物营养与肥料学报,2007,13(2):324-330.
[6] 张立军,刘新.植物生理学.2版[M].北京:科学出版社,2011.
[7] 杨丽丽.铜胁迫对甜菜幼苗生长和光合特性的影响[D].济南:山东师范大学,2013.
[8] 胡筑兵,陈亚华,王桂萍,等.铜胁迫对玉米幼苗生长、叶绿素荧光参数和抗氧化酶活性的影响[J].植物学通报,2006,23(2):129-137.
[9] 林义章,张淑媛,朱海生,等.铜胁迫对小白菜叶肉细胞超微结构的影响[J].中国生态农业学报,2008,16(4):948-951.
[10] 王瑞刚,唐世荣,郭军康,等.铜胁迫对高丹草和紫花苜蓿生长和光合特性的影响[J].生态环境学报,2010,19(12):2 922-2 928.
[11] Xiong Z T, Liu C, Geng B. Phytotoxic effects of copper on nitrogen metabolism and plant growth in Brassica pekinensis Rupr. [J]. Ecotoxicology and Environmental Safety, 2006, 64: 273-280.
[12] 肖志华,张义贤,张喜文,等.外源铅、铜胁迫对不同基因型谷子幼苗生理生态特性的影响[J].生态学报,2012,32(3): 889-897.
[13] 沈伟其.测定水稻叶片叶绿素含量的混合液提取法[J].植物生理学通讯,1988(3):62-64.
[14] 王素平,郭世荣,胡晓辉,等.盐胁迫对黄瓜幼苗叶片光合色素含量的影响[J].江西农业大学学报,2006,28(2):32-38.
[15] 王学奎.植物生理生化实验原理和技术.2版[M].北京:高等教育出版社,2006.
[16] 赵会杰.抗坏血酸含量及抗坏血酸过氧化物酶活性的测定[M]//中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南.北京:科学出版社,1999.
[17] 江行玉,赵可夫.植物重金属伤害及其抗性生理[J].应用与环境生物学报,2001,7(1):92-97.
[18] 薛艳,周东美,郝秀珍,等.两种不同耐性青菜种子萌发和根伸长对铜响应的研究[J].农业环境科学学报,2006,
25(5):1 107-1 110.
[19] 简敏菲,弓晓峰,游海,等.水生植物对铜、铅、锌等重金属元素富集作用的评价研究[J].南昌大学学报:工科版,2004,26(1):84-88.
[20] 李红.铜对荠菜与小白菜萌发和生长的影响的研究[D]. 杨凌:西北农林科技大学,2009.
[21] 徐磊.铜胁迫对小白菜生理生化指标的毒害作用[D].福州:福建农林大学,2003.
[22] 袁霞,李艳梅,张兴昌.铜对小青菜生长和叶片保护酶活性的影响[J].农业环境科学学报,2008,27(2):467-471.
[23] Patsikka E, Kairavuo M, Sersen F, et al. Excess copper predisposes photosystemⅡto photoinhibition in vivo by outcompeting iron and causing decrease in leaf chlorophyll[J]. Plant Physiology, 2002, 129: 1 359-1 367.
[24] 涂俊芳,王兴明,刘登义,等.不同浓度铜对紫背萍和青萍色素含量及抗氧化酶系统的影响[J].应用生态学报,2006,17(3):502-506.
[25] Chettri M K, Cook C M, Vardaka E, et al. The effect of Cu, Zn and Pb on the chlorophyll content of the lichens Cladonia convoluta and Cladonia rangiformis[J]. Environmental and Experimental Botany, 1998, 39(1): 1-10.
[26] Bibi M, Hussain M. Effect of copper and lead on photosynthesis and plant pigments in black gram [Vigna mungo (L.) Hepper] [J]. Bulletin of Environmental and Contamination Toxicology, 2005, 74: 1 126-1 133.
[27] 王友保,刘登义,张莉,等.铜、砷及其复合污染对黄豆(Glycine max)影响的初步研究[J].应用生态学报,2001,
12(1):117-120.
[28] Drazkiewicz M, Skórzyńska-Polit E, Krupa Z. Copper-induced oxidative stress and antioxidant defence in Arabidopsis thaliana[J]. Bio Metals, 2004, 17: 379-387.
[29] Wannaz E D, Carreras H A, Abril G A, et al. Maximum values of Ni2+, Cu2+, Pb2+ and Zn2+ in the biomonitor Tillandsia capillaris (Bromeliaceae): relationship with cell membrane damage[J]. Environmental and Experimental Botany, 2011, 74: 296-301.
[30] 周长芳,吴国荣,施国新,等.水花生抗氧化系统在抵御Cu2+胁迫中的作用[J].植物学报,2002,43(4):389-394.
[31] Tewari R K, Kumar P, Sharma P N. Antioxidant responses to enhanced generation of superoxide anion radical and hydrogen peroxide in the copper-stressed mulberry plants[J]. Planta, 2006, 223: 1 145-1 153.