食管癌同期放化疗中脂质体紫杉醇与游离紫杉醇联合顺铂的对照研究
2015-06-24孙荣刚郑安平张光斌
孙荣刚,郑安平,张光斌
(河南省安阳市肿瘤医院放疗一科,河南 安阳 455000)
食管癌同期放化疗中脂质体紫杉醇与游离紫杉醇联合顺铂的对照研究
孙荣刚,郑安平,张光斌
(河南省安阳市肿瘤医院放疗一科,河南 安阳 455000)
目的 探讨食管癌同期放化疗中应用脂质体紫杉醇联合顺铂的临床疗效及安全性。方法 92例同期放化疗的食管癌患者,其中46例采用脂质体紫杉醇+顺铂化疗(A组),46例采用紫杉醇+顺铂化疗(B组)。比较两组患者的近期疗效、远期疗效及不良反应。结果 两组近期有效率、1年生存率、2年生存率比较,差异均无统计学意义(P> 0.05);A组神经毒性、过敏及关节/肌肉痛发生率明显低于B组,差异有统计学意义(P< 0.01)。结论 与紫杉醇相比,食管癌同期放化疗中应用脂质体紫杉醇联合顺铂疗效较好,紫杉醇相关不良反应低,值得临床进一步研究及推广应用。
食管癌;同期放化疗;紫杉醇;脂质体
我国食管癌发病率居世界第一,但目前患者就诊时多为晚期,临床疗效较差。同期放化疗是不可切除食管癌的标准治疗方案[1],疗效高于单纯放疗,但也给患者带来较大的痛苦[2]。紫杉醇联合顺铂为食管癌同期放化疗常用方案之一,但相关毒性如过敏、外周神经毒性、肌肉/关节疼痛等限制了该方案的临床应用。脂质体紫杉醇采取脂质体替代聚氧乙烯蓖麻油以及无水乙醇复合溶媒,以降低紫杉醇毒性及避免因溶媒导致的过敏反应[3]。本文分析我院92例食管癌同期放化疗中应用脂质体紫杉醇联合顺铂化疗和游离紫杉醇联合顺铂化疗的疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料 我院2009年8月至2010年10月食管癌同期放化疗中应用紫杉醇联合顺铂化疗的92例患者,脂质体紫杉醇+顺铂方案治疗(A组)和游离紫杉醇+顺铂方案治疗(B组)各46例。两组基本临床资料比较,差异无统计学意义(P> 0.05),具有可比性,见表1。

表1 两组基本临床资料比较
1.2 治疗方法
1.2.1 放疗方案 放疗前体膜固定,16排螺旋CT 5 mm层厚扫描。按瓦里安计划系统制作计划。参考文献[4]勾画肿瘤靶区(gross tumor volume GTV)、临床靶区(clinical target volume,CTV)。GTV外放8 mm为计划肿瘤靶区(planning gross tumor volume PGTV),CTV外放5 mm为计划靶区(planning target volume,PTV)。PTV照射50 Gy,每周5次,每天1次,2 Gy/次。PGTV照射10 Gy,每周5次,每天1次,2 Gy/次。计划评估通过后,经过CT验证、医生摆位,开始照射PTV,PTV照射结束后照射PGTV。根据靶区包绕云图及DVH图评价计划,评估参数:双肺V20 < 28%,V30 < 20%,平均剂量 <13 Gy;心脏 V40 < 50%;脊髓最大剂量小于45 Gy。
1.2.2 化疗方案 A组为脂质体紫杉醇+顺铂方案,B组为游离紫杉醇+顺铂方案。脂质体紫杉醇及游离紫杉醇均为40 mg/m2,顺铂25 mg/m2,静脉滴注,每周一次,连用6周。同期放化疗结束后1个月,根据患者耐受情况,辅助1~2周期化疗,方案:脂质体紫杉醇及游离紫杉醇135 mg/m2,第一天静脉滴注,顺铂25 mg/m2,第2、3、4天静脉滴注,21天一个周期。每两周复查食管造影评价疗效、查看有无穿孔征象。每周复查血常规及肝肾功1次。随访至2014年8月。
1.3 观察指标 放疗结束后1个月时采用RECIST1.1标准评定近期疗效。所有目标病灶消失为完全缓解(CR);基线病灶长径总和缩小 ≥ 30% 为部分缓解(PR);基线病灶长径总和增加 ≥ 20%或出现新病灶为进展(PD);病灶介于PR和PD之间为疾病稳定(SD)。采用RTOG急性放射反应评价标准评定放射性食管/气管炎。其余不良反应如消化道反应、骨髓抑制、外周神经毒性采用CTCAE3.0标准评定。
1.4 统计学方法 采用SPSS 17.0 统计软件包。率的比较采用卡方检验,等级资料采用秩和检验。生存率比较采用Kaplan Meier法及Logrank检验。P< 0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较 92例患者总有效率(CR+PR)为94.6%。A组:CR15例,PR29例,SD2例,有效率95.7%;B组:CR17例,PR26例,SD3例,有效率93.5%。两组近期疗效及有效率比较差异无统计学意义(P> 0.05)。
2.2 两组远期疗效比较 A、B两组分别有2例、4例患者失访,随访率93.5%。92例患者1、2 年生存率分别为74%和53%,平均生存时间为17.2个月。A组1、2生存率分别是77%和54%;B组1、2生存率分别为68%和51%。两组比较差异无统计学(χ2=0.054,P= 0.817)。两组食管癌同期放疗2年累积生存率比较见图1。
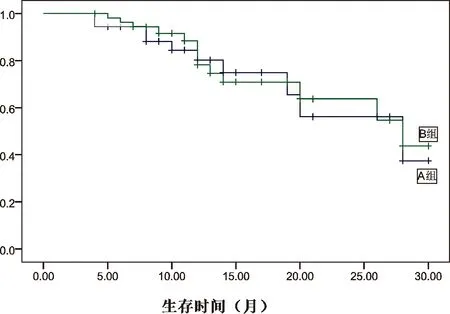
图1 两组食管癌同期放疗2年累积生存率比较
2.3 两组不良反应比较 两组最常见的不良反应为轻度(Ⅰ级+Ⅱ级)的放射性食管/气管炎、胃肠道反应、骨髓抑制。但A组紫杉醇相关毒性如神经毒性、过敏、关节/肌肉痛明显少于B组,差异有统计学意义(P< 0.01),见表2。
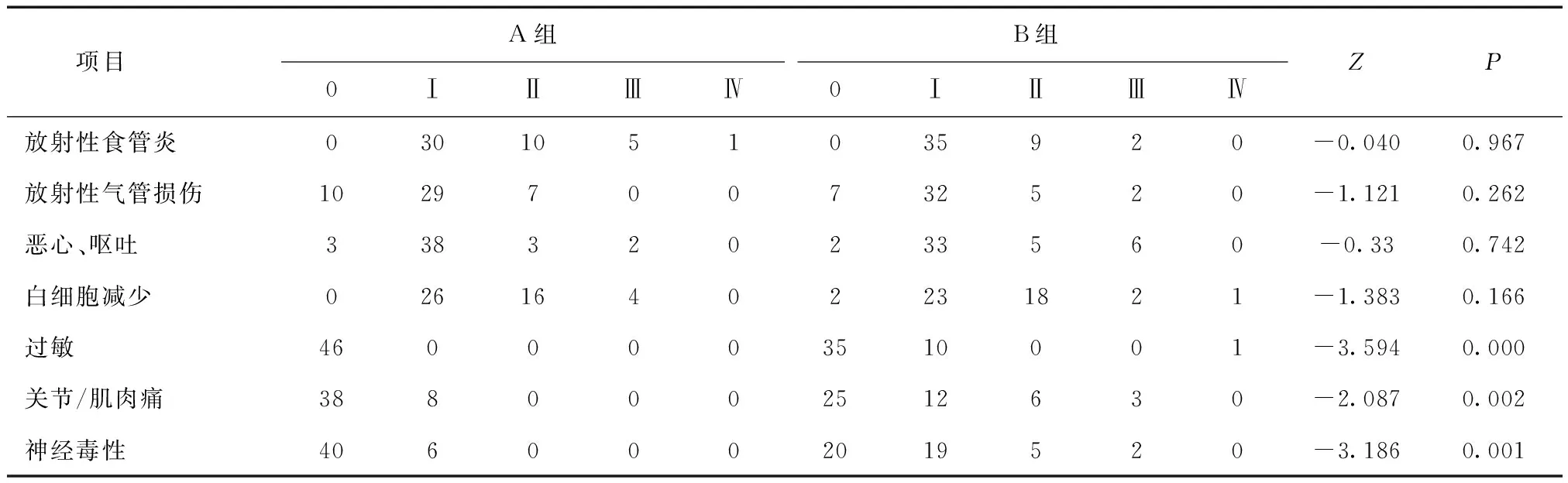
表2 两组患者不良反应比较 (n)
3 讨论
同期放化疗是不可手术切除食管癌的标准治疗手段。紫杉醇联合顺铂是目前临床常用方案之一,国内临床研究资料[5~8]报道目前该化疗方案同期放疗疗效较好。程惠华[6]报道其1、3、5年生存率分别为74.2%、58.3%和29.2%。
虽然紫杉醇抗肿瘤活性良好,但由于在水中的溶解度很小,静脉用药难度大,因此注射剂中加入了表面活性剂聚氧乙烯蓖麻油(Cremophor EL,CrEL)。CrEL能释放组织胺,引起多种不良反应,如过敏反应、肾损害、神经轴索变性及脱髓鞘、心脏血管毒性等[9,10]。尽管紫杉醇使用前24小时给予药物抗变态反应,例如使用地塞米松、苯海拉明、抑酸等药物处理,极大减少变态反应的发生率,但仍有少数患者发生变态反应。而脂质体(liposomes)最初作为一种生物膜的研究模型,目前已经作为一种定向药物载体。药物被包埋在直径为纳米级的脂质体微粒中,由于这种微粒具有类细胞结构,在体内主要可被网状内皮系统吞噬,激活人体的自身免疫功能,而且可以改变被包封药物的体内分布,使药物主要积蓄在肺、肝、脾和骨髓等组织中,从而提高了药物的治疗指数,降低了药物的治疗剂量及毒性,提高了临床用药的安全性。多项临床随机对照研究证实脂质体紫杉醇与游离紫杉醇的临床疗效相当[11,12],但是在食管癌的同期放化疗中应用脂质体紫杉醇联合顺铂的报道较少,其中倪新初[13]报道了46例脂质体紫杉醇联合顺铂与氟尿嘧啶联合顺铂同期放化疗治疗晚期食管癌的随机对照研究,脂质体紫杉醇组的有效率为87.0%,1年生存率为63.5%,两者疗效相当,生存无差异。本研究提示脂质体紫杉醇联合顺铂与游离紫杉醇联合顺铂同期放疗治疗食管癌的疗效相同,全组患者总有效率为94.6%,1、2年生存率为74%、53%,平均生存时间为17.2个月,与倪新初、程惠华治疗效果相近[6,13]。由于目前并没有证据明确证明脂质体紫杉醇在食管癌的治疗疗效优于游离紫杉醇,而且脂质体紫杉醇市场价格较高,因此很难开展随机对照研究,应开展更多的临床试验来证实脂质体紫杉醇在食管癌的同期放化疗中的作用。
尽管脂质体紫杉醇与游离紫杉醇在肿瘤治疗的疗效相近,但是不良反应却较游离紫杉醇低。在脂质体紫杉醇与游离紫杉醇随机对照临床研究[11,14]中显示两者的疗效相似,但是脂质体紫杉醇血压下降、胃肠反应、皮疹和肌肉痛优于游离紫杉醇,陈鹏[11]对晚期乳腺癌、非小细胞肺癌患者46例进行随机分组,详细报道了脂质体紫杉醇与游离紫杉醇不良反应的差异。紫杉醇相关毒性中,脂质体组中面部潮红发生率4/26(15.4%),皮疹1/26(3.8%),肌肉痛7/26(26.9%),关节痛7/26(26.9%)。游离紫杉醇组中面部潮红发生率10/26(38.5%),皮疹4/26(15.4%),肌肉痛16/26(61.5%),关节痛11/26(42.3%)。而本研究中不良反应多为轻度(Ⅰ~Ⅱ级),脂质体紫杉醇在紫杉醇相关毒性方面显著优于游离紫杉醇,脂质体紫杉醇外周神经毒性、肌肉/关节痛、过敏发生率分别为13%、17.4%、0,与陈鹏[9]研究结果相近。临床报道游离紫杉醇外周神经毒性、肌肉/关节痛、过敏不良反应发生率分别高达30.1%、61.3%、34.7%[15]。本研究游离紫杉醇外周神经毒性、肌肉/关节痛、过敏不良反应发生率分别56.5%、45.7%、21.7%,可能由于入组病例较少,导致临床数据差异,应增加样本量。尽管如此,也可看到脂质体紫杉醇在紫杉醇相关毒性方面显著优于游离紫杉醇。
综上所述,脂质体紫杉醇联合顺铂在食管癌的同期放化疗中具有较好的临床疗效,并且紫杉醇相关毒性如过敏、外周神经毒性、肌肉/关节痛等不良反应较游离紫杉醇低,值得进一步开展临床试验,推广应用。
[1] Suntharalingam M,Moughan J,Coia LR,et al.The national practice for patients receiving radiation therapy for carcinoma of the esophagus results of the 1996-1999 Pattems of Care Study[J].Int J Radiat Oncol Biol Phys,2003,56(4):981.
[2] 尹雪,刘杰,田金徽,等.紫杉醇联合顺铂同步放化疗治疗中晚期食管癌的Meta分析[J].肿瘤防治研究,2012,39(7):851-854.
[3] Cabanes A,Briggs KE,Gokhale PC,et al.Comparativein rive studies with paclitaxel and liposome-encapsulatedpaclitaxel[J].Int J Oncol,1998,12(5):1035-1040.
[4] 肖泽芬.食管癌[M]//殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学.第4 版.北京:中国协和医科大学出版社,2008:563.
[5] 李峰,周远,张立成,等.紫杉醇联合放疗同步治疗中晚期食管癌的临床观察[J].中华肿瘤防治研究,2011,18(20):1635-1638.
[6] 程惠华,林贵山,傅志超,等.紫杉醇加顺铂同步放化疗治疗局部晚期食管癌的临床研究[J].临床肿瘤学杂志,2007,12(4):290-294.
[7] 郭建新,徐正阳,陈俊,等.泰素加顺铂联合放疗对局部晚期食管癌的疗效观察[J].肿瘤学杂志,2006,12(3):214-216.
[8] 吴煌坚,何宝贞,叶金辉,等.三维适形放疗联合多西紫杉醇与卡铂治疗食管癌临床疗效观察[J].实用医院临床杂志,2008,5 (3):49-51.
[9] Mu L,Feng SS.A novel controlled release formulation for the anticancer drug paclitaxel (Taxol):PLGA nanoparticles containing vitamin E TPGS[J].Journal of Controlled Release,2003,86(1):33-48.
[10]Mu L,Feng SS.Vitamin E TPGS used as emulsifier in the solvent evaporation/extraction technique for fabrication of polymeric nanospheres for controlled release of paclitaxel (Taxol)[J].Journal of Controlled Release,2002,80(1-3):129-144.
[11]陈鹏,李丽庆,李淑芬,等.脂质体紫杉醇与紫杉醇在肿瘤患者的临床Ⅲ期试验[J].中国肿瘤临床,2003,30(2):141-143.
[12]成海燕,陈秀玮.脂质体紫杉醇与紫杉醇治疗100例卵巢癌分析[J].中国肿瘤,2008,17 (8):723-725.
[13]倪新初,孙苏平,张旭光,等.脂质体紫杉醇联合顺铂与5-氟尿嘧啶联合奈达铂同期放疗中晚期食管癌的安全性与近期临床疗效分析[J].癌症进展,2010,8(6):613-617.
[14]陈强,张其忠,刘健,等.脂质体紫杉醇与游离紫杉醇治疗乳腺癌和非小细胞肺癌的随机对照研究[J].中华肿瘤杂志,2003,25(2):190-192.
[15]李文军.紫杉醇不良反应文献综述[J].药物流行病学杂志,2002,11(4):187-188.
R730.5
A
1672-6170(2015)04-0060-03
2014-12-22;
2015-05-15)
