免疫相关因素在膀胱癌发病机制与免疫治疗中的研究进展
2015-06-24胡吉梦综述姜昊文审校
胡吉梦 综述,姜昊文 审校
(上海市复旦大学附属华山医院泌尿外科,上海 200040)
·综 述·
免疫相关因素在膀胱癌发病机制与免疫治疗中的研究进展
胡吉梦 综述,姜昊文 审校
(上海市复旦大学附属华山医院泌尿外科,上海 200040)
机体的防御机制一方面能够通过免疫反应抑制肿瘤生长,但同时一些免疫细胞或细胞因子,例如巨噬细胞、树突状细胞、T淋巴细胞、白细胞介素-6和肿瘤坏死因子-α等,在膀胱癌的发生与进展过程中起促进作用。随着分子免疫学以及相关技术的发展,研究人员将肿瘤免疫学应用于治疗和预防膀胱肿瘤,取得了一定的成果。本文就免疫相关因素对膀胱癌的发病机制以及膀胱肿瘤免疫治疗进行综述。
免疫;膀胱癌;细胞因子;肿瘤疫苗
膀胱癌(bladder cancer, BC)是泌尿生殖系统中最常见的恶性肿瘤之一,其发病率在美国位于泌尿系肿瘤第2位,占所有肿瘤患者死亡率的5%[1]。大多数膀胱癌为移行上皮细胞癌,所占比例超过90%,其中相当一部分为浅表性膀胱癌,其余鳞癌及腺癌各占5%~10%[2]。膀胱癌的早期临床表现为血尿伴尿频,以及排尿时的不适和疼痛感。目前认为致癌的危险因素很多,其中吸烟是主要因素之一,相对于不吸烟者增加约4倍风险;此外染料、橡胶、皮革和铝工业等职业增加了工人致癌风险。膀胱癌的诊断往往需要尿细胞学检查或获取膀胱组织的膀胱镜检查。由于膀胱癌的复发率近80%,其临床治疗十分困难,往往需要对患者进行长期随访[3]。目前临床除手术治疗外还辅以化疗和放疗,以改善预后。
机体的免疫应答反应在膀胱癌的发病机制中起十分重要的作用,固有免疫系统产生促肿瘤作用,而适应性免疫系统与抗肿瘤效果有关。近年来随着肿瘤免疫学的发展,国内外普遍开始采用免疫疗法。肿瘤免疫治疗是通过调动机体的天然免疫防卫机制或利用具有肿瘤抗原性的疫苗刺激机体产生特异性的抗肿瘤效应。本文主要从免疫因素对膀胱癌的发病机制与免疫治疗两方面对相关研究进展作一综述。
1 免疫相关因素在膀胱癌发病机制中的研究进展
1.1 髓源性抑制细胞 髓源性抑制细胞 (myeloid-derived suppressor cells, MDSCs)是骨髓来源的一群异质性细胞,是树突状细胞、巨噬细胞和(或)粒细胞的前体,具有显著抑制免疫细胞应答的能力,20多年前首先在癌症患者中发现,被定义为骨髓来源的抑制性细胞。随着研究的深入,这群细胞在免疫系统中的重要作用逐渐被发现,大量的证据证明它们在癌症和其他疾病中具有负向调控免疫应答的功能。其可通过促进血管和淋巴管生成,同时维持肿瘤细胞的存活,因而在肿瘤发生与转移中发挥重要作用[4]。此外,MDSCs可以通过释放血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)、肿瘤坏死因子(tumor necrosis factor, TNF)、白细胞介素-1b(interleukin-1b, IL-1b)和碱性成纤维细胞生长因子(b fibroblast growth factor, bFGF)等因子刺激血管生成[5]。

1.2 巨噬细胞 巨噬细胞(macrophages)在固有免疫和适应性免疫反应中起着关键性的作用,是炎性反应中主要的调节细胞。通过干扰素-γ(interferon-γ, IFN-γ)及细菌脂多糖(lipopolysaccharides, LPS)活化的经典巨噬细胞即为I型巨噬细胞(classically activated macrophage, M1),释放细胞因子,包括肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)和白细胞介素-12(interleukin-12, IL-12),并刺激Th-1细胞释放IFN-γ和IL-2以激活细胞毒性T细胞,在炎症早期承担着重要作用,起着促炎症反应[9]。而通过Th-2细胞因子,如IL-4、IL-13及免疫复合物等活化的巨噬细胞为替代活化巨噬细胞即Ⅱ型巨噬细胞(alternatively activated macrophage, M2),抑制炎症因子,起着抑制炎症反应及修复组织作用[10]。
经典活化的巨噬细胞在早期阶段对肿瘤具有杀伤作用,然而随着肿瘤的生长,肿瘤微环境对一些巨噬细胞产生影响,这些巨噬细胞被称为肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs),有研究表明其能够通过释放如VEGF、转化生长因子-α、胰岛素样生长因子等物质,促进肿瘤周围组织的血管化[11]。AJILI等[12]发现随着机体TAMs计数的增加,膀胱肿瘤的复发率就越高,其产生机制可能为膀胱肿瘤组织的缺氧环境刺激巨噬细胞释放一系列促血管生成因子,为肿瘤生长提供良好生存环境。LIMA等[13]发现低氧的肿瘤微环境可使Ⅱ型巨噬细胞在膀胱肿瘤组织中集结,导致Ⅱ型巨噬细胞的表型在低氧环境中出现改变;此外,近期研究发现CD47在膀胱肿瘤原始细胞中的表达增加,且通过信号调控蛋白-α的配体,起到抑制巨噬细胞介导的吞噬作用。CD47作为膀胱肿瘤干细胞的标记物之一,能同时在尿路上皮和膀胱肿瘤细胞表达[14]。
1.3 树突状细胞抗原呈递细胞(antigen-presenting cell, APC) 包括三种类型:树突状细胞(dendritic cells, DCs)、巨噬细胞和B细胞,其中DCs是最有效的抗肿瘤免疫诱导剂[15]。BEATTY等[16]在膀胱癌患者尿液中发现未成熟和低度活化的DCs,提示DCs可能从膀胱肿瘤组织迁移至尿液中,且肿瘤细胞与抑制DCs的发育成熟有关。由于未成熟的DCs无法引起 T淋巴细胞活化,进一步促进了肿瘤的发生。有研究表明由于正常的DCs与自然杀伤细胞(natural killer cell, NK)、T淋巴细胞之间缺乏关联,因而DCs的减少相应地阻碍了抗肿瘤免疫反应[17]。AYARI等[18]认为可通过检测机体内成熟的肿瘤浸润DCs和潜在的TAMs对初次诊断为非肌层浸润性膀胱癌的患者进行危险程度分级,从而协助制订膀胱癌症患者在随访过程中的治疗方案。
另有研究者针对益生菌促进DCs活性的作用进行了一项研究,益生菌能够通过多种方式作用于机体的免疫系统,可减少尿路感染的发生率,并可能延缓膀胱癌复发,在给实验小鼠注射乳酸菌菌株后,能抑制小鼠肿瘤增长,提示益生菌具有增强DCs活性的作用。其效应机制包括增加腺体粘液分泌,防止细菌结合于上皮细胞,抑制细菌的侵袭,并能改变单核细胞、巨噬细胞、树突状细胞和淋巴细胞的活力,其对适应性免疫系统的活化至关重要。随着对DCs与益生菌之间相互作用机制的研究深入,益生菌在不久的将来有望用来治疗非肌层侵入性膀胱肿瘤[19]。
1.4 T淋巴细胞 T淋巴细胞(T-lymphocytes)来源于骨髓的多能干细胞,具有多种生物学功能,如直接杀伤靶细胞、辅助或抑制B细胞产生抗体、对特异性抗原和促有丝分裂原的应答反应以及产生细胞因子等。其产生的免疫应答是细胞免疫,效应形式主要有两种:与靶细胞特异性结合,破坏靶细胞膜,直接杀伤靶细胞;另一种是释放淋巴因子,最终使免疫效应扩大和增强。
T淋巴细胞在肿瘤微环境的作用下,对膀胱肿瘤组织的生长起促进与抑制的双重作用,有研究发现Th-17在膀胱肿瘤组织中的水平高于外周血水平[20],而调节性T细胞(regulatory T cell, Treg)在外周血的水平高于膀胱肿瘤组织中的水平[21]。Treg细胞有助于调节免疫系统、监控自身耐受和维持免疫稳态,但同时发现Treg细胞能够下调机体的抗肿瘤反应[22]。T淋巴细胞分泌的IL-2使Treg的免疫调控能力下降,同时促进Treg细胞转化成Th-17细胞,因此Th-17细胞和Treg细胞之间的平衡与膀胱肿瘤的发生密切相关,Treg细胞水平在肿瘤组织中水平越高则预后越差。SATYAM等[23]发现Th-1细胞因子在膀胱癌中被抑制,而Th-2细胞因子则优先表达。正常情况下,通过Fas/Fas配体介导能够在感染或肿瘤组织中引起程序性细胞凋亡,其中Fas配体主要存在于T淋巴细胞和NK细胞中,而膀胱癌通过一种潜在的机制,抑制Fas/Fas配体介导的免疫反应,从而有效逃避细胞凋亡程序,发生免疫逃逸[24]。
1.5 IL-6和TNF-α IL-6是机体中重要的促炎症细胞因子,主要由T淋巴细胞和巨噬细胞产生。有研究通过分析膀胱尿路上皮癌患者的血清和尿液,发现两种标本的IL-6水平均较正常对照组增高,同时尿路上皮细胞癌患者尿液中的IL-6水平明显高于低度恶性的非肌层浸润性膀胱癌,且体内外研究均发现通过抑制IL-6的释放能够延缓膀胱癌的发展,提示IL-6与膀胱癌患者的不良预后有关[25]。IL-6促瘤作用机制可能是其作为Janus激酶/信号转导和转录激活因子3(Janus kinase/signal transducer and activator of transcription 3, JAK/STAT3)信号通路的主要活化剂,有助于肿瘤的增殖,是肿瘤侵袭过程的关键步骤之一。此外,IL-6能够通过VEGF和STAT3促进肿瘤周围血管生成。HO等[26]发现通过在小鼠模型中激活STAT3,能够使原位癌不经非侵袭性乳头状肿瘤分期而直接进展为侵袭性肿瘤,STAT3通过表达Bcl-XL,产生抗凋亡作用而促进肿瘤细胞存活。此外,WU等[27]报道STAT3 在由Jak2介导的尿路上皮肿瘤细胞生长中起到重要作用,通过阻碍Jak2表达能够抑制肿瘤细胞生长。
TNF-α主要由激活的巨噬细胞产生,能够直接杀伤肿瘤细胞而对正常细胞无明显毒性。目前已发现其具有16种基因多态性,这些基因多态性与许多肿瘤的发生有关,包括非霍奇金淋巴瘤、骨髓瘤和前列腺癌等,其中两个多态性可能增加膀胱癌的患病风险,分别是TNF+488A和TNF-859T。TNF+488A多态性在膀胱癌患者中占28.1%,健康人占14.9%,而TNF-859T在膀胱癌患者中占26.6%,健康人仅占14.4%[28]。LEE等[29]发现TNF-α能够刺激基质金属蛋白酶9(matrix metalloprotein-9, MMP-9)的分泌以促进肿瘤侵袭和传播,且MMP-9在侵袭性膀胱癌组织中的活性相比正常人增加了17倍。
2 免疫疗法在膀胱癌治疗方案中的研究进展
2.1 卡介苗治疗 卡介苗(Bacillus Calmette-Guérin, BCG)是一种减毒牛型结核分支杆菌疫苗,自1976年MORALES等[30]首先报道用BCG治疗膀胱癌以来,临床证实通过膀胱腔内灌注BCG在预防肿瘤术后复发、治疗原位癌、防止肿瘤进展、提高生存率及延长生存时间等方面是一种有效的生物免疫疗法。
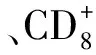
多形核白细胞(polymorphonuclear leukocytes, PMNs)在BCG治疗中起重要作用,PMNs激活后可使BCG刺激Th-1细胞分泌促炎症细胞因子,IL-8作为其释放的主要细胞因子,能够增加BCG介导的Th-1细胞免疫反应,产生抗膀胱癌的肿瘤免疫,并能够降低膀胱癌的复发率[31]。TAKEUCHI等[32]发现Th-17细胞在BCG免疫治疗中起重要作用,可以通过分泌IL-17使原始中性粒细胞在膀胱组织聚集,产生抗肿瘤免疫反应。
由于BCG是活菌制剂,因此有其特有的副作用,最常见的BCG副作用表现为尿频、尿急,其他并发症包括高热、血尿、肝炎,少数患者出现全身各系统并发症[33]。
2.2 肿瘤疫苗治疗 肿瘤疫苗(tumor vaccines,TV)是利用肿瘤抗原来激发机体的主动特异性免疫反应,产生抗肿瘤的作用。研究人员试图克服肿瘤细胞的弱免疫原性和肿瘤微环境的免疫抑制,获得能打破免疫耐受和引发肿瘤相关抗原(tumor associated antigen, TAA)免疫应答的策略,如联合各种佐剂[34]。理论上,通过疫苗诱导抗肿瘤免疫是一种直接有效的治疗方法,但实际应用中,疫苗治疗后产生的客观的抗肿瘤应答十分有限,需多项Ⅲ期临床试验验证[35]。肿瘤疫苗越早期使用则疗效越好,对晚期患者疗效有限,其中一个重要原因就是肿瘤的免疫逃逸机制[36]。
膀胱肿瘤有一些较特异的抗原,如膀胱肿瘤抗原(bladder tumor antigen, BTA)、癌症-睾丸抗原(cancer-testis antigen, CTA)、突变的P53抗原、细胞核基质蛋白(nuclear matrix protein, NMP22)、细胞粘附素(adherins)等,这些抗原在膀胱肿瘤免疫治疗中均为有效靶点。KOMOHARA等[37]选取了3种膀胱肿瘤细胞特异性表达的蛋白(SART3、MRP3和EZH2)作为肿瘤疫苗的表型,利用表型的抗原性刺激患者外周血中细胞毒性T细胞(cytotoxic T cell, CTL)的活化增殖,并检测患者体内淋巴细胞变化情况。结果表明:患者体内杀伤肿瘤淋巴细胞百分比明显上升,且治疗过程中患者无不适症状,表明此方法安全有效。
因此选择正确的靶向抗原,以及佐剂的组合选择、免疫调节制剂的联用,可以抑制抗肿瘤免疫,引起疫苗诱导抗肿瘤免疫反应[38]。通过分析已报道的肿瘤疫苗临床试验发现,如按照WHO或RECIST疗效评价标准,无法客观地对肿瘤疫苗疗效作出评价[39]。肿瘤疫苗安全性好,引发的免疫应答反应微弱且持久,虽然对于肿瘤消退效果一般,但可延长总体生存时间,故对于疫苗疗效的评价,应考虑总体生存时间和其他的免疫指标作为评价标准。
3 总结与展望
近年来随着分子免疫学、分子生物学及相关技术的不断发展,免疫细胞及相关细胞因子在膀胱癌的发病机制中起到的重要作用已逐渐被研究人员发现。由于膀胱独特的解剖结构及膀胱灌注局部应用的有利条件,使得膀胱癌在免疫治疗中尤其具有独特的优势。以BCG为代表的主动免疫治疗是目前膀胱癌最主要的免疫疗法,特别是对浅表性膀胱癌。
然而肿瘤疫苗在临床上治疗膀胱癌还面临许多尚未攻克的难题,目前动物及临床试验结果还没有达到临床应用的要求,其潜在的细胞和分子机制仍不清楚。此外,个别的免疫细胞、细胞因子以及趋化因子在膀胱肿瘤侵入、增殖和肿瘤转移过程中的作用尚有待进一步深入研究。相信随着肿瘤免疫研究领域的不断突破,其势必成为人类战胜肿瘤的一种强有力武器。
[1] SIMONS MP, NAUSEEF WM,GRIFFITH TS. Neutrophils and TRAIL: insights into BCG immunotherapy for bladder cancer[J]. Immunol Res, 2007, 39(1-3):79-93.
[2] ROSSI R, LICHTNER M, IORI F, et al. Dendritic cells in blood and urine samples from bladder cancer patients undergoing BCG immunotherapy[J]. Arch Ital Urol Androl, 2013, 85(4):157-163.
[3] VAN DER HORST G, BOS L, VAN DER PLUIJM G. Epithelial plasticity, cancer stem cells, and the tumor-supportive stroma in bladder carcinoma[J]. Mol cancer Res, 2012, 10(8):995-1009.
[4] ZHU Z, SHEN Z, XU C. Inflammatory pathways as promising targets to increase chemotherapy response in bladder cancer[J]. Mediators Inflamm, 2012,110:528690.
[5] GABRILOVICH DI, NAGARAJ S. Myeloid-derived suppressor cells as regulators of the immune system[J]. Nat Rev Immunol, 2009, 9(3):162-174.
[6] ERUSLANOV E, NEUBERGER M, DAURKIN I, et al. Circulating and tumor-infiltrating myeloid cell subsets in patients with bladder cancer[J]. Int J cancer, 2012, 130(5):1109-1119.
[7] ROBINSON BD, SICA GL, LIU YF, et al. Tumor microenvironment of metastasis in human breast carcinoma: a potential prognostic marker linked to hematogenous dissemination[J]. Clin Cancer Res, 2009, 15(7):2433-2441.
[8] RODRIGUEZ PC, ERNSTOFF MS, HERNANDEZ C, et al. Arginase I-producing myeloid-derived suppressor cells in renal cell carcinoma are a subpopulation of activated granulocytes[J]. Cancer Res, 2009, 69(4):1553-1560.
[9] MANTOVANI A, LOCATI M. Tumor-associated macrophages as a paradigm of macrophage plasticity, diversity, and polarization: lessons and open questions[J]. Arterioscler Thromb Vasc Biol, 2013, 33(7):1478-1483.
[10] MANTOVANI A, SICA A, SOZZANI S,et al. The chemokine system in diverse forms of macrophage activation and polarization[J]. Trends Immunol, 2004, 12(12): 677-686.
[11] QIAN BZ, POLLARD JW. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010, 141(1): 39-51.
[12] AJILI F, KOURDA N, DAROUICHE A, et al. Prognostic value of tumor-associated macrophages count in human non-muscle-invasive bladder cancer treated by BCG immunotherapy[J]. Ultrastruct Pathol, 2013, 37(1):56-61.
[13] LIMA L, OLIVEIRA D, TAVARES A, et al. The predominance of M2-polarized macrophages in the stroma of low-hypoxic bladder tumors is associated with BCG immunotherapy failure[J]. Urol Oncol, 2014, 32(4):449-457.
[14] HOFNER T, MACHER-GOEPPINGER S, KLEIN C,et al. Expression and prognostic significance of cancer stem cell markers CD24 and CD44 in urothelial bladder cancer xenografts and patients undergoing radical cystectomy[J]. Urol Oncol, 2014, 32(5):678-686.
[15] NISHIYAMA T, TACHIBANA M, HORIGUCHI Y, et al. Immunotherapy of bladder cancer using autologous dendritic cells pulsed with human lymphocyte antigen-A24-specific MAGE-3 peptide[J]. Clin Cancer Res, 2001, 7(1):23-31.
[16] BEATTY JD, ISLAM S,NORTH ME, et al. Urine dendritic cells: a noninvasive probe for immune activity in bladder cancer?[J]. BJU Int, 2004, 94(9):1377-1383.
[17] AYARI C, LARUE H, HOVINGTON H, et al. Bladder tumor infiltrating mature dendritic cells and macrophages as predictors of response to bacillus Calmette-Guérin immunotherapy[J]. Eur Urol, 2009, 55(6):1386-1395.
[18] AYARI C, LARUE H, HOVINGTON H, et al. High level of mature tumor-infiltrating dendritic cells predicts progression to muscle invasion in bladder cancer[J]. Hum Pathol, 2013, 44(8):1630-1637.
[19] FEYISETAN O, TRACEY C, HELLAWELL GO. Probiotics, dendritic cells and bladder cancer[J]. BJU Int, 2012, 109(11):1594-1597.
[20] ZHU Z, SHEN Z, XU C. Inflammatory pathways as promising targets to increase chemotherapy response in bladder cancer[J]. Mediators Inflamm, 2012, 2012:528690.
[21] CHEN T, WANG H, ZHANG Z, et al. A novel cellular senescence gene, senex, is involved in peripheral regulatory T cells accumulation in aged urinary bladder cancer[J]. PLoS One, 2014, 9(2):e87774.
[22] NISHIKAWA H, SAKAGUCHI S. Regulatory T cells in tumor immunity[J]. Int J Cancer, 2010, 127(4):759-767.
[23] SATYAM A, SINGH P, BADJATIA N,et al. A disproportion of TH1/TH2 cytokines with predominance of TH2, in urothelial carcinoma of bladder[J]. Urol Oncol, 2011, 29(1):58-65.
[24] PERABO FG, KAMP S, SCHMIDT D, et al. Bladder cancer cells acquire competent mechanisms to escape Fas-mediated apoptosis and immune surveillance in the course of malignant transformation[J]. Br J Cancer, 2001, 84(10):1330-1338.
[25] CHEN MF, LIN PY, WU CF, et al. IL-6 expression regulates tumorigenicity and correlates with prognosis in bladder cancer[J]. PLoS One, 2013, 8(4):e61901.
[26] HO PL, LAY EJ, JIAN W, et al. Stat3 activation in urothelial stem cells leads to direct progression to invasive bladder cancer[J]. Cancer Res, 2012, 72(13):3135-3142.
[27] WU ML, LI H, YU LJ, et al. Short-term resveratrol exposure causes in vitro and in vivo growth inhibition and apoptosis of bladder cancer cells[J]. PLoS One, 2014, 9(2):e89806.
[28] MARSH HP, HALDAR NA, BUNCE M, et al. Polymorphisms in tumour necrosis factor (TNF) are associated with risk of bladder cancer and grade of tumour at presentation[J]. Br J Cancer, 2003, 89(6):1096-1101.
[29] LEE SJ, PARK SS, CHO YH, et al. Activation of matrix metalloproteinase-9 by TNF-alpha in human urinary bladder cancer HT1376 cells: the role of MAP kinase signaling pathways[J]. Oncol Rep, 2008, 19(4):1007-1013.
[30] MORALES A, EIDINGER D, BRUCE AW. Intracavitary Bacillus Calmette-Guerin in the treatment of superficial bladder tumors[J]. J Urol, 1976, 116(2):180-183.
[31] SUTTMANN H, RIEMENSBERGER J, BENTIEN G, et al. Neutrophil granulocytes are required for effective Bacillus Calmette-Guérin immunotherapy of bladder cancer and orchestrate local immune responses[J]. Cancer Res, 2006, 66(16):8250-8257.
[32] TAKEUCHI A, DEJIMA T, YAMADA H, et al. IL-17 production by ⒌γ δ T cells is important for the antitumor effect of mycobacterium bovis bacillus Calmette-Guérin treatment against bladder cancer[J]. Eur J Immunol, 2011, 41(1):246-251.
[33] BRINCKS EL, RISK MC,GRIFFITH TS. PMN and anti-tumor immunity-the case of bladder cancer immunotherapy[J]. Semin Cancer Biol, 2013, 23(3):183-189.
[34] ARANDA F, VACCHELLI E, EGGERMONT A, et al. Trial watch: Peptide vaccines in cancer therapy[J]. Oncoimmunology, 2013, 2(12): e26621.
[35] DRAKE CG, LIPSON EJ, BRAHMER JR. Breathing new life into immunotherapy: Review of melanoma, lung and kidney cancer[J]. Nat Rev Clin Oncol, 2014, 11(1):24-37.
[36] VAN DEN BOORN JG, HARTMANN G. Turning tumors into vaccines: Co-opting the innate immune system[J]. Immunity, 2013, 39(1):27-37.
[37] KOMOHARA Y, HARADA M, ARIMA Y, et al. Anti-cancer vaccine candidates in specific immunotherapy for bladder carcinoma[J]. Int J Oncol, 2006, 29(6):1555-1560.
[38] XU LW, CHOW KK, LIM M, et al. Current vaccine trials in glioblastoma: a review[J]. J Immunol Res, 2014, 2014:796856.
[39] ANGUILLE S, SMITS EL, LION E, et al. Clinical use of dendritic cells for cancer therapy[J]. Lancet Oncol, 2014, 15(7):257-267.
(编辑 何宏灵)
2014-11-30
2015-01-14
姜昊文,教授.E-mail: haowenj@gmail.com
胡吉梦(1987-),男(汉族),博士研究生.研究方向:泌尿系统肿瘤.E-mail:jimeng1214@126.com
R737
A
10.3969/j.issn.1009-8291.2015.07.022
